PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [706166]: Trong quá trình tái chế kim loại, ở công đoạn phân loại phế liệu, có thể dùng nam châm lớn để tách riêng phế liệu
A, nhôm.
B, thép.
C, đồng.
D, kẽm.
Nam châm có khả năng hút các vật liệu từ tính, trong đó thép là một ví dụ điển hình.
Các kim loại khác như nhôm, đồng và kẽm không có tính từ tính, do đó không bị nam châm hút.
Vì vậy, trong quá trình tái chế kim loại, nam châm lớn có thể được sử dụng để tách riêng phế liệu thép ra khỏi hỗn hợp các kim loại khác.
⟹ Chọn đáp án B Đáp án: B
Các kim loại khác như nhôm, đồng và kẽm không có tính từ tính, do đó không bị nam châm hút.
Vì vậy, trong quá trình tái chế kim loại, nam châm lớn có thể được sử dụng để tách riêng phế liệu thép ra khỏi hỗn hợp các kim loại khác.
⟹ Chọn đáp án B Đáp án: B
Câu 2 [706167]: Phát biểu nào sau đây là không đúng?
A, Chromium thường được mạ bên ngoài một số đồ vật là do kim loại này cứng và có khả năng chống mài mòn tốt.
B, Nhôm được sử dụng nhiều trong sản xuất máy bay là do nhôm có ánh kim phản xạ các tia cực tím từ mặt trời.
C, Bạc được dùng phổ biến làm dây dẫn điện vì là kim loại có độ dẫn điện tốt nhất.
D, Bạc được dùng để tráng gương là do bạc là kim loại dẫn nhiệt rất tốt.
Phân tích các đáp án:
✔️A: Chromium là kim loại cứng, chống mài mòn tốt, nên được dùng để mạ bảo vệ các đồ vật.
✔️B: Nhôm nhẹ, bền, có khả năng phản xạ tia cực tím nên được dùng trong sản xuất máy bay.
✔️C: Bạc là kim loại dẫn điện tốt nhất, nên được dùng làm dây dẫn điện.
❌D. Bạc được dùng để tráng gương vì nó có khả năng phản xạ ánh sáng tốt, không phải vì dẫn nhiệt tốt.
⟹ Chọn đáp án D Đáp án: D
✔️A: Chromium là kim loại cứng, chống mài mòn tốt, nên được dùng để mạ bảo vệ các đồ vật.
✔️B: Nhôm nhẹ, bền, có khả năng phản xạ tia cực tím nên được dùng trong sản xuất máy bay.
✔️C: Bạc là kim loại dẫn điện tốt nhất, nên được dùng làm dây dẫn điện.
❌D. Bạc được dùng để tráng gương vì nó có khả năng phản xạ ánh sáng tốt, không phải vì dẫn nhiệt tốt.
⟹ Chọn đáp án D Đáp án: D
Câu 3 [706168]: Trong môi trường có pH = 7, các kim loại tan trong nước thường có giá trị thể điện cực chuẩn
A, lớn hơn –0,413 V.
B, nhỏ hơn -0,413 V.
C, lớn hơn –0,826 V.
D, nhỏ hơn –0,826 V.
Các kim loại có thế điện cực chuẩn âm hơn so với thế điện cực chuẩn của cặp H2O/H2, OH- sẽ có khả năng khử nước, tức là tan trong nước.
Phản ứng khử nước: 2H2O + 2e → H2 + 2OH-
Thế điện cực chuẩn của phản ứng này là Eo(H2O/H2, OH-) = -0,413 V.
Các kim loại tan được trong nước sẽ khử nước để giải phóng khí H2. Phản ứng này xảy ra khi thế điện cực chuẩn của kim loại nhỏ hơn thế điện cực khử của nước trong môi trường trung tính (pH = 7).
Để kim loại tan trong nước (khử nước), thế điện cực chuẩn của kim loại đó phải nhỏ hơn -0,413 V.
⟹ Chọn đáp án B
Đáp án: B ⟹ Chọn đáp án B
Câu 4 [706169]: Khi điện phân muối NaCl nóng chảy, quá trình nào xảy ra ở anode?
A, Sự khử ion Na+.
B, Sự oxi hoá ion Na+.
C, Sự oxi hoá ion Cl–.
D, Sự khử ion Cl–.
Điện phân NaCl nóng chảy
- Tại anode: xảy ra quá trình oxi hóa (nhường electron)
Ion Cl- (anion) di chuyển về anode. Phản ứng: 2Cl- → Cl2 + 2e
- Tại cathode: nơi xảy ra quá trình khử (nhận electron)
Ion Na+ (cation) di chuyển về cathode. Phản ứng: Na+ + e → Na
⟹ Chọn đáp án C Đáp án: C
- Tại anode: xảy ra quá trình oxi hóa (nhường electron)
Ion Cl- (anion) di chuyển về anode. Phản ứng: 2Cl- → Cl2 + 2e
- Tại cathode: nơi xảy ra quá trình khử (nhận electron)
Ion Na+ (cation) di chuyển về cathode. Phản ứng: Na+ + e → Na
⟹ Chọn đáp án C Đáp án: C
Câu 5 [706170]: Dùng panh lấy các mẩu kim loại (Li, Na hoặc K) có kích cỡ xấp xỉ nhau đã thấm khô dầu và cho vào chậu thuỷ tinh đã chứa khoảng 1/3 thể tích nước. Thêm 2 – 3 giọt dung dịch phenolphthalein vào chậu sau khi kim loại tan hết. Phát biểu nào sau đây không đúng?
A, Các dung dịch thu được sau phản ứng đều có màu hồng.
B, Trong nước, K tan nhanh hơn so với Na, Na tan nhanh hơn so với Li.
C, Eo tương ứng các kim loại đều lớn hơn Eo của cặp oxi hoá – khử: 2H2O/H2, 2OH–.
D, Kết quả thí nghiệm cho kết luận tính khử của các kim loại tăng dần theo dãy Li, Na, K.
Các kim loại kiềm (Li, Na, K) phản ứng mạnh với nước, tạo ra dung dịch base (kiềm) và khí hydrogen.
Phản ứng tổng quát: 2M + 2H2O → 2MOH + H2
Do tạo ra dung dịch base, dung dịch phenolphthalein (chất chỉ thị pH) sẽ chuyển sang màu hồng.
Phân tích các đáp án:
✔️A. Đúng: Các dung dịch thu được đều có tính base, làm phenolphthalein chuyển màu hồng.
✔️B. Đúng: Tính hoạt động hóa học của kim loại kiềm tăng dần từ Li đến K. Do đó, tốc độ phản ứng với nước cũng tăng dần theo thứ tự Li < Na < K.
❌ C. Sai: thế điện cực chuẩn của các kim loại kiềm (Li, Na, K) đều nhỏ hơn Eo của cặp 2H2O/H2, 2OH⁻. Điều này giải thích tại sao chúng có khả năng khử nước mạnh mẽ.
✔️D. Đúng: Kết quả thí nghiệm cho thấy tính khử của các kim loại kiềm tăng dần từ Li đến K, phù hợp với quy luật biến đổi tính chất trong bảng tuần hoàn.
⟹ Chọn đáp án C Đáp án: C
Phản ứng tổng quát: 2M + 2H2O → 2MOH + H2
Do tạo ra dung dịch base, dung dịch phenolphthalein (chất chỉ thị pH) sẽ chuyển sang màu hồng.
Phân tích các đáp án:
✔️A. Đúng: Các dung dịch thu được đều có tính base, làm phenolphthalein chuyển màu hồng.
✔️B. Đúng: Tính hoạt động hóa học của kim loại kiềm tăng dần từ Li đến K. Do đó, tốc độ phản ứng với nước cũng tăng dần theo thứ tự Li < Na < K.
❌ C. Sai: thế điện cực chuẩn của các kim loại kiềm (Li, Na, K) đều nhỏ hơn Eo của cặp 2H2O/H2, 2OH⁻. Điều này giải thích tại sao chúng có khả năng khử nước mạnh mẽ.
✔️D. Đúng: Kết quả thí nghiệm cho thấy tính khử của các kim loại kiềm tăng dần từ Li đến K, phù hợp với quy luật biến đổi tính chất trong bảng tuần hoàn.
⟹ Chọn đáp án C Đáp án: C
Câu 6 [706171]: Nguyên tố nhóm IIA được tìm thấy trong tự nhiên dưới dạng nào?
(1) Các cation M2+ trong nước ao hồ, nước ngầm.
(2) Các khoáng vật ít tan như carbonate, sulfate, silicate.
(3) Các hợp chất ít tan trong răng, xương động vật.
(1) Các cation M2+ trong nước ao hồ, nước ngầm.
(2) Các khoáng vật ít tan như carbonate, sulfate, silicate.
(3) Các hợp chất ít tan trong răng, xương động vật.
A, (1) và (2).
B, (1) và (3).
C, (1), (2) và (3).
D, (2) và (3).
Phân tích các phát biểu :
(1) Đúng, vì các ion kim loại kiềm thổ (M2+) có thể tồn tại trong nước ao hồ, nước ngầm, nhưng với nồng độ thấp.
(2) Đúng, vì các kim loại kiềm thổ thường tồn tại trong tự nhiên dưới dạng các khoáng vật như carbonate (ví dụ: CaCO3 - đá vôi), sulfate (ví dụ: CaSO4 - thạch cao), silicate (ví dụ: Mg2SiO4 - olivin).
(3) Đúng, vì (Ca) là thành phần chính của xương và răng động vật, tồn tại dưới dạng hợp chất ít tan như (Ca3(PO4)2).
Cả 3 phát biểu đều đúng.
⟹ Chọn đáp án C Đáp án: C
(1) Đúng, vì các ion kim loại kiềm thổ (M2+) có thể tồn tại trong nước ao hồ, nước ngầm, nhưng với nồng độ thấp.
(2) Đúng, vì các kim loại kiềm thổ thường tồn tại trong tự nhiên dưới dạng các khoáng vật như carbonate (ví dụ: CaCO3 - đá vôi), sulfate (ví dụ: CaSO4 - thạch cao), silicate (ví dụ: Mg2SiO4 - olivin).
(3) Đúng, vì (Ca) là thành phần chính của xương và răng động vật, tồn tại dưới dạng hợp chất ít tan như (Ca3(PO4)2).
Cả 3 phát biểu đều đúng.
⟹ Chọn đáp án C Đáp án: C
Câu 7 [706172]: M là nguyên tố kim loại chuyển tiếp dãy thứ nhất, có một số đặc điểm sau:
∎ Hợp chất M(II) có tính oxi hoá nên phản ứng được với dung dịch thuốc tím.
∎ Ion M3+ có 5 electron độc thân.
∎ Là nguyên tố kim loại thuộc nhóm nguyên tố hoá học phổ biến trong tự nhiên.
M là nguyên tố nào sau đây?
∎ Hợp chất M(II) có tính oxi hoá nên phản ứng được với dung dịch thuốc tím.
∎ Ion M3+ có 5 electron độc thân.
∎ Là nguyên tố kim loại thuộc nhóm nguyên tố hoá học phổ biến trong tự nhiên.
M là nguyên tố nào sau đây?
A, Fe.
B, Al.
C, Mn.
D, Cu.
Kim loại chuyển tiếp dãy thứ nhất: Điều này giới hạn các nguyên tố M trong dãy từ Sc (Z=21) đến Zn (Z=30).
Hợp chất M(II) có tính oxi hóa, phản ứng được với dung dịch thuốc tím (KMnO4): Cho thấy M(II) có khả năng bị oxi hóa lên số oxi hóa cao hơn.
Hợp chất M(II) có tính oxi hóa, phản ứng được với dung dịch thuốc tím (KMnO4): Cho thấy M(II) có khả năng bị oxi hóa lên số oxi hóa cao hơn.
Ion M3+có 5 electron độc thân: Cho thấy M3+ có cấu hình electron d5.
Là nguyên tố kim loại thuộc nhóm nguyên tố hóa học phổ biến trong tự nhiên: Điều này loại trừ một số nguyên tố hiếm.
Phân tích các đáp án:
Đáp án: A Phân tích các đáp án:
✔️ A. Fe: Cấu hình electron: [Ar] 3d64s2. Fe2+ có cấu hình 3d6, có thể bị oxi hóa lên Fe3+. Fe3+ có cấu hình 3d5, có 5 electron độc thân. Sắt là kim loại phổ biến trong tự nhiên.
❌ B. Al không phải là kim loại chuyển tiếp. Al thuộc nhóm IIIA và nằm ở chu kỳ 3 của bảng tuần hoàn.
❌ C. Mn: Cấu hình electron: [Ar] 3d54s2. Mn2+ có cấu hình 3d5, có thể bị oxi hóa lên Mn3+. Mn3+ có cấu hình 3d4, có 4 electron độc thân, không thỏa mãn điều kiện.
❌ C. Mn: Cấu hình electron: [Ar] 3d54s2. Mn2+ có cấu hình 3d5, có thể bị oxi hóa lên Mn3+. Mn3+ có cấu hình 3d4, có 4 electron độc thân, không thỏa mãn điều kiện.
❌ D. Cu: Cấu hình electron: [Ar] 3d104s1. Cu2+ có cấu hình 3d9, không thể bị oxi hóa lên số oxi hóa cao hơn trong điều kiện thông thường. Cu3+ có cấu hình 3d8, có 2 electron độc thân, không thỏa mãn điều kiện.
⟹ Chọn đáp án A
⟹ Chọn đáp án A
Câu 8 [561077]: Nguyên tử trung tâm trong phức chất [Co(en)2Br2]+ là
A, Co+.
B, CO2+.
C, CO3+.
D, CO6+.
Giả sử điện tích của Co trong phức là x
Tổng hợp điện tích trong phức [Co(en)2Br2]+ ta có:
x + 0.2 + (-1).2 = +1
⟹ x = +3
Vậy nguyên tử trung tâm trong phức [Co(en)2Br2]+ là Co3+
⟹ Chọn đáp án C Đáp án: C
Tổng hợp điện tích trong phức [Co(en)2Br2]+ ta có:
x + 0.2 + (-1).2 = +1
⟹ x = +3
Vậy nguyên tử trung tâm trong phức [Co(en)2Br2]+ là Co3+
⟹ Chọn đáp án C Đáp án: C
Câu 9 [247383]: Nguyên tử của nguyên tố R có cấu hình electron là 1s22s22p63s23p4. R có công thức oxide cao nhất là
A, RO3.
B, R2O3.
C, RO2.
D, R2O.
R thuộc nhóm VIA nên công thức oxide cao nhất RO3.
Lớp ngoài cùng của R có 6 electron (3s23p4).
R thuộc nhóm VIA trong bảng tuần hoàn.
Oxide cao nhất của nguyên tố nhóm VIA có dạng RO3.
Trong RO3, số oxi hóa của R là +6, bằng với số electron lớp ngoài cùng của R.
⟹ Chọn đáp án A Đáp án: A
Lớp ngoài cùng của R có 6 electron (3s23p4).
R thuộc nhóm VIA trong bảng tuần hoàn.
Oxide cao nhất của nguyên tố nhóm VIA có dạng RO3.
Trong RO3, số oxi hóa của R là +6, bằng với số electron lớp ngoài cùng của R.
⟹ Chọn đáp án A Đáp án: A
Câu 10 [304141]: Dân gian có câu ca dao: “Chẳng thơm cũng thể hoa nhài, dẫu không thanh lịch cũng người Tràng An”. Benzyl acetate là ester tạo nên mùi thơm của hoa nhài có công thức cấu tạo là
A, 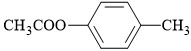

B, 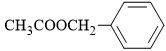
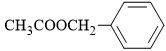
C, 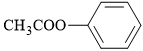

D, 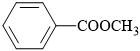

Phân tích tên gọi: benzyl acetate
• benzyl là gốc hydrocarbon có cấu tạo C6H5CH2–.
• acetate là gốc acid có cấu tạo CH3COO
⇒ Ghép lại ⇝ cấu tạo ester tương ứng là CH3COOCH2C6H5
⟹ Chọn đáp án B. Đáp án: B
• benzyl là gốc hydrocarbon có cấu tạo C6H5CH2–.
• acetate là gốc acid có cấu tạo CH3COO
⇒ Ghép lại ⇝ cấu tạo ester tương ứng là CH3COOCH2C6H5
⟹ Chọn đáp án B. Đáp án: B
Câu 11 [706173]: Trong quá trình điều chế xà phòng trong phòng thí nghiệm từ chất béo, dung cụ nào không phù hợp để sử dụng?
A, đũa thủy tinh và ống hút nhỏ giọt.
B, lưới amiăng và kẹp sắt.
C, đèn cồn và bát sứ.
D, bát nhôm hoặc xoong nhôm.
Phân tích các đáp án:
✔️ A. Đũa thủy tinh được dùng để khuấy trộn hỗn hợp phản ứng, ống hút nhỏ giọt dùng để thêm các hóa chất với lượng nhỏ. Đây là các dụng cụ thông thường trong phòng thí nghiệm hóa học.
✔️ B. Lưới amiăng được dùng để phân tán nhiệt khi đun nóng, kẹp sắt dùng để giữ các dụng cụ thủy tinh. Đây là các dụng cụ cần thiết khi đun nóng hỗn hợp phản ứng.
✔️ C. Đèn cồn được dùng để đun nóng hỗn hợp phản ứng, bát sứ được dùng để chứa hỗn hợp phản ứng. Đây là các dụng cụ phù hợp trong quá trình điều chế xà phòng.
❌ D. Nhôm phản ứng với dung dịch kiềm (NaOH hoặc KOH) trong quá trình xà phòng hóa, tạo ra khí hydro và muối aluminat. Do đó, không nên sử dụng bát nhôm hoặc xoong nhôm để điều chế xà phòng.
⟹ Chọn đáp án D Đáp án: D
✔️ A. Đũa thủy tinh được dùng để khuấy trộn hỗn hợp phản ứng, ống hút nhỏ giọt dùng để thêm các hóa chất với lượng nhỏ. Đây là các dụng cụ thông thường trong phòng thí nghiệm hóa học.
✔️ B. Lưới amiăng được dùng để phân tán nhiệt khi đun nóng, kẹp sắt dùng để giữ các dụng cụ thủy tinh. Đây là các dụng cụ cần thiết khi đun nóng hỗn hợp phản ứng.
✔️ C. Đèn cồn được dùng để đun nóng hỗn hợp phản ứng, bát sứ được dùng để chứa hỗn hợp phản ứng. Đây là các dụng cụ phù hợp trong quá trình điều chế xà phòng.
❌ D. Nhôm phản ứng với dung dịch kiềm (NaOH hoặc KOH) trong quá trình xà phòng hóa, tạo ra khí hydro và muối aluminat. Do đó, không nên sử dụng bát nhôm hoặc xoong nhôm để điều chế xà phòng.
⟹ Chọn đáp án D Đáp án: D
Câu 12 [308359]: Công thức chiếu Haworth nào sau đây là của saccharose?
A, 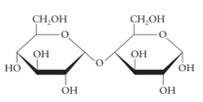

B, 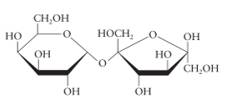

C, 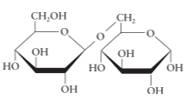

D, 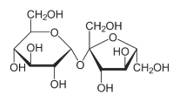

► Đi từ cấu tạo chuẩn của saccharose mà ta cần nhớ và phân tích rất nhiều trước đó:
⇒ cấu tạo ở đáp án D trùng hợp ⇝ Chọn đáp án D.
► Cách 2: phân tích loại trừ nhanh đáp án:
saccharose cấu tạo từ glucose (vòng 6 cạnh) và fructose (vòng 5 cạnh) ⇒ loại nhanh đáp án A và C.
Ở đáp án B. thừa 1 nhóm OH, hoặc đếm số O thì cấu tạo này có 12O trong khi saccharose chỉ có 11O ⇝ loại.
Theo đó, chỉ có đáp án D thỏa mãn thôi.! Đáp án: D

⇒ cấu tạo ở đáp án D trùng hợp ⇝ Chọn đáp án D.
► Cách 2: phân tích loại trừ nhanh đáp án:
saccharose cấu tạo từ glucose (vòng 6 cạnh) và fructose (vòng 5 cạnh) ⇒ loại nhanh đáp án A và C.
Ở đáp án B. thừa 1 nhóm OH, hoặc đếm số O thì cấu tạo này có 12O trong khi saccharose chỉ có 11O ⇝ loại.
Theo đó, chỉ có đáp án D thỏa mãn thôi.! Đáp án: D
Câu 13 [308769]: Trong phân tử tetrapeptide Gly-Glu-Ala-Val, amino acid đầu N là
A, Valine.
B, Alanine.
C, Glutamic acid.
D, Glycine.
Trong phân tử peptide, ta quy ước :
- amino acid đầu N (nằm bên trái, chứa nhóm -NH2)
- amino acid đầu C (nằm bên phải, chứa nhóm -COOH).
Vậy trong peptide Gly-Glu-Ala-Val, amino acid đầu N là Glycine.
⟹ Chọn đáp án D Đáp án: D
- amino acid đầu N (nằm bên trái, chứa nhóm -NH2)
- amino acid đầu C (nằm bên phải, chứa nhóm -COOH).
Vậy trong peptide Gly-Glu-Ala-Val, amino acid đầu N là Glycine.
⟹ Chọn đáp án D Đáp án: D
Câu 14 [308418]: Tinh bột và saccharose đều có khả năng tham gia phản ứng
A, Hòa tan Cu(OH)2.
B, Trùng ngưng.
C, Tráng gương.
D, Thủy phân.
Tinh bột là polysaccharide ⇒ có khả năng tham gia phản ứng thủy phân (H2O cắt nhỏ thành các phân tử nhỏ hơn). Quá trình thủy phân tinh bột đến hoàn toàn thu được glucose theo phương trình minh họa sau:
(C6H10O5)n + nH2O ––enzyme→ nC6H12O6 (glucose)
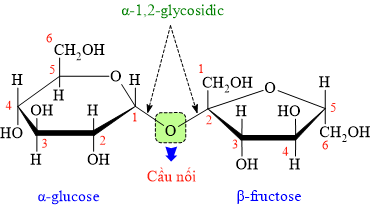
Saccharose thuộc loại disaccharide gồm 1 gốc α – glucose và 1 gốc β – fructose liên kết với nhau bằng liên kết glycoside có khả năng tham gia phản ứng thủy phân trong môi trường acid.
⟹ Chọn đáp án D. Đáp án: D
(C6H10O5)n + nH2O ––enzyme→ nC6H12O6 (glucose)
Saccharose thuộc loại disaccharide gồm 1 gốc α – glucose và 1 gốc β – fructose liên kết với nhau bằng liên kết glycoside có khả năng tham gia phản ứng thủy phân trong môi trường acid.
⟹ Chọn đáp án D. Đáp án: D
Câu 15 [706174]: Hỗn hợp của bốn chất dưới đây có thể được phân tách bằng một loạt các bước chiết xuất acid – base. Biết rằng base vô cơ và acid vô cơ được sử dụng trong sơ đồ bên dưới lần lượt là NaOH và HCl.
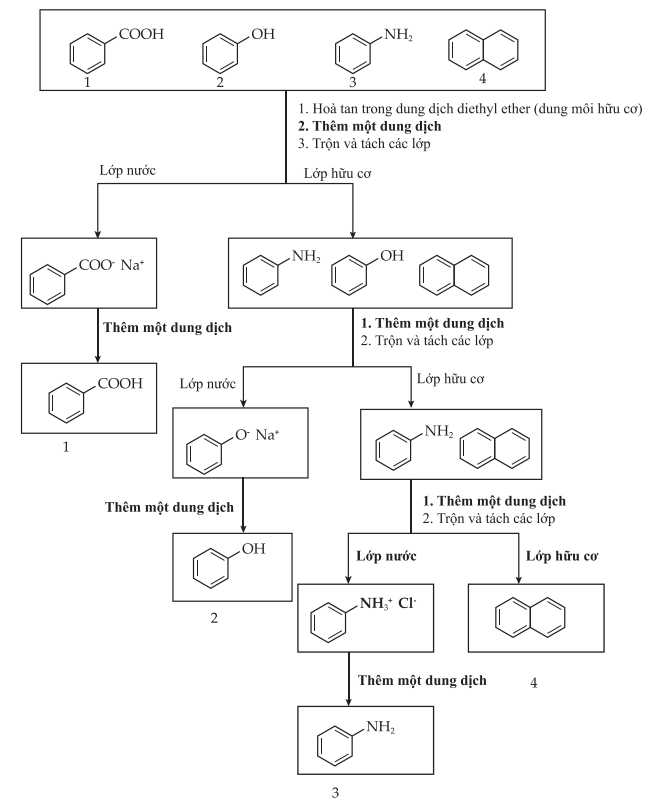
Cho các phát biểu sau:
(a) Benzoic acid và phenol đều có thể phản ứng với NaOH.
(b) Acid HCl giúp chuyển hóa gốc muối carboxylate thành carboxylic acid.
(c) Có 3 bước “thêm một dung dịch” trong sơ đồ cần sử dụng dung dịch NaOH.
(d) Có thể kiểm tra lớp nước và lớp hữu cơ bằng cách nhỏ 1 vào giọt nước vào hỗn hợp.
Các phát biểu đúng là

Cho các phát biểu sau:
(a) Benzoic acid và phenol đều có thể phản ứng với NaOH.
(b) Acid HCl giúp chuyển hóa gốc muối carboxylate thành carboxylic acid.
(c) Có 3 bước “thêm một dung dịch” trong sơ đồ cần sử dụng dung dịch NaOH.
(d) Có thể kiểm tra lớp nước và lớp hữu cơ bằng cách nhỏ 1 vào giọt nước vào hỗn hợp.
Các phát biểu đúng là
A, (a), (b).
B, (a), (c).
C, (a), (b), (c).
D, (a), (b), (d).
Chất 1: benzoic acid
Chất 2: phenol
Chất 3: Aniline
Chất 4: Naphtalein
Phân tích các phát biểu :
✔️ (a) – Đúng. Benzoic acid và phenol đều có thể phản ứng với NaOH.
C6H5COOH + NaOH → C6H5COONa + H2O
C6H5OH + NaOH → C6H5ONa + H2O
✔️ (b) – Đúng. Acid HCI giúp chuyển hóa gốc muối carboxylate thành carboxylic acid.RCOONa + HCl → RCOOH + NaCl
❌ (c) – Sai. Có 6 bước "thêm một dung dịch” trong sơ đồ cần sử dụng dung dịch HCl và có NaOH tùy thuộc vào chất có trong dung dịch
1, C6H5COOH + NaHCO3 → C6H5COONa + H2O + CO2
2, C6H5COONa+ HCl → C6H5COOH + NaCl
3, C6H5COOH + NaOH → C6H5COONa + H2O
4, C6H5COONa + HCl → C6H5COOH + NaCl
5, C6H5COONH2 + HCl → C6H5COONH3Cl
6, C6H5COONH3Cl + NaOH → C6H5COONH2 + NaCl + H2O
✔️(d) –Đúng. Khi nhỏ giọt nước vào hỗn hợp hai lớp, nếu giọt nước tan vào lớp nào thì lớp đó là lớp nước. Nếu giọt tụ lại và chìm/không tan thì đó là lớp hữu cơ.
Các phát biểu đúng là (a),(b),(d)
⟹ Chọn đáp án D Đáp án: D
Chất 2: phenol
Chất 3: Aniline
Chất 4: Naphtalein
Phân tích các phát biểu :
✔️ (a) – Đúng. Benzoic acid và phenol đều có thể phản ứng với NaOH.
C6H5COOH + NaOH → C6H5COONa + H2O
C6H5OH + NaOH → C6H5ONa + H2O
✔️ (b) – Đúng. Acid HCI giúp chuyển hóa gốc muối carboxylate thành carboxylic acid.RCOONa + HCl → RCOOH + NaCl
❌ (c) – Sai. Có 6 bước "thêm một dung dịch” trong sơ đồ cần sử dụng dung dịch HCl và có NaOH tùy thuộc vào chất có trong dung dịch
1, C6H5COOH + NaHCO3 → C6H5COONa + H2O + CO2
2, C6H5COONa+ HCl → C6H5COOH + NaCl
3, C6H5COOH + NaOH → C6H5COONa + H2O
4, C6H5COONa + HCl → C6H5COOH + NaCl
5, C6H5COONH2 + HCl → C6H5COONH3Cl
6, C6H5COONH3Cl + NaOH → C6H5COONH2 + NaCl + H2O
✔️(d) –Đúng. Khi nhỏ giọt nước vào hỗn hợp hai lớp, nếu giọt nước tan vào lớp nào thì lớp đó là lớp nước. Nếu giọt tụ lại và chìm/không tan thì đó là lớp hữu cơ.
Các phát biểu đúng là (a),(b),(d)
⟹ Chọn đáp án D Đáp án: D
Câu 16 [310498]: Đồng trùng hợp buta-1,3-diene với chất nào sau đây thu được polymer dùng sản xuất cao su buna-S?
A, Isoprene.
B, Lưu huỳnh.
C, Vinyl cyanide.
D, Styrene.
Đồng trùng hợp buta-1,3-diene với styrene thu được polymer dùng sản xuất cao su buna-S theo phương trình:
CH2=CH-CH=CH2 + C6H5-CH=CH2 → (-CH2-CH=CH-CH2-CH(C6H5)-CH2-)n
⟹ Chọn đáp án D Đáp án: D
CH2=CH-CH=CH2 + C6H5-CH=CH2 → (-CH2-CH=CH-CH2-CH(C6H5)-CH2-)n
⟹ Chọn đáp án D Đáp án: D
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Quy trình Haber được sử dụng trong công nghiệp để sản xuất ra ammonia, phần lớn dùng để sản xuất phân bón, phương trình được biểu diễn như sau:
N2(g) + 3H2(g) ⇋ 2NH3(g)
Phản ứng của nitrogen N2 và hydrogen H2 để điều chế ra ammonia NH3 là một phản ứng thuận nghịch.
N2(g) + 3H2(g) ⇋ 2NH3(g)
Phản ứng của nitrogen N2 và hydrogen H2 để điều chế ra ammonia NH3 là một phản ứng thuận nghịch.
Câu 17 [706175]: Xét các tác động sau đến cân bằng của phản ứng tổng hợp NH3:
(a) tăng áp suất;
(b) tăng nồng độ N2 và H2;
(c) tăng nhiệt độ;
(d) giảm nồng độ NH3;
(e) thêm chất xúc tác Fe.
Trong những tác động trên, có bao nhiêu tác động làm tăng hiệu suất của phản ứng tổng hợp?
(a) tăng áp suất;
(b) tăng nồng độ N2 và H2;
(c) tăng nhiệt độ;
(d) giảm nồng độ NH3;
(e) thêm chất xúc tác Fe.
Trong những tác động trên, có bao nhiêu tác động làm tăng hiệu suất của phản ứng tổng hợp?
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các đáp án:
✔️(a) – Đúng. Tăng áp suất làm cân bằng chuyển dịch theo chiều thuận, tăng hiệu suất phản ứng.
✔️(b) – Đúng. Tăng nồng độ N2 và H2 cân bằng chuyển dịch theo chiều làm giảm N2, H2 nghĩa là chiều thuận.
❌(c) – Sai. Khi tăng nhiệt độ cân bằng chuyển dịch theo nghịch, giảm hiệu suất phản ứng.
✔️(d) – Đúng. Khi giảm nồng độ NH3 làm cân bằng chuyển dịch theo chiều tăng nồng độ NH3 làm cân bằng chuyển dịch theo chiều thuận, tăng hiệu suất phản ứng.
❌(e) – Sai. Chất xúc tác không làm ảnh hưởng đến chuyển dịch cân bằng.
Có 3 tác động làm tăng hiệu suất.
⟹Chọn đáp án C Đáp án: C
✔️(a) – Đúng. Tăng áp suất làm cân bằng chuyển dịch theo chiều thuận, tăng hiệu suất phản ứng.
✔️(b) – Đúng. Tăng nồng độ N2 và H2 cân bằng chuyển dịch theo chiều làm giảm N2, H2 nghĩa là chiều thuận.
❌(c) – Sai. Khi tăng nhiệt độ cân bằng chuyển dịch theo nghịch, giảm hiệu suất phản ứng.
✔️(d) – Đúng. Khi giảm nồng độ NH3 làm cân bằng chuyển dịch theo chiều tăng nồng độ NH3 làm cân bằng chuyển dịch theo chiều thuận, tăng hiệu suất phản ứng.
❌(e) – Sai. Chất xúc tác không làm ảnh hưởng đến chuyển dịch cân bằng.
Có 3 tác động làm tăng hiệu suất.
⟹Chọn đáp án C Đáp án: C
Câu 18 [382567]: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol tương ứng 4 : 1), trong bình kín có xúc tác, thu được hỗn hợp khí, đồng thời thấy áp suất giảm 9% so với ban đầu (trong cùng điều kiện). Hiệu suất phản ứng tổng hợp là
A, 20%.
B, 22,5%.
C, 25%.
D, 27%.
Tỉ lệ mol của H2 và N2 là 4:1
Giả sử có 4 mol H2 và 1 mol N2
Gọi áp xuất ban đầu là p
Áp suất tỉ lệ thuận với số mol khí → 4 + 1 = p (1)
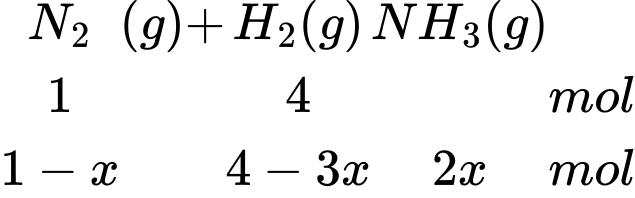
Tổng số mol khí sau phản ứng là: nH2 + nN2 + nNH3 = 4 – 3x + 1 – x + 2x = 5 – 2x (mol)
Sau phản ứng số áp suất khí của hệ giảm đi 9% so với ban đầu → 5 – 2x = 0,91p (2)
Ta có: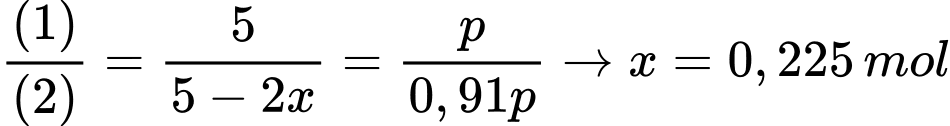
Hiệu suất của phản ứng là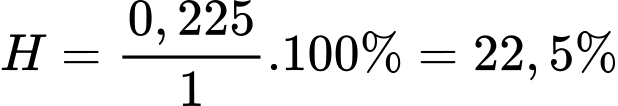
⇒ Chọn đáp án B Đáp án: B
Giả sử có 4 mol H2 và 1 mol N2
Gọi áp xuất ban đầu là p
Áp suất tỉ lệ thuận với số mol khí → 4 + 1 = p (1)
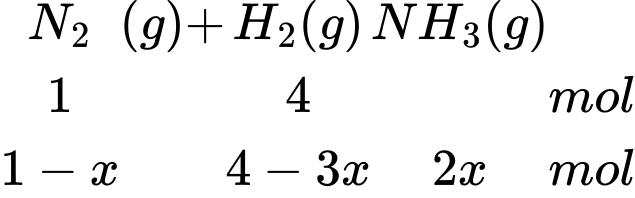
Tổng số mol khí sau phản ứng là: nH2 + nN2 + nNH3 = 4 – 3x + 1 – x + 2x = 5 – 2x (mol)
Sau phản ứng số áp suất khí của hệ giảm đi 9% so với ban đầu → 5 – 2x = 0,91p (2)
Ta có:
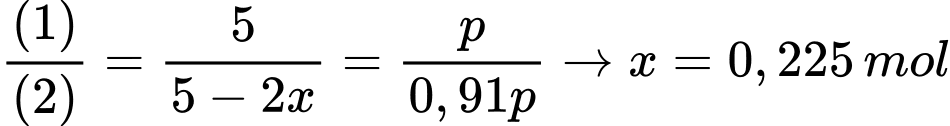
Hiệu suất của phản ứng là
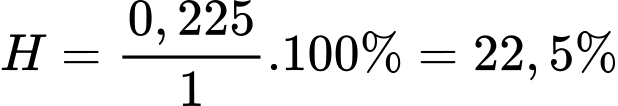
⇒ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [706176]: Trong không khí ẩm, trên bề mặt của gang, thép luôn có một lớp nước rất mỏng đã hoà tan khí oxygen và carbon dioxide trong khí quyển, tạo thành dung dịch chất điện li. Gang, thép có thành phần chính là sắt và carbon cùng tiếp xúc với dung dịch chất điện li tạo nên vô số pin rất nhỏ mà trong đó sắt đóng vai trò là anode và carbon đóng vai trò là cathode.
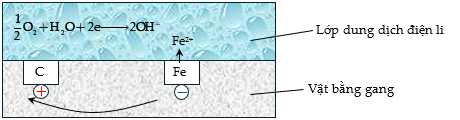

Phân tích các phát biểu:
❌a. Sai. Carbon đóng vai trò là cực dương (cathode)
✔️ b. Đúng. Oxygen bị khử, nhận electron, đóng vai trò là chất oxi hóa.
✔️ c. Đúng. Các electron di chuyển từ anode đến cathode.
❌ d .Sai. Xuất hiện hiện tượng ăn mòn điện hoá: Sắt phản ứng trực tiếp với oxygen trong không khí ẩm. Sắt và carbon tạo thành pin nhỏ, gây ăn mòn điện hóa.
❌a. Sai. Carbon đóng vai trò là cực dương (cathode)
✔️ b. Đúng. Oxygen bị khử, nhận electron, đóng vai trò là chất oxi hóa.
✔️ c. Đúng. Các electron di chuyển từ anode đến cathode.
❌ d .Sai. Xuất hiện hiện tượng ăn mòn điện hoá: Sắt phản ứng trực tiếp với oxygen trong không khí ẩm. Sắt và carbon tạo thành pin nhỏ, gây ăn mòn điện hóa.
Câu 20 [684393]: Tiến hành thí nghiệm theo các bước
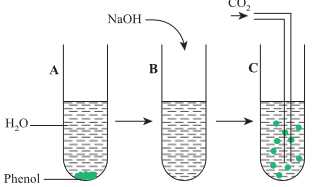
Bước 1: Cho phenol vào ống nghiệm, thêm nước và lắc đều ống nghiệm (ống nghiệm A).
Bước 2: Cho dung dịch NaOH tới dư vào ống nghiệm A thấy dung dịch chuyển sang trong suốt (ống nghiệm B).
Bước 3: Sục khí CO2 tới dư vào ống nghiệm B thấy dung dịch chuyển màu trắng đục như ban đầu (ống nghiệm C).

Bước 1: Cho phenol vào ống nghiệm, thêm nước và lắc đều ống nghiệm (ống nghiệm A).
Bước 2: Cho dung dịch NaOH tới dư vào ống nghiệm A thấy dung dịch chuyển sang trong suốt (ống nghiệm B).
Bước 3: Sục khí CO2 tới dư vào ống nghiệm B thấy dung dịch chuyển màu trắng đục như ban đầu (ống nghiệm C).
Phân tích các phát biểu:
❌a. Sai. Khi cho phenol vào ống nghiệm A, thêm nước và lắc ống nghiệm ta thấy ống nghiệm A chuyển sang màu trắng đục. Phenol ít tan trong nước ở nhiệt độ thường nên một phần phenol không tan chuyển sang màu trắng đục ( phenol bão hòa)
✔️b. Đúng. CO2 và SO2 đều là oxide acid nên có thể tác dụng với dung dịch base tạo ra muối và nước. Trong trường hợp này cả 2 khí đều tác dụng với natri phenolate (C6H5ONa) tạo ra muối mới và phenol.
C6H5ONa + CO2 + H2O ⟶ C6H5OH + NaHCO3
2C6H5ONa + SO2 + H2O ⟶ 2C6H5OH + Na2SO3
Phản ứng này được gọi là phản ứng trung hòa acid base nên khi thay CO2 bằng SO2 thì hiện tượng quan sát được dung dịch chuyển màu trắng đục như ban đầu.
❌c. Sai. Cho dung dịch NaOH vào ống nghiệm A thấy dung dịch chuyển màu trong suốt do phản ứng của phenol với NaOH tạo muối tan .
C6H5OH + NaOH ⟶ C6H5ONa + H2O.
Khi cho phenolphtalein vào ống nghiệm B, NaOH dư làm dung dịch trở thành môi trường, làm phenolphtalein chuyển sang màu hồng.
✔️d. Đúng. Phenol có tính chất ở nhiệt độ thường, tan ít trong nước lạnh nhưng khi đun nóng lên phenol tan tốt trong nước làm dung dịch trở nên trong suốt hơn. Hiện tượng này cho thấy độ tan của phenol phụ thuộc vào nhiệt độ.
❌a. Sai. Khi cho phenol vào ống nghiệm A, thêm nước và lắc ống nghiệm ta thấy ống nghiệm A chuyển sang màu trắng đục. Phenol ít tan trong nước ở nhiệt độ thường nên một phần phenol không tan chuyển sang màu trắng đục ( phenol bão hòa)
✔️b. Đúng. CO2 và SO2 đều là oxide acid nên có thể tác dụng với dung dịch base tạo ra muối và nước. Trong trường hợp này cả 2 khí đều tác dụng với natri phenolate (C6H5ONa) tạo ra muối mới và phenol.
C6H5ONa + CO2 + H2O ⟶ C6H5OH + NaHCO3
2C6H5ONa + SO2 + H2O ⟶ 2C6H5OH + Na2SO3
Phản ứng này được gọi là phản ứng trung hòa acid base nên khi thay CO2 bằng SO2 thì hiện tượng quan sát được dung dịch chuyển màu trắng đục như ban đầu.
❌c. Sai. Cho dung dịch NaOH vào ống nghiệm A thấy dung dịch chuyển màu trong suốt do phản ứng của phenol với NaOH tạo muối tan .
C6H5OH + NaOH ⟶ C6H5ONa + H2O.
Khi cho phenolphtalein vào ống nghiệm B, NaOH dư làm dung dịch trở thành môi trường, làm phenolphtalein chuyển sang màu hồng.
✔️d. Đúng. Phenol có tính chất ở nhiệt độ thường, tan ít trong nước lạnh nhưng khi đun nóng lên phenol tan tốt trong nước làm dung dịch trở nên trong suốt hơn. Hiện tượng này cho thấy độ tan của phenol phụ thuộc vào nhiệt độ.
Câu 21 [706177]: Methyl lactate có công thức phân tử là C4H8O3, là một ester của tinh dầu bạc hà và lactic acid, được sử dung như một loại hương liệu và chất hòa tan. Methyl lactate an toàn khi sử dụng trong mỹ phẩm và các sản phẩm chăm sóc cá nhân bao gồm việc sử dụng hàng ngày chống nắng. Tiến hành phân tách phân tử methyl lactate thu được phổ hồng ngoại có số sóng hấp thụ đặc trưng như sau:
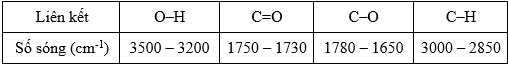

Phân tích các phát biểu:
✔️a. Đúng. Phân tử methyl lactate có công thức cấu tạo:
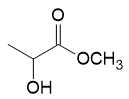
Có công thức phân tử C4H8O3
Độ bất bão hoà: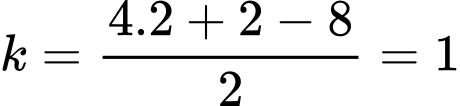
✔️b. Đúng. Phân tử methyl lactate có nhóm chức ester và alcohol nên vừa có khả năng phản ứng với NaOH, vừa phản ứng với Na.
✔️c. Đúng. Phương trình phản ứng:
CH3CH(OH)COOCH3 + NaOH → CH3CH(OH)COONa + CH3OH
Sản phẩm thu được có khả năng tham gia phản ứng với Cu(OH)2 trong môi trường kiềm.
❌d. Sai. Khoảng 1750 - 1730 cm-1 là đặc trưng của liên kết C=O trong nhóm ester, không có nhóm formate (HCOO-) trong phân tử methyl lactate.
✔️a. Đúng. Phân tử methyl lactate có công thức cấu tạo:

Có công thức phân tử C4H8O3
Độ bất bão hoà:
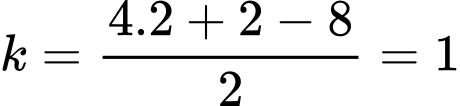
✔️b. Đúng. Phân tử methyl lactate có nhóm chức ester và alcohol nên vừa có khả năng phản ứng với NaOH, vừa phản ứng với Na.

✔️c. Đúng. Phương trình phản ứng:
CH3CH(OH)COOCH3 + NaOH → CH3CH(OH)COONa + CH3OH
Sản phẩm thu được có khả năng tham gia phản ứng với Cu(OH)2 trong môi trường kiềm.
❌d. Sai. Khoảng 1750 - 1730 cm-1 là đặc trưng của liên kết C=O trong nhóm ester, không có nhóm formate (HCOO-) trong phân tử methyl lactate.
Câu 22 [706178]: Học sinh tiến hành phản ứng giữa dung dịch NaCl 0,2 M và một dung dịch chứa ion Pb2+ 0,2 M.
∎ Bước 1: Trộn dung dịch NaCl và dung dịch chứa ion Pb2+ trong tám cốc riêng biệt theo tỉ lệ thể tích được thể hiện trong bảng sau:
∎ Bước 2: Lọc mỗi cốc để thu lấy kết tủa.
∎ Bước 3: Làm khô kết tủa đến khối lượng không đổi trong 3 phút trong lò và để nguội.
∎ Bước 4: Cân và ghi lại khối lượng kết tủa tạo ra trong mỗi cốc.
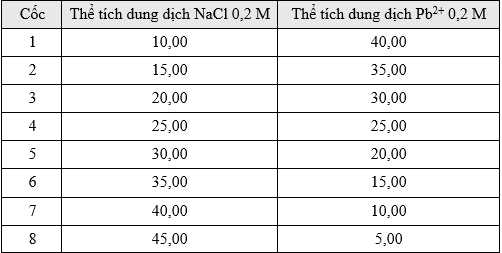
∎ Bước 1: Trộn dung dịch NaCl và dung dịch chứa ion Pb2+ trong tám cốc riêng biệt theo tỉ lệ thể tích được thể hiện trong bảng sau:
∎ Bước 2: Lọc mỗi cốc để thu lấy kết tủa.
∎ Bước 3: Làm khô kết tủa đến khối lượng không đổi trong 3 phút trong lò và để nguội.
∎ Bước 4: Cân và ghi lại khối lượng kết tủa tạo ra trong mỗi cốc.

Phân tích các phát biểu:
✔️a. Đúng. Ở bước 2, khi thu kết tủa cần sấy khô và rửa lại bằng nước lạnh để loại bỏ NaCl. Nước lạnh giúp loại bỏ NaCl mà không làm tan kết tủa PbCl2.
✔️b. Đúng.Theo phương trình phản ứng, 2 mol Cl- (từ 2 mol NaCl) phản ứng với 1 mol Pb2+.
Pb2+ + 2Cl- ⟶ PbCl2
❌c. Sai. Cốc số 5 và 6 cho khối lượng kết tủa là lớn nhất
Pb2+ + 2Cl- ⟶ PbCl2
Cốc 4 có số mol của NaCl và Pb2+ lần lượt là 0,05 mol và 0,05 mol => Số mol của kết tủa là 0,025 mol
Cốc 5 có số mol của NaCl và Pb2+ lần lượt là 0,06 mol và 0,04 mol => Số mol của kết tủa là 0,03 mol
Cốc 6 có số mol của NaCl và Pb2+ lần lượt là 0,07 mol và 0,03 mol => Số mol của kết tủa là 0,03 mol.
✔️d. Đúng. Khối lượng kết tủa trong cốc 5 và cốc 6 thu được là bằng nhau.
Pb2+ + 2Cl- → PbCl2
Cốc 5 có số mol của NaCl và Pb2+ lần lượt là 0,06 mol và 0,04 mol => Số mol của kết tủa là 0,03 mol
Cốc 6 có số mol của NaCl và Pb2+ lần lượt là 0,07 mol và 0,03 mol => Số mol của kết tủa là 0,03 mol
✔️a. Đúng. Ở bước 2, khi thu kết tủa cần sấy khô và rửa lại bằng nước lạnh để loại bỏ NaCl. Nước lạnh giúp loại bỏ NaCl mà không làm tan kết tủa PbCl2.
✔️b. Đúng.Theo phương trình phản ứng, 2 mol Cl- (từ 2 mol NaCl) phản ứng với 1 mol Pb2+.
Pb2+ + 2Cl- ⟶ PbCl2
❌c. Sai. Cốc số 5 và 6 cho khối lượng kết tủa là lớn nhất
Pb2+ + 2Cl- ⟶ PbCl2
Cốc 4 có số mol của NaCl và Pb2+ lần lượt là 0,05 mol và 0,05 mol => Số mol của kết tủa là 0,025 mol
Cốc 5 có số mol của NaCl và Pb2+ lần lượt là 0,06 mol và 0,04 mol => Số mol của kết tủa là 0,03 mol
Cốc 6 có số mol của NaCl và Pb2+ lần lượt là 0,07 mol và 0,03 mol => Số mol của kết tủa là 0,03 mol.
✔️d. Đúng. Khối lượng kết tủa trong cốc 5 và cốc 6 thu được là bằng nhau.
Pb2+ + 2Cl- → PbCl2
Cốc 5 có số mol của NaCl và Pb2+ lần lượt là 0,06 mol và 0,04 mol => Số mol của kết tủa là 0,03 mol
Cốc 6 có số mol của NaCl và Pb2+ lần lượt là 0,07 mol và 0,03 mol => Số mol của kết tủa là 0,03 mol
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [706179]: Cho các mẫu chất và dán nhãn tương ứng như sau: Fructose (1), saccharose (2), aniline (3), hồ tinh bột (4). Kết quả thí nghiệm các dung dịch X, Y, Z, T với các thuốc thử được ghi lại:
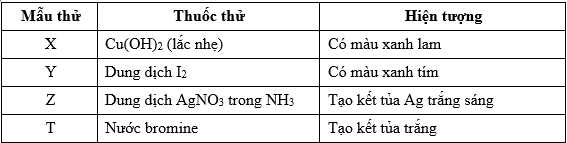
Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)
⭐Mẫu thử X: Saccharose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
2C12H22O11 + Cu(OH)2 → (C12H21O11)2Cu + 2H2O
→ Ứng với (2)
⭐Mẫu thử Y: Phân tử tinh bột hấp phụ iodine tạo thành hợp chất màu xanh tím. Phản ứng được sử dụng nhận biết tinh bột hoặc iodine. → Ứng với (4)
⭐Mẫu thử Z: Tính chất của aldehyde: Fructose cũng tham gia phản ứng tráng gương do trong môi trường NH3 chuyển hóa thành glucose. Dẫn đến fructose tham gia phản ứng với thuốc thử Tollens tạo kết tủa bạc kim loại (phản ứng tráng gương). → Ứng với (1)
→ Ứng với (1)
⭐Mẫu thử T: Aniline + nước bromine
⟹Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine
→ Ứng với (3)
⟹ Điền đáp án: 2413
→ Ứng với (2)
⭐Mẫu thử Y: Phân tử tinh bột hấp phụ iodine tạo thành hợp chất màu xanh tím. Phản ứng được sử dụng nhận biết tinh bột hoặc iodine. → Ứng với (4)
⭐Mẫu thử Z: Tính chất của aldehyde: Fructose cũng tham gia phản ứng tráng gương do trong môi trường NH3 chuyển hóa thành glucose. Dẫn đến fructose tham gia phản ứng với thuốc thử Tollens tạo kết tủa bạc kim loại (phản ứng tráng gương).
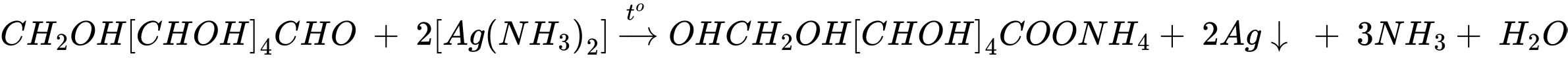 → Ứng với (1)
→ Ứng với (1)
⭐Mẫu thử T: Aniline + nước bromine

⟹Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine
→ Ứng với (3)
⟹ Điền đáp án: 2413
Câu 24 [706180]: Calcium là nguyên tố cần thiết đối với cơ thể con người, là thành phần chủ yếu cấu tạo nên xương và răng, không thể thiếu trong quá trình đông máu. Theo khuyến cáo của Viện Dinh dưỡng Quốc gia Việt Nam, mỗi ngày người lớn cũng như trẻ em cần khoảng 500 mg calcium dưới dạng ion Ca2+. Hãy số mol calcium được đưa vào cơ thể khi một người uống 300 g sữa bò, biết nồng độ ion calcium trong sữa bò là 2%.
Khối lượng của Ca2+ trong 300 gam sữa bò là:
mCa2+ = 300 × 2% = 6 gam
Số mol của Ca2+ là nCa2+ = 6 ÷ 40 = 0,15 mol
⟹ Điền đáp án: 0,15
mCa2+ = 300 × 2% = 6 gam
Số mol của Ca2+ là nCa2+ = 6 ÷ 40 = 0,15 mol
⟹ Điền đáp án: 0,15
Câu 25 [706181]: Thí nghiệm: Tính biến thiên enthalpy của quá trình đốt cháy propan-1-ol trong phòng thí nghiệm.
∎ Bước 1: Cân đèn cồn chứa propan-1-ol. Nắp đèn đốt phải được đậy kín để tránh nhiên liệu bị bay hơi.
∎ Bước 2: Đổ chính xác 100 g nước vào nhiệt lượng kế.
∎ Bước 3: Ghi lại nhiệt độ của nước bằng nhiệt kế.
∎ Bước 4: Đốt đèn cồn, chiều dài của bấc phải được điều chỉnh trước đó sao cho vật liệu của bấc không bị cháy và ngọn lửa chỉ chạm vào đáy nhiệt lượng kế.
∎ Bước 5: Khi nhiệt độ tăng khoảng 10 °C thì ghi lại nhiệt độ này.Kết quả của thí nghiệm được ghi lại trong bảng sau:
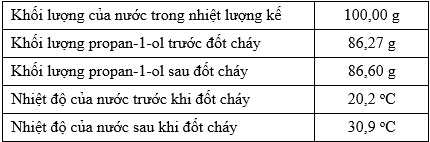
Biết rằng nhiệt dung riêng của nước là 4,18 J/(g.K). Từ thí nghiệm tính được biến thiên enthalpy của quá trình đốt cháy 1 mol propan-1-ol là a × 103 kJ.mol–1. Xác định giá trị của a (làm tròn đến hàng phần trăm).

∎ Bước 1: Cân đèn cồn chứa propan-1-ol. Nắp đèn đốt phải được đậy kín để tránh nhiên liệu bị bay hơi.
∎ Bước 2: Đổ chính xác 100 g nước vào nhiệt lượng kế.
∎ Bước 3: Ghi lại nhiệt độ của nước bằng nhiệt kế.
∎ Bước 4: Đốt đèn cồn, chiều dài của bấc phải được điều chỉnh trước đó sao cho vật liệu của bấc không bị cháy và ngọn lửa chỉ chạm vào đáy nhiệt lượng kế.
∎ Bước 5: Khi nhiệt độ tăng khoảng 10 °C thì ghi lại nhiệt độ này.Kết quả của thí nghiệm được ghi lại trong bảng sau:

Biết rằng nhiệt dung riêng của nước là 4,18 J/(g.K). Từ thí nghiệm tính được biến thiên enthalpy của quá trình đốt cháy 1 mol propan-1-ol là a × 103 kJ.mol–1. Xác định giá trị của a (làm tròn đến hàng phần trăm).
Khối lượng của propan-1-ol phản ứng là mC3H7OH = 86,6 – 86,27 = 0,33 gam
Nhiệt lượng mà nước nhận vào là:
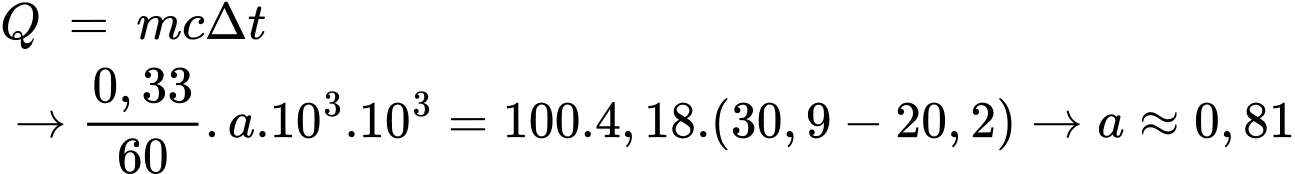
⟹ Điền đáp án: 0,81
Nhiệt lượng mà nước nhận vào là:
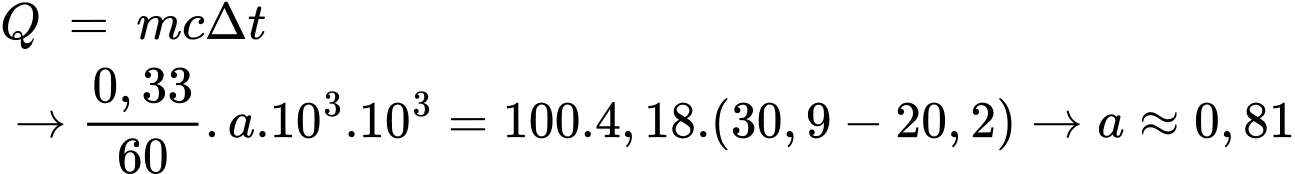
⟹ Điền đáp án: 0,81
Câu 26 [706182]: Cho 8,9 gam H2NCH2COOCH3 phản ứng vừa đủ với dung dịch NaOH thu được m gam muối. Giá trị của m là bao nhiêu gam?
Số mol của H2NCH2COOCH3 là n H2NCH2COOCH3 = 8,9 ÷ 89 = 0,1 mol
Phương trình phản ứng:
H2NCH2COOCH3 + NaOH → H2NCH2COONa + CH3OH
Theo phương trình số mol của muối là 0,1 mol
Khối lượng của muối là mH2NCH2COONa = 0,1 × 97 = 9,7 gam.
⟹ Điền đáp án: 9,7
Phương trình phản ứng:
H2NCH2COOCH3 + NaOH → H2NCH2COONa + CH3OH
Theo phương trình số mol của muối là 0,1 mol
Khối lượng của muối là mH2NCH2COONa = 0,1 × 97 = 9,7 gam.
⟹ Điền đáp án: 9,7
Câu 27 [706183]: Cho các phát biểu sau:
(a) Tơ visco, tơ acetate đều thuộc loại tơ tổng hợp.
(b) Polyethylene và poly(vinyl chloride) là sản phẩm của phản ứng trùng hợp.
(c) Tơ nylon-6,6 được điều chế từ hexamethylendiamine và stearic acid.
(d) Cao su thiên nhiên không tan trong nước cũng như trong xăng, benzene.
(e) Tơ nytron (olon) được tổng hợp từ vinyl cyanide (acrylonitrile).
Số phát biểu đúng là
(a) Tơ visco, tơ acetate đều thuộc loại tơ tổng hợp.
(b) Polyethylene và poly(vinyl chloride) là sản phẩm của phản ứng trùng hợp.
(c) Tơ nylon-6,6 được điều chế từ hexamethylendiamine và stearic acid.
(d) Cao su thiên nhiên không tan trong nước cũng như trong xăng, benzene.
(e) Tơ nytron (olon) được tổng hợp từ vinyl cyanide (acrylonitrile).
Số phát biểu đúng là
Phân tích các phát biểu:
❌Sai. a. Tơ visco, tơ acetate đều thuộc loại tơ bán tổng hợp. Tơ bán tổng hợp (tơ nhân tạo) thuộc loại tơ hóa học: xuất phát từ polymer thiên nhiên nhưng được chế biến thêm bằng phương pháp hóa hóa học ( ví dụ tơ visco, tơ acetate...).
✔️Đúng. b. Polyethylene và poly(vinyl chloride) là sản phẩm của phản ứng trùng hợp.
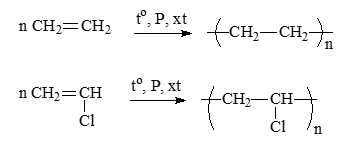
❌Sai. c. Tơ nylon-6,6 được điều chế từ hexamethylendiamine và adipic acid.
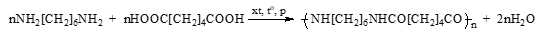
❌Sai. d. Cao su thiên nhiên không tan trong nước nhưng tan được trong xăng, benzene.
✔️Đúng. e. Tơ nytron (olon) được tổng hợp từ vinyl cyanide (acrylonitrile).
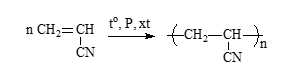
Số phát biểu đúng là: (b), (d)
⟹ Điền đáp án: 2
❌Sai. a. Tơ visco, tơ acetate đều thuộc loại tơ bán tổng hợp. Tơ bán tổng hợp (tơ nhân tạo) thuộc loại tơ hóa học: xuất phát từ polymer thiên nhiên nhưng được chế biến thêm bằng phương pháp hóa hóa học ( ví dụ tơ visco, tơ acetate...).
✔️Đúng. b. Polyethylene và poly(vinyl chloride) là sản phẩm của phản ứng trùng hợp.
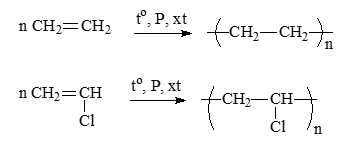
❌Sai. c. Tơ nylon-6,6 được điều chế từ hexamethylendiamine và adipic acid.
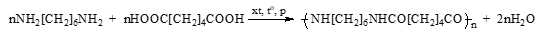
❌Sai. d. Cao su thiên nhiên không tan trong nước nhưng tan được trong xăng, benzene.
✔️Đúng. e. Tơ nytron (olon) được tổng hợp từ vinyl cyanide (acrylonitrile).
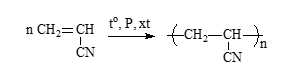
Số phát biểu đúng là: (b), (d)
⟹ Điền đáp án: 2
Câu 28 [706184]: Việc tái chế nhôm phế liệu chỉ tiêu tốn 5% năng lượng sử dụng để sản xuất nhôm mới. Vì lý do này, hầu hết các loại nhôm thành phẩm được sản xuất từ việc tái chế nhôm phế liệu. Lon nước giải khát là ứng dụng được sử dụng nhiều nhất trong tái chế nhôm và hầu hết các sản phẩm được sản xuất từ phế liệu nhôm đều được sử dụng trở lại cũng là Lon nhôm. Theo EPA (Hiệp hội bảo vệ môi trường Mỹ) tái chế 10 lon bia sẽ tiết kiệm nguồn năng lượng đủ cho 1 chiếc máy tính xách tay hoạt động trong 52 giờ. Một nhà máy phế liệu dùng m tấn phế thải chứa 98% khối lượng Al2O3, còn lại tạp chất trơ không chứa Al để luyện nhôm. Cho biết hàm lượng 1 kg Al sinh ra tương ứng với 30 lon bia. Hiệu suất quá trình phản ứng là 93%. Với lượng phế liệu trên sẽ tiết kiệm năng lượng đủ để cho 1 chiếc máy tính hoạt động trong 78343,2 giờ. Giá trị của m bằng bao nhiêu (làm tròn kết quả đến hàng trăm)?
10 lon bia tiết kiệm năng lượng cho máy tính hoạt động trong 52 giờ
x lon bin tiết kiệm năng lượng cho máy tính hoạt động trong 78343,2 giờ
→ x = 10 × 78343,2 ÷ 52 = 15066 lon
Khối lượng Al là: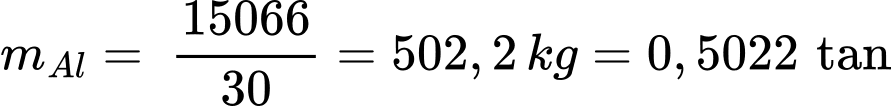
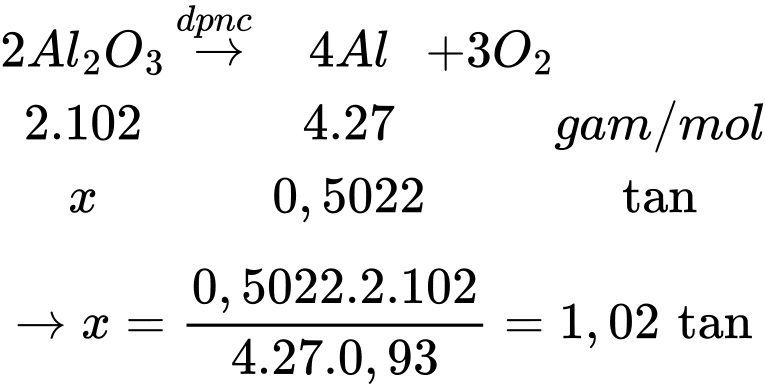
Khối lượng phế liệu là m = 1,02 ÷ 98% ≈ 1,04 tấn
⟹ Điền đáp án: 1,04
x lon bin tiết kiệm năng lượng cho máy tính hoạt động trong 78343,2 giờ
→ x = 10 × 78343,2 ÷ 52 = 15066 lon
Khối lượng Al là:
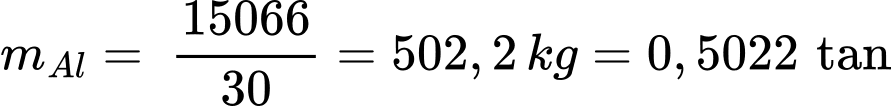
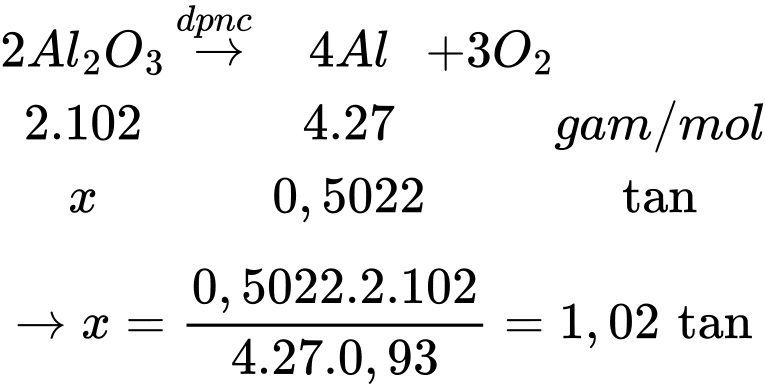
Khối lượng phế liệu là m = 1,02 ÷ 98% ≈ 1,04 tấn
⟹ Điền đáp án: 1,04