PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [706199]: Xỉ xuất hiện trong quá trình tách kim loại, luyện kim và tinh luyện để tái chế kim loại. Xỉ là hỗn hợp nhiều chất, hỗn hợp này thường
A, dễ bay hơi.
B, dễ chảy lỏng.
C, có nhiều độc tính nên cần phải được chôn lấp sau khi được tháo ra khỏi lò.
D, có khối lượng riêng nhỏ hơn so với kim loại cần tách hoặc cần tái chế.
Xỉ là sản phẩm phụ trong quá trình luyện kim, thường là hỗn hợp các oxit kim loại và tạp chất khác. Xỉ là hỗn hợp nhiều chất, hỗn hợp này thường có khối lượng riêng nhỏ hơn so với kim loại cần tách hoặc cần tái chế. Điều này giải thích tại sao trong quá trình luyện kim, xỉ thường nổi lên trên bề mặt kim loại nóng chảy. Nhờ đó, người ta dễ dàng loại bỏ xỉ khỏi kim loại tinh khiết bên dưới bằng cách gạn hoặc vớt.
⟹ Chọn đáp án D Đáp án: D
⟹ Chọn đáp án D Đáp án: D
Câu 2 [706200]: Cho các phát biểu sau về tinh thể kim loại M:
(1) Tinh thể kim loại M trung hoà về điện.
(2) Trong tinh thể kim loại M có các cation Mn⁺ và các electron hoá trị tự do.
(3) Trong tinh thể kim loại M có các electron hoá trị tự do chuyển động.
(4) Trong tinh thể kim loại M, các cation Mn+ và electron hoá trị tự do được phân bố theo trật tự nhất định.
Số phát biểu đúng là
(1) Tinh thể kim loại M trung hoà về điện.
(2) Trong tinh thể kim loại M có các cation Mn⁺ và các electron hoá trị tự do.
(3) Trong tinh thể kim loại M có các electron hoá trị tự do chuyển động.
(4) Trong tinh thể kim loại M, các cation Mn+ và electron hoá trị tự do được phân bố theo trật tự nhất định.
Số phát biểu đúng là
A, 2.
B, 3.
C, 4.
D, 1.
Phân tích các phát biểu:
✔️Đúng. (1) Tinh thể kim loại M trung hòa về điện:
✔️Đúng. (1) Tinh thể kim loại M trung hòa về điện:
Tinh thể kim loại được tạo thành từ các ion kim loại dương (cation) và electron tự do, tổng điện tích của chúng cân bằng.
✔️ Đúng. (2) Trong tinh thể kim loại M có các cation Mn+ và các electron hóa trị tự do
Các nguyên tử kim loại mất electron hóa trị để tạo thành cation, các electron này di chuyển tự do trong mạng tinh thể.
✔️Đúng. (3) Trong tinh thể kim loại M có các electron hóa trị tự do chuyển động.
Đây là đặc điểm quan trọng của kim loại, giúp chúng dẫn điện và dẫn nhiệt tốt.
❌Sai. (4) Trong tinh thể kim loại M, các cation Mn+ và electron hóa trị tự do được phân bố theo trật tự nhất định.Các electron tự do không được sắp xếp theo trật tự nhất định, chúng chuyển động hỗn loạn.
Số phát biểu đúng: (1), (2), (3)
Số phát biểu đúng: (1), (2), (3)
⟹ Chọn đáp án B
Câu 3 [706201]: Magnesium tác dụng với nước ở nhiệt độ thường (dù chậm) tạo ra hydroxide và khí hydrogen. Tính chất này phù hợp với dữ kiện là cặp oxi hoá – khử Mg2+/Mg có giá trị thế điện cực chuẩn
A, lớn hơn –0,413 V.
B, nhỏ hơn –0,413 V.
C, lớn hơn 0 V.
D, nhỏ hơn 0 V.
Magnesium (Mg) phản ứng với nước ở nhiệt độ thường tạo ra hydroxide Mg(OH)2 và khí hydrogen H2.
Phản ứng này xảy ra được vì Mg là kim loại có tính khử mạnh, có thế điện cực chuẩn Eo nhỏ hơn thế điện cực chuẩn của cặp 2H2O/H2,OH- (-0,413V).
Khi Eo (Mg2+/Mg) < -0.413V, Mg có khả năng khử H2O thành H2.
⟹ Chọn đáp án B
Đáp án: B ⟹ Chọn đáp án B
Câu 4 [706202]: Trong các phản ứng sau đây, phản ứng nào diễn ra mãnh liệt nhất?
A, Lithium và bromine.
B, Potassium và chlorine.
C, Lithium và chlorine.
D, Sodium và bromine.
Phản ứng diễn ra mạnh nhất khi kim loại có tính khử mạnh nhất (dễ nhường electron nhất) và phi kim có tính oxi hóa mạnh nhất (dễ nhận electron nhất).
Trong dãy hoạt động hóa học, tính khử của kim loại tăng dần theo thứ tự:
Li < Na < K .
Li < Na < K .
Trong bảng tuần hoàn, tính oxi hóa của phi kim tăng dần theo thứ tự: Br < Cl.
Do đó, phản ứng giữa K và Cl là mạnh nhất.
⟹ Chọn đáp án B
Đáp án: B ⟹ Chọn đáp án B
Câu 5 [706203]: Barium phản ứng với nước dễ dàng hơn so với magnesium ở điều kiện thường là do các nguyên nhân nào sau đây?
(1) Barium có tính khử mạnh hơn magnesium.
(2) Độ tan của barium hydroxide trong nước cao hơn nhiều so với magnesium hydroxide.
(3) Bọt khí hydrogen sinh ra bám trên bề mặt magnesium nhiều hơn, cản trở phản ứng tiếp diễn.
(1) Barium có tính khử mạnh hơn magnesium.
(2) Độ tan của barium hydroxide trong nước cao hơn nhiều so với magnesium hydroxide.
(3) Bọt khí hydrogen sinh ra bám trên bề mặt magnesium nhiều hơn, cản trở phản ứng tiếp diễn.
A, (1).
B, (1), (2) và (3).
C, (1) và (3).
D, (1) và (2).
Phân tích các phát biểu:
✔️ (1) Đúng. Barium nằm ở vị trí dưới Magnesium trong bảng tuần hoàn, do đó nó có tính khử mạnh hơn, dễ dàng nhường electron hơn để phản ứng với nước.
✔️ (2) Đúng. Ba(OH)2 tan tốt hơn Mg(OH)2, tạo điều kiện cho phản ứng tiếp diễn nhanh hơn.
❌ (3) Sai. Khi Mg phản ứng với nước, sinh ra Mg(OH)2 ít tan bám trên bề mặt kim loại Mg ngăn cản Mg phản ứng với nước dẫn đến làm chậm phản ứng.
Có 2 phát biểu đúng.
⟹ Chọn đáp án D Đáp án: D
✔️ (1) Đúng. Barium nằm ở vị trí dưới Magnesium trong bảng tuần hoàn, do đó nó có tính khử mạnh hơn, dễ dàng nhường electron hơn để phản ứng với nước.
✔️ (2) Đúng. Ba(OH)2 tan tốt hơn Mg(OH)2, tạo điều kiện cho phản ứng tiếp diễn nhanh hơn.
❌ (3) Sai. Khi Mg phản ứng với nước, sinh ra Mg(OH)2 ít tan bám trên bề mặt kim loại Mg ngăn cản Mg phản ứng với nước dẫn đến làm chậm phản ứng.
Có 2 phát biểu đúng.
⟹ Chọn đáp án D Đáp án: D
Câu 6 [706204]: Một kim loại X được nhúng qua một dung dịch chứa ion Ym+ 1 M ở 25 °C. Nếu giá trị thế điện cực chuẩn của các cặp oxi hoá – khử: Xn+/X > Ym+/Y. Phát biểu nào sau đây đúng?
A, Kim loại X khử được ion Ym+.
B, Kim loại X oxi hóa được ion Ym+.
C, Ion Xn+ khử được kim loại Y.
D, Ion Xn+ oxi hóa được kim loại Y.
Phân tích các đáp án:
Vì Xn+/X có thế điện cực chuẩn lớn hơn, nên Y có tính khử mạnh hơn X.
⟶ ion Xn+ dễ bị khử hơn ion Ym+
❌ A. Sai. Kim loại X không khử được ion Ym+
❌ B. Sai. Kim loại X có tính khử, không có tính oxi hóa.
❌ C. Sai. Ion Xn+ có tính oxi hóa, không có tính khử.
✔️ D. Đúng. Xn+ là chất oxi hóa, Ym+/Y có thế điện cực chuẩn nhỏ hơn, nên Y bị oxi hóa bởi Xn+.
⟹ Chọn đáp án D Đáp án: D
Vì Xn+/X có thế điện cực chuẩn lớn hơn, nên Y có tính khử mạnh hơn X.
⟶ ion Xn+ dễ bị khử hơn ion Ym+
❌ A. Sai. Kim loại X không khử được ion Ym+
❌ B. Sai. Kim loại X có tính khử, không có tính oxi hóa.
❌ C. Sai. Ion Xn+ có tính oxi hóa, không có tính khử.
✔️ D. Đúng. Xn+ là chất oxi hóa, Ym+/Y có thế điện cực chuẩn nhỏ hơn, nên Y bị oxi hóa bởi Xn+.
⟹ Chọn đáp án D Đáp án: D
Câu 7 [706205]: Số hiệu nguyên tử của chromium là 24. Theo các nguyên lí và quy tắc thông thường thì cấu hình electron của nguyên tử chromium được viết ở dạng (I). Tuy nhiên, dựa vào kết quả thực nghiệm về phổ phát xạ của nguyên tử người ta cho rằng nguyên tử chromium phải có 6 electron độc thân, nên cấu hình electron của nguyên tử này được viết ở dạng (II). Dạng (I) và dạng (II) lần lượt là
A, 1s22s22p63s23p63d44s2 và 1s22s22p63s23p63d54s1.
B, 1s22s22p63s23p63d6 và 1s22s22p63s23p63d44s2.
C, 1s22s22p63s23p63d6 và 1s22s22p63s23p63d54s1.
D, 1s22s22p63s23p63d44s2 và 1s22s22p63s23p64s24p24d2.
Dạng (I) - Cấu hình electron theo quy tắc thông thường
Theo quy tắc Pauli, và Hund, ta sẽ phân bố electron vào các orbital theo mức năng lượng tăng dần.
Cấu hình electron thông thường của Cr sẽ là: 1s22s22p63s23p63d44s2
Dạng (II) - Cấu hình electron thực tế
Thực nghiệm cho thấy Cr có 6 electron độc thân, tức là sự phân bố electron thực tế sẽ ưu tiên làm cho số electron độc thân lớn nhất. Do đó, một electron từ 4s sẽ chuyển sang 3d, tạo ra cấu hình bền hơn: 11s22s22p63s23p63d54s1
⟹ Chọn đáp án A Đáp án: A
Theo quy tắc Pauli, và Hund, ta sẽ phân bố electron vào các orbital theo mức năng lượng tăng dần.
Cấu hình electron thông thường của Cr sẽ là: 1s22s22p63s23p63d44s2
Dạng (II) - Cấu hình electron thực tế
Thực nghiệm cho thấy Cr có 6 electron độc thân, tức là sự phân bố electron thực tế sẽ ưu tiên làm cho số electron độc thân lớn nhất. Do đó, một electron từ 4s sẽ chuyển sang 3d, tạo ra cấu hình bền hơn: 11s22s22p63s23p63d54s1
⟹ Chọn đáp án A Đáp án: A
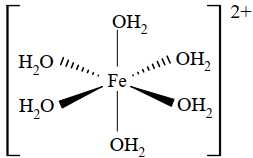
Câu 8 [561079]: Nguyên tử trung tâm và phối tử trong phức chất sau đây lần lượt là

A, Fe2+ và Cl–.
B, Fe3+ và Cl–.
C, Fe2+ và H2O.
D, Fe2+ và OH–.
Phức chất bao gồm:
- Nguyên tử hoặc ion kim loại trung tâm: Là ion kim loại có khả năng nhận cặp electron từ phối tử.Thường là các kim loại chuyển tiếp như Fe, Cu, Co, Ni, Zn, Pt, Ag...
- Phối tử: Là các phân tử hoặc ion có chứa cặp electron chưa sử dụng, có thể cho cặp electron này để tạo liên kết với ion kim loại trung tâm. Phối tử có thể là trung hòa (H2O, NH3, CO) hoặc mang điện tích (Cl- , CN- ,…)
Với phức trên, nguyên tử trung tâm là Fe 2+ và 6 phối tử là H2O
⟹ Chọn đáp án C Đáp án: C
- Nguyên tử hoặc ion kim loại trung tâm: Là ion kim loại có khả năng nhận cặp electron từ phối tử.Thường là các kim loại chuyển tiếp như Fe, Cu, Co, Ni, Zn, Pt, Ag...
- Phối tử: Là các phân tử hoặc ion có chứa cặp electron chưa sử dụng, có thể cho cặp electron này để tạo liên kết với ion kim loại trung tâm. Phối tử có thể là trung hòa (H2O, NH3, CO) hoặc mang điện tích (Cl- , CN- ,…)
Với phức trên, nguyên tử trung tâm là Fe 2+ và 6 phối tử là H2O
⟹ Chọn đáp án C Đáp án: C
Câu 9 [247390]: Nguyên tố M có khả năng tạo hợp chất với oxi ở mức hóa trị cao nhất là M2O5. Trong hợp chất của M tạo với hydrogen thì hydrogen chiếm 8,82% về khối lượng. M là
A, N.
B, P.
C, Al.
D, C.
Hợp chất M tạo với H là MH3. 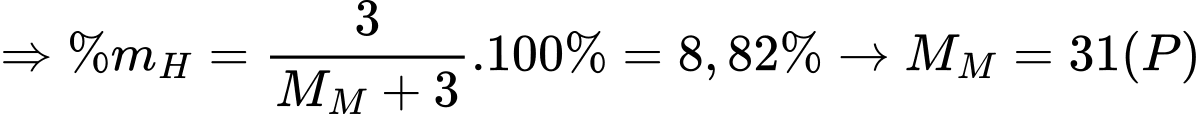
⟹ Chọn đáp án B Đáp án: B
Xét hợp chất MH3:
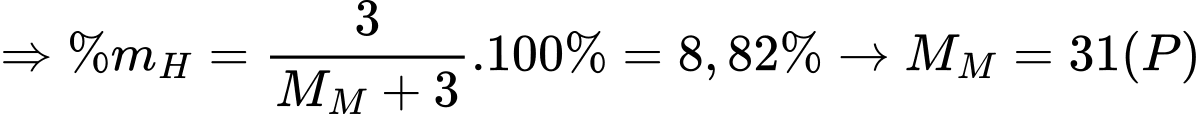
⟹ Chọn đáp án B
Câu 10 [304789]: Chất nào sau đây có độ tan lớn nhất trong nước?
A, CH3COOH.
B, C6H6.
C, C2H5Cl.
D, HCOOCH3.
Thông tin về độ hòa tan các chất trong nước ở 20 oC:
A. CH3COOH: acetic acid là tan vô hạn.
B. C6H6: benzene là 0,179 g/100 mL H2O.
C. C2H5Cl: ethyl chloride là 0,574 g/100 mL H2O.
D. HCOOCH3: methyl formate là 30%.
⇒ Có thể thấy, acetic acid có độ tan tốt nhất trong các chất do tạo được liên kết hydrogen mạnh với nước; benzene thì không; còn 2 chất còn lại có nhưng không đáng kể so với acid
⟹Chọn đáp án A. Đáp án: A
A. CH3COOH: acetic acid là tan vô hạn.
B. C6H6: benzene là 0,179 g/100 mL H2O.
C. C2H5Cl: ethyl chloride là 0,574 g/100 mL H2O.
D. HCOOCH3: methyl formate là 30%.
⇒ Có thể thấy, acetic acid có độ tan tốt nhất trong các chất do tạo được liên kết hydrogen mạnh với nước; benzene thì không; còn 2 chất còn lại có nhưng không đáng kể so với acid
⟹Chọn đáp án A. Đáp án: A
Câu 11 [304868]: Ester nào sau đây tác dụng với NaOH theo tỉ lệ mol tương ứng 1 : 2?
A, C2H5COOCH3.
B, C6H5COOCH3.
C, CH3COOC6H5.
D, HCOOCH3.
HD: Trong 4 phương án, đáp án C. CH3COOC6H5 là ester của phenol - một ester bất thường, khi tác dụng NaOH sẽ theo tỉ lệ 1 : 2 và thu được 2 muối:
CH3COOC6H5 + 2NaOH ––to→ CH3COONa + C6H5ONa + H2O.
♣ Các đáp án còn lại:
❌ A. C2H5COOCH3 + NaOH ––to→ C2H5COONa + CH3OH.
❌ B. C6H5COOCH3 + NaOH ––to→ C6H5COONa + CH3OH.
❌ D. HCOOCH3 + NaOH ––to→ HCOONa + CH3OH.
⟹ Chọn đáp án C. Đáp án: C
CH3COOC6H5 + 2NaOH ––to→ CH3COONa + C6H5ONa + H2O.
♣ Các đáp án còn lại:
❌ A. C2H5COOCH3 + NaOH ––to→ C2H5COONa + CH3OH.
❌ B. C6H5COOCH3 + NaOH ––to→ C6H5COONa + CH3OH.
❌ D. HCOOCH3 + NaOH ––to→ HCOONa + CH3OH.
⟹ Chọn đáp án C. Đáp án: C
Câu 12 [308363]: Cho các carbohydrate sau: glucose, fructose, saccharose và maltose. Số carbohydrate có khả năng mở vòng trong dung dịch nước là
A, 1.
B, 2.
C, 3.
D, 4.
4 chất trong dãy: glucose, fructose, saccharose và maltose thì saccharose không có khả năng mở vòng; còn lại 3 chất thỏa mãn. Điều này thể hiện ở việc saccharose không có tính khử.
⟹ Chọn đáp án C. Đáp án: C
⟹ Chọn đáp án C. Đáp án: C
Câu 13 [308793]: Thủy phân peptide:
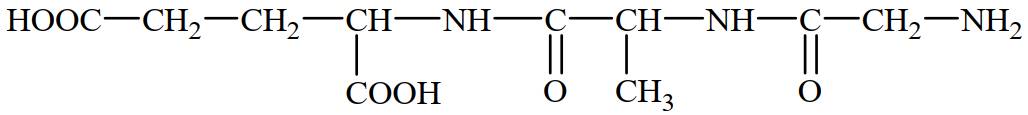
Chất nào dưới đây là có thể tạo thành trong hỗn hợp sản phẩm sau phản ứng?
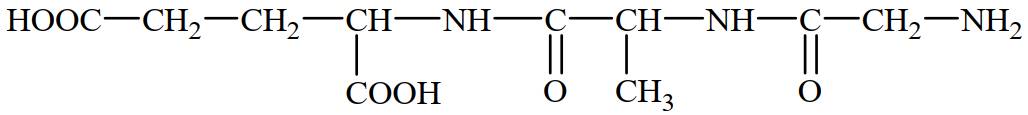
Chất nào dưới đây là có thể tạo thành trong hỗn hợp sản phẩm sau phản ứng?
A, Ala-Glu.
B, Glu-Ala.
C, Ala-Gly.
D, Glu-Gly.
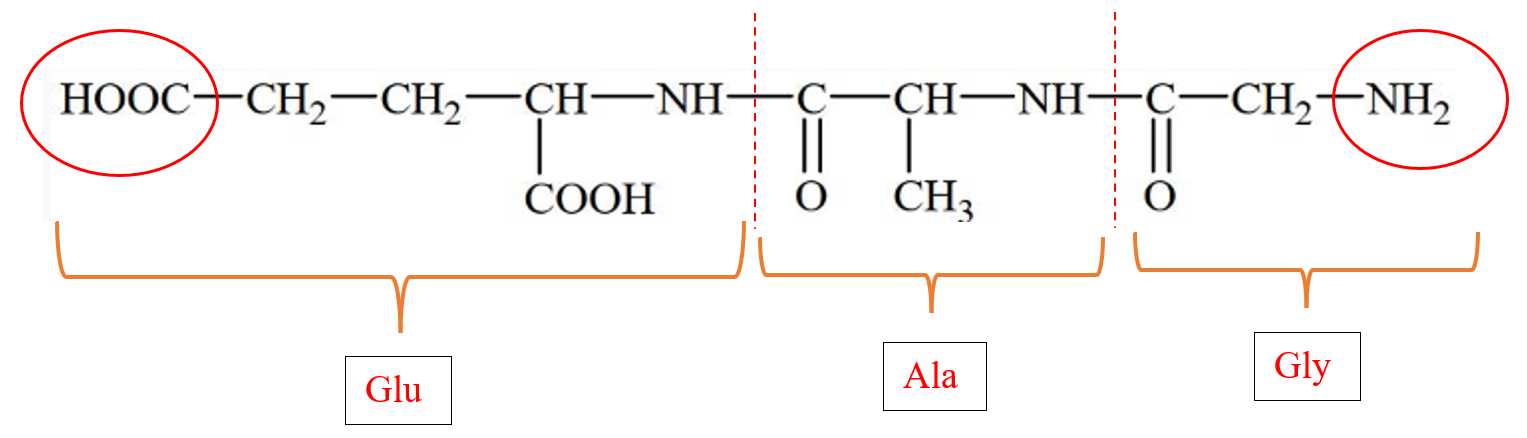
Peptide có tên: Gly-Ala-Glu khi thủy phân có thể thu được Gly, Ala, Glu, Gly-Ala, Ala-Glu.
⟹ Chọn đáp án A Đáp án: A
Câu 14 [706206]: Hỗn hợp chứa 3 chất: benzoic acid, m-nitroaniline, β-naphthol.
Quy trình tách riêng 3 chất được cho dưới đây:
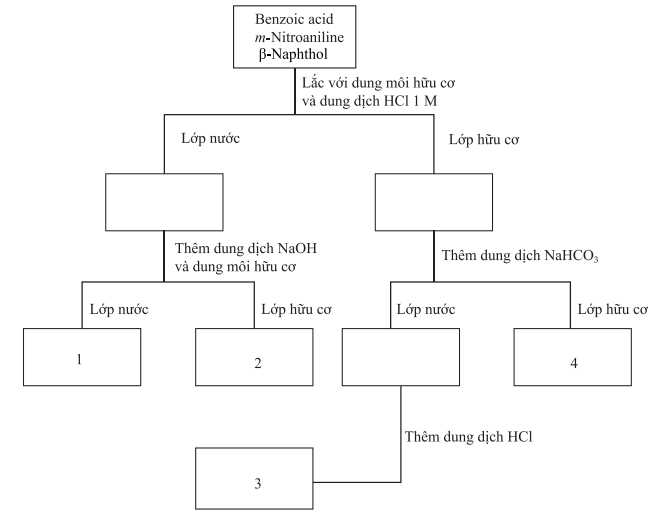
Phát biểu nào sau đây không đúng?

Quy trình tách riêng 3 chất được cho dưới đây:

Phát biểu nào sau đây không đúng?
A, β-naphthol có thể phản ứng với dung dịch NaHCO3.
B, Khi cho HCl vào hỗn hợp ban đầu thì chỉ có m-nitroaniline phản ứng.
C, Lớp nước trong ô (1) chứa chủ yếu muối vô cơ NaCl.
D, Ở ô (3), lớp hữu cơ sẽ chứa chủ yếu benzoic acid.
Ô 1: Chứa m-Nitroaniline (dạng muối).
Ô 2: Chứa Benzoic Acid và β-Naphthol.
Ô 3: Chứa muối sodium benzoate.
Ô 4: Chứa β-Naphthol.
Phân tích các đáp án:❌A – Sai. ẞ-naphthol không phản ứng với dung dịch NaHCO3.
✔️B – Đúng. Khi cho HCl vào hỗn hợp ban đầu thì chỉ có m-nitroaniline phản ứng.
✔️C – Đúng. Lớp nước trong ô (1) chứa chủ yếu muối vô cơ NaCl.
Bước đâu khi thêm HCl vào hỗn hợp 3 hợp chất hữu cơ chỉ có m-nitroaniline phản ứng thu được lớp nước chứa muối của m-nitroaniline.
Muối này phản ứng với NaOH thu được chất hữu cơ và muối NaCl.
✔️D – Đúng Trong quy trình tách chiết, sau khi cho NaOH vào để phản ứng với acid benzoic, acid benzoic sẽ chuyển thành dạng muối và tan trong nước. Vậy ở ô (3) sau lớp nước chứa muối benzoate.
C6H5COOH + NaHCO3 → C6H5COONa + H2O + CO2
C6H5COONa + HCl → C6H5COOH + NaCl.
Sau khi phản ứng với HCl thì thu được dung dịch có lớp hữu cơ chứa acid
⟹ Chọn đáp án A Đáp án: A
Câu 15 [309739]: Phản ứng lưu hóa cao su thuộc loại phản ứng
A, depolymer hóa.
B, giảm mạch polymer.
C, giữ nguyên mạch polymer.
D, tăng mạch polymer.
Phân tích các phát biểu:
❌A. depolymer hóa: Depolymer hóa là quá trình phân hủy polymer thành các monome nhỏ hơn. Phản ứng lưu hóa cao su không phải là phản ứng depolymer hóa.
❌A. depolymer hóa: Depolymer hóa là quá trình phân hủy polymer thành các monome nhỏ hơn. Phản ứng lưu hóa cao su không phải là phản ứng depolymer hóa.
❌B. giảm mạch polymer: Phản ứng lưu hóa cao su không làm giảm mạch polymer. Thay vào đó, nó tạo ra các liên kết chéo giữa các mạch polymer, làm tăng kích thước và độ phức tạp của phân tử.
❌C. giữ nguyên mạch polymer: Phản ứng lưu hóa cao su làm thay đổi cấu trúc của mạch polymer bằng cách tạo ra các liên kết chéo.
✔️D. tăng mạch polymer : Phản ứng lưu hóa cao su tạo ra các liên kết chéo giữa các mạch polymer, làm tăng kích thước và độ phức tạp của phân tử.
⟹ Chọn đáp án D
Đáp án: D ⟹ Chọn đáp án D
Câu 16 [308426]: Công thức hóa học nào sau đây là của nước Schweizer, dùng để hòa tan cellulose trong quá trình sản xuất tơ nhân tạo?
A, [Cu(NH3)4](OH)2.
B, [Zn(NH3)4](OH)2.
C, [Cu(NH3)4]OH.
D, [Ag(NH3)4]OH.
Nước Schweizer là dung dịch chứa phức chất của ion Cu2+ với ammonia có công thức ([Cu(NH3)4](OH)2). Quá trình tạo phức chất được biểu diễn như sau:
• NH3 + H2O ⇄ NH4+ + OH–.
• Cu2+ + 2OH– → Cu(OH)2.
• Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2.
► Cellulose ❌ không tan trong nước nhưng ✔️ tan trong nước Schweizer.
⟹ Chọn đáp án A Đáp án: A
• NH3 + H2O ⇄ NH4+ + OH–.
• Cu2+ + 2OH– → Cu(OH)2.
• Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2.
► Cellulose ❌ không tan trong nước nhưng ✔️ tan trong nước Schweizer.
⟹ Chọn đáp án A Đáp án: A
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Cho phản ứng thuận nghịch như sau: A(g) ⇌ B(g). Tại một nhiệt độ nhất định, hằng số cân bằng KC của phản ứng là 10. Cho các sơ đồ biểu thị sau với các hạt A màu xám to và các hạt B màu xanh nhỏ.
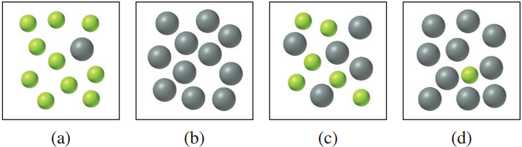

Câu 17 [706207]: Nếu chỉ đưa vào hệ ban đầu các hạt A, sơ đồ biểu diễn hệ ở trạng thái cân bằng là
A, sơ đồ (a).
B, sơ đồ (b).
C, sơ đồ (c).
D, sơ đồ (d).
Nếu ban đầu hệ chỉ gồm các hạt A, khi đạt đến trạng thái cân bằng có KC = 10, tại cân bằng sẽ có 10 hạt B ứng với 1 hạt A . Sơ đồ phù hợp là sơ đồ (a)
So sánh các sơ đồ:
(a) : chênh lệch nồng độ lớn B >> A
(b) : chỉ có A , không có B
(c) : phù hợp
(d) : chênh lệch nồng độ lớn A >> B
Sơ đồ phù hợp là sơ đồ (a)
⟹ Chọn đáp án A Đáp án: A
So sánh các sơ đồ:
(a) : chênh lệch nồng độ lớn B >> A
(b) : chỉ có A , không có B
(c) : phù hợp
(d) : chênh lệch nồng độ lớn A >> B
Sơ đồ phù hợp là sơ đồ (a)
⟹ Chọn đáp án A Đáp án: A
Câu 18 [706208]: Giả sử cho vào hệ ban đầu 10 hạt A và 2 hạt B thì tổng số hạt trong hệ khi hệ đạt trạng thái cân bằng là
A, 2.
B, 3.
C, 6.
D, 12.
A(g) ⥤ B(g)
Từ PTHH cứ 1 hạt A phản ứng hình thành 1 hạt B
→ Tổng số hạt của hệ trước và sau phản ứng không đổi
Tổng số hạt là 10 + 2 = 12 hạt
⟹ Chọn đáp án D Đáp án: D
Từ PTHH cứ 1 hạt A phản ứng hình thành 1 hạt B
→ Tổng số hạt của hệ trước và sau phản ứng không đổi
Tổng số hạt là 10 + 2 = 12 hạt
⟹ Chọn đáp án D Đáp án: D
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [706209]: Hình dưới đây cho thấy thiết bị được sử dụng để tạo ra hydrogen chloride từ sodium chloride rắn và sulfuric acid đậm đặc:
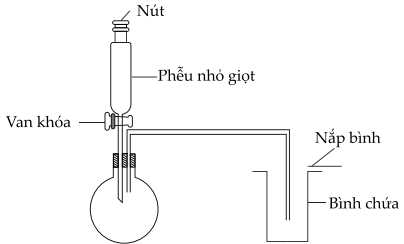

Phân tích các phát biểu:
❌Sai. a. NaCl rắn được để trong bình cầu phía dưới.
❌Sai. b. Nếu để ngửa bình thu được khí HCl, nguyên do HCl nặng hơn không khí nên có thể thu được khí khi ngửa bình.
✔️Đúng. c. Thu khí HCl bằng H2SO4 đậm đặc dựa trên nguyên tắc acid mạnh đẩy acid yếu ra khỏi muối.Phản ứng điều chế HCl bằng phương pháp sulfate là phản ứng trao đổi. Phương pháp sulfate dựa trên cơ sở tính chất hóa học của H2SO4 đặc là acid mạnh, bền khi đun nóng không bay hơi.
❌Sai. Để nhận biết bình đã chứa đầy khí hydrogen chloride bằng cách để mẩu quỳ tím ẩm trên nắp bình.
❌Sai. a. NaCl rắn được để trong bình cầu phía dưới.
❌Sai. b. Nếu để ngửa bình thu được khí HCl, nguyên do HCl nặng hơn không khí nên có thể thu được khí khi ngửa bình.
✔️Đúng. c. Thu khí HCl bằng H2SO4 đậm đặc dựa trên nguyên tắc acid mạnh đẩy acid yếu ra khỏi muối.Phản ứng điều chế HCl bằng phương pháp sulfate là phản ứng trao đổi. Phương pháp sulfate dựa trên cơ sở tính chất hóa học của H2SO4 đặc là acid mạnh, bền khi đun nóng không bay hơi.
❌Sai. Để nhận biết bình đã chứa đầy khí hydrogen chloride bằng cách để mẩu quỳ tím ẩm trên nắp bình.
Câu 20 [706210]: Tiến hành tách hai chất hữu cơ là cyclohexane và 4-nitrophenol ra khỏi một hỗn hợp. Các bước như sau:
∎ Bước 1: Hòa tan hỗn hợp vào dung môi diethyl ether, sau đó cho vào phễu chiết.
∎ Bước 2: Thêm từ từ dung dịch X vào phễu và lắc đều thì thu được như hình bên.
∎ Bước 3: Mở van và thu lấy các lớp:
Lớp diethyl ether có chứa cyclohexane, đuổi dung môi và thu lấy cyclohexane.
Lớp nước chứa muối 4-nitrophenolate. Acid hóa và thêm dung môi diethyl ether. Tách riêng lớp hữu cơ, đuổi dung môi và thu lấy 4-nitrophenol.
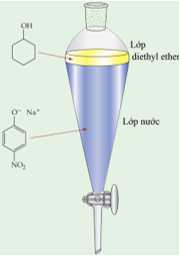
∎ Bước 1: Hòa tan hỗn hợp vào dung môi diethyl ether, sau đó cho vào phễu chiết.
∎ Bước 2: Thêm từ từ dung dịch X vào phễu và lắc đều thì thu được như hình bên.
∎ Bước 3: Mở van và thu lấy các lớp:
Lớp diethyl ether có chứa cyclohexane, đuổi dung môi và thu lấy cyclohexane.
Lớp nước chứa muối 4-nitrophenolate. Acid hóa và thêm dung môi diethyl ether. Tách riêng lớp hữu cơ, đuổi dung môi và thu lấy 4-nitrophenol.

Phân tích các phát biểu:
❌Sai. a. Dung dịch X có chứa chất tan là NaOH, NaOH có khả năng phản ứng với 4-nitrophenol tạo dung dịch còn cyclohexane không tan tạo thành 2 dung dịch phân lớp.
O2NC6H4OH + NaOH → O2NC6H4ONa + H2O
✔️Đúng. b. Lớp diethyl ether có khối lượng riêng nhỏ hơn lớp nước nên nổi trên mặt nước.
✔️Đúng. c. Để acid hóa lớp nước chứa muối 4-nitrophenolate có thể dùng acid HCI.
O2NC6H4ONa + HCl → O2NC6H4OH + NaCl
✔️Đúng. d. Dung môi diethyl ether được thêm cùng với dung môi nước nhằm mục đích tạo thành hai lớp chất lỏng phân cực và không phân cực không hòa tan vào nhau thực hiện phương pháp chiết.
❌Sai. a. Dung dịch X có chứa chất tan là NaOH, NaOH có khả năng phản ứng với 4-nitrophenol tạo dung dịch còn cyclohexane không tan tạo thành 2 dung dịch phân lớp.
O2NC6H4OH + NaOH → O2NC6H4ONa + H2O
✔️Đúng. b. Lớp diethyl ether có khối lượng riêng nhỏ hơn lớp nước nên nổi trên mặt nước.
✔️Đúng. c. Để acid hóa lớp nước chứa muối 4-nitrophenolate có thể dùng acid HCI.
O2NC6H4ONa + HCl → O2NC6H4OH + NaCl
✔️Đúng. d. Dung môi diethyl ether được thêm cùng với dung môi nước nhằm mục đích tạo thành hai lớp chất lỏng phân cực và không phân cực không hòa tan vào nhau thực hiện phương pháp chiết.
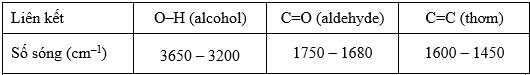
Câu 21 [706211]: Một hợp chất hữu cơ S (Salicylaldehyde) có mùi hương đặc trưng của hoa nhài, được tách từ một loại cây dược liệu. Phân tích nguyên tố cho thấy S chứa 68,85% C và 4,92% H, còn lại là O. Phổ MS cho thấy S có phân tử khối bằng 122. Trên phổ IR của S có một tín hiệu mạnh tại 1690 cm-1. S có khả năng phản ứng với thuốc thử Toluene tạo kết tủa bạc và làm mất màu dung dịch Br2. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:

Ta có: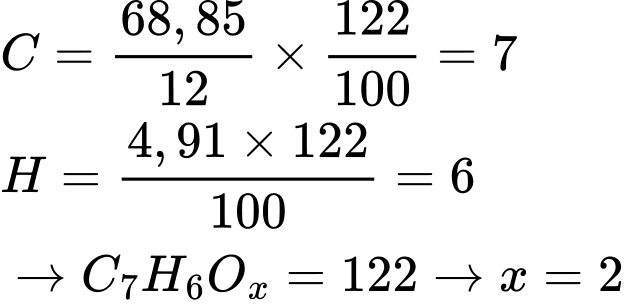
Công thức phân tử là C7H6O2
Phân tích các phát biểu:
❌Sai. a. Tín hiệu tại 1690 cm-1 trên phổ IR cho thấy S chứa nhóm chức C=O có thể thuộc Kentone, aldehyde, ester hay carboxylic acid.
✔️Đúng. b. S có thể phản ứng với NaBH4, tạo ra sản phẩm chứa nhóm -CH2.
Tín hiệu tại 1690 cm-1 trên phổ IR cho thấy S chứa nhóm chức C=O
S có khả năng tham gia phản ứng tráng bạc và phản ứng với dung dịch Br2
→ S là aldehyde
Công thức tổng quát

❌Sai. c. Khi oxi hóa S bằng KMnO4, sản phẩm thu được không có khả năng phản ứng với dung dịch Br2.
Aldehyde là một nhóm chức năng hữu cơ có công thức chung R-CHO. KMnO4 (potasium permanganate) là một chất oxi hóa mạnh.
Khi aldehyde phản ứng với KMnO4, các phản ứng chủ yếu có thể xảy ra như:
1. Oxidation thành acid carboxylic: Aldehyde có thể bị oxy hóa bởi KMnO4 thành acid carboxylic tương ứng.
2. Chuyển hóa thành rượu: Trong một số trường hợp, aldehyde có thể bị khử mạnh bởi KMnO4 thành rượu.
✔️Đúng. Phân tử S có liên kết đôi C=C trong vòng thơm, thể hiện tính không bão hòa.
Nhân benzene là một nhân bền vững nhờ có sự liên hợp của các electron π, tạo nên một hệ liên hợp kín, có năng lượng thấp gọi là năng lượng thơm. Do đó tính chất của nhân benzene là dễ thế, khó cộng và bền với các tác nhân oxi hóa, nhân benzene chỉ bị oxi hóa khi ở pha khí.
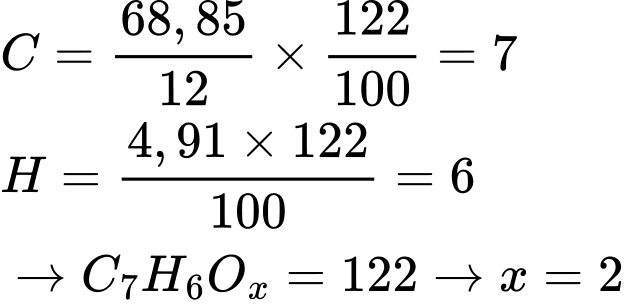
Công thức phân tử là C7H6O2
Phân tích các phát biểu:
❌Sai. a. Tín hiệu tại 1690 cm-1 trên phổ IR cho thấy S chứa nhóm chức C=O có thể thuộc Kentone, aldehyde, ester hay carboxylic acid.
✔️Đúng. b. S có thể phản ứng với NaBH4, tạo ra sản phẩm chứa nhóm -CH2.
Tín hiệu tại 1690 cm-1 trên phổ IR cho thấy S chứa nhóm chức C=O
S có khả năng tham gia phản ứng tráng bạc và phản ứng với dung dịch Br2
→ S là aldehyde
Công thức tổng quát

❌Sai. c. Khi oxi hóa S bằng KMnO4, sản phẩm thu được không có khả năng phản ứng với dung dịch Br2.
Aldehyde là một nhóm chức năng hữu cơ có công thức chung R-CHO. KMnO4 (potasium permanganate) là một chất oxi hóa mạnh.
Khi aldehyde phản ứng với KMnO4, các phản ứng chủ yếu có thể xảy ra như:
1. Oxidation thành acid carboxylic: Aldehyde có thể bị oxy hóa bởi KMnO4 thành acid carboxylic tương ứng.
2. Chuyển hóa thành rượu: Trong một số trường hợp, aldehyde có thể bị khử mạnh bởi KMnO4 thành rượu.
✔️Đúng. Phân tử S có liên kết đôi C=C trong vòng thơm, thể hiện tính không bão hòa.
Nhân benzene là một nhân bền vững nhờ có sự liên hợp của các electron π, tạo nên một hệ liên hợp kín, có năng lượng thấp gọi là năng lượng thơm. Do đó tính chất của nhân benzene là dễ thế, khó cộng và bền với các tác nhân oxi hóa, nhân benzene chỉ bị oxi hóa khi ở pha khí.
Câu 22 [706212]: Trong nhiều thế kỷ, các kim loại cơ bản Fe, Cu, Ni, Zn, Al, Sn và Pb đã được sử dụng làm thành phần hợp kim trong tiền xu. Nhìn chung, kim loại phải có độ bền tương đối để đảm bảo tuổi thọ của đồng xu, phải giữ được vẻ ngoài trong điều kiện khí quyển và không được quá đắt. Là một kim loại mềm và đắt tiền, vàng (gold) thường được kết hợp với đồng để tạo thành hợp kim bền. Đồng tiền vàng sovereign của Anh, hiện vẫn đang được đúc, được làm từ khoảng 91 % Au và 8,3 % Cu. Một đồng vàng sovereign được phân tích bằng quy trình hóa học sau:
∎ Bước 1: Cho đồng vàng sovereign phản ứng với nitric acid đậm đặc dư trong tủ hút.
Cu(s) + 4H+(aq) + 2NO3–(aq) → Cu2+(aq) + 2NO2(g) + 2H2O(1)
∎ Bước 2: Hỗn hợp sau phản ứng được lọc để loại bỏ vàng không phản ứng.
∎ Bước 3: Dung dịch sau lọc được pha loãng với nước cất đến thể tích 250 mL.
∎ Bước 4: Hút 25 mL dung dịch này vào bình tam giác và thêm lượng dư 50 mL dung dịch KI 1 M. Dung dịch thu được ngay lập tức chuyển sang màu cam nâu.
2Cu2+(aq) + 4I–(aq) → 2CuI(s) + I2(aq)
∎ Bước 5: Sau đó chuẩn độ dung dịch này bằng dung dịch Na2S2O3 0,05 M cho đến khi dung dịch chuyển sang màu vàng rơm.
2S2O32–(aq) + I2(aq) → 2I–(aq) + S4O62–(aq)
∎ Bước 6: Sau đó thêm chất chỉ thị tinh bột để tạo màu xanh đen.
∎ Bước 7: Thêm tiếp dung dịch Na2S2O3 cho đến khi dung dịch không màu. Ghi lại sự thay đổi thể tích dung dịch Na2S2O3 ở bảng dưới. Lặp lại chuẩn độ 3 lần và ghi lại kết quả chính xác đến 0,05 mL.
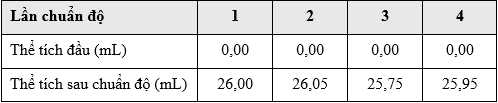
∎ Bước 1: Cho đồng vàng sovereign phản ứng với nitric acid đậm đặc dư trong tủ hút.
Cu(s) + 4H+(aq) + 2NO3–(aq) → Cu2+(aq) + 2NO2(g) + 2H2O(1)
∎ Bước 2: Hỗn hợp sau phản ứng được lọc để loại bỏ vàng không phản ứng.
∎ Bước 3: Dung dịch sau lọc được pha loãng với nước cất đến thể tích 250 mL.
∎ Bước 4: Hút 25 mL dung dịch này vào bình tam giác và thêm lượng dư 50 mL dung dịch KI 1 M. Dung dịch thu được ngay lập tức chuyển sang màu cam nâu.
2Cu2+(aq) + 4I–(aq) → 2CuI(s) + I2(aq)
∎ Bước 5: Sau đó chuẩn độ dung dịch này bằng dung dịch Na2S2O3 0,05 M cho đến khi dung dịch chuyển sang màu vàng rơm.
2S2O32–(aq) + I2(aq) → 2I–(aq) + S4O62–(aq)
∎ Bước 6: Sau đó thêm chất chỉ thị tinh bột để tạo màu xanh đen.
∎ Bước 7: Thêm tiếp dung dịch Na2S2O3 cho đến khi dung dịch không màu. Ghi lại sự thay đổi thể tích dung dịch Na2S2O3 ở bảng dưới. Lặp lại chuẩn độ 3 lần và ghi lại kết quả chính xác đến 0,05 mL.

Phân tích các phát biểu:
✔️Đúng. a. Bước 1 cần thực hiện trong tủ hút vì phản ứng sinh ra khí NO2 độc.Nitrogen dioxide là một hợp chất vô cơ có công thức hóa học NO2. Nó là một trong các loại nitrogen oxide. Nitrogen dioxide là chất trung gian trong quá trình tổng hợp công nghiệp của nitric acid, với hàng triệu tấn được sản xuất mỗi năm. Khí độc màu nâu đỏ này có mùi gắt giống với mùi clo đặc trưng và là một chất gây ô nhiễm không khí nổi bật (Tủ hút có tác dụng hút và giữ các chất độc hại, nguy hiểm, ngăn chặn không cho nó phân tán trong môi trường làm việc, bảo vệ con người tránh việc tiếp xúc với chất độc qua đường hô hấp trong khi làm việc. Không khí và các chất thải sẽ được quạt hút qua các ống hút và màng lọc rồi thải ra môi trường.)
✔️Đúng. b. Trong số các thí nghiệm, kết quả của thí nghiệm số 3 không đáng tin cậy, vì sau nhiều lần chuẩn độ thì kết quả thí nghiệm số 3 lêch nhiều nhất so với các kết quả còn lại.
✔️Đúng. c. Vì hồ tinh bột nhạy với lượng nhỏ I2 nên được thêm vào để giúp kết quả chuẩn độ chính xác, khu dung dịch chuyển sang màu xanh tím tại đấy là điểm tương đương.
✔️ Đúng. d. Phương trình phản ứng:
2Cu2+ + 4I- →2CuI + I2
I2 + 2S2O32- →2I- + S4O62-
Thể tích trung bình của Na2S2O3 đã dùng là:
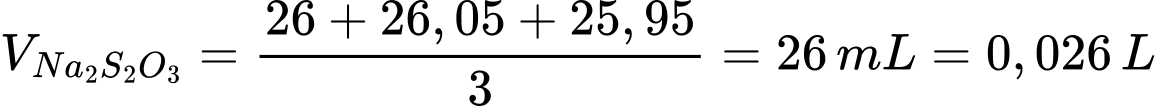
Số mol Na2S2O3 phản ứng là: nNa2S2O3 = 0,026 × 0,05 = 0,0013 mol
Theo phương trình số mol của Cu là 0,0013 mol
Khối lượng của Cu là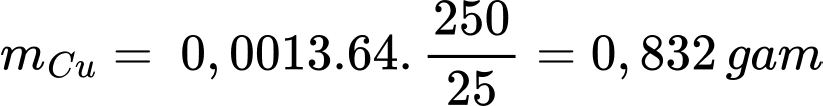
✔️Đúng. a. Bước 1 cần thực hiện trong tủ hút vì phản ứng sinh ra khí NO2 độc.Nitrogen dioxide là một hợp chất vô cơ có công thức hóa học NO2. Nó là một trong các loại nitrogen oxide. Nitrogen dioxide là chất trung gian trong quá trình tổng hợp công nghiệp của nitric acid, với hàng triệu tấn được sản xuất mỗi năm. Khí độc màu nâu đỏ này có mùi gắt giống với mùi clo đặc trưng và là một chất gây ô nhiễm không khí nổi bật (Tủ hút có tác dụng hút và giữ các chất độc hại, nguy hiểm, ngăn chặn không cho nó phân tán trong môi trường làm việc, bảo vệ con người tránh việc tiếp xúc với chất độc qua đường hô hấp trong khi làm việc. Không khí và các chất thải sẽ được quạt hút qua các ống hút và màng lọc rồi thải ra môi trường.)
✔️Đúng. b. Trong số các thí nghiệm, kết quả của thí nghiệm số 3 không đáng tin cậy, vì sau nhiều lần chuẩn độ thì kết quả thí nghiệm số 3 lêch nhiều nhất so với các kết quả còn lại.
✔️Đúng. c. Vì hồ tinh bột nhạy với lượng nhỏ I2 nên được thêm vào để giúp kết quả chuẩn độ chính xác, khu dung dịch chuyển sang màu xanh tím tại đấy là điểm tương đương.
✔️ Đúng. d. Phương trình phản ứng:
2Cu2+ + 4I- →2CuI + I2
I2 + 2S2O32- →2I- + S4O62-
Thể tích trung bình của Na2S2O3 đã dùng là:
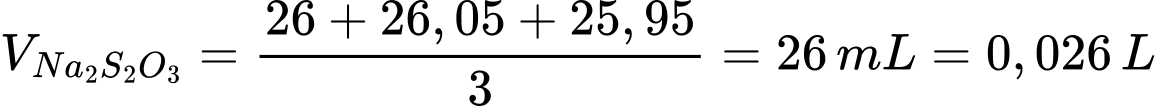
Số mol Na2S2O3 phản ứng là: nNa2S2O3 = 0,026 × 0,05 = 0,0013 mol
Theo phương trình số mol của Cu là 0,0013 mol
Khối lượng của Cu là
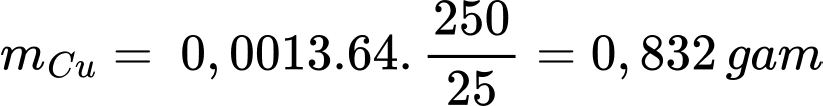
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [308819]: Thủy phân không hoàn toàn peptide Y mạch hở, thu được hỗn hợp sản phẩm trong đó có chứa các dipeptide Gly-Gly và Ala-Ala. Để thủy phân hoàn toàn 1 mol Y cần 4 mol NaOH, thu được muối và nước. Số công thức cấu tạo phù hợp của Y là
Điền đáp án: [……….]
Điền đáp án: [……….]
Thủy phân không hoàn toàn peptit Y mạch hở thu được hỗn hợp sản phẩm trong đó có hai đipeptit Gly-Gly và Ala-Ala
⟹ Có 2 CTCT phù hợp với Y là:
1. Gly-Gly-Ala-Ala.
2. Ala-Ala-Gly-Gly.
⇒ Điền đáp án: 2
⟹ Có 2 CTCT phù hợp với Y là:
1. Gly-Gly-Ala-Ala.
2. Ala-Ala-Gly-Gly.
⇒ Điền đáp án: 2
Câu 24 [706227]: Trong tự nhiên quặng bauxite có thành phần chính là Al2O3. Quặng bauxite mỏ Tây Tân Rai – Lâm Đồng nói riêng và các mỏ thuộc vùng Tây nguyên của Việt Nam nói chung là loại quặng bauxite có nguồn gốc phong hóa từ các loại đá bazan, quặng thường có màu nâu sẫm, nâu đỏ, hoặc xám, xám phớt vàng.
Có phương trình nhiệt hóa học:
2Al2O3(s) 4Al(s) + 3O2(g);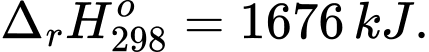
Để thu được 1 tấn Al với hiệu suất sử dụng năng lượng đạt 75% và 1 W = 1 J/s, tính lượng điện đã tiêu thụ để sản xuất lượng nhôm trên theo kWh (làm tròn đến hàng phần trăm)?
Có phương trình nhiệt hóa học:
2Al2O3(s) 4Al(s) + 3O2(g);
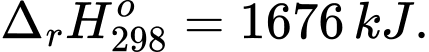
Để thu được 1 tấn Al với hiệu suất sử dụng năng lượng đạt 75% và 1 W = 1 J/s, tính lượng điện đã tiêu thụ để sản xuất lượng nhôm trên theo kWh (làm tròn đến hàng phần trăm)?
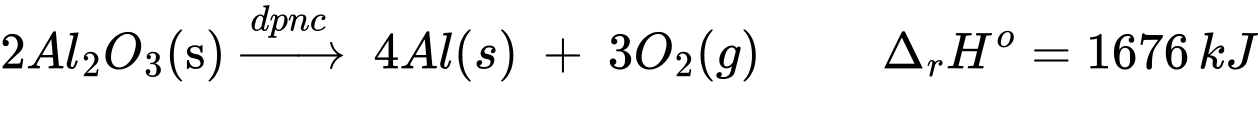
Đổi 1 tấn = 1000000 gam; 1 kWh = 3600 kJ
Để điều chế 4 mol Al cần 1676 kJ
→ Để điều chế 108 gam Al cần 1676 kJ
→ Để điều chế 1000000 gam A cần 15518518,52 kJ
Lượng điện năng cần tiêu thụ để sản xuất nhôm là: 15518518,52 ÷ 3600 × 100 ÷ 75 ≈ KWh.
⟹ Điền đáp án: 5748
Câu 25 [706228]: Cho các mẫu chất và dán nhãn tương ứng như sau: Glycine (1), glutamic acid (2), aniline (3), methylamine (4). Hiện tượng khi làm thí nghiệm với các chất sau ở dạng dung dịch X, Y, Z, T được ghi lại như sau:

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...).

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...).
🌟Mẫu thử X: Làm quỳ tím hóa xạnh, và không tạo kết tủa với bromine
→ Chất tương ứng là methylamine (4)
🌟Mẫu thử Y: Không làm quỳ tím đổi màu, nhưng tạo kết tủa trắng khí tác dụng với Bromine
→ Chất tương ứng là aniline (3)
🌟Mẫu thử Z: không làm đổi màu quì tím, không phản ứng với dung dịch Bromine,
→ Chất tương ứng là glycine (1)
🌟Mẫu thử T: làm quỳ tím hóa đỏ, không phản ứng với dung dịch Bromine,
→ Chất tương ứng là glutamic acid (2)
⟹ Điền đáp án: 4312
→ Chất tương ứng là methylamine (4)
🌟Mẫu thử Y: Không làm quỳ tím đổi màu, nhưng tạo kết tủa trắng khí tác dụng với Bromine
→ Chất tương ứng là aniline (3)

🌟Mẫu thử Z: không làm đổi màu quì tím, không phản ứng với dung dịch Bromine,
→ Chất tương ứng là glycine (1)
🌟Mẫu thử T: làm quỳ tím hóa đỏ, không phản ứng với dung dịch Bromine,
→ Chất tương ứng là glutamic acid (2)
⟹ Điền đáp án: 4312
Câu 26 [706229]: Cho các phát biểu sau:
(a) Để phân biệt Ala-Ala và Gly-Gly-Gly ta dùng phản ứng màu biuret.
(b) Dung dịch lysine làm phenolphtalein hóa hồng.
(c) Ở điều kiện thường, aniline là chất khí.
(d) Các aminoacid thiên nhiên hầu hết là các β-aminoacid.
(e) Thủy phân hoàn toàn albumin nhờ xúc tác enzyme thu được các α-aminoacid.
(g) Lực base của ethylamine yếu hơn của methylamine.
Số phát biểu đúng là
(a) Để phân biệt Ala-Ala và Gly-Gly-Gly ta dùng phản ứng màu biuret.
(b) Dung dịch lysine làm phenolphtalein hóa hồng.
(c) Ở điều kiện thường, aniline là chất khí.
(d) Các aminoacid thiên nhiên hầu hết là các β-aminoacid.
(e) Thủy phân hoàn toàn albumin nhờ xúc tác enzyme thu được các α-aminoacid.
(g) Lực base của ethylamine yếu hơn của methylamine.
Số phát biểu đúng là
Phân tích các phát biểu:
✔️Đúng. a. Để phân biệt Ala-Ala và Gly-Gly-Gly ta dùng phản ứng màu biuret.Trừ các dipeptide, các peptide còn lại có khả năng hoà tan Cu(OH)2 trong môi trường kiềm tạo thành phức chất tan trong nước có màu tím đặc trưng.Phản ứng này được gọi là phản ứng màu biuret.
✔️Đúng. b. Lysine có 2 nhóm NH2 và 1 nhóm COOH nên có tính base. Dung dịch lysine làm phenolphtalein hóa hồng.
❌Sai. c. Aniline là một chất lỏng với điểm sôi ở 184 độ Celsius, không có màu sắc đặc trưng, và mang mùi tanh không thể chịu nổi, giống mùi của cá thối. Chất này cực kỳ độc hại, có màu sắc đen, dễ cháy và tạo ra khói. Aniline không hòa tan trong nước, và khi tiếp xúc với da có thể gây cháy nám.
❌Sai. d. Các aminoacid thiên nhiên hầu hết là các α-aminoacid.
✔️Đúng. e. Thủy phân hoàn toàn albumin nhờ xúc tác enzyme thu được các α-aminoacid nguyên do albumin là protein đơn giản cấu thanh từ các α-aminoacid.
❌Sai. g. Lực base của ethylamine mạnh hơn của methylamine.
Số phát biểu đúng là: (a), (b), (e)
⟹ Điền đáp án: 3
✔️Đúng. a. Để phân biệt Ala-Ala và Gly-Gly-Gly ta dùng phản ứng màu biuret.Trừ các dipeptide, các peptide còn lại có khả năng hoà tan Cu(OH)2 trong môi trường kiềm tạo thành phức chất tan trong nước có màu tím đặc trưng.Phản ứng này được gọi là phản ứng màu biuret.
✔️Đúng. b. Lysine có 2 nhóm NH2 và 1 nhóm COOH nên có tính base. Dung dịch lysine làm phenolphtalein hóa hồng.
❌Sai. c. Aniline là một chất lỏng với điểm sôi ở 184 độ Celsius, không có màu sắc đặc trưng, và mang mùi tanh không thể chịu nổi, giống mùi của cá thối. Chất này cực kỳ độc hại, có màu sắc đen, dễ cháy và tạo ra khói. Aniline không hòa tan trong nước, và khi tiếp xúc với da có thể gây cháy nám.
❌Sai. d. Các aminoacid thiên nhiên hầu hết là các α-aminoacid.
✔️Đúng. e. Thủy phân hoàn toàn albumin nhờ xúc tác enzyme thu được các α-aminoacid nguyên do albumin là protein đơn giản cấu thanh từ các α-aminoacid.
❌Sai. g. Lực base của ethylamine mạnh hơn của methylamine.
Số phát biểu đúng là: (a), (b), (e)
⟹ Điền đáp án: 3
Câu 27 [706230]: Nitrogen là nguyên tố dinh dưỡng khoáng thiết yếu trong cây, là thành phần cấu tạo nên nhiều hợp chất quan trọng. Đơn chất nitrogen (N2) có rất nhiều trong thành phần không khí, chiếm 78 % về thể tích. Tuy nhiên do năng lượng liên kết ba trong N≡N rất lớn nên N2 tương đối bền và trơ, dẫn tới cây trồng không thể sử dụng nguồn nitrogen này. Thông qua phản ứng của nitrogen với hydrogen tổng hợp NH3:
N2(g) + 3H2(g) 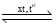 2NH3(g).
2NH3(g).
Cho giá trị năng lượng liên kết của EN–H (trong phân tử NH3) = 391 kJ.mol–1; EH–H = 436 kJ.mol–1 và biến thiên enthalpy tạo thành chuẩn của phản ứng là –93 kJ. Tính năng lượng liên kết của N≡N theo đơn vị kJ.mol–1. 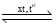 2NH3(g).
2NH3(g).
N2 + 3H2 ⇌ 2NH3
Biến thiên enthalpy của phản ứng là:
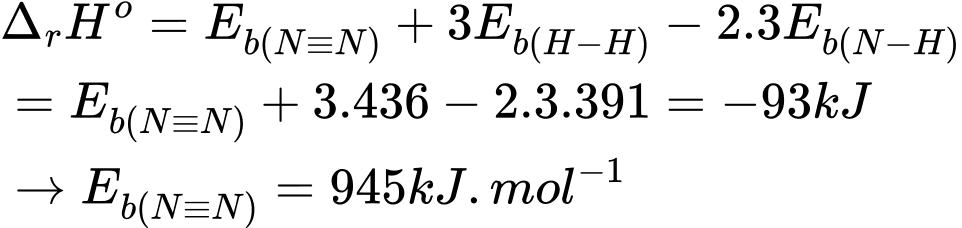
⟹ Điền đáp án: 945
Biến thiên enthalpy của phản ứng là:
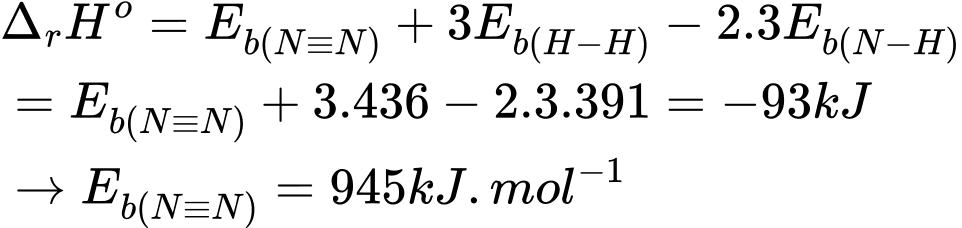
⟹ Điền đáp án: 945
Câu 28 [706231]: Reppe Carbonylation là một phương pháp tổng hợp acrylic acid từ acetylene và CO với xúc tác Ni(CO)4, nhiệt độ 50 – 100oC, áp suất 10 – 20 atm.
HC≡CH + CO + H2O CH2=CH–COOH
CH2=CH–COOH
Trong các quá trình công nghiệp, khí CO sẽ thu từ phản ứng khí than ướt:
C + H2O CO + H2
CO + H2
Giả sử có 150 g than (chứa 96% C), hiệu suất của phản ứng khí than ướt là 60% và lượng acetylene thu được là từ 260 g đất đèn (chứa 85% CaC2):
CaC2 + H2O Ca(OH)2 + HC≡CH
Ca(OH)2 + HC≡CH
Hãy cho biết lượng acrylic acid (tính theo gam) có thể thu được nếu hiệu suất tổng hợp của phản ứng là 75% (làm tròn đến hàng đơn vị).
HC≡CH + CO + H2O
 CH2=CH–COOH
CH2=CH–COOH Trong các quá trình công nghiệp, khí CO sẽ thu từ phản ứng khí than ướt:
C + H2O
 CO + H2
CO + H2 Giả sử có 150 g than (chứa 96% C), hiệu suất của phản ứng khí than ướt là 60% và lượng acetylene thu được là từ 260 g đất đèn (chứa 85% CaC2):
CaC2 + H2O
 Ca(OH)2 + HC≡CH
Ca(OH)2 + HC≡CH Hãy cho biết lượng acrylic acid (tính theo gam) có thể thu được nếu hiệu suất tổng hợp của phản ứng là 75% (làm tròn đến hàng đơn vị).
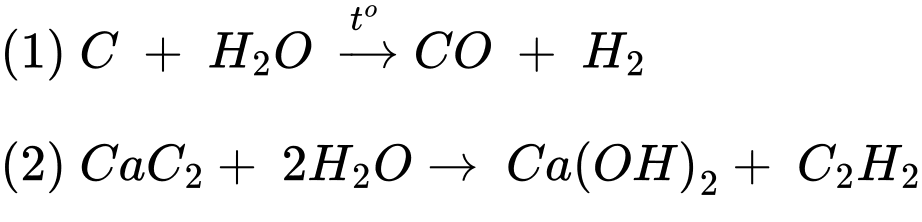
Khối lượng carbon là mC = 150 × 96% = 144 gam
Số mol của C là nC = 144 ÷ 12 = 12 mol
Theo phương trình số mol của CO là nCO = 12 × 60% = 7,2 mol
Số mol của CaC2 là
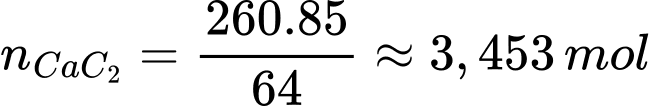
Theo phương trình số mol của C2H2 là 3,453 mol
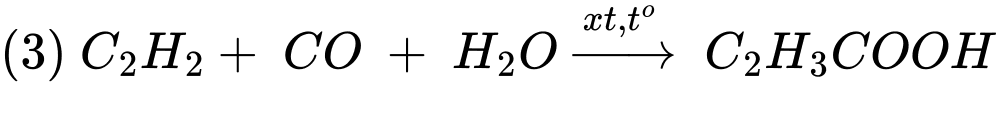
Ta có số mol của CO và C2H2 lần lượt là 7,2 mol và 3,453 mol
Khối lượng của acrylic acid là mC2H3COOH = 3,453 × 72 × 75% ≈ 186 gam
⟹ Điền đáp án: 186