PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [706239]: Kim loại cơ bản trong dural và thép 304 lần lượt là
A, nhôm và magnesium.
B, nhôm và sắt.
C, magnesium và sắt.
D, kẽm và sắt.
Phân tích các đáp án:
❌A. SAI. Mặc dù magnesium có trong duralumin, nhưng kim loại cơ bản của thép 304 là sắt, không phải magnesium.
✔️B. ĐÚNG. Nhôm là kim loại cơ bản trong duralumin và sắt là kim loại cơ bản trong thép 304.
❌C. SAI. Magnesium không phải là kim loại cơ bản trong duralumin.
❌D. SAI. Kẽm không phải là kim loại cơ bản trong duralumin.
⟹ Chọn đáp án B Đáp án: B
❌A. SAI. Mặc dù magnesium có trong duralumin, nhưng kim loại cơ bản của thép 304 là sắt, không phải magnesium.
✔️B. ĐÚNG. Nhôm là kim loại cơ bản trong duralumin và sắt là kim loại cơ bản trong thép 304.
❌C. SAI. Magnesium không phải là kim loại cơ bản trong duralumin.
❌D. SAI. Kẽm không phải là kim loại cơ bản trong duralumin.
⟹ Chọn đáp án B Đáp án: B
Câu 2 [560614]: Kim loại nào sau đây có khối lượng riêng lớn nhất?
A, Fe.
B, Ag.
C, Li.
D, Os
Fe: ~7.87 g/cm3
Ag: ~10.49 g/cm3
Li: ~0.53 g/cm3
Os: ~22.59 g/cm3
Khối lượng riêng lớn nhất: Osmium (Os)
⟹ Chọn đáp án D Đáp án: D
Ag: ~10.49 g/cm3
Li: ~0.53 g/cm3
Os: ~22.59 g/cm3
Khối lượng riêng lớn nhất: Osmium (Os)
⟹ Chọn đáp án D Đáp án: D
Câu 3 [706240]: Ở điều kiện chuẩn, những kim loại tan trong hydrochloric acid hoặc sulfuric acid loãng thường có thế điện cực chuẩn
A, lớn hơn 0 V.
B, nhỏ hơn 0 V.
C, lớn hơn –0,413 V.
D, nhỏ hơn –0,413 V.
Phân tích các đáp án:
❌A. SAI. Kim loại có thế điện cực chuẩn lớn hơn 0 V (ví dụ: Cu, Ag, Au) không phản ứng với acid HCl hoặc H2SO4 loãng.
✔️B. ĐÚNG. Kim loại có thế điện cực chuẩn nhỏ hơn 0 V (ví dụ: Zn, Fe, Al) phản ứng với acid HCl hoặc H2SO4 loãng.
❌C,D. SAI. Giá trị -0,413 V không phải là một mốc quan trọng trong phản ứng của kim loại với acid.
⟹ Chọn đáp án B Đáp án: B
❌A. SAI. Kim loại có thế điện cực chuẩn lớn hơn 0 V (ví dụ: Cu, Ag, Au) không phản ứng với acid HCl hoặc H2SO4 loãng.
✔️B. ĐÚNG. Kim loại có thế điện cực chuẩn nhỏ hơn 0 V (ví dụ: Zn, Fe, Al) phản ứng với acid HCl hoặc H2SO4 loãng.
❌C,D. SAI. Giá trị -0,413 V không phải là một mốc quan trọng trong phản ứng của kim loại với acid.
⟹ Chọn đáp án B Đáp án: B
Câu 4 [706255]: Một khí X ở 1 atm được sục qua một dung dịch chứa hỗn hợp Ym– 1 M và Zk– 1 M ở 25 °C. Nếu giá trị thế điện cực chuẩn của các cặp oxi hoá – khử X/Xn–, Y/Ym– và Z/Zk– xếp theo trật tự Z/Zk– > X/Xn– >Y/Ym–. Cho các phát biểu sau:
(a) X sẽ oxi hoá được Ym– nhưng không oxi hoá được Zk–.
(b) X sẽ oxi hoá được cả Ym– và Zk–.
(c) X sẽ oxi hoá được Zk– nhưng không oxi hoá được Ym–.
(d) X sẽ khử được cả Ym– và Zk–.
(e) Phản ứng giữa X và Ym– là phản ứng tự diễn biến.
Số phát biểu không đúng là
(a) X sẽ oxi hoá được Ym– nhưng không oxi hoá được Zk–.
(b) X sẽ oxi hoá được cả Ym– và Zk–.
(c) X sẽ oxi hoá được Zk– nhưng không oxi hoá được Ym–.
(d) X sẽ khử được cả Ym– và Zk–.
(e) Phản ứng giữa X và Ym– là phản ứng tự diễn biến.
Số phát biểu không đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Ta có: Z/Zk– > X/Xn– >Y/Ym–
⟶Tính khử : Y > X > Z
⟶Tính oxi hóa : Zk– > Xn– > Ym–
Phân tích các phát biểu:
✔️(a) ĐÚNG. Vì X/Xn- > Y/Ym-, X có thể oxi hóa Ym-. Vì Z/Zk- > X/Xn-, X không thể oxi hóa Zk-.
⟶Tính khử : Y > X > Z
⟶Tính oxi hóa : Zk– > Xn– > Ym–
Phân tích các phát biểu:
✔️(a) ĐÚNG. Vì X/Xn- > Y/Ym-, X có thể oxi hóa Ym-. Vì Z/Zk- > X/Xn-, X không thể oxi hóa Zk-.
❌(b) SAI. Như đã phân tích ở trên, X không thể oxi hóa Zk-.
❌(c) SAI. X không oxi hóa được Zk-.
❌(d) SAI. X khử được Z nhưng không
✔️(e) ĐÚNG. Vì X có thể oxi hóa Ym-, phản ứng này tự diễn biến.
Các phát biểu (b), (c), (d) là các phát biểu không đúng.
⟹ Chọn đáp án C
Câu 5 [706256]: Những phát biểu nào sau đây là đúng về hợp chất sodium hydrogencarbonate?
(1) Còn gọi là sodium bicarbonate hay baking soda.
(2) Được dùng để điều trị chứng dư acid trong dạ dày, làm mềm thực phẩm.
(3) Là chất dạng bột màu trắng, dễ bị oxi hoá bởi oxygen trong không khí.
(1) Còn gọi là sodium bicarbonate hay baking soda.
(2) Được dùng để điều trị chứng dư acid trong dạ dày, làm mềm thực phẩm.
(3) Là chất dạng bột màu trắng, dễ bị oxi hoá bởi oxygen trong không khí.
A, (1) và (2).
B, (1), (2) và (3).
C, (1) và (3).
D, (2).
Phân tích các phát biểu:
✔️(1) ĐÚNG. Sodium hydrogencarbonate (NaHCO3) có nhiều tên gọi khác nhau, bao gồm sodium bicarbonate và baking soda.
✔️(2) ĐÚNG.Điều trị chứng dư acid trong dạ dày: NaHCO3 là một chất kiềm yếu, có khả năng trung hòa acid trong dạ dày, giúp giảm triệu chứng ợ nóng và khó tiêu.Làm mềm thực phẩm: NaHCO3 có thể phân hủy khi đun nóng, tạo ra khí CO2, giúp làm mềm và tạo độ xốp cho thực phẩm.
❌(3) SAI. NaHCO3 là chất dạng bột màu trắng, nhưng nó không dễ bị oxi hóa bởi oxygen trong không khí. NaHCO3 có thể bị phân hủy bởi nhiệt độ cao, tạo ra Na2CO3, H2O và CO2.
⟹ Chọn đáp án A Đáp án: A
✔️(1) ĐÚNG. Sodium hydrogencarbonate (NaHCO3) có nhiều tên gọi khác nhau, bao gồm sodium bicarbonate và baking soda.
✔️(2) ĐÚNG.Điều trị chứng dư acid trong dạ dày: NaHCO3 là một chất kiềm yếu, có khả năng trung hòa acid trong dạ dày, giúp giảm triệu chứng ợ nóng và khó tiêu.Làm mềm thực phẩm: NaHCO3 có thể phân hủy khi đun nóng, tạo ra khí CO2, giúp làm mềm và tạo độ xốp cho thực phẩm.
❌(3) SAI. NaHCO3 là chất dạng bột màu trắng, nhưng nó không dễ bị oxi hóa bởi oxygen trong không khí. NaHCO3 có thể bị phân hủy bởi nhiệt độ cao, tạo ra Na2CO3, H2O và CO2.
⟹ Chọn đáp án A Đáp án: A
Câu 6 [706257]: Trong cấu hình electron nguyên tử hoặc cấu hình electron của cation nguyên tố chuyển tiếp dãy thứ nhất phải có
A, phân lớp 4s chưa bão hoà electron.
B, phân lớp 3d chưa bão hoà electron.
C, sự điền electron vào phân lớp 3d.
D, phân lớp 3d và 4s đều chưa bão hoà electron.
Nguyên tố chuyển tiếp dãy thứ nhất: Là các nguyên tố có cấu hình electron lớp ngoài cùng là ns2(n-1)dx, trong đó n = 4 và x có thể từ 1 đến 10.
Cation của nguyên tố chuyển tiếp: Khi tạo cation, các nguyên tố chuyển tiếp thường mất electron ở lớp 4s trước, sau đó mới mất electron ở lớp 3d.
Phân tích các đáp án:
❌A. SAI. Phân lớp 4s thường bão hòa (4s2) hoặc mất electron khi tạo cation.
✔️B. ĐÚNG. Các nguyên tố chuyển tiếp dãy thứ nhất có phân lớp 3d chưa bão hòa electron, đây là đặc điểm quan trọng tạo nên tính chất đặc trưng của chúng.
❌C. SAI. Sự điền electron vào phân lớp 3d là một đặc điểm của nguyên tố chuyển tiếp, nhưng không phải là điều kiện bắt buộc trong cấu hình electron của nguyên tử hoặc cation.
❌D. SAI. Phân lớp 4s thường bão hòa hoặc mất electron khi tạo cation.
⟹ Chọn đáp án B Đáp án: B
Cation của nguyên tố chuyển tiếp: Khi tạo cation, các nguyên tố chuyển tiếp thường mất electron ở lớp 4s trước, sau đó mới mất electron ở lớp 3d.
Phân tích các đáp án:
❌A. SAI. Phân lớp 4s thường bão hòa (4s2) hoặc mất electron khi tạo cation.
✔️B. ĐÚNG. Các nguyên tố chuyển tiếp dãy thứ nhất có phân lớp 3d chưa bão hòa electron, đây là đặc điểm quan trọng tạo nên tính chất đặc trưng của chúng.
❌C. SAI. Sự điền electron vào phân lớp 3d là một đặc điểm của nguyên tố chuyển tiếp, nhưng không phải là điều kiện bắt buộc trong cấu hình electron của nguyên tử hoặc cation.
❌D. SAI. Phân lớp 4s thường bão hòa hoặc mất electron khi tạo cation.
⟹ Chọn đáp án B Đáp án: B
Câu 7 [304793]: Tên gọi của ester có mùi dứa là
A, Ethyl propionate.
B, Methyl formate.
C, Vinyl acetate.
D, Benzyl acetate.
HD: Các em xem lại bảng một số mùi quen thuộc và đặc trưng:
✔️ A. Ethyl propionate: CH3CH2COOC2H5 có mùi dứa.
❌ B. Methyl formate: HCOOCH3 có mùi táo.
❌ C. Vinyl acetate: CH3COOCH=CH2: không rõ.
❌ D. Benzyl acetate: CH3COOCH2C6H5: mùi hoa nhài.
⟹ Chọn đáp án A Đáp án: A
✔️ A. Ethyl propionate: CH3CH2COOC2H5 có mùi dứa.
❌ B. Methyl formate: HCOOCH3 có mùi táo.
❌ C. Vinyl acetate: CH3COOCH=CH2: không rõ.
❌ D. Benzyl acetate: CH3COOCH2C6H5: mùi hoa nhài.
⟹ Chọn đáp án A Đáp án: A
Câu 8 [706258]: Thực hiện phản ứng giữa các dung dịch sau:
(a) Potassium carbonate và calcium hydroxide.
(b) Sodium phosphate và barium chloride.
(c) Magnesium hydrogencarbonate và sulfuric acid.
(d) Sodium hydrogencarbonate và barium hydroxide.
(e) Barium hydroxide và nitric acid.
Số phản ứng thu được kết tủa là
(a) Potassium carbonate và calcium hydroxide.
(b) Sodium phosphate và barium chloride.
(c) Magnesium hydrogencarbonate và sulfuric acid.
(d) Sodium hydrogencarbonate và barium hydroxide.
(e) Barium hydroxide và nitric acid.
Số phản ứng thu được kết tủa là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
(a) Potassium carbonate (K2CO3) và calcium hydroxide (Ca(OH)2):
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Kết tủa: CaCO3
(b) Sodium phosphate (Na3PO4) và barium chloride (BaCl2):
2Na3PO4 + 3BaCl2 → Ba3(PO4)2↓ + 6NaCl
Kết tủa: Ba3(PO4)2
(c) Magnesium hydrogencarbonate (Mg(HCO3)2) và sulfuric acid (H2SO4):
Mg(HCO3)2 + H2SO4 → MgSO4 + 2H2O + 2CO2↑
Không có kết tủa. Khí CO2 bay lên.
(d) Sodium hydrogencarbonate (NaHCO3) và barium hydroxide (Ba(OH)2):
2NaHCO3 + Ba(OH)2 → BaCO3↓ + Na2CO3 + 2H2O
Kết tủa: BaCO3
(e) Barium hydroxide (Ba(OH)2) và nitric acid (HNO3):
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Không có kết tủa.
Các phản ứng (a), (b), (d) tạo kết tủa.
⟹ Chọn đáp án C Đáp án: C
(a) Potassium carbonate (K2CO3) và calcium hydroxide (Ca(OH)2):
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Kết tủa: CaCO3
(b) Sodium phosphate (Na3PO4) và barium chloride (BaCl2):
2Na3PO4 + 3BaCl2 → Ba3(PO4)2↓ + 6NaCl
Kết tủa: Ba3(PO4)2
(c) Magnesium hydrogencarbonate (Mg(HCO3)2) và sulfuric acid (H2SO4):
Mg(HCO3)2 + H2SO4 → MgSO4 + 2H2O + 2CO2↑
Không có kết tủa. Khí CO2 bay lên.
(d) Sodium hydrogencarbonate (NaHCO3) và barium hydroxide (Ba(OH)2):
2NaHCO3 + Ba(OH)2 → BaCO3↓ + Na2CO3 + 2H2O
Kết tủa: BaCO3
(e) Barium hydroxide (Ba(OH)2) và nitric acid (HNO3):
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Không có kết tủa.
Các phản ứng (a), (b), (d) tạo kết tủa.
⟹ Chọn đáp án C Đáp án: C
Câu 9 [561080]: Chlorophyll là phức chất tạo màu xanh cho lá cây, có cấu tạo như hình bên.
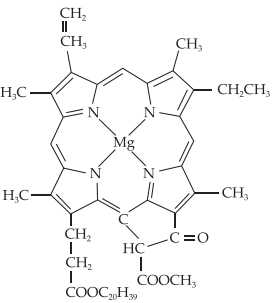
Số liên kết quanh nguyên tử trung tâm và số phối tử trong chlorophyll lần lượt là

Số liên kết quanh nguyên tử trung tâm và số phối tử trong chlorophyll lần lượt là
A, 6 và 6.
B, 4 và 1.
C, 4 và 4.
D, 6 và 4.
Mg là nguyên tử trung tâm trong chlorophyll được phối trí bởi bốn nguyên tử (N) trong vòng tạo thành 4 liên kết nằm trong 1 vòng.
Phối tử là porphyrin => Có 1 phối tử
⟹ Chọn đáp án B Đáp án: B
Phối tử là porphyrin => Có 1 phối tử
⟹ Chọn đáp án B Đáp án: B
Câu 10 [247410]: Hai nguyên tử A, B thuộc hai nhóm liên tiếp nhau trong bảng tuần hoàn 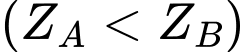 có tổng số hạt electron trong hai nguyên tử là 29 hạt. Điện tích hạt nhân của nguyên tử A, B lần lượt là
có tổng số hạt electron trong hai nguyên tử là 29 hạt. Điện tích hạt nhân của nguyên tử A, B lần lượt là
 có tổng số hạt electron trong hai nguyên tử là 29 hạt. Điện tích hạt nhân của nguyên tử A, B lần lượt là
có tổng số hạt electron trong hai nguyên tử là 29 hạt. Điện tích hạt nhân của nguyên tử A, B lần lượt là A, +14, +15.
B, +13, +16.
C, +15, +14.
D, +16, +13.
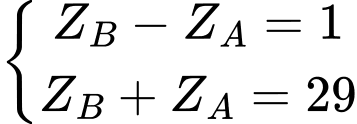
⇒
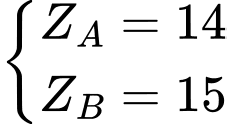
⟹ Chọn đáp án A Đáp án: A
Câu 11 [308362]: Dung dịch saccharose phản ứng chất X tạo ra dung dịch màu xanh lam đặc trưng. Chất X là
A, H2/Ni, tº.
B, AgNO3/NH3.
C, H2O/H+, to.
D, Cu(OH)2/OH–.
HD: Phân tích các đáp án:
❌ A. saccharose + H2/Ni, to: không xảy ra phản ứng, không có hiện tượng gì.
❌ B. saccharose + AgNO3/NH3: saccharose không tráng bạc, nên cũng không có hiện tượng.
❌ C. saccharose + H2O/H+, to: xảy ra phản ứng thủy phân thu được glucose + fructose cùng trạng thái và màu sắc nên cũng không có hiện tượng quan sát được.
✔️ D. saccharose + Cu(OH)2/OH–: xảy ra phản ứng do tính chất của polyalcohol có OH liền kề của saccharose tương tự như glucose và fructose:
2C12H22O11 (saccharose) + Cu(OH)2 → Cu(C12H21O11)2 (phức chất màu xanh lam) + 2H2O.
⇒ Hiện tượng quan sát được đúng theo yêu cầu ⇝ Chọn đáp án D. ♠ Đáp án: D
❌ A. saccharose + H2/Ni, to: không xảy ra phản ứng, không có hiện tượng gì.
❌ B. saccharose + AgNO3/NH3: saccharose không tráng bạc, nên cũng không có hiện tượng.
❌ C. saccharose + H2O/H+, to: xảy ra phản ứng thủy phân thu được glucose + fructose cùng trạng thái và màu sắc nên cũng không có hiện tượng quan sát được.
✔️ D. saccharose + Cu(OH)2/OH–: xảy ra phản ứng do tính chất của polyalcohol có OH liền kề của saccharose tương tự như glucose và fructose:
2C12H22O11 (saccharose) + Cu(OH)2 → Cu(C12H21O11)2 (phức chất màu xanh lam) + 2H2O.
⇒ Hiện tượng quan sát được đúng theo yêu cầu ⇝ Chọn đáp án D. ♠ Đáp án: D
Câu 12 [305727]: Hydrogen hoá hoàn toàn triolein có công thức (C17H33COO)3C3H5 trong điều kiện xúc tác Ni, đun nóng, thu được chất béo X. Công thức của X là
A, (C17H35COO)3C3H5.
B, (C17H37COO)3C3H5.
C, (C17H31COO)3C3H5.
D, (C15H31COO)3C3H5.
Phản ứng hydrogen hóa:
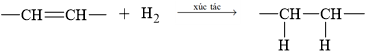
Triolein: (C17H33COO)3C3H5 có 3 nối đôi C=C ⟶ khi phản ứng hoàn toàn sẽ thu được tristearin: (C17H35COO)3C3H5.
(C17H33COO)3C3H5 + 3H2 –––Ni, to–→ (C17H35COO)3C3H5.
⟹ Chọn đáp án A. Đáp án: A
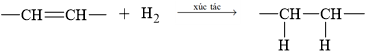
Triolein: (C17H33COO)3C3H5 có 3 nối đôi C=C ⟶ khi phản ứng hoàn toàn sẽ thu được tristearin: (C17H35COO)3C3H5.
(C17H33COO)3C3H5 + 3H2 –––Ni, to–→ (C17H35COO)3C3H5.
⟹ Chọn đáp án A. Đáp án: A
Câu 13 [308791]: Thủy phân hoàn toàn a mol Gly-Ala-Val-Glu trong dung dịch NaOH dư, có b mol NaOH phản ứng. Tỉ lệ a : b tương ứng là
A, 1 : 3.
B, 1 : 5.
C, 1 : 4.
D, 1 : 2.
Gly−Ala−Val−Glu + 5 NaOH → Gly−Na + Ala−Na + Val−Na + Glu−(Na)2 + 2H2O
⇒ tỉ lệ a : b = 1 : 5
(Gốc glutamic acid còn chứa thêm một nhóm carboxyl tự do nên tỉ lệ mol khi tác dụng với NaOH tăng 1 đơn vị)
⟹ Chọn đáp án B Đáp án: B
⇒ tỉ lệ a : b = 1 : 5
(Gốc glutamic acid còn chứa thêm một nhóm carboxyl tự do nên tỉ lệ mol khi tác dụng với NaOH tăng 1 đơn vị)
⟹ Chọn đáp án B Đáp án: B
Câu 14 [309737]: Giải trùng hợp polymer có cấu tạo
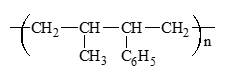
ta sẽ thu được monome nào sau đây?
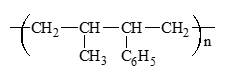
ta sẽ thu được monome nào sau đây?
A, 2-Methyl–3–phenylbut-2-ene.
B, 2–Methyl–3–phenylbutane.
C, Propylene và styrene.
D, Isoprene và toluene.
Đây là cấu trúc của một đồng trùng hợp giữa propylene (CH2=CH-CH3) và styrene (C6H5CH=CH2).
Nên khi giải trùng hợp polymer này, các monomer thu được là:
+ Propylene (CH2=CH-CH3)
+ Styrene (C6H5CH=CH2).
⟹ Chọn đáp án C Đáp án: C
Nên khi giải trùng hợp polymer này, các monomer thu được là:
+ Propylene (CH2=CH-CH3)
+ Styrene (C6H5CH=CH2).
⟹ Chọn đáp án C Đáp án: C
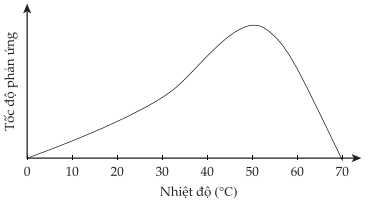
Câu 15 [706259]: Hầu hết những phản ứng sinh hoá xảy ra nhờ sự xúc tác của các enzyme. Biểu đồ dưới đây thể hiện tốc độ của một phản ứng sinh hoá do enzyme X làm xúc tác theo nhiệt độ:

A, 0 oC.
B, 50 oC.
C, 60 oC.
D, 70 oC.
Biểu đồ cho thấy tốc độ phản ứng tăng dần khi nhiệt độ tăng từ 0oC đến khoảng 50oC.
Tốc độ phản ứng đạt cực đại ở khoảng 50oC.
Sau đó, tốc độ phản ứng giảm nhanh khi nhiệt độ tiếp tục tăng.
⟹ Chọn đáp án B Đáp án: B
Tốc độ phản ứng đạt cực đại ở khoảng 50oC.
Sau đó, tốc độ phản ứng giảm nhanh khi nhiệt độ tiếp tục tăng.
⟹ Chọn đáp án B Đáp án: B
Câu 16 [308304]: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho 1 mL dung dịch AgNO3 1% vào ống nghiệm sạch.
Bước 2: Thêm từ từ từng giọt dung dịch NH3, lắc đều cho đến khi kết tủa tan hết.
Bước 3: Thêm tiếp khoảng 1 mL dung dịch glucose 1% vào ống nghiệm; đun nóng nhẹ.
Phát biểu nào sau đây sai?
Bước 1: Cho 1 mL dung dịch AgNO3 1% vào ống nghiệm sạch.
Bước 2: Thêm từ từ từng giọt dung dịch NH3, lắc đều cho đến khi kết tủa tan hết.
Bước 3: Thêm tiếp khoảng 1 mL dung dịch glucose 1% vào ống nghiệm; đun nóng nhẹ.
Phát biểu nào sau đây sai?
A, Sản phẩm hữu cơ thu được sau bước 3 là ammonium gluconate.
B, Thí nghiệm trên chứng minh glucose có tính chất của polyalcohol.
C, Sau bước 3, có lớp bạc kim loại bám trên thành ống nghiệm.
D, Trong phản ứng ở bước 3, glucose đóng vai trò là chất khử.
HD: Phân tích thí nghiệm:
• Sau bước 2: Ống nghiệm xuất hiện kết tủa AgOH màu trắng.
NH3 + H2O ⇄ NH4+ + OH–.
Ag+ + OH– → AgOH↓.
Tiếp tục nhỏ NH3 vào thì kết tủa tan do tạo thành phức chất [Ag(NH3)2]OH.
AgOH + 2NH3 → [Ag(NH3)2]OH.
• Sau bước 3: Ống nghiệm xuất hiện một lớp kim loại bạc bám trên bề mặt của ống nghiệm.
CH2OH[CHOH]4CHO + [Ag(NH3)2]OH → CH2OH[CHOH]4COONH4 + 2Ag↓ + 3NH3 + H2O.
⇒ Phân tích các phát biểu:
✔️ A. đúng. CH2OH[CHOH]4COONH4 có tên là ammonium gluconate.
❌ B. sai. Thí nghiệm chứng minh tính chất của nhóm chức aldehyde CHO.
✔️ C. đúng theo phân tích trên.
✔️ D. đúng. Mẹo nhỏ: AgNO3 → Ag nên AgNO3 thể hiện tính oxy hóa ⇒ glucose thể hiện tính khử là đúng.
⟹ Chọn đáp án B Đáp án: B
• Sau bước 2: Ống nghiệm xuất hiện kết tủa AgOH màu trắng.
NH3 + H2O ⇄ NH4+ + OH–.
Ag+ + OH– → AgOH↓.
Tiếp tục nhỏ NH3 vào thì kết tủa tan do tạo thành phức chất [Ag(NH3)2]OH.
AgOH + 2NH3 → [Ag(NH3)2]OH.
• Sau bước 3: Ống nghiệm xuất hiện một lớp kim loại bạc bám trên bề mặt của ống nghiệm.
CH2OH[CHOH]4CHO + [Ag(NH3)2]OH → CH2OH[CHOH]4COONH4 + 2Ag↓ + 3NH3 + H2O.
⇒ Phân tích các phát biểu:
✔️ A. đúng. CH2OH[CHOH]4COONH4 có tên là ammonium gluconate.
❌ B. sai. Thí nghiệm chứng minh tính chất của nhóm chức aldehyde CHO.
✔️ C. đúng theo phân tích trên.
✔️ D. đúng. Mẹo nhỏ: AgNO3 → Ag nên AgNO3 thể hiện tính oxy hóa ⇒ glucose thể hiện tính khử là đúng.
⟹ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Cho giá trị thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
Cl2 + 2e ⟶ 2Cl–; Eo = 1,36 V.
Fe3+ + e ⟶ Fe2+; Eo = 0,77 V.
MnO4– + 8H+ + 5e ⟶ Mn2+ + 4H2O; Eo = 1,51 V.
SO42– + 4H+ + 2e ⟶ SO2 + 2H2O; Eo = 0,17 V.
Để chuẩn hóa dung dịch KMnO4 (xác định nồng độ dung dịch), một học sinh đã cân 5,56 g FeSO4.7H2O, hòa tan nó trong H2SO4 và pha loãng đến tổng thể tích là 250,0 mL bằng nước cất. Lấy 3 phần vào 3 bình tam giác, mỗi phần lấy 25,0 mL dung dịch này và thêm 10 mL H2SO4 2,00 M. Sau đó chuẩn độ các phần này bằng dung dịch KMnO4. Thể tích dung dịch KMnO4 sử dụng trung bình là 21,2 mL.
Cl2 + 2e ⟶ 2Cl–; Eo = 1,36 V.
Fe3+ + e ⟶ Fe2+; Eo = 0,77 V.
MnO4– + 8H+ + 5e ⟶ Mn2+ + 4H2O; Eo = 1,51 V.
SO42– + 4H+ + 2e ⟶ SO2 + 2H2O; Eo = 0,17 V.
Để chuẩn hóa dung dịch KMnO4 (xác định nồng độ dung dịch), một học sinh đã cân 5,56 g FeSO4.7H2O, hòa tan nó trong H2SO4 và pha loãng đến tổng thể tích là 250,0 mL bằng nước cất. Lấy 3 phần vào 3 bình tam giác, mỗi phần lấy 25,0 mL dung dịch này và thêm 10 mL H2SO4 2,00 M. Sau đó chuẩn độ các phần này bằng dung dịch KMnO4. Thể tích dung dịch KMnO4 sử dụng trung bình là 21,2 mL.
Câu 17 [706260]: Mục đích chính của việc bạn học sinh sử dụng sulfuric acid chứ không phải hydrochloric acid trong quá trình chuẩn độ?
A, Acid HCl chứa ion Cl– sẽ tạo phức với ion Fe2+.
B, Acid H2SO4 tạo ra nhiều ion H+ hơn acid HCl.
C, Acid HCl chứa ion Cl– sẽ phản ứng với KMnO4.
D, Muối FeSO4 chứa gốc acid SO42– nên sử dụng acid H2SO4.
Không sử dụng HCl vì HCl phản ứng với KMnO4 tạo ra khí Cl2 có độc tính cao và ảnh hưởng đến kết quả chuẩn độ.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Phân tích các đáp án:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Phân tích các đáp án:
❌A. SAI. Acid HCl chứa ion Cl– không tạo phức với ion Fe2+
❌B. SAI. Cả hai đều là axit mạnh và phân ly hoàn toàn trong dung dịch loãng, tạo ra lượng ion H+ tương đương nhau.
✔️C. ĐÚNG. Ion clorua phản ứng trực tiếp với KMnO4 trong chuẩn độ, gây ảnh hưởng tới kết quả chuẩn độ.
❌D. SAI. Mặc dù muối FeSO4 chứa gốc SO42-, nhưng đây không phải là lý do chính khiến H2SO4 được sử dụng.
⟹ Chọn đáp án C
Đáp án: C ⟹ Chọn đáp án C
Câu 18 [706275]: Nếu mỗi phần không lấy 25,0 mL mà là lấy 50,0 mL, các số liệu kết quả khác coi như không thay đổi thì nồng độ dung dịch KMnO4 là
A, 0,019 M.
B, 0,038 M.
C, 0,050 M.
D, 0,067 M.
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Đổi 21,2 mL = 0,0212 L
Số mol của FeSO4.7H2O là nFeSO4.7H2O = 5,56 : 278 = 0,02 mol
Số mol FeSO4 trong 50 mL dung dịch là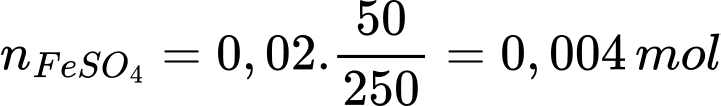
Từ PTHH số mol của KMnO4 là nKMnO4 = 0,0008 mol
Nồng độ của dung dịch KMnO4 là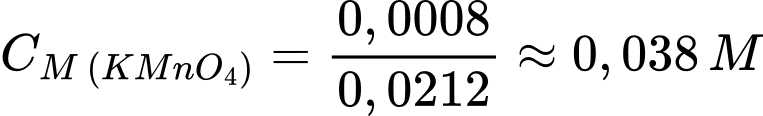
⟹ Chọn đáp án B Đáp án: B
Đổi 21,2 mL = 0,0212 L
Số mol của FeSO4.7H2O là nFeSO4.7H2O = 5,56 : 278 = 0,02 mol
Số mol FeSO4 trong 50 mL dung dịch là
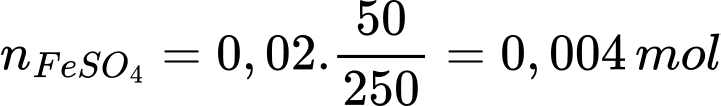
Từ PTHH số mol của KMnO4 là nKMnO4 = 0,0008 mol
Nồng độ của dung dịch KMnO4 là
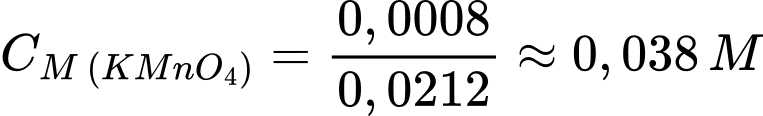
⟹ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
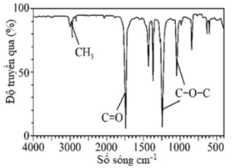
Câu 19 [706276]: Hợp chất hữu cơ X (đơn chức) là một chất lỏng dễ cháy, không màu, có nhiệt độ sôi thấp (57°C), được dùng làm dung môi cho nhiều loại nhựa và dầu. Phần trăm khối lượng các nguyên tố trong X là 48,85% carbon, 8,11% hydrogen còn lại là oxygen. Kết quả phân tích phổ IR của hợp chất hữu cơ X như hình sau:

Ta có: %O = 100% - 48,85% - 8,11% = 43,04%.
Gọi công thức tổng quát của X có dạng CxHyOz
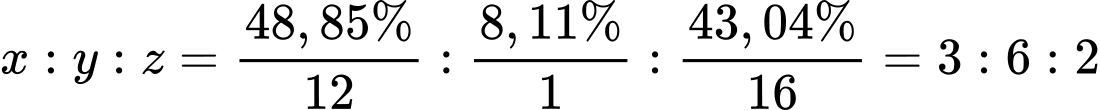
Công thức đơn giản nhất của X là (C3H6O2)n
Công thức phân tử của hợp chất hữu cơ là: C3H6O2
Từ kết quả phổ hồng ngoại các công thức cấu tạo của X là
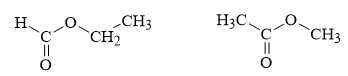
Phân tích các phát biểu:
❌ a.Sai. Số nguyên tử Carbon là 3. Số nguyên tử O là 2. X có số nguyên tử carbon gấp 1,5 lần số nguyên tử oxygen.
✔️ b.Đúng. Liên kết C-O-C trên phổ IR của X có thể là nhóm chức ether hoặc là C-O-C trong nhóm ester.
❌ c. Sai.Từ kết quả phổ hồng ngoại các công thức cấu tạo của X là
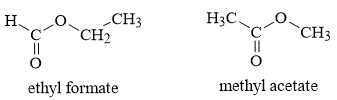
✔️ d. Đúng.Thuỷ phân hoàn toàn X trong dung dịch NaOH thu được muối và alcohol.
HCOOC2H5 + NaOH → HCOONa + C2H5OH
CH3COOCH3 + NaOH → CH3COONa + CH3OH
Gọi công thức tổng quát của X có dạng CxHyOz
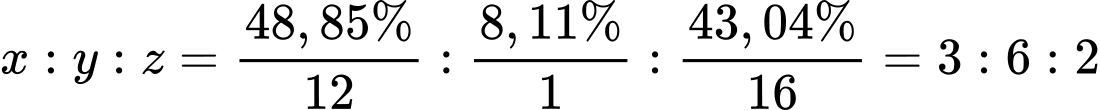
Công thức đơn giản nhất của X là (C3H6O2)n
Công thức phân tử của hợp chất hữu cơ là: C3H6O2
Từ kết quả phổ hồng ngoại các công thức cấu tạo của X là
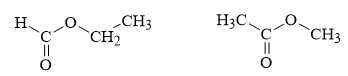
Phân tích các phát biểu:
❌ a.Sai. Số nguyên tử Carbon là 3. Số nguyên tử O là 2. X có số nguyên tử carbon gấp 1,5 lần số nguyên tử oxygen.
✔️ b.Đúng. Liên kết C-O-C trên phổ IR của X có thể là nhóm chức ether hoặc là C-O-C trong nhóm ester.
❌ c. Sai.Từ kết quả phổ hồng ngoại các công thức cấu tạo của X là
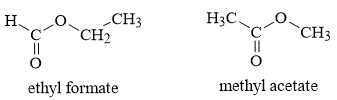
✔️ d. Đúng.Thuỷ phân hoàn toàn X trong dung dịch NaOH thu được muối và alcohol.
HCOOC2H5 + NaOH → HCOONa + C2H5OH
CH3COOCH3 + NaOH → CH3COONa + CH3OH
Câu 20 [706277]: Biến thiên entropy tiêu chuẩn (ΔSo) của một phản ứng là đại lượng đặc trưng cho mức độ hỗn loạn của hệ.
∎ ΔSo > 0: Mức độ hỗn loạn của hệ tăng.
∎ ΔSo < 0: Mức độ hỗn loạn của hệ giảm.
Để nghiên cứu sự biến đổi giá trị entropy tiêu chuẩn (ΔSo) của một phản ứng, tiến hành thí nghiệm như sau: Nung một mẫu khí SiH4 ở nhiệt độ cao, lúc này SiH4 bị phân hủy tạo thành silicon rắn và khí hydrogen.
(*) SiH4(g) ⇌ Si(s) + 2H2(g).
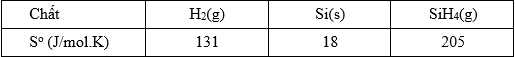
Bảng dưới đây cho biết giá trị entropy tiêu chuẩn của các chất.
∎ ΔSo > 0: Mức độ hỗn loạn của hệ tăng.
∎ ΔSo < 0: Mức độ hỗn loạn của hệ giảm.
Để nghiên cứu sự biến đổi giá trị entropy tiêu chuẩn (ΔSo) của một phản ứng, tiến hành thí nghiệm như sau: Nung một mẫu khí SiH4 ở nhiệt độ cao, lúc này SiH4 bị phân hủy tạo thành silicon rắn và khí hydrogen.
(*) SiH4(g) ⇌ Si(s) + 2H2(g).
Bảng dưới đây cho biết giá trị entropy tiêu chuẩn của các chất.

Phân tích các phát biểu:
❌(a) – Sai. SiH4 là hợp chất cộng hoá trị nên kém bền với nhiệt hơn hợp chất ion.
❌(b) – Sai. H2 tồn tại ở thể khí nên có mức độ hỗn loạn lớn hơn Si tồn tại ở thể rắn, trạng thái khí các phân tử phân tán hơn và di chuyển không có trật tự như trạng thái rắn nên H2 có giá trị entropy (độ hỗn loạn) lớn hơn Si
✔️(c) – Đúng. Hệ có càng nhiều số mol chất khí thì mức độ hỗn loạn của hệ càng tăng. Khi số mol chất khí tăng, số lượng các phân tử trong hệ tăng lên, dẫn đến khả năng chuyển động và phân bố năng lượng của các phân tử trong không gian rộng hơn. Điều này làm cho hệ trở nên hỗn loạn hơn, tức là entropy của hệ tăng. Đây là nguyên lý thứ hai của nhiệt động lực học, khi nó nói rằng trong một hệ kín, entropy có xu hướng tăng cho đến khi đạt được trạng thái cân bằng nhiệt động.
❌(d) – Sai.
SiH4(g) ⟶ Si(s) + H2(g)
Biến thiên entropy của phản ứng là
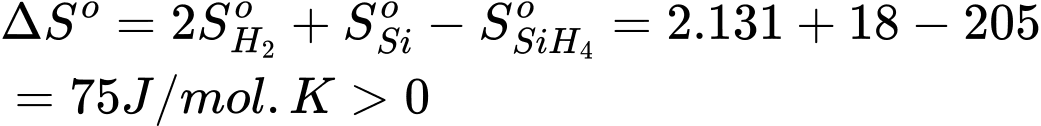
→ Mức độ hỗn loạn của hệ tăng.
❌(a) – Sai. SiH4 là hợp chất cộng hoá trị nên kém bền với nhiệt hơn hợp chất ion.
❌(b) – Sai. H2 tồn tại ở thể khí nên có mức độ hỗn loạn lớn hơn Si tồn tại ở thể rắn, trạng thái khí các phân tử phân tán hơn và di chuyển không có trật tự như trạng thái rắn nên H2 có giá trị entropy (độ hỗn loạn) lớn hơn Si
✔️(c) – Đúng. Hệ có càng nhiều số mol chất khí thì mức độ hỗn loạn của hệ càng tăng. Khi số mol chất khí tăng, số lượng các phân tử trong hệ tăng lên, dẫn đến khả năng chuyển động và phân bố năng lượng của các phân tử trong không gian rộng hơn. Điều này làm cho hệ trở nên hỗn loạn hơn, tức là entropy của hệ tăng. Đây là nguyên lý thứ hai của nhiệt động lực học, khi nó nói rằng trong một hệ kín, entropy có xu hướng tăng cho đến khi đạt được trạng thái cân bằng nhiệt động.
❌(d) – Sai.
SiH4(g) ⟶ Si(s) + H2(g)
Biến thiên entropy của phản ứng là
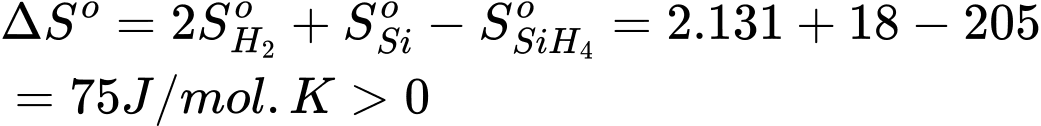
→ Mức độ hỗn loạn của hệ tăng.
Câu 21 [308649]: Dưới đây là sơ đồ để tách hỗn hợp amine béo chính (RNH2), carboxylic acid (RCOOH) và phenol (ArOH). Giả sử các chất trên không tan trong nước nhưng tan trong diethyl ether. Hỗn hợp này được tách thành các phần A, B và C.
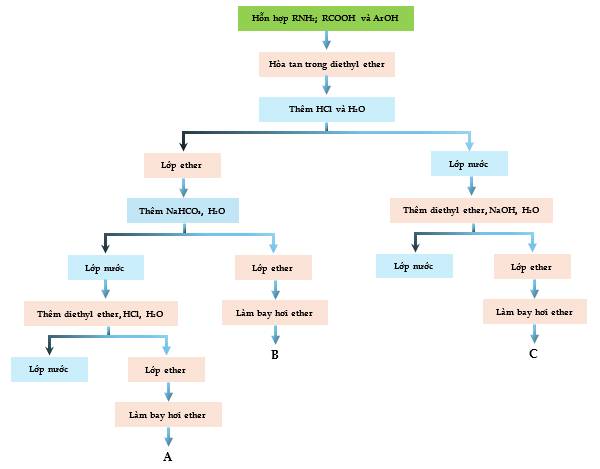

Phân tích sơ đồ tách chế hỗn hợp:
Hỗn hợp RNH2; RCOOH và ArOH khi hòa tan trong diethyl ether rồi thêm HCl và H2O thì dung dịch được tách làm 2 lớp:
① Lớp ether gồm RCOOH và ArOH ở phía trên → Thêm NaHCO3 thu được 2 lớp:
+ Lớp ether là ArOH (B)
+ Lớp nước là RCOO-Na+ → Thêm diethyl ether, HCl, H2O thì dd tách 2 lớp: lớp nước và lớp ether. Làm bay hơi ether thu được RCOOH (A)
② Lớp nước là RNH3+Cl- ở dưới. Thêm diethyl ether, NaOH và H2O vào thì dd tách làm 2 lớp: lớp nước và lớp ether. Làm bay hơi ether thu được RNH2 (C)
Phân tích các phát biểu:
❌ Sai. A là carboxylic acid RCOOH theo phân tích sơ đồ
✔️ Đúng. C là amine RNH2
✔️ Đúng. Carboxylic acid RCOOH có khả năng tác dụng với NaHCO3
✔️ Đúng. C là amine, có tính base yếu nên có phản ứng với dung dịch HCl tạo muối RNH3+ tan trong nước.
Hỗn hợp RNH2; RCOOH và ArOH khi hòa tan trong diethyl ether rồi thêm HCl và H2O thì dung dịch được tách làm 2 lớp:
① Lớp ether gồm RCOOH và ArOH ở phía trên → Thêm NaHCO3 thu được 2 lớp:
+ Lớp ether là ArOH (B)
+ Lớp nước là RCOO-Na+ → Thêm diethyl ether, HCl, H2O thì dd tách 2 lớp: lớp nước và lớp ether. Làm bay hơi ether thu được RCOOH (A)
② Lớp nước là RNH3+Cl- ở dưới. Thêm diethyl ether, NaOH và H2O vào thì dd tách làm 2 lớp: lớp nước và lớp ether. Làm bay hơi ether thu được RNH2 (C)
Phân tích các phát biểu:
❌ Sai. A là carboxylic acid RCOOH theo phân tích sơ đồ
✔️ Đúng. C là amine RNH2
✔️ Đúng. Carboxylic acid RCOOH có khả năng tác dụng với NaHCO3
✔️ Đúng. C là amine, có tính base yếu nên có phản ứng với dung dịch HCl tạo muối RNH3+ tan trong nước.
Câu 22 [706278]: Bornite là một loại quặng chứa đồng với thành phần chính là Cu5FeS4. Tiến hành quá trình sản xuất đồng từ quặng borinite qua 4 giai đoạn như sau:
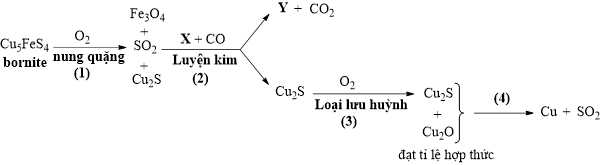
∎ Nung quặng (giai đoạn 1): Đun nóng quặng chứa thành phần chính là Cu5FeS4 trong oxygen, tạo ra sản phẩm gồm hỗn hợp Cu2S, Fe3O4 và SO2.
∎ Luyện kim (giai đoạn 2): Hỗn hợp phản ứng với CO và hợp chất X (chứa hai nguyên tố với 53,25 % O, có nhiệt độ nóng chảy cao), chỉ có Fe3O4 phản ứng tạo thành hợp chất Y (chứa 31,41% O và 54,81% Fe) và CO2. Trong pha lỏng, hợp chất Y không trộn lẫn được với Cu2S, do đó nhanh chóng bị tách ra dưới dạng xỉ.
∎ Loại lưu huỳnh (giai đoạn 3): Đun nóng với oxyen để chuyển hóa một phần Cu2S thành Cu2O.
∎ Oxi hóa khử (giai đoạn 4): Khi Cu2S và Cu2O đạt tỉ lệ hợp thức sẽ được cho phản ứng với nhau, tạo thành đồng và SO2.

∎ Nung quặng (giai đoạn 1): Đun nóng quặng chứa thành phần chính là Cu5FeS4 trong oxygen, tạo ra sản phẩm gồm hỗn hợp Cu2S, Fe3O4 và SO2.
∎ Luyện kim (giai đoạn 2): Hỗn hợp phản ứng với CO và hợp chất X (chứa hai nguyên tố với 53,25 % O, có nhiệt độ nóng chảy cao), chỉ có Fe3O4 phản ứng tạo thành hợp chất Y (chứa 31,41% O và 54,81% Fe) và CO2. Trong pha lỏng, hợp chất Y không trộn lẫn được với Cu2S, do đó nhanh chóng bị tách ra dưới dạng xỉ.
∎ Loại lưu huỳnh (giai đoạn 3): Đun nóng với oxyen để chuyển hóa một phần Cu2S thành Cu2O.
∎ Oxi hóa khử (giai đoạn 4): Khi Cu2S và Cu2O đạt tỉ lệ hợp thức sẽ được cho phản ứng với nhau, tạo thành đồng và SO2.
(1) Gọi X có dạng MxOy
Phần trăm khối lượng của nguyên tố oxygen là:
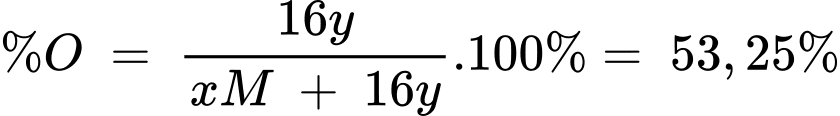
Chọn x = 1 y = 2 M = 28 M là Si, X là SiO2
Tỉ lệ nguyên tố trong Y:
Fe: Si: O = 54, 81/56 : 13, 78/28 : 31, 41/16
= 0 ,98 : 0,49 : 1,96 = 2:1:4
⟶ Y là Fe2SiO4 hay 2FeO.SiO2
Giai đoạn (1)
Giai đoạn (2)
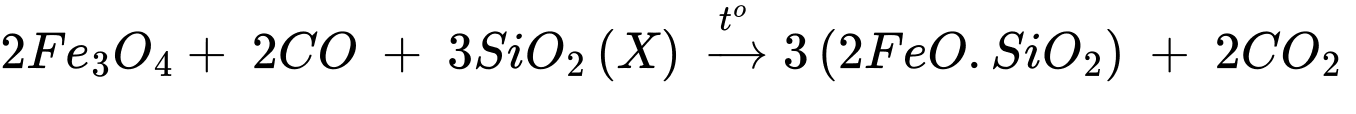
Giai đoạn (3):
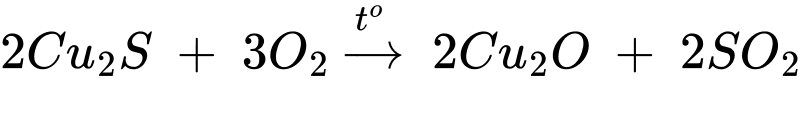
Giai đoạn (4):
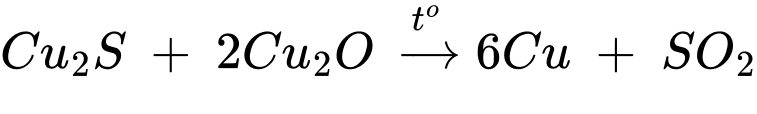
Phân tích các phát biểu:
✔️(a) – Đúng. Theo lời giải phần (1), hợp chất X là SiO2.
✔️(b) – Đúng. Cứ 1 mol Cu2S phản ứng với 2 mol Cu2O nên tỉ lệ hợp thức của Cu2S và Cu2O là 1 : 2.
✔️(c) – Đúng. Từ 1 mol Cu5FeS4 theo bảo toàn nguyên tố có thể tạo thành tối đa 5 mol đồng nguyên chất.
✔️(d) – Đúng. Thành phần phần trăm của đồng trong các hợp chất tăng dần qua các giai đoạn: 63,52%(Cu5FeS4) ⟶ 80%(Cu2S)⟶ 100%(Cu).
Phần trăm khối lượng của nguyên tố oxygen là:
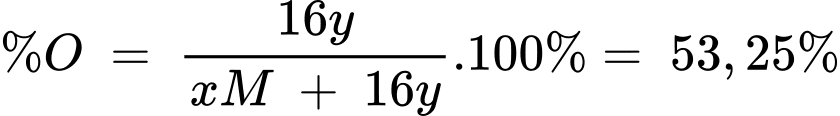
Chọn x = 1 y = 2 M = 28 M là Si, X là SiO2
Tỉ lệ nguyên tố trong Y:
Fe: Si: O = 54, 81/56 : 13, 78/28 : 31, 41/16
= 0 ,98 : 0,49 : 1,96 = 2:1:4
⟶ Y là Fe2SiO4 hay 2FeO.SiO2
Giai đoạn (1)
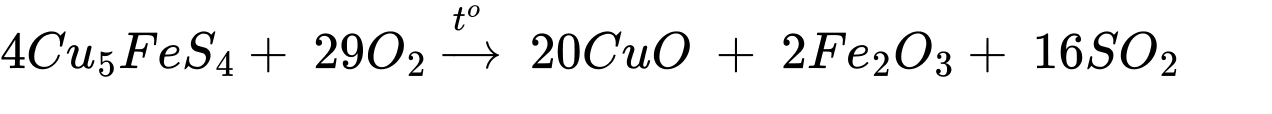
Giai đoạn (2)
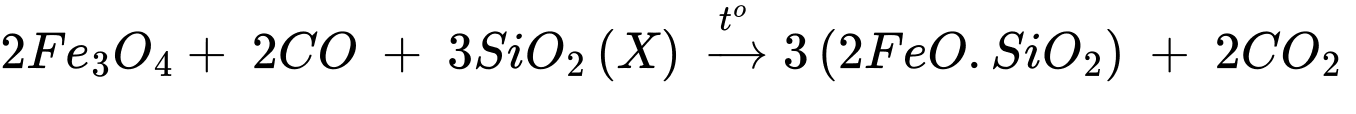
Giai đoạn (3):
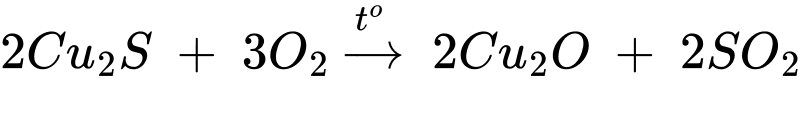
Giai đoạn (4):
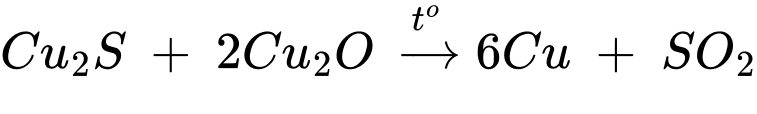
Phân tích các phát biểu:
✔️(a) – Đúng. Theo lời giải phần (1), hợp chất X là SiO2.
✔️(b) – Đúng. Cứ 1 mol Cu2S phản ứng với 2 mol Cu2O nên tỉ lệ hợp thức của Cu2S và Cu2O là 1 : 2.
✔️(c) – Đúng. Từ 1 mol Cu5FeS4 theo bảo toàn nguyên tố có thể tạo thành tối đa 5 mol đồng nguyên chất.
✔️(d) – Đúng. Thành phần phần trăm của đồng trong các hợp chất tăng dần qua các giai đoạn: 63,52%(Cu5FeS4) ⟶ 80%(Cu2S)⟶ 100%(Cu).
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [706286]: Một mẫu nước cứng có nồng độ các ion như sau: Ca2+ x M; Mg2+ y M; HCO3– 0,005 M; Cl– 0,004 M; SO42– 0,001 M. Để làm mềm 10 L nước này cần dùng tối thiểu bao nhiêu gam sodium carbonate?
Áp dụng định luật bảo toàn điện tích:
2x + 2y = 0,005 + 0,004 + 0,001.2 → x + y = 0,0055 M
Tổng số mol của Mg2+ và Ca2+ là nCa2+ + nMg2+ = 0,0055 × 10 = 0,055 mol
Mg2+ + CO32- → MgCO3
Ca2+ + CO32- → CaCO3
Theo phương trình số mol của CO32- là 0,055 mol
Khối lượng của Na2CO3 cần thiết là mNa2CO3 = 0,055 × 106 = 5,83 gam
⟹ Điền đáp án: 5,83
2x + 2y = 0,005 + 0,004 + 0,001.2 → x + y = 0,0055 M
Tổng số mol của Mg2+ và Ca2+ là nCa2+ + nMg2+ = 0,0055 × 10 = 0,055 mol
Mg2+ + CO32- → MgCO3
Ca2+ + CO32- → CaCO3
Theo phương trình số mol của CO32- là 0,055 mol
Khối lượng của Na2CO3 cần thiết là mNa2CO3 = 0,055 × 106 = 5,83 gam
⟹ Điền đáp án: 5,83
Câu 24 [706287]: Cho các mẫu chất và dán nhãn tương ứng như sau: Methyl formate (1), hồ tinh bột (2), aniline (3), acetic acid (4). Kết quả thí nghiệm các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng:

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)
⭐Mẫu thử X: Phân tử tinh bột hấp phụ iodine tạo thành hợp chất màu xanh tím. Phản ứng được sử dụng nhận biết tinh bột hoặc iodine.
→ Ứng với hồ tinh bột (2).
⭐Mẫu thử Y: Aniline + nước bromine
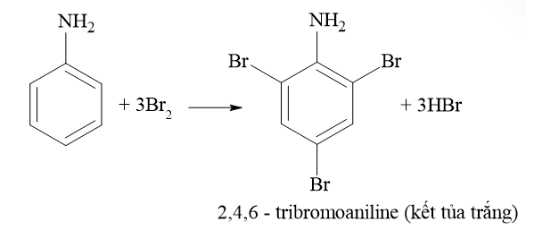
=> Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine
→ Ứng với aniline (3)
⭐Mẫu thử Z: Tác dung với NaHCO3 có khí thoát ra ứng với acetic acid (4)
Phương trình phản ứng:
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
⭐Mẫu thử T: Phản ứng với AgNO3/NH3 tạo ra kết tủa màu tráng bạc
→ Ứng với methyl formate (1) chứa nhóm -CHO nên có khả năng tham gia phản ứng tráng bạc
HCOOCH3 + 2AgNO3 + 3NH3 + H2O → CH3OCOONH4 + 2NH4NO3 + 2Ag
⟹ Điền đáp án: 2341
→ Ứng với hồ tinh bột (2).
⭐Mẫu thử Y: Aniline + nước bromine

=> Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine
→ Ứng với aniline (3)
⭐Mẫu thử Z: Tác dung với NaHCO3 có khí thoát ra ứng với acetic acid (4)
Phương trình phản ứng:
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
⭐Mẫu thử T: Phản ứng với AgNO3/NH3 tạo ra kết tủa màu tráng bạc
→ Ứng với methyl formate (1) chứa nhóm -CHO nên có khả năng tham gia phản ứng tráng bạc
HCOOCH3 + 2AgNO3 + 3NH3 + H2O → CH3OCOONH4 + 2NH4NO3 + 2Ag
⟹ Điền đáp án: 2341
Câu 25 [706288]: Tiến hành khử 15 g nitroethane thành ethylamine bằng tác nhân Fe trong dung dịch HCl. Amine thu được tồn tại dưới dạng muối RNH3+Cl–. Khối lượng muối thu được là bao nhiêu gam?
Sơ đồ phản ứng:
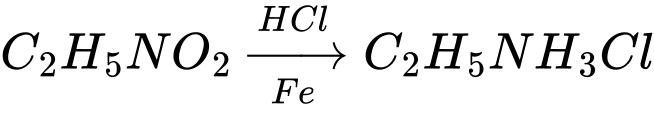
Số mol của nitroethane là
nC2H5NO2 = 15 ÷ 75 = 0,2 mol
Theo phương trình số mol của C2H5NH3Cl là:
nC2H5NH3Cl = nC2H5NO2 = 0,2 mol
Khối lượng muối thu được là
m C2H5NH3Cl = 0,2 × 81,5 = 16,3 gam
⟹ Điền đáp án: 16,3
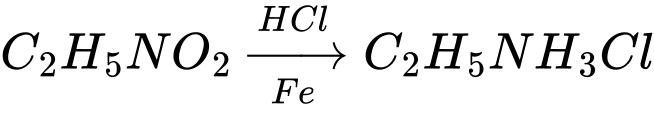
Số mol của nitroethane là
nC2H5NO2 = 15 ÷ 75 = 0,2 mol
Theo phương trình số mol của C2H5NH3Cl là:
nC2H5NH3Cl = nC2H5NO2 = 0,2 mol
Khối lượng muối thu được là
m C2H5NH3Cl = 0,2 × 81,5 = 16,3 gam
⟹ Điền đáp án: 16,3
Câu 26 [706289]: Cho các phát biểu sau:
(a) Chất béo nhẹ hơn nước và không tan trong nước.
(b) Mật ong và nước ép quả nho chín đều có phản ứng tráng bạc.
(c) Tơ visco và tơ acetate đều có nguồn gốc từ cellulose.
(d) Dung dịch lòng trắng trứng gà bị đông tụ khi đun nóng.
(e) Cacboxylic acid có lực acid mạnh hơn phenol và alcohol.
Số phát biểu đúng là
(a) Chất béo nhẹ hơn nước và không tan trong nước.
(b) Mật ong và nước ép quả nho chín đều có phản ứng tráng bạc.
(c) Tơ visco và tơ acetate đều có nguồn gốc từ cellulose.
(d) Dung dịch lòng trắng trứng gà bị đông tụ khi đun nóng.
(e) Cacboxylic acid có lực acid mạnh hơn phenol và alcohol.
Số phát biểu đúng là
Phân tích các phát biểu:
✔️Đúng. a. Chất béo nhẹ hơn nước và không tan trong nước.
✔️Đúng. b. Mật ong (Trong mật ong thành phần carbohydrate chiến hơn 82%, trong đó fructose chiếm khoảng 38.2% và glucose chiếm khoảng 31% còn lại) và nước ép quả nho chín (Chứa glucose) nên đều có phản ứng tráng bạc.
Phương trình phản ứng:
CH2OH[CHOH]4CHO + 2[Ag(NH3)2] ⟶ OHCH2OH[CHOH]4COONH4 + 2Ag + 3NH3 + H2O
✔️Đúng. c. Tơ visco và tơ acetate đều có nguồn gốc từ cellulose.
✔️Đúng. d. Protein sẽ đông tụ và tách khỏi dung dịch khi được đun nóng hoặc khi thêm dung dịch acid, base, muối của các kim loại nặng như Pb2+, Hg2+,... Trong các trường hợp này, sự đông tụ xảy ra do cấu trúc ban đầu của protein đã bị biến đổi. Dung dịch lòng trắng trứng gà (chứa protein) bị đông tụ khi đun nóng.
✔️Đúng. e. Nhóm carboxyl có chứa nhóm hydroxy (kí hiệu –O–H) liên kết với nhóm carbonyl (kí hiệu C=O). Nhóm C=O là một nhóm hút electron cho nên liên kết O-H trong hợp chất carboxylic acid phân cực nhiều hơn so với các alcohol và phenol. Cacboxylic acid có lực acid mạnh hơn phenol và alcohol.
Số phát biểu đúng là: (a), (b), (c), (d), (e).
⟹ Điền đáp án: 5
✔️Đúng. a. Chất béo nhẹ hơn nước và không tan trong nước.
✔️Đúng. b. Mật ong (Trong mật ong thành phần carbohydrate chiến hơn 82%, trong đó fructose chiếm khoảng 38.2% và glucose chiếm khoảng 31% còn lại) và nước ép quả nho chín (Chứa glucose) nên đều có phản ứng tráng bạc.
Phương trình phản ứng:
CH2OH[CHOH]4CHO + 2[Ag(NH3)2] ⟶ OHCH2OH[CHOH]4COONH4 + 2Ag + 3NH3 + H2O
✔️Đúng. c. Tơ visco và tơ acetate đều có nguồn gốc từ cellulose.
✔️Đúng. d. Protein sẽ đông tụ và tách khỏi dung dịch khi được đun nóng hoặc khi thêm dung dịch acid, base, muối của các kim loại nặng như Pb2+, Hg2+,... Trong các trường hợp này, sự đông tụ xảy ra do cấu trúc ban đầu của protein đã bị biến đổi. Dung dịch lòng trắng trứng gà (chứa protein) bị đông tụ khi đun nóng.
✔️Đúng. e. Nhóm carboxyl có chứa nhóm hydroxy (kí hiệu –O–H) liên kết với nhóm carbonyl (kí hiệu C=O). Nhóm C=O là một nhóm hút electron cho nên liên kết O-H trong hợp chất carboxylic acid phân cực nhiều hơn so với các alcohol và phenol. Cacboxylic acid có lực acid mạnh hơn phenol và alcohol.
Số phát biểu đúng là: (a), (b), (c), (d), (e).
⟹ Điền đáp án: 5
Câu 27 [706290]: Để tăng độ bền và độ cứng khi rèn dao và lưỡi, thép nóng được “tôi” bằng cách làm nguội nhanh trong nước. Một lưỡi thép nặng 454 gam được nung nóng đến nhiệt độ đồng nhất, và sau đó được “tôi” trong 2000 mL nước ở 25,0 oC. Biết rằng, khối lượng riêng khối lượng riêng của nước là 1,0 g mL–1, để nâng nhiệt độ của 1 gam nước lên 1 oC, cần 4,184 J và không có nước bay hơi trong quá trình “tôi”. Nếu lưỡi thép mất đi 173,7 kJ nhiệt trong quá trình "tôi" thì nhiệt độ cuối cùng của nước là bao nhiêu oC (làm tròn đến hàng phần mười)?
Đổi 2000 mL = 2000 gam
Nhiệt lượng mà lưỡi thép mất đi là:
Q = mC∆T
⟶ 173,7 . 1000 = 2000 . 4,184 . (t - 25)
⟶ t = 45,8
⟹ Điền đáp án: 45,8
Nhiệt lượng mà lưỡi thép mất đi là:
Q = mC∆T
⟶ 173,7 . 1000 = 2000 . 4,184 . (t - 25)
⟶ t = 45,8
⟹ Điền đáp án: 45,8
Câu 28 [706298]: Trong công nghiệp, nitric acid được sản xuất theo 3 giai đoạn của quá trình Ostwald:
∎ Giai đoạn 1: Oxi hóa NH3 thành NO. Nung nóng hỗn hợp gồm 1 phần thể tích amnonia với 9 phần thể tích không khí (không khí dùng dư) tới nhiệt độ khoảng 900°C (xúc tác Pt, Pb).
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g); H%(1) = 90%
∎ Giai đoạn 2: Oxi hóa NO thành NO2.
2NO(g) + O2(g) → 2NO2(g); H%(2) = 95%
∎ Giai đoạn 3: Tổng hợp nitric acid.
4NO2(g) + O2(g) + 2H2O(l) → 4HNO3(aq); H%(3) = 90%
Tính thể tích không khí (m3 ở đkc) đã sử dụng trong quá trình trên để sản xuất được 1 m3 dung dịch HNO3 63% với d = 1,4 g/mL (làm tròn đến số nguyên).
∎ Giai đoạn 1: Oxi hóa NH3 thành NO. Nung nóng hỗn hợp gồm 1 phần thể tích amnonia với 9 phần thể tích không khí (không khí dùng dư) tới nhiệt độ khoảng 900°C (xúc tác Pt, Pb).
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g); H%(1) = 90%
∎ Giai đoạn 2: Oxi hóa NO thành NO2.
2NO(g) + O2(g) → 2NO2(g); H%(2) = 95%
∎ Giai đoạn 3: Tổng hợp nitric acid.
4NO2(g) + O2(g) + 2H2O(l) → 4HNO3(aq); H%(3) = 90%
Tính thể tích không khí (m3 ở đkc) đã sử dụng trong quá trình trên để sản xuất được 1 m3 dung dịch HNO3 63% với d = 1,4 g/mL (làm tròn đến số nguyên).
Hiệu suất chung của cả quá trình là
H = 90% × 95% × 90% = 76,95%
Đổi 1 m3 = 1000000 cm3
Khối lượng dung dịch HNO3 63% là m HNO3 = 1000000 × 1,4 = 1400000 gam
Khối lượng HNO3 là mHNO3 = 1400000 × 63% = 882000 gam
Sơ đồ phản ứng
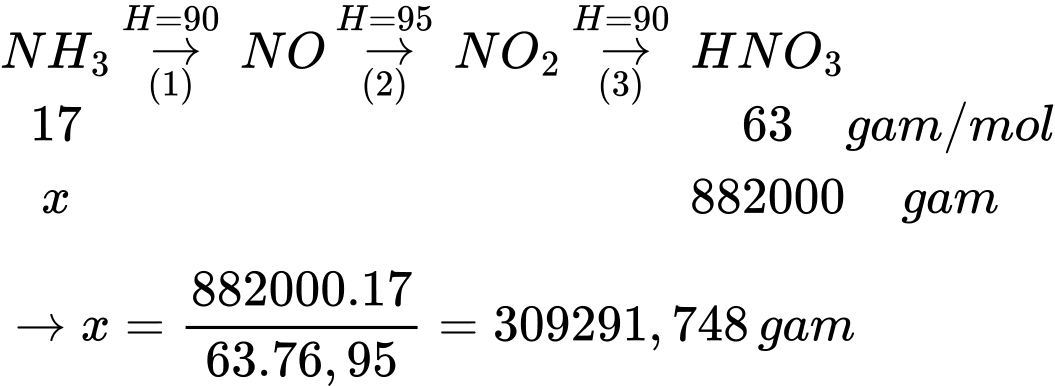
Thể tích khí NH3 là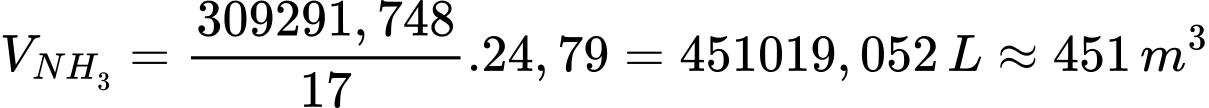
Vkk = 451 × 9 = 4059
⟹ Điền đáp án: 4059
H = 90% × 95% × 90% = 76,95%
Đổi 1 m3 = 1000000 cm3
Khối lượng dung dịch HNO3 63% là m HNO3 = 1000000 × 1,4 = 1400000 gam
Khối lượng HNO3 là mHNO3 = 1400000 × 63% = 882000 gam
Sơ đồ phản ứng
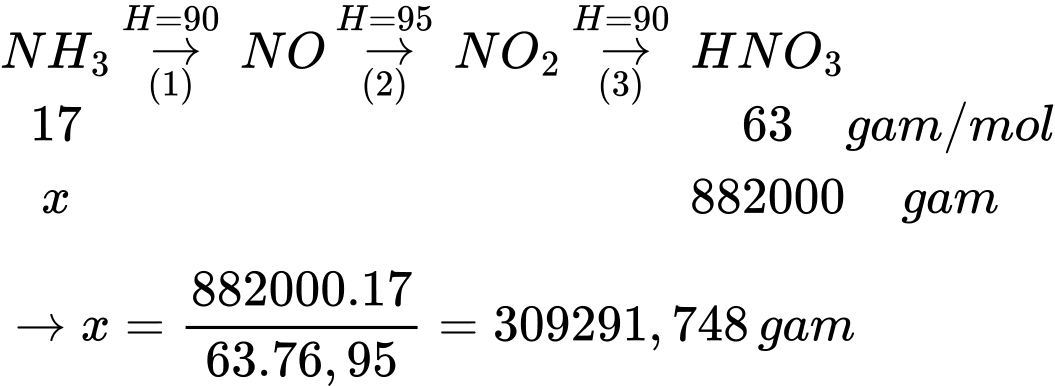
Thể tích khí NH3 là
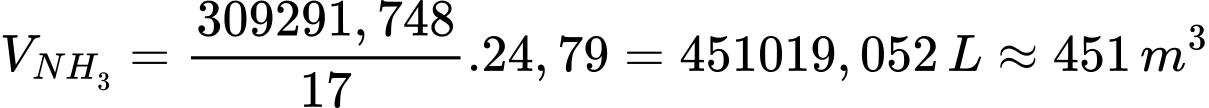
Vkk = 451 × 9 = 4059
⟹ Điền đáp án: 4059