PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [706327]: Thành phần quan trọng của inox là
A, sắt, chromium, carbon.
B, đồng, kẽm.
C, nhôm, magnesium.
D, sắt, magnesium, carbon.
Inox (thép không gỉ): Là một hợp kim của sắt (Fe) với một lượng lớn chromium (Cr) và một lượng nhỏ carbon (C). Chromium tạo ra lớp oxide bảo vệ trên bề mặt inox, giúp chống lại sự ăn mòn.
✔️A. ĐÚNG. Đây là thành phần chính của inox.
❌B. SAI. Đồng và kẽm không phải là thành phần chính của inox.
❌C. SAI. Nhôm và magnesium không phải là thành phần chính của inox.
❌D. SAI. Magnesium không phải là thành phần chính của inox.
⟹ Chọn đáp án A Đáp án: A
✔️A. ĐÚNG. Đây là thành phần chính của inox.
❌B. SAI. Đồng và kẽm không phải là thành phần chính của inox.
❌C. SAI. Nhôm và magnesium không phải là thành phần chính của inox.
❌D. SAI. Magnesium không phải là thành phần chính của inox.
⟹ Chọn đáp án A Đáp án: A
Câu 2 [560625]: Cho dãy các kim loại: Na, Cu, Al, Cr. Kim loại mềm nhất trong dãy là
A, Na.
B, Cr.
C, Cu.
D, Al.
Sodium là một kim loại kiềm, có cấu trúc tinh thể đơn giản và chỉ có một electron tự do trong lớp vỏ ngoài cùng. Điều này làm cho liên kết giữa các nguyên tử trong Sodium khá yếu, làm cho kim loại này dễ bị biến dạng và có độ cứng thấp. Sodium có thể bị cắt bằng dao và bị uốn cong dễ dàng.
Các kim loại khác như Cu, Al và Cr cứng hơn do cấu trúc mạng tinh thể phức tạp hơn và liên kết giữa các nguyên tử mạnh mẽ hơn.
⟹ Chọn đáp án A Đáp án: A
Các kim loại khác như Cu, Al và Cr cứng hơn do cấu trúc mạng tinh thể phức tạp hơn và liên kết giữa các nguyên tử mạnh mẽ hơn.
⟹ Chọn đáp án A Đáp án: A
Câu 3 [706328]: Ở điều kiện chuẩn có các phản ứng xảy ra theo phương trình hoá học sau:
Fe(s) + CuSO4(aq) FeSO4(aq) + Cu(s)
FeSO4(aq) + Cu(s)
Cu(s) + Fe2(SO4)3(aq) 2FeSO4(aq) + CuSO4(aq)
2FeSO4(aq) + CuSO4(aq)
Các phản ứng trên diễn ra là do
Fe(s) + CuSO4(aq)
 FeSO4(aq) + Cu(s)
FeSO4(aq) + Cu(s)Cu(s) + Fe2(SO4)3(aq)
 2FeSO4(aq) + CuSO4(aq)
2FeSO4(aq) + CuSO4(aq)Các phản ứng trên diễn ra là do
A, 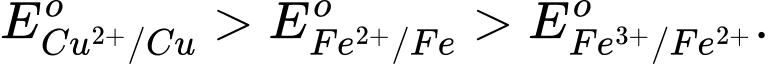
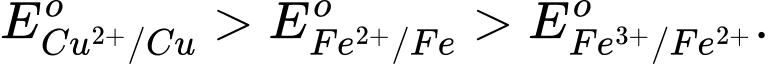
B, 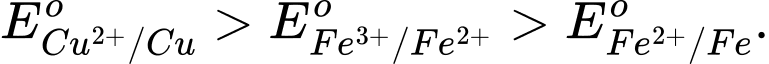
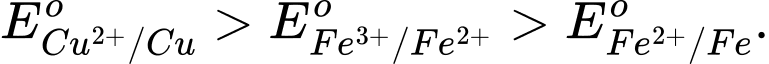
C, 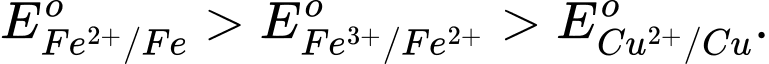
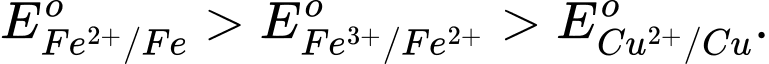
D, 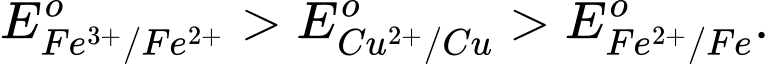
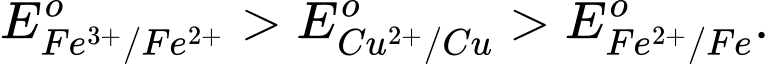
Fe(s) + CuSO4(aq) → Phản ứng này xảy ra, cho thấy Fe có tính khử mạnh hơn Cu.
→ Eo Fe2+/Fe < Eo Cu2+/Cu.
Cu(s) + Fe2(SO4)3(aq) → Phản ứng này xảy ra, cho thấy Cu có tính khử mạnh hơn Fe2+ và Fe3+ có tính oxi hóa mạnh hơn Cu2+.
→ EoCu2+/Cu < EoFe3+/Fe2+.
⟹ Chọn đáp án D Đáp án: D
→ Eo Fe2+/Fe < Eo Cu2+/Cu.
Cu(s) + Fe2(SO4)3(aq) → Phản ứng này xảy ra, cho thấy Cu có tính khử mạnh hơn Fe2+ và Fe3+ có tính oxi hóa mạnh hơn Cu2+.
→ EoCu2+/Cu < EoFe3+/Fe2+.
⟹ Chọn đáp án D Đáp án: D
Câu 4 [560413]: Hai cặp oxi hóa khử Zn2+/Zn và Cu2+/Cu đều được thiết lập ở điều kiện chuẩn thì nồng độ mol của 2 ion Zn2+ và Cu2+ trong dung dịch của từng điện cực như thế nào so với nhau?
A, 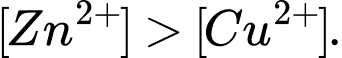
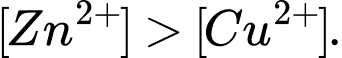
B, 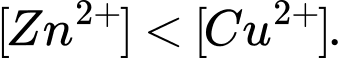
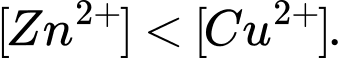
C, 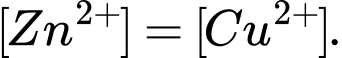
D, Chưa đủ thông tin để xác định.
Ở điều kiện chuẩn, cả hai cặp oxi hóa khử Zn2+/Zn và Cu2+/Cu đều có nồng độ mol chuẩn của ion là 1 M
→ nồng độ mol của Zn2+ và Cu2+ trong dung dịch của từng điện cực đều bằng 1 M vì điều kiện chuẩn trong điện hóa học được định nghĩa là nồng độ 1 M cho các ion trong dung dịch.
→ Nồng độ mol của Zn2+ và Cu2+ trong dung dịch của từng điện cực là bằng nhau và đều là 1 M trong điều kiện chuẩn.
⟹ Chọn đáp án C Đáp án: C
→ nồng độ mol của Zn2+ và Cu2+ trong dung dịch của từng điện cực đều bằng 1 M vì điều kiện chuẩn trong điện hóa học được định nghĩa là nồng độ 1 M cho các ion trong dung dịch.
→ Nồng độ mol của Zn2+ và Cu2+ trong dung dịch của từng điện cực là bằng nhau và đều là 1 M trong điều kiện chuẩn.
⟹ Chọn đáp án C Đáp án: C
Câu 5 [706329]: Nhúng que platinum sạch vào dung dịch chất X, sau đó đưa lên ngọn lửa đèn khí, đèn khí cháy với ngọn lửa màu vàng. Mặt khác, thêm vài giọt dung dịch chất X vào dung dịch silver nitrate thấy xuất hiện kết tủa vàng. X có thể là chất nào sau đây?
(1) Potassium iodide.
(2) Sodium iodide.
(3) Sodium phosphate.
(4) Potassium phosphate.
(1) Potassium iodide.
(2) Sodium iodide.
(3) Sodium phosphate.
(4) Potassium phosphate.
A, (1) hoặc (4).
B, (2) hoặc (3).
C, (2).
D, (3) hoặc (4).
Ngọn lửa màu vàng: Cho thấy sự có mặt của ion (Na⁺).
Kết tủa màu vàng với dung dịch silver nitrate (AgNO3): Cho thấy sự có mặt của ion iodua (I-) hoặc ion photphate (PO43-), vì cả AgI và Ag3PO4 đều có màu vàng.
Phân tích các đáp án:
(1) Potassium iodide (KI): Chứa ion (K+) và (I-). K+ cho ngọn lửa màu tím, không phải màu vàng.
(2) Sodium iodide (NaI): Chứa ion (Na+) và (I-). Na cho ngọn lửa màu vàng. AgI tạo kết tủa vàng.
(3) Sodium phosphate (Na3PO4): Chứa ion (Na+) và (PO43-). Na cho ngọn lửa màu vàng. Ag3PO4 tạo kết tủa vàng.
(4) Potassium phosphate (K3PO4): Chứa ion (K+) và (PO43-). K cho ngọn lửa màu tím.
⟹ Chọn đáp án B Đáp án: B
Kết tủa màu vàng với dung dịch silver nitrate (AgNO3): Cho thấy sự có mặt của ion iodua (I-) hoặc ion photphate (PO43-), vì cả AgI và Ag3PO4 đều có màu vàng.
Phân tích các đáp án:
(1) Potassium iodide (KI): Chứa ion (K+) và (I-). K+ cho ngọn lửa màu tím, không phải màu vàng.
(2) Sodium iodide (NaI): Chứa ion (Na+) và (I-). Na cho ngọn lửa màu vàng. AgI tạo kết tủa vàng.
(3) Sodium phosphate (Na3PO4): Chứa ion (Na+) và (PO43-). Na cho ngọn lửa màu vàng. Ag3PO4 tạo kết tủa vàng.
(4) Potassium phosphate (K3PO4): Chứa ion (K+) và (PO43-). K cho ngọn lửa màu tím.
⟹ Chọn đáp án B Đáp án: B
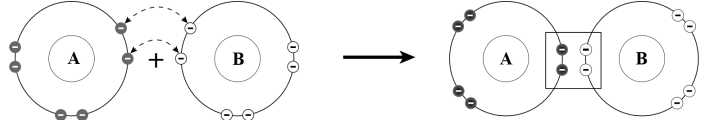
Câu 6 [244134]: Hình dưới biểu diễn sự hình thành liên kết cộng hóa trị giữa hai nguyên tử A, B. Liên kết tạo thành có tên gọi là

A, liên kết đơn.
B, liên kết đôi.
C, liên kết ba.
D, liên kết pi.
Trong hình ảnh, hai nguyên tử A và B góp chung hai cặp electron để tạo thành liên kết. Liên kết được hình thành do sự góp chung hai cặp electron được gọi là liên kết đôi.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 7 [706330]: Một học sinh thực hiện các thí nghiệm để nhận biết hai dung dịch chất X và chất Y, thu được một số kết quả như sau:
– Dung dịch chất X và chất Y đều làm dung dịch phenolphthalein chuyển sang màu hồng.
– Trộn X và Y thu được kết tủa màu trắng.
– Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
Biết mỗi chất X, Y đều chỉ chứa một loại cation và một loại anion. Phát biểu nào sau đây không đúng?
– Dung dịch chất X và chất Y đều làm dung dịch phenolphthalein chuyển sang màu hồng.
– Trộn X và Y thu được kết tủa màu trắng.
– Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
Biết mỗi chất X, Y đều chỉ chứa một loại cation và một loại anion. Phát biểu nào sau đây không đúng?
A, Chất X có chứa cation Ba2+, chất Y chứa cation K+.
B, Chất X không thể là barium chloride.
C, Chất Y phải là potassium carbonate.
D, Kết tủa màu trắng phải là hợp chất của barium.
X và Y đều làm dung dịch phenolphthalein chuyển sang màu hồng:
⟹ Cả X và Y đều có tính base, chứa nhóm OH-
Trộn X và Y thu được kết tủa màu trắng: Phản ứng tạo kết tủa cho thấy có sự kết hợp của cation và anion từ X và Y tạo thành chất không tan.
⟹ có khả năng chứa ion CO32- và SO42-
Tuy nhiên ion CO32- có khả năng :
CO32- + H2O ⟶ HCO3- + OH-
Tạo môi trường base làm đổi màu quỳ tím.
X cháy với ngọn lửa màu lục: Điều này cho thấy X chứa ion (Ba2+).
Y cháy với ngọn lửa màu tím: Điều này cho thấy Y chứa ion (K+).
⟹ Chứa 4 ion K+, Ba2+ , CO32- , OH-
Phân tích các đáp án:
✔️A. ĐÚNG. Phù hợp với kết quả thí nghiệm về màu ngọn lửa.
✔️B. ĐÚNG. Vì X chứa Ba2+ và có tính base (làm phenolphthalein chuyển màu hồng), nên X phải là một base của barium, ví dụ như Ba(OH)2 hoặc BaCO3, không thể là BaCl2 (muối trung tính).
❌C. SAI. Y chứa K+ và có tính base, nhưng không nhất thiết phải là K2CO3. Y có thể là KOH hoặc một base khác của potassium.
✔️D. ĐÚNG. Vì X chứa Ba2+, nên kết tủa tạo thành khi trộn X và Y phải chứa barium.
⟹ Chọn đáp án C Đáp án: C
⟹ Cả X và Y đều có tính base, chứa nhóm OH-
Trộn X và Y thu được kết tủa màu trắng: Phản ứng tạo kết tủa cho thấy có sự kết hợp của cation và anion từ X và Y tạo thành chất không tan.
⟹ có khả năng chứa ion CO32- và SO42-
Tuy nhiên ion CO32- có khả năng :
CO32- + H2O ⟶ HCO3- + OH-
Tạo môi trường base làm đổi màu quỳ tím.
X cháy với ngọn lửa màu lục: Điều này cho thấy X chứa ion (Ba2+).
Y cháy với ngọn lửa màu tím: Điều này cho thấy Y chứa ion (K+).
⟹ Chứa 4 ion K+, Ba2+ , CO32- , OH-
Phân tích các đáp án:
✔️A. ĐÚNG. Phù hợp với kết quả thí nghiệm về màu ngọn lửa.
✔️B. ĐÚNG. Vì X chứa Ba2+ và có tính base (làm phenolphthalein chuyển màu hồng), nên X phải là một base của barium, ví dụ như Ba(OH)2 hoặc BaCO3, không thể là BaCl2 (muối trung tính).
❌C. SAI. Y chứa K+ và có tính base, nhưng không nhất thiết phải là K2CO3. Y có thể là KOH hoặc một base khác của potassium.
✔️D. ĐÚNG. Vì X chứa Ba2+, nên kết tủa tạo thành khi trộn X và Y phải chứa barium.
⟹ Chọn đáp án C Đáp án: C
Câu 8 [706331]: Vì sao calcium (Z = 20) không phải là nguyên tố chuyển tiếp?
A, Vì Ca có ít electron hoá trị.
B, Vì trong cấu hình electron nguyên tử Ca không có phân lớp d chưa bão hoà.
C, Vì Ca không phải là nguyên tố nhóm B.
D, Vì trong cấu hình electron nguyên tử Ca không có electron d.
Nguyên tố chuyển tiếp : là các nguyên tố có phân lớp d chưa bão hòa.
Ca (Z=20) : 1s22s22p63s23p64s2 có phân lớp ngoài cùng là 4s đã bão hòa, không có phân lớp 3d.
Vậy Ca không phải nguyên tố kim loại chuyển tiếp.
Phân tích các đáp án:
❌A. SAI. Số electron hóa trị không quyết định việc một nguyên tố có phải là nguyên tố chuyển tiếp hay không.
✔️B. ĐÚNG. Cấu hình electron của Ca kết thúc ở 4s2, không có electron nào ở phân lớp d. Để là nguyên tố chuyển tiếp, nguyên tố cần có phân lớp d chưa bão hòa.
❌C. SAI. Nhóm B là nhóm chứa các nguyên tố chuyển tiếp, nhưng Ca thuộc nhóm A
❌D. SAI. Ca không có electron ở phân lớp d, nhưng chưa phải lí do trực tiếp.
⟹ Chọn đáp án B
Đáp án: B
Ca (Z=20) : 1s22s22p63s23p64s2 có phân lớp ngoài cùng là 4s đã bão hòa, không có phân lớp 3d.
Vậy Ca không phải nguyên tố kim loại chuyển tiếp.
Phân tích các đáp án:
❌A. SAI. Số electron hóa trị không quyết định việc một nguyên tố có phải là nguyên tố chuyển tiếp hay không.
✔️B. ĐÚNG. Cấu hình electron của Ca kết thúc ở 4s2, không có electron nào ở phân lớp d. Để là nguyên tố chuyển tiếp, nguyên tố cần có phân lớp d chưa bão hòa.
❌C. SAI. Nhóm B là nhóm chứa các nguyên tố chuyển tiếp, nhưng Ca thuộc nhóm A
❌D. SAI. Ca không có electron ở phân lớp d, nhưng chưa phải lí do trực tiếp.
⟹ Chọn đáp án B
Đáp án: B
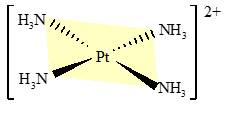
Câu 9 [561082]: Phức chất sau đây có điện tích bằng bao nhiêu?

A, 1+.
B, 2+.
C, 3+.
D, 4+.
Phức chất [Pt(NH3)4]2+ gồm ion trung tâm Pt2+ và 4 phối tử trung hòa NH3 nên phức chất [Pt(NH3)4]2+ có điện tích là 2+.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 10 [304794]: Khi chúng ta ăn chè, bánh trôi, bánh chay,... người bán thường cho thêm vài giọt dung dịch không màu, có mùi thơm của chuối chín được gọi là dầu chuối. Ester có mùi chuối chín có tên là
A, Isoamyl acetate.
B, Benzyl acetate.
C, Glycerol.
D, Ethyl acetate.
Phân tích các phát biểu:
✔️ A. Isoamyl acetate: CH3COOCH2CH2CH(CH3)2 có mùi chuối chín.
❌ B. Benzyl acetate: CH3COOCH2C6H5: mùi hoa nhài.
❌ C. Glycerol: C3H5(OH)3: không mùi.
❌ D. Ethyl acetate: CH3COOCH2CH3: không rõ.
⟹ Chọn đáp án A Đáp án: A
✔️ A. Isoamyl acetate: CH3COOCH2CH2CH(CH3)2 có mùi chuối chín.
❌ B. Benzyl acetate: CH3COOCH2C6H5: mùi hoa nhài.
❌ C. Glycerol: C3H5(OH)3: không mùi.
❌ D. Ethyl acetate: CH3COOCH2CH3: không rõ.
⟹ Chọn đáp án A Đáp án: A
Câu 11 [306062]: Hợp chất có cấu tạo nào sau đây không được sử dụng để tạo thành xà phòng hoặc chất tẩy rửa tổng hợp?
A, 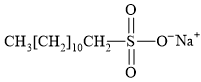

B, 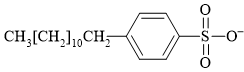

C, 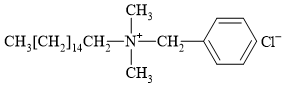

D, 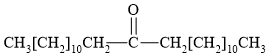
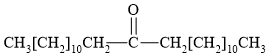
Phân tích các phát biểu:
✔️ A. Thỏa mãn mạch carbon dài không phân nhánh, một đầu mạch hydrocarbon không phân cực; đầu kia là NaSO3 phân cực.
✔️ B. thỏa mãn bởi cấu tạo một đầu là chuối hydrocarbon dài kỵ nước, đầu còn lại phân cực là ion tích điện âm. (Chú ý chất này là sodium dodecyl benzene sulfonate (SDBS) - Một chất tẩy rửa lâu đời và được sử dụng rộng rãi).
✔️ C. Thỏa mãn bởi có cấu tạo tương tự chất B; tuy nhiên phần đầu phân cực là ion tích điện dương (amine) (Thực tế chất này dạng benzalkonium chloride).
❌ D. C=O phân cực yếu nằm ở giữa; 2 đầu gắn với điểm phân cực này là hai gốc hydrocarbon mạch dài không phân cực ⇝ không thỏa mãn (bởi yêu cầu là 1 đầu phân cực + 1 đầu không phân cực thôi).
⟹ Chọn đáp án D Đáp án: D
✔️ A. Thỏa mãn mạch carbon dài không phân nhánh, một đầu mạch hydrocarbon không phân cực; đầu kia là NaSO3 phân cực.
✔️ B. thỏa mãn bởi cấu tạo một đầu là chuối hydrocarbon dài kỵ nước, đầu còn lại phân cực là ion tích điện âm. (Chú ý chất này là sodium dodecyl benzene sulfonate (SDBS) - Một chất tẩy rửa lâu đời và được sử dụng rộng rãi).
✔️ C. Thỏa mãn bởi có cấu tạo tương tự chất B; tuy nhiên phần đầu phân cực là ion tích điện dương (amine) (Thực tế chất này dạng benzalkonium chloride).
❌ D. C=O phân cực yếu nằm ở giữa; 2 đầu gắn với điểm phân cực này là hai gốc hydrocarbon mạch dài không phân cực ⇝ không thỏa mãn (bởi yêu cầu là 1 đầu phân cực + 1 đầu không phân cực thôi).
⟹ Chọn đáp án D Đáp án: D
Câu 12 [308410]: Kiểu liên kết giữa các gốc glucose trong mạch amylose là
A, β-1,6-glycosidic.
B, α-1,6-glycosidic.
C, β-1,4-glycosidic.
D, α-1,4-glycosidic.
HD: Amylose: tạo bởi nhiều đơn vị (mắt xích) α-glucose qua liên kết α-1,4-glycosidic ⇒ Amylose sẽ có chuỗi dài xoắn, không phân nhánh.
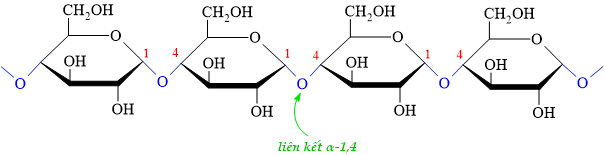
⟹ Chọn đáp án D. Đáp án: D

⟹ Chọn đáp án D. Đáp án: D
Câu 13 [308783]: Phân biệt được hai dung dịch chứa riêng biệt các dipeptide mạch hở là Ala–Val và Val–Lys bằng thuốc thử là
A, Phenolphthalein.
B, Hydrochloric acid.
C, Sodium hydroxide.
D, Đồng(II) hydroxide.
Nhận xét:
+) Ala–Val có số nhóm NH2 bằng số nhóm COOH.
⇒ Dung dịch có môi trường trung tính → không làm phenolphthalein đổi màu.
+) Val–Lys có số nhóm NH2 hơn số nhóm COOH
⇒ Dung dịch Val–Lys có môi trường base, làm phenolphthalein đổi màu hồng.
⇒ Phenolphtalein giúp ta phân biệt được 2 dung dịch trên.
⟹ Chọn đáp án A Đáp án: A
+) Ala–Val có số nhóm NH2 bằng số nhóm COOH.
⇒ Dung dịch có môi trường trung tính → không làm phenolphthalein đổi màu.
+) Val–Lys có số nhóm NH2 hơn số nhóm COOH
⇒ Dung dịch Val–Lys có môi trường base, làm phenolphthalein đổi màu hồng.
⇒ Phenolphtalein giúp ta phân biệt được 2 dung dịch trên.
⟹ Chọn đáp án A Đáp án: A
Câu 14 [308422]: Thêm vài giọt nước bromine vào ống nghiệm chứa dung dịch potassiumiodide và hồ tinh bột, lắc đều. Dự đoán hiện tượng xảy ra là gì?
A, Xuất hiện màu xanh tím.
B, Xuất hiện màu nâu đỏ.
C, Xuất hiện kết tủa xanh.
D, Không có hiện tượng.
Khi cho nước bromine (Br2) màu vàng nâu vào dung dịch potassium iodine (KI) không màu có thêm hồ tinh bột thì thấy dung dịch chuyển sang màu xanh tím.
Br2 + 2I- ⟶ 2Br- + I2
⟹ Chọn đáp án A Đáp án: A
Br2 + 2I- ⟶ 2Br- + I2
⟹ Chọn đáp án A Đáp án: A
Câu 15 [309506]: Cặp chất nào sau đây không thể tham gia phản ứng trùng ngưng?
A, Phenol và formaldehyde.
B, Buta-1,3-diene và styrene.
C, Adipic acid và hexamethylenediamine.
D, Terephthalic acid và ethylene glycol.
- Trùng ngưng là quá trình kết hợp nhiều phân tử nhỏ (monomer) thành phân tử lớn (polymer) đồng thời giải phóng những phân tử nhỏ khác (như H, O, ...)
- Điều kiện cần để có phản ứng trùng ngưng: Các monomer tham gia phản ứng trùng ngưng phải có ít nhất hai nhóm chức có khả năng phản ứng để tạo liên kết với nhau.
→ Buta-1,3-diene và styrene không thể tham gia phản ứng trùng ngưng..
⟹ Chọn đáp án B Đáp án: B
- Điều kiện cần để có phản ứng trùng ngưng: Các monomer tham gia phản ứng trùng ngưng phải có ít nhất hai nhóm chức có khả năng phản ứng để tạo liên kết với nhau.
→ Buta-1,3-diene và styrene không thể tham gia phản ứng trùng ngưng..
⟹ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 16 – 17:
Hãy xem xét hỗn hợp ban đầu của khí N2 và H2 có thể được biểu diễn như sau:
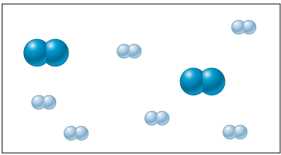
Các khí phản ứng tạo thành khí ammonia (NH3) và nồng độ của các chất biến đổi theo thời gian được biểu diễn bằng sơ đồ sau:
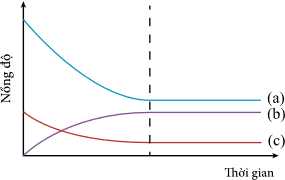

Các khí phản ứng tạo thành khí ammonia (NH3) và nồng độ của các chất biến đổi theo thời gian được biểu diễn bằng sơ đồ sau:

Câu 16 [706332]: Đồ thị hình bên biểu diễn nồng độ các chất trong phản ứng theo thời gian. Đường biểu diễn nồng độ của NH3 là
A, đường (a).
B, đường (b).
C, đường (c).
D, cả đường (a) và (b).
Từ đồ thị, NH3 là sản phẩm sau thời gian phản ứng nồng độ NH3 tăng dần đến khi phản ứng đặt trạng thái cân bằng.
→ Đường (b) phù hợp với NH3
⟹ Chọn đáp án B Đáp án: B
→ Đường (b) phù hợp với NH3
⟹ Chọn đáp án B Đáp án: B
Câu 17 [706333]: Nếu coi nồng độ của N2 trong hỗn hợp ban đầu là 2 M và tại nhiệt độ t oC, hằng số cân bằng KC là 3,125. Nồng độ sản phẩm NH3 tại thời điểm cân bằng là
A, 0,56.
B, 1,44.
C, 2,88.
D, 2,42.
Từ hình minh họa thấy rằng tỉ lệ số nguyên tử của N2 và H2 là 1:3
Trong hỗn hợp ban đầu N2 có nồng độ là 2 M → Nồng độ của H2 là 6M
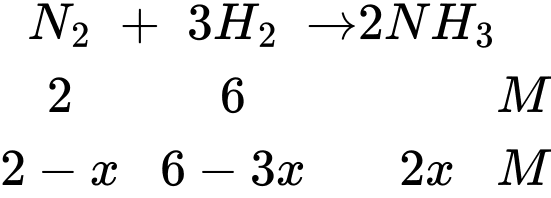
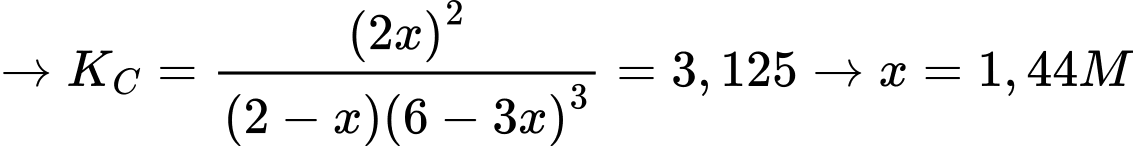
Nồng độ sản phẩm là 2x = 2,88 M
⟹ Chọn đáp án C Đáp án: C
Trong hỗn hợp ban đầu N2 có nồng độ là 2 M → Nồng độ của H2 là 6M
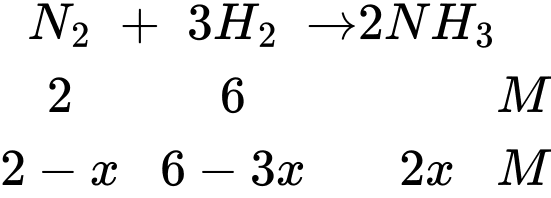
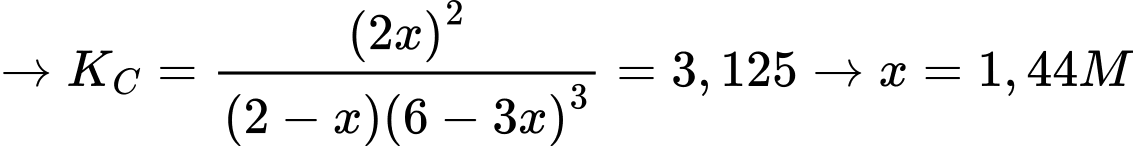
Nồng độ sản phẩm là 2x = 2,88 M
⟹ Chọn đáp án C Đáp án: C
Câu 18 [706334]: Biểu đồ sau thể hiện độ hoạt động của các enzyme A, B, C xúc tác cho các phản ứng sinh hoá trong cơ thể theo pH của môi trường phản ứng:
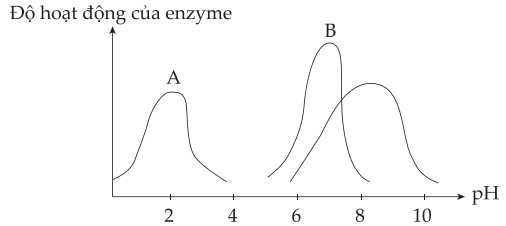
Trong số các enzyme đã nêu trong biểu đồ, amylase là một enzyme tiêu hoá chủ yếu được tiết ra bởi tuyến tụy và tuyến nước bọt, có tác dụng thuỷ phân tinh bột thành maltose. Pepsin và trypsin cũng là các enzyme tiêu hoá, lần lượt có trong dịch vị và ruột non với vai trò phân giải protein. Trypsin hoạt động tốt nhất trong môi trường kiềm nhẹ.
Enzyme A và B lần lượt là

Trong số các enzyme đã nêu trong biểu đồ, amylase là một enzyme tiêu hoá chủ yếu được tiết ra bởi tuyến tụy và tuyến nước bọt, có tác dụng thuỷ phân tinh bột thành maltose. Pepsin và trypsin cũng là các enzyme tiêu hoá, lần lượt có trong dịch vị và ruột non với vai trò phân giải protein. Trypsin hoạt động tốt nhất trong môi trường kiềm nhẹ.
Enzyme A và B lần lượt là
A, amylase và trypsin.
B, pepsin và trypsin.
C, amylase và pepsin.
D, pepsin và amylase.
Trong số các enzyme đã nêu trong biểu đồ, amylase là một enzyme tiêu hoá chủ yếu được tiết ra bởi tuyến tụy và tuyến nước bọt, có tác dụng thuỷ phân tinh bột thành maltose.
Pepsin và trypsin cũng là các enzyme tiêu hoá, lần lượt có trong dịch vị và ruột non có môi trừng acid với vai trò phân giải protein → Pepsin có thể là A
Trypsin hoạt động tốt nhất trong môi trường kiềm nhẹ. → Trypsin có thể là B
⟹ Chọn đáp án B Đáp án: B
Pepsin và trypsin cũng là các enzyme tiêu hoá, lần lượt có trong dịch vị và ruột non có môi trừng acid với vai trò phân giải protein → Pepsin có thể là A
Trypsin hoạt động tốt nhất trong môi trường kiềm nhẹ. → Trypsin có thể là B
⟹ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [683595]: Có 1 nhóm học sinh tiến hành ba thí nghiệm nghiên cứu tính chất của arene:
▪ Thí nghiệm 1: Cho 5 mL benzene vào bình hình nón 150 mL. Sau đó, dẫn một lượng nhỏ khí chlorine vào bình. Đậy kín nắp bình và đưa ra ngoài ánh nắng.
▪ Thí nghiệm 2: Cho vào ống nghiệm khoảng 2 mL dung dịch HNO3 đặc, sau đó thêm từ từ khoảng 4 mL dung dịch H2SO4 đặc. Lắc đều. Thêm tiếp vào ống nghiệm khoảng 2 mL benzene. Dùng đũa thuỷ tinh khuấy đều trong 1 phút. Sau đó ngâm ống nghiệm vào cốc nước nóng ở khoảng 60°C. Rót hỗn hợp sau phản ứng vào cốc nước lạnh, để yên cốc khoảng 2 phút.
▪ Thí nghiệm 3: Cho vào hai ống nghiệm, mỗi ống 2 mL dung dịch KMnO4 0,1 M. Thêm vào ống nghiệm thứ nhất 1 mL toluene và vào ống nghiệm thứ hai 1 mL benzene. Lắc đều các ống nghiệm, sau đó dùng kẹp ống nghiệm kẹp các ống nghiệm rồi lần lượt đun nóng các ống nghiệm trên ngọn lửa đèn cồn khoảng 3 phút (vừa đun vừa lắc đều).
▪ Thí nghiệm 1: Cho 5 mL benzene vào bình hình nón 150 mL. Sau đó, dẫn một lượng nhỏ khí chlorine vào bình. Đậy kín nắp bình và đưa ra ngoài ánh nắng.
▪ Thí nghiệm 2: Cho vào ống nghiệm khoảng 2 mL dung dịch HNO3 đặc, sau đó thêm từ từ khoảng 4 mL dung dịch H2SO4 đặc. Lắc đều. Thêm tiếp vào ống nghiệm khoảng 2 mL benzene. Dùng đũa thuỷ tinh khuấy đều trong 1 phút. Sau đó ngâm ống nghiệm vào cốc nước nóng ở khoảng 60°C. Rót hỗn hợp sau phản ứng vào cốc nước lạnh, để yên cốc khoảng 2 phút.
▪ Thí nghiệm 3: Cho vào hai ống nghiệm, mỗi ống 2 mL dung dịch KMnO4 0,1 M. Thêm vào ống nghiệm thứ nhất 1 mL toluene và vào ống nghiệm thứ hai 1 mL benzene. Lắc đều các ống nghiệm, sau đó dùng kẹp ống nghiệm kẹp các ống nghiệm rồi lần lượt đun nóng các ống nghiệm trên ngọn lửa đèn cồn khoảng 3 phút (vừa đun vừa lắc đều).
Phân tích các phát biểu:
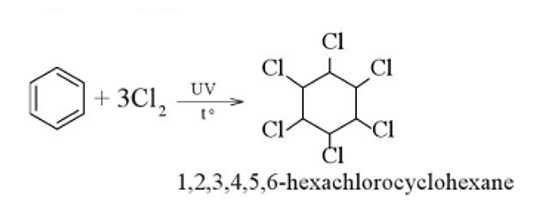
✔️a. Đúng.Trong bình xuất hiện khói trắng và trên thành bình thấy xuất hiện một lớp bột 1,2,3,4,5,6-hexachlorocyclohexane màu trắng. Phản ứng chlorine hoá benzene xảy ra thuận lợi trong điều kiện chiếu sáng.
.
❌b. Sai. Phản ứng giữa benzene và hỗn hợp HNO3/H2SO4 đặc là phản ứng thế nitro hóa, tạo ra nitrobenzene. Sản phẩm chính là nitrobenzene là chất lỏng màu vàng nhạt, nặng hơn nước nên tách thành lớp dưới. 1,3,5-trinitrobenzene là sản phẩm của quá trình nitro hóa tiếp theo, thường ít được tạo ra trong điều kiện phản ứng này.
❌c.Sai. Toluene làm mất màu dung dịch thuốc tím khi đun nóng. Benzene không làm mất màu dung dịch thuốc tím cả ở điều kiện thường và khi đun nóng.
- Do hiệu ứng liên hợp π bền vững nên benzene không tác dụng với KMnO4 (không làm mất màu dung dịch KMnO4) kể cả khi đun nóng.
- Do ảnh hưởng của vòng benzene, mạch nhánh – CH3 của toluene dễ bị oxi hoá khi tương tác với chất oxi hoá mạnh như KMnO4. Phương trình hoá học:
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O.
❌d. Sai. Benzen không dễ dàng tham gia phản ứng cộng như alkene hoặc alkyne vì vòng benzene có hệ liên kết π bền vững (do hiện tượng cộng hưởng).
✔️a. Đúng.Trong bình xuất hiện khói trắng và trên thành bình thấy xuất hiện một lớp bột 1,2,3,4,5,6-hexachlorocyclohexane màu trắng. Phản ứng chlorine hoá benzene xảy ra thuận lợi trong điều kiện chiếu sáng.
.

❌b. Sai. Phản ứng giữa benzene và hỗn hợp HNO3/H2SO4 đặc là phản ứng thế nitro hóa, tạo ra nitrobenzene. Sản phẩm chính là nitrobenzene là chất lỏng màu vàng nhạt, nặng hơn nước nên tách thành lớp dưới. 1,3,5-trinitrobenzene là sản phẩm của quá trình nitro hóa tiếp theo, thường ít được tạo ra trong điều kiện phản ứng này.
❌c.Sai. Toluene làm mất màu dung dịch thuốc tím khi đun nóng. Benzene không làm mất màu dung dịch thuốc tím cả ở điều kiện thường và khi đun nóng.
- Do hiệu ứng liên hợp π bền vững nên benzene không tác dụng với KMnO4 (không làm mất màu dung dịch KMnO4) kể cả khi đun nóng.
- Do ảnh hưởng của vòng benzene, mạch nhánh – CH3 của toluene dễ bị oxi hoá khi tương tác với chất oxi hoá mạnh như KMnO4. Phương trình hoá học:
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O.
❌d. Sai. Benzen không dễ dàng tham gia phản ứng cộng như alkene hoặc alkyne vì vòng benzene có hệ liên kết π bền vững (do hiện tượng cộng hưởng).
Câu 20 [706335]: Hợp chất hữu cơ X (chứa C, H, O) được sử dụng rộng rãi trong chăn nuôi gia súc, gia cầm và là một phụ gia mới trong thức ăn thủy sản; có công dụng tối đa sự phát triển của tế bào ruột enterocyte giúp cải thiện khả năng hấp thụ chất dinh dưỡng. Bằng phương pháp phổ khối lượng xác định được phân tử khối của X là 88 g/mol.
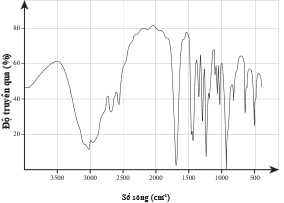
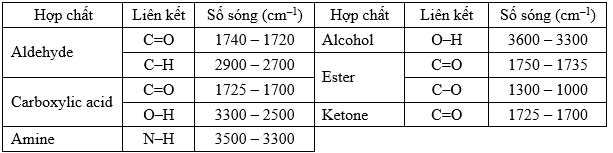


Phân tích các phát biểu:
✔️(a) – Đúng. Trong phổ IR, có tín hiệu đặc trưng khoảng 1700 cm-1 đặc trung cho liên kết C=O và tín hiệu trong khoảng 3300 – 2500 cm-1 đặc trung cho liên kết O-H
Phân tử X có nhóm COOH.
❌(b) – Sai. Trong phổ IR, có tín hiệu đặc trưng khoảng 1700 cm-1 đặc trung cho liên kết C=O và tín hiệu trong khoảng 3300 – 2500 cm-1 đặc trung cho liên kết O-H
Phân tử X có nhóm COOH.
Hợp chất hữu cơ X có phân tử khối là 88 gam/mol và có các nguyên tố C, H, O.
→ X là carboxylic acid đơn chức.
→ X có CTPT là C4H8O2
✔️(c) – Đúng.Đốt cháy hoàn toàn 2,64 gam X, hỗn hợp sản hấp thụ hết vào bình đựng 200 mL dung dịch Ca(OH)2 0,4M thấy khối lượng dung dịch tăng 3,44 gam.
Số mol của X là nC4H8O2 = 2,64:88 = 0,03 mol
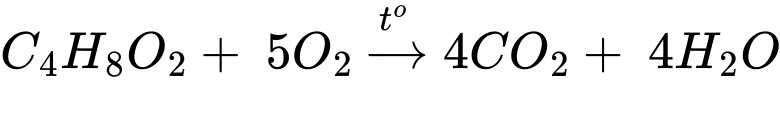
Từ PTHH số mol của CO2 và H2O lần lượt là 0,12 mol và 0,12 mol
Số mol của Ca(OH)2 là nCa(OH)2 = 0,4.0,2 = 0,08 mol
Ta có: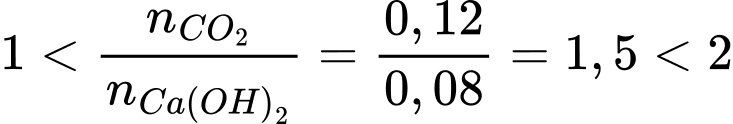
→ phản ứng sinh ra 2 muối CaCO3 và Ca(HCO3)2
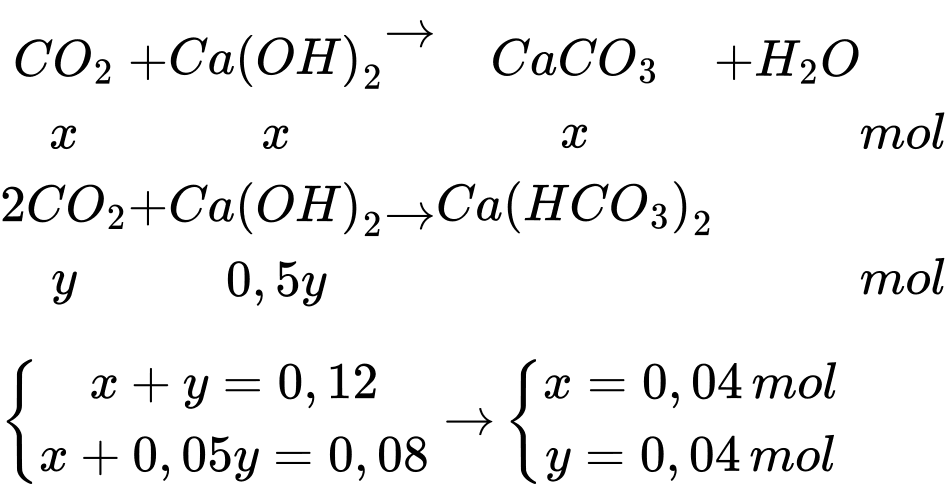
Khối lượng dung dịch thay đổi sau phản ứng là
∆m = 0,12.44 + 0,12.18 – 0,04.100 = 3,44 gam
Khối lượng dung dịch tăng 3,44 gam
❌(d) – Sai. Các công thức cấu tạo của X là CH3CH2CH2COOH và CH3CH(CH3)COOH
✔️(a) – Đúng. Trong phổ IR, có tín hiệu đặc trưng khoảng 1700 cm-1 đặc trung cho liên kết C=O và tín hiệu trong khoảng 3300 – 2500 cm-1 đặc trung cho liên kết O-H
Phân tử X có nhóm COOH.
❌(b) – Sai. Trong phổ IR, có tín hiệu đặc trưng khoảng 1700 cm-1 đặc trung cho liên kết C=O và tín hiệu trong khoảng 3300 – 2500 cm-1 đặc trung cho liên kết O-H
Phân tử X có nhóm COOH.
Hợp chất hữu cơ X có phân tử khối là 88 gam/mol và có các nguyên tố C, H, O.
→ X là carboxylic acid đơn chức.
→ X có CTPT là C4H8O2
✔️(c) – Đúng.Đốt cháy hoàn toàn 2,64 gam X, hỗn hợp sản hấp thụ hết vào bình đựng 200 mL dung dịch Ca(OH)2 0,4M thấy khối lượng dung dịch tăng 3,44 gam.
Số mol của X là nC4H8O2 = 2,64:88 = 0,03 mol
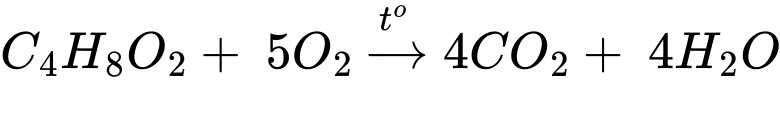
Từ PTHH số mol của CO2 và H2O lần lượt là 0,12 mol và 0,12 mol
Số mol của Ca(OH)2 là nCa(OH)2 = 0,4.0,2 = 0,08 mol
Ta có:
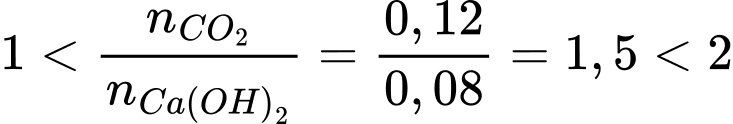
→ phản ứng sinh ra 2 muối CaCO3 và Ca(HCO3)2
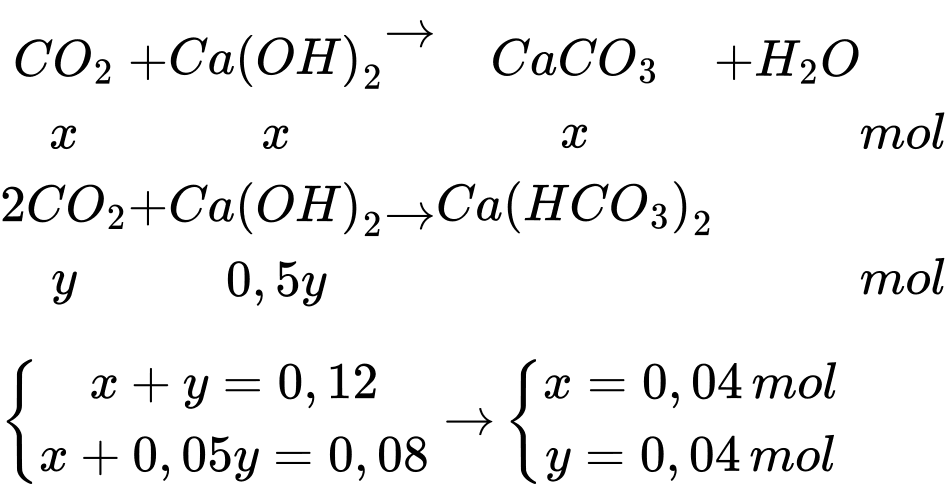
Khối lượng dung dịch thay đổi sau phản ứng là
∆m = 0,12.44 + 0,12.18 – 0,04.100 = 3,44 gam
Khối lượng dung dịch tăng 3,44 gam
❌(d) – Sai. Các công thức cấu tạo của X là CH3CH2CH2COOH và CH3CH(CH3)COOH
Câu 21 [706336]: Biến thiên năng lượng tự do Gibbs (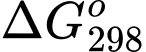 ) cho biết khả năng tự xảy ra của một phản ứng hóa học và nó được liên hệ bởi các yếu tố: nhiệt độ T, biến thiên enthalpy và biến thiên entropy của quá trình tại nhiệt độ tương ứng là
) cho biết khả năng tự xảy ra của một phản ứng hóa học và nó được liên hệ bởi các yếu tố: nhiệt độ T, biến thiên enthalpy và biến thiên entropy của quá trình tại nhiệt độ tương ứng là 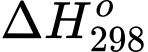 ;
; 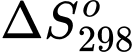 như sau:
như sau:
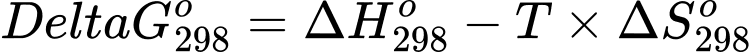
Trong đó T là nhiệt độ tính theo thang Kelvin (K). Đơn vị của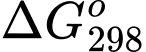 thường là J và giá trị
thường là J và giá trị 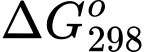 càng âm thì phản ứng diễn ra càng thuận lợi.
càng âm thì phản ứng diễn ra càng thuận lợi.
Ở 1 bar, nhiệt độ a oC quá trình nước lỏng chuyển thành nước dạng hơi có thể tự diễn ra:
(*) H2O(l) H2O(g)
H2O(g)
Biết rằng biến thiên enthalpy và biến thiên entropy của quá trình trên lần lượt là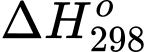 = 44,01 kJ;
= 44,01 kJ; 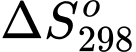 = 118,74 J.K–1. Giả sử biến thiên enthalpy và biến thiên entropy của quá trình không phụ thuộc vào nhiệt độ.
= 118,74 J.K–1. Giả sử biến thiên enthalpy và biến thiên entropy của quá trình không phụ thuộc vào nhiệt độ.
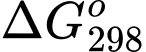 ) cho biết khả năng tự xảy ra của một phản ứng hóa học và nó được liên hệ bởi các yếu tố: nhiệt độ T, biến thiên enthalpy và biến thiên entropy của quá trình tại nhiệt độ tương ứng là
) cho biết khả năng tự xảy ra của một phản ứng hóa học và nó được liên hệ bởi các yếu tố: nhiệt độ T, biến thiên enthalpy và biến thiên entropy của quá trình tại nhiệt độ tương ứng là 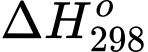 ;
; 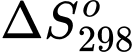 như sau:
như sau: 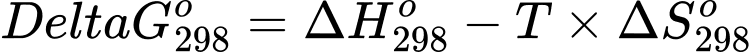
Trong đó T là nhiệt độ tính theo thang Kelvin (K). Đơn vị của
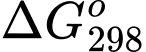 thường là J và giá trị
thường là J và giá trị 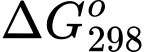 càng âm thì phản ứng diễn ra càng thuận lợi.
càng âm thì phản ứng diễn ra càng thuận lợi. Ở 1 bar, nhiệt độ a oC quá trình nước lỏng chuyển thành nước dạng hơi có thể tự diễn ra:
(*) H2O(l)
 H2O(g)
H2O(g) Biết rằng biến thiên enthalpy và biến thiên entropy của quá trình trên lần lượt là
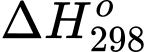 = 44,01 kJ;
= 44,01 kJ; 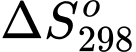 = 118,74 J.K–1. Giả sử biến thiên enthalpy và biến thiên entropy của quá trình không phụ thuộc vào nhiệt độ.
= 118,74 J.K–1. Giả sử biến thiên enthalpy và biến thiên entropy của quá trình không phụ thuộc vào nhiệt độ.
Phân tích các đáp án:
✔️(a) – Đúng.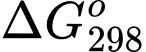 lớn hơn 0 thì quá trình không tự diễn ra.
lớn hơn 0 thì quá trình không tự diễn ra.
Năng lượng tự do Gibbs (Gibbs free energy) là năng lượng vốn có của một hệ , khi cần nó được dùng để thực hiện công dưới các nhiệt độ và áp suất nhất định. Khái niệm về năng lượng tự do được ông Josiah Willard Gibbs nêu ra đầu tiên nên ký hiệu là G. Nó là năng lượng tối đa tiềm ẩn trong hệ thống. Các chất hóa học đều có chứa năng lượng tự do. Khi xảy ra phản ứng hóa học, có sự biến đổi năng lượng tự do được ký hiệu bằng ΔG.
Dựa vào dấu của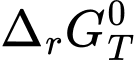 có thể dự đoán được hoặc giải thích được chiều hướng của một phản ứng hóa học ở nhiệt độ T như sau:
có thể dự đoán được hoặc giải thích được chiều hướng của một phản ứng hóa học ở nhiệt độ T như sau:
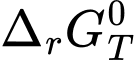 < 0: phản ứng tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
< 0: phản ứng tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
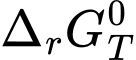 > 0: phản ứng không tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
> 0: phản ứng không tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
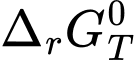 = 0: phản ứng đạt trạng thái cân bằng.
= 0: phản ứng đạt trạng thái cân bằng.
❌(b) – Sai. Ở 1 bar, nhiệt độ 298 K, nước tồn tại chủ yếu ở dạng lỏng
❌(c) – Sai. Với giá trị a bằng 97,64
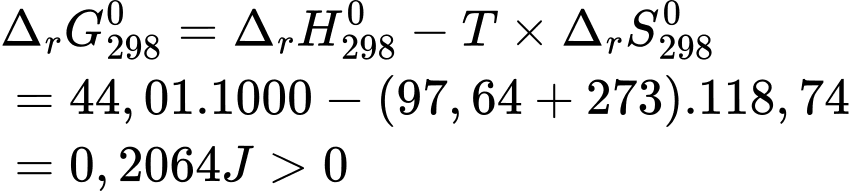 thì quá trình (*) không tự diễn biến.
thì quá trình (*) không tự diễn biến.
✔️(d) – Đúng.
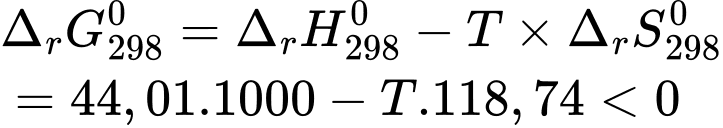
Nhiệt độ càng lớn thì phản ứng càng dễ xảy ra
✔️(a) – Đúng.
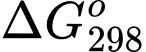 lớn hơn 0 thì quá trình không tự diễn ra.
lớn hơn 0 thì quá trình không tự diễn ra.Năng lượng tự do Gibbs (Gibbs free energy) là năng lượng vốn có của một hệ , khi cần nó được dùng để thực hiện công dưới các nhiệt độ và áp suất nhất định. Khái niệm về năng lượng tự do được ông Josiah Willard Gibbs nêu ra đầu tiên nên ký hiệu là G. Nó là năng lượng tối đa tiềm ẩn trong hệ thống. Các chất hóa học đều có chứa năng lượng tự do. Khi xảy ra phản ứng hóa học, có sự biến đổi năng lượng tự do được ký hiệu bằng ΔG.
Dựa vào dấu của
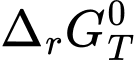 có thể dự đoán được hoặc giải thích được chiều hướng của một phản ứng hóa học ở nhiệt độ T như sau:
có thể dự đoán được hoặc giải thích được chiều hướng của một phản ứng hóa học ở nhiệt độ T như sau: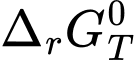 < 0: phản ứng tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
< 0: phản ứng tự xảy ra ở điều kiện chuẩn, nhiệt độ T.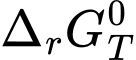 > 0: phản ứng không tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
> 0: phản ứng không tự xảy ra ở điều kiện chuẩn, nhiệt độ T.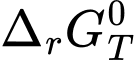 = 0: phản ứng đạt trạng thái cân bằng.
= 0: phản ứng đạt trạng thái cân bằng.❌(b) – Sai. Ở 1 bar, nhiệt độ 298 K, nước tồn tại chủ yếu ở dạng lỏng
❌(c) – Sai. Với giá trị a bằng 97,64
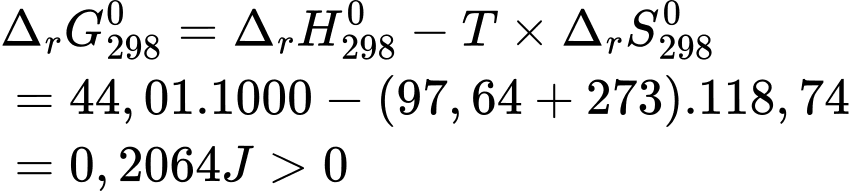 thì quá trình (*) không tự diễn biến.
thì quá trình (*) không tự diễn biến.✔️(d) – Đúng.
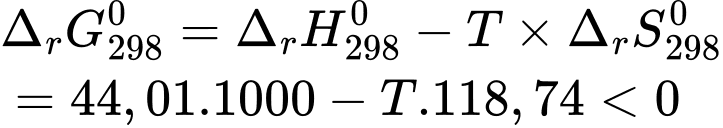
Nhiệt độ càng lớn thì phản ứng càng dễ xảy ra
Câu 22 [706337]: Một ví dụ điển hình về việc sử dụng phản ứng kết tủa để tìm tỉ lệ hợp thức của phương trình là phản ứng giữa dung dịch lead nitrate và potassium iodide. Cả hai dung dịch đều không màu, khi chúng được trộn lẫn, kết tủa màu màu vàng lead iodide được hình thành.
Phương trình phản ứng bằng chữ được thể hiện như sau:
lead nitrate + potassium iodide → lead iodide + potassium nitrate
Sau đây là các bước tiến hành thí nghiệm.
∎ Bước 1: Đổ cùng một thể tích dung dịch potassium iodide vào một loạt ống nghiệm.
∎ Bước 2: Thêm các thể tích khác nhau của dung dịch lead nitrate vào ống nghiệm.
∎ Bước 3: Đặt từng ống nghiệm vào máy ly tâm và quay các ống trong cùng khoảng thời gian. Máy li tâm giúp kết tủa lắng động ở phía dưới đáy ở ống nghiệm.
∎ Bước 4: Đo chiều cao của kết tủa trong mỗi ống.Kết quả của các thí nghiệm được thể hiện trong bảng.
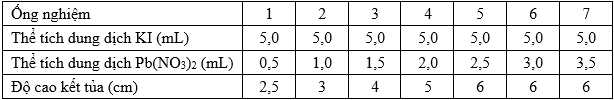
Nồng độ của cả hai dung dịch là 1,0 M.
Phương trình phản ứng bằng chữ được thể hiện như sau:
lead nitrate + potassium iodide → lead iodide + potassium nitrate
Sau đây là các bước tiến hành thí nghiệm.
∎ Bước 1: Đổ cùng một thể tích dung dịch potassium iodide vào một loạt ống nghiệm.
∎ Bước 2: Thêm các thể tích khác nhau của dung dịch lead nitrate vào ống nghiệm.
∎ Bước 3: Đặt từng ống nghiệm vào máy ly tâm và quay các ống trong cùng khoảng thời gian. Máy li tâm giúp kết tủa lắng động ở phía dưới đáy ở ống nghiệm.
∎ Bước 4: Đo chiều cao của kết tủa trong mỗi ống.Kết quả của các thí nghiệm được thể hiện trong bảng.

Nồng độ của cả hai dung dịch là 1,0 M.

Phân tích các phát biểu:
✔️(a) – Đúng. Từ hình minh họa, chiều cao của kết tủa tỉ lệ thuận với khối lượng kết tủa được hình thành.
✔️(b) – Đúng. Dựa vào phương trình ion rút gọn, ion K+ và NO3- chỉ đóng vai trò là ion quan sát.
PTHH: 2KI + Pb(NO3)2→ PbI2 + 2KNO3
Phương trình ion rút gọn: Pb2+ + 2I- → PbI2
❌(c) – Sai. Trong các thí nghiệm, khối lượng kết tủa phụ thuộc vào lượng KI và Pb(NO3)2, lượng càng nhiều thì kết tủa càng lớn.
❌(d) – Sai.
Thí nghiệm (1) số mol của KI và Pb(NO3)2 lần lượt là 0,005 mol và 0,0005 mol
Thí nghiệm (1) số mol của KI và Pb(NO3)2 lần lượt là 0,005 mol và 0,002 mol
Chỉ cung cáp thông tin về thay đổi độ cao kết tủa chưa thể xác định được tỉ lệ giữa KI và Pb(NO3)2
✔️(a) – Đúng. Từ hình minh họa, chiều cao của kết tủa tỉ lệ thuận với khối lượng kết tủa được hình thành.
✔️(b) – Đúng. Dựa vào phương trình ion rút gọn, ion K+ và NO3- chỉ đóng vai trò là ion quan sát.
PTHH: 2KI + Pb(NO3)2→ PbI2 + 2KNO3
Phương trình ion rút gọn: Pb2+ + 2I- → PbI2
❌(c) – Sai. Trong các thí nghiệm, khối lượng kết tủa phụ thuộc vào lượng KI và Pb(NO3)2, lượng càng nhiều thì kết tủa càng lớn.
❌(d) – Sai.
Thí nghiệm (1) số mol của KI và Pb(NO3)2 lần lượt là 0,005 mol và 0,0005 mol
Thí nghiệm (1) số mol của KI và Pb(NO3)2 lần lượt là 0,005 mol và 0,002 mol
Chỉ cung cáp thông tin về thay đổi độ cao kết tủa chưa thể xác định được tỉ lệ giữa KI và Pb(NO3)2
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [706338]: Để đánh giá chất lượng của chất béo người ta sử dụng các chỉ số chất lượng, trong đó có chỉ số acid và chỉ số xà phòng hóa. Chỉ số acid của chất béo là số mg KOH cần dùng để trung hòa acid béo tự do có trong 1,0 g chất béo, còn chỉ số xà phòng hóa là tổng số mg KOH cần để xà phòng hóa hết lượng triglyceride và trung hòa acid béo tự do trong 1,0 g chất béo.
Chất béo E gồm có chỉ số xà phòng hóa là 190,96 và chỉ số acid là 6,16 được sử dụng để sản xuất xà phòng. Nếu đun nóng 1,0 g chất béo E trong dung dịch KOH dư thì thu được m g muối. Giá trị của m là bao nhiêu (làm tròn đến hàng phần trăm)?
Chất béo E gồm có chỉ số xà phòng hóa là 190,96 và chỉ số acid là 6,16 được sử dụng để sản xuất xà phòng. Nếu đun nóng 1,0 g chất béo E trong dung dịch KOH dư thì thu được m g muối. Giá trị của m là bao nhiêu (làm tròn đến hàng phần trăm)?
(1) RCOOH + KOH → RCOOK + H2O
(2) (RCOO)3C3H5 + 3KOH → 3RCOOK +C3H5(OH)3
Ta có mE = 1 gam
Số mol KOH cần dùng là
nKOH = 190,96 .10-3 : 56 = 3,41.10-3 mol
Số mol KOH cần dùng để trung hòa acid béo là
nH2O = nKOH trung hòa acid = 6,16.10-3 : 56 = 0,11.10-3 mol
Số mol KOH cần dùng cho phản ứng xà phòng hóa là
nKOH = 3,41.10-3 - 0,11.10-3 = 3,3.10-3 mol
Từ PTHH số mol của glycerol là
-> nC3H5(OH)3 = 1,1.10-3 mol
Bảo toàn khối lượng:
mE + mKOH = mmuối + mH2O + mC3H5(OH)3
→ mmuối ≈ 1,09 gam
⟹ Điền đáp án : 1,09
(2) (RCOO)3C3H5 + 3KOH → 3RCOOK +C3H5(OH)3
Ta có mE = 1 gam
Số mol KOH cần dùng là
nKOH = 190,96 .10-3 : 56 = 3,41.10-3 mol
Số mol KOH cần dùng để trung hòa acid béo là
nH2O = nKOH trung hòa acid = 6,16.10-3 : 56 = 0,11.10-3 mol
Số mol KOH cần dùng cho phản ứng xà phòng hóa là
nKOH = 3,41.10-3 - 0,11.10-3 = 3,3.10-3 mol
Từ PTHH số mol của glycerol là
-> nC3H5(OH)3 = 1,1.10-3 mol
Bảo toàn khối lượng:
mE + mKOH = mmuối + mH2O + mC3H5(OH)3
→ mmuối ≈ 1,09 gam
⟹ Điền đáp án : 1,09
Câu 24 [706339]: Cho các mẫu chất và dán nhãn tương ứng như sau: Ammonium formate (1), lysine (2), fructose (3), aniline (4). Tiến hành thí nghiệm với dung dịch X, Y, Z và T. Kết quả được ghi ở bảng:

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)
Mẫu thử Z: tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam
Tác dụng với dung dịch AgNO3/NH3 xuất hiện kết tủa Ag
→ Z là fructose (3)
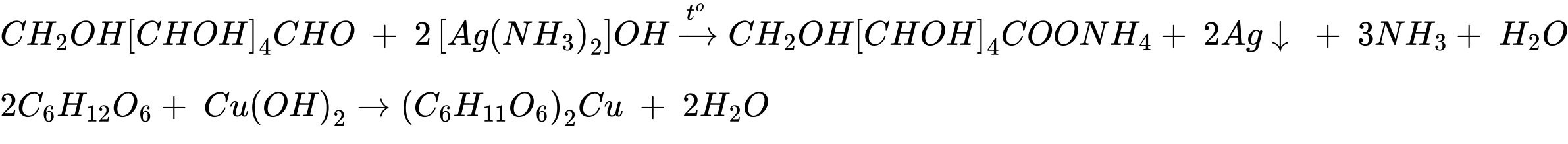
Mẫu thử X: Tác dụng với dung dịch AgNO3/NH3 xuất hiện kết tủa Ag
→ X là ammonium formate (1)
6HCOONH4 + 10AgNO3 + 11NH3 → 10Ag + 12NH4NO3 + 3CHCOONH4
Mẫu thử Y làm quì tím chuyển xanh
→ Y là lysine (2)
Mẫu thử T: Aniline + nước bromine
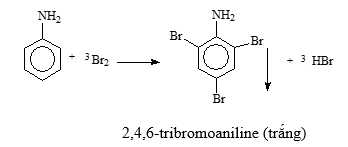
=> Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine → ứng với aniline (4)
⟹ Điền đáp án : 1234
Tác dụng với dung dịch AgNO3/NH3 xuất hiện kết tủa Ag
→ Z là fructose (3)
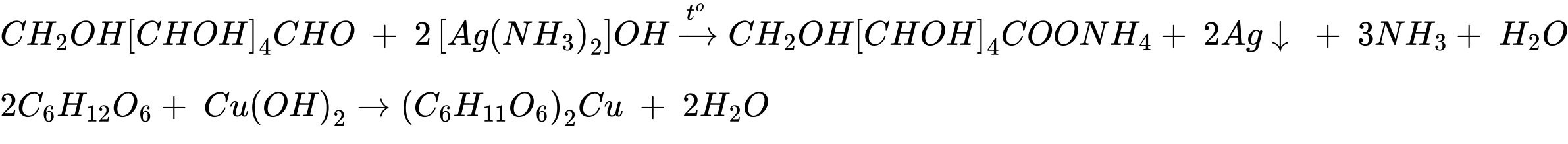
Mẫu thử X: Tác dụng với dung dịch AgNO3/NH3 xuất hiện kết tủa Ag
→ X là ammonium formate (1)
6HCOONH4 + 10AgNO3 + 11NH3 → 10Ag + 12NH4NO3 + 3CHCOONH4
Mẫu thử Y làm quì tím chuyển xanh
→ Y là lysine (2)
Mẫu thử T: Aniline + nước bromine

=> Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine → ứng với aniline (4)
⟹ Điền đáp án : 1234
Câu 25 [706340]: Acetone [(CH3)2CO, M = 58g/mol, nhiệt độ sôi 56 oC] là một chất lỏng không màu và dễ cháy, là dung môi để làm sạch dụng cụ thủy tinh trong phòng thí nghiệm. Ở nhiệt độ 500-600 oC với xúc tác thích hợp, acetone phân hủy thành ethylene như sau:
(CH3)2CO → CO +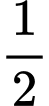 C2H4 + CH4.
C2H4 + CH4.
Sinh viên nghiên cứu sự phân hủy acetone ở 550 oC bằng cách cho acetone vào bình kín chịu nhiệt có dung tích không đổi (1 L) và ghi nhận sự thay đổi áp suất (P) của hỗn hợp phản ứng (X) theo thời gian sau mỗi 75 giây. Kết quả:
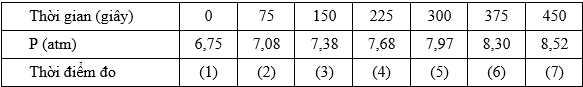
Kết quả đo áp suất ở thời điểm nào được nghi ngờ là sai lầm?
(CH3)2CO → CO +
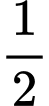 C2H4 + CH4.
C2H4 + CH4.Sinh viên nghiên cứu sự phân hủy acetone ở 550 oC bằng cách cho acetone vào bình kín chịu nhiệt có dung tích không đổi (1 L) và ghi nhận sự thay đổi áp suất (P) của hỗn hợp phản ứng (X) theo thời gian sau mỗi 75 giây. Kết quả:

Kết quả đo áp suất ở thời điểm nào được nghi ngờ là sai lầm?
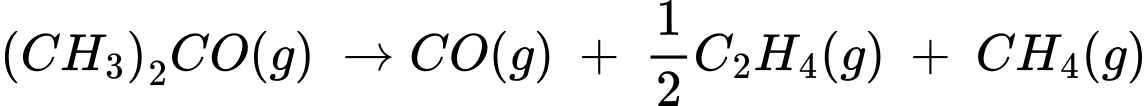
(2) t = 75 giây → ∆p = ps - pt = 7,08 – 6,75 = 0,33 atm
(3) t = 150 giây → ∆p = ps - pt = 7,38 – 7,08 = 0,3 atm
(4) t = 225 giây → ∆p = ps - pt = 7,68 – 7,38 = 0,3 atm
(5) t = 300 giây → ∆p = ps - pt = 7,97 – 6,68 = 0,29 atm
(6) t = 375 giây → ∆p = ps - pt = 8,3 – 7,97 = 0,33 atm
(7) t = 450 giây → ∆p = ps - pt = 8,52 – 8,3 = 0,22 atm
Sau phản ứng lượng biến thiên áp suất giảm dần, nhưng thời điểm thứ (6) biến thiên lại tăng nên đây là thời điểm nghi ngờ.
⟹ Điền đáp án : 6
Câu 26 [309527]: Kevlar là một polyamide có độ bền kéo rất cao. Loại vật liệu này được dùng để sản xuất áo chống đạn và mũ bảo hiểm cho quân đội. Kevlar được điều chế bằng phản ứng trùng ngưng của hai chất sau:
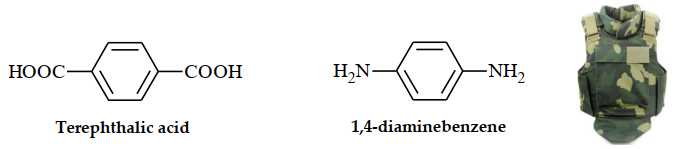
Trong một mắt xích của Kevlar có chứa bao nhiêu nguyên tử oxygen?
Điền đáp án: [..........]

Trong một mắt xích của Kevlar có chứa bao nhiêu nguyên tử oxygen?
Điền đáp án: [..........]
Công thức cấu tạo của Kevlar là:
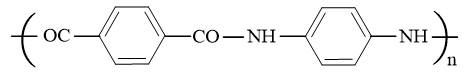
→ Trong một mắt xích của Kevlar có chứa 2 nguyên tử oxygen.
⇒ Điền đáp án: 2
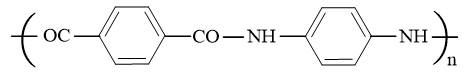
→ Trong một mắt xích của Kevlar có chứa 2 nguyên tử oxygen.
⇒ Điền đáp án: 2
Câu 27 [706341]: Cho các phát biểu sau:
(a) Phân tử lysine chứa số nguyên tử oxygen bằng số nguyên tử nitrogen.
(b) Hydrogen hóa hoàn toàn triolein (Ni, to), thu được tristearin.
(c) Glucose còn gọi là đường nho do có nhiều trong quả nho chín.
(d) Tơ hóa học gồm hai nhóm: tơ tổng hợp và tơ nhân tạo.
(e) Phản ứng ester hóa (H2SO4 đặc, to) xảy ra thuận nghịch.
Số phát biểu đúng là
(a) Phân tử lysine chứa số nguyên tử oxygen bằng số nguyên tử nitrogen.
(b) Hydrogen hóa hoàn toàn triolein (Ni, to), thu được tristearin.
(c) Glucose còn gọi là đường nho do có nhiều trong quả nho chín.
(d) Tơ hóa học gồm hai nhóm: tơ tổng hợp và tơ nhân tạo.
(e) Phản ứng ester hóa (H2SO4 đặc, to) xảy ra thuận nghịch.
Số phát biểu đúng là
Phân tích các phát biển:
✔️(a) – Đúng. Phân tử lysine: NH2-(CH2)4-CH(NH2)-COOH chứa 2 nguyên tử oxygen do có chứa 1 nhóm COOH.
✔️(b) – Đúng. Hydrogen hóa hoàn toàn triolein (Ni, to), thu được tristearin.
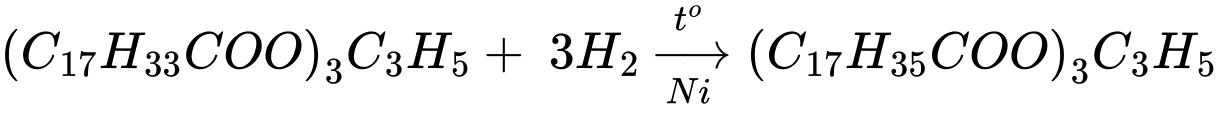
✔️(c) – Đúng. Glucose còn gọi là đường nho do có nhiều trong quả nho chín.
- Glucose là chất rắn, vị ngọt, dễ tan trong nước. Có trong các bộ phận của cây, đặc biệt là trong các quả chín.
- Glucose cũng có trong máu người và động vật. Nồng độ glucose trong máu người trưởng thành khoảng 4,4 – 7,2 mmol/L (hay 80 – 130 mg/dL).
- Glucose là chất dinh dưỡng quan trọng đối với con người. Dùng làm thực phẩm, đồ uống, tráng gương – tráng rột phích, dung dịch truyền tĩnh mạch glucose 5%, sản xuất ethanol, …
✔️(d) – Đúng. Tơ được chia thành hai loại:
- Tơ thiên nhiên (sãn có trong thiên nhiên) như bông, len, tơ tằm.
- Tơ hóa học (chế tạo bằng phương pháp hóa học): được chia làm hai nhóm
+ Tơ tổng hợp (chế tạo từ các polymeẻ tổng hợp) như các tơ polyamide (nilon, capron), tơ vinylic (vinilon).
+ Tơ bán tổng hợp hay tơ nhân tạo (xuất phát từ polymer thiên nhiên nhưng được chế biến thêm bằng phương pháp hóa học)
✔️(e) – Đúng. Phản ứng ester hóa (H2SO4 đặc, to) xảy ra thuận nghịch.
Ester bị thuỷ phân trong môi trường acid thường tạo thành carboxylic acid và alcohol (hoặc phenol) tương ứng.
RCOOR + H2O ⇌ RCOOH + ROH
Có 5 phát biểu đúng.
⟹ Điền đáp án: 5
✔️(a) – Đúng. Phân tử lysine: NH2-(CH2)4-CH(NH2)-COOH chứa 2 nguyên tử oxygen do có chứa 1 nhóm COOH.
✔️(b) – Đúng. Hydrogen hóa hoàn toàn triolein (Ni, to), thu được tristearin.
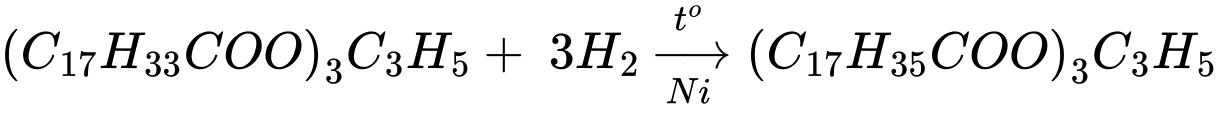
✔️(c) – Đúng. Glucose còn gọi là đường nho do có nhiều trong quả nho chín.
- Glucose là chất rắn, vị ngọt, dễ tan trong nước. Có trong các bộ phận của cây, đặc biệt là trong các quả chín.
- Glucose cũng có trong máu người và động vật. Nồng độ glucose trong máu người trưởng thành khoảng 4,4 – 7,2 mmol/L (hay 80 – 130 mg/dL).
- Glucose là chất dinh dưỡng quan trọng đối với con người. Dùng làm thực phẩm, đồ uống, tráng gương – tráng rột phích, dung dịch truyền tĩnh mạch glucose 5%, sản xuất ethanol, …
✔️(d) – Đúng. Tơ được chia thành hai loại:
- Tơ thiên nhiên (sãn có trong thiên nhiên) như bông, len, tơ tằm.
- Tơ hóa học (chế tạo bằng phương pháp hóa học): được chia làm hai nhóm
+ Tơ tổng hợp (chế tạo từ các polymeẻ tổng hợp) như các tơ polyamide (nilon, capron), tơ vinylic (vinilon).
+ Tơ bán tổng hợp hay tơ nhân tạo (xuất phát từ polymer thiên nhiên nhưng được chế biến thêm bằng phương pháp hóa học)
✔️(e) – Đúng. Phản ứng ester hóa (H2SO4 đặc, to) xảy ra thuận nghịch.
Ester bị thuỷ phân trong môi trường acid thường tạo thành carboxylic acid và alcohol (hoặc phenol) tương ứng.
RCOOR + H2O ⇌ RCOOH + ROH
Có 5 phát biểu đúng.
⟹ Điền đáp án: 5
Câu 28 [706342]: Urea (NH2)2C=O là chất hữu cơ nhân tạo đầu tiên của nhân loại. Để tổng hợp urea có thể đi theo con đường sau:
∎ Giai đoạn 1: Than (80% carbon) được thực hiện phản ứng khí than ướt (hiệu suất 70%) nhằm thu CO và H2.
C(s) + H2O(g)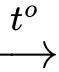 CO(g) + H2(g)
CO(g) + H2(g)
∎ Giai đoạn 2: Mang CO đi phản ứng với oxygen dư để thu CO2 (hiệu suất 100%).
2CO(g) + O2(g)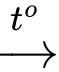 2CO2(g)
2CO2(g)
∎ Giai đoạn 3: Cho CO2 và NH3 vừa thu được ở trên phản ứng với nhau để có urea (hiệu suất 70%).
CO2(g) + 2NH3(g)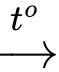 (NH2)2C=O(s) + H2O(l)
(NH2)2C=O(s) + H2O(l)
Tính khối lượng urea (kg) thu được sản xuất từ 10 kg than? Các chất phản ứng khác dùng dư.
∎ Giai đoạn 1: Than (80% carbon) được thực hiện phản ứng khí than ướt (hiệu suất 70%) nhằm thu CO và H2.
C(s) + H2O(g)
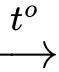 CO(g) + H2(g)
CO(g) + H2(g)∎ Giai đoạn 2: Mang CO đi phản ứng với oxygen dư để thu CO2 (hiệu suất 100%).
2CO(g) + O2(g)
 2CO2(g)
2CO2(g)∎ Giai đoạn 3: Cho CO2 và NH3 vừa thu được ở trên phản ứng với nhau để có urea (hiệu suất 70%).
CO2(g) + 2NH3(g)
 (NH2)2C=O(s) + H2O(l)
(NH2)2C=O(s) + H2O(l)Tính khối lượng urea (kg) thu được sản xuất từ 10 kg than? Các chất phản ứng khác dùng dư.
Khối lượng carbon là mC = 10.80% = 8 kg
Hiệu suất chung của cả quá trình là H = 70%.100%.70% = 49%
Sơ đồ phản ứng:
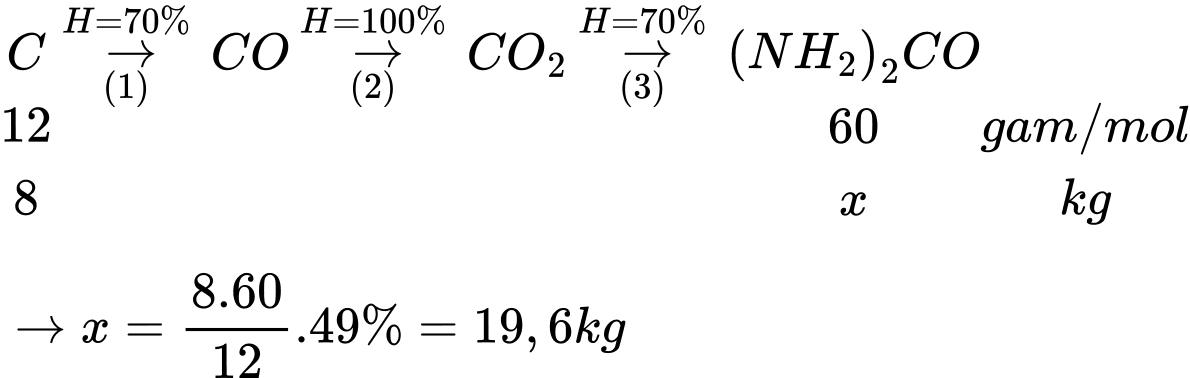
⟹ x = 19,6 kg
⟹ Điền đáp án: 19,6
Hiệu suất chung của cả quá trình là H = 70%.100%.70% = 49%
Sơ đồ phản ứng:
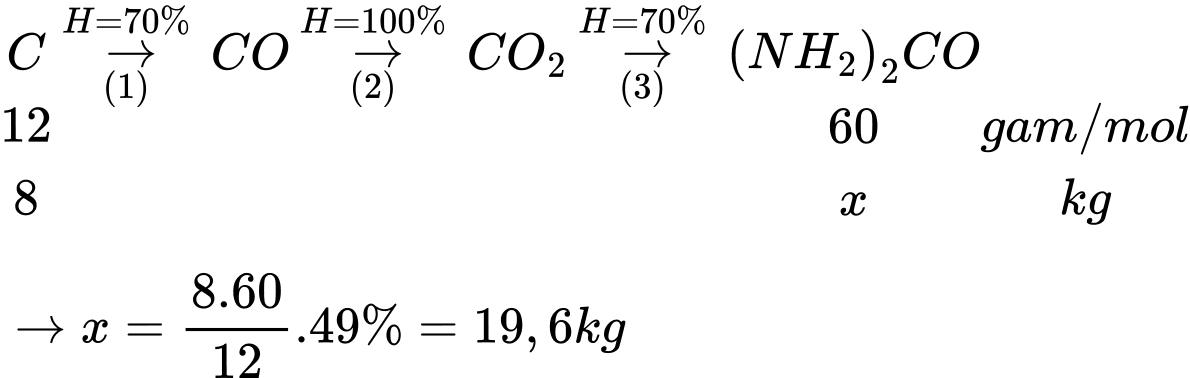
⟹ x = 19,6 kg
⟹ Điền đáp án: 19,6