PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [703815]: “Trong tinh thể kim loại, liên kết kim loại được hình thành do ...(1)... giữa các electron hoá trị tự do với các ...(2)... kim loại ở các nút mạng”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, lực hút tĩnh điện, ion dương.
B, lực hút tĩnh điện, ion âm.
C, lực hạt nhân, ion dương.
D, lực đẩy tĩnh điện, ion âm.
Trong tinh thể kim loại, các nguyên tử kim loại giải phóng electron hóa trị (electron ở lớp ngoài cùng) để trở thành ion dương. Lực hút tĩnh điện giữa các electron tự do và ion dương kim loại là yếu tố chính giữ các ion dương ở vị trí cố định trong mạng tinh thể. Do đó, lực hút tĩnh điện là đặc trưng cơ bản của liên kết kim loại.
⇒ Trong tinh thể kim loại, liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron hoá trị tự do với các ion dương kim loại ở các nút mạng.
Chọn đáp án A Đáp án: A
⇒ Trong tinh thể kim loại, liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron hoá trị tự do với các ion dương kim loại ở các nút mạng.
Chọn đáp án A Đáp án: A
Câu 2 [703816]: Kim loại nào sau đây là kim loại kiềm?
A, Potassium (K).
B, Mercury (Hg).
C, Cooper (Cu).
D, Magnesium (Mg).
Kim loại kiềm là các kim loại thuộc nhóm IA trong bảng tuần hoàn. Các nguyên tố này bao gồm:
⭐ Li (Lithium)
⭐ Na (Sodium)
⭐ K (Potassium)
⭐ Rb (Rubidium)
⭐ Cs (Caesi)
⭐ Fr (Franci)
⇒ Kim loại kiềm trong dãy các kim loại trên là Potassium (K)
⇒ Chọn đáp án A Đáp án: A
⭐ Li (Lithium)
⭐ Na (Sodium)
⭐ K (Potassium)
⭐ Rb (Rubidium)
⭐ Cs (Caesi)
⭐ Fr (Franci)
⇒ Kim loại kiềm trong dãy các kim loại trên là Potassium (K)
⇒ Chọn đáp án A Đáp án: A
Câu 3 [703817]: Trùng hợp acrylonitrile (CH2=CHCN) thu được polymer được sử dụng để sản xuất loại tơ nào sau đây?
A, Tơ capron.
B, Tơ lapsan.
C, Tơ visco.
D, Tơ nitron.
Trùng hợp acrylonitrile (CH2=CHCN) sẽ tạo ra polymer polyacrylonitrile (PAN), đây là nguyên liệu chính để sản xuất tơ nitron (hay còn gọi là tơ olon), một loại tơ nhân tạo bền, dai và nhẹ.
Quá trình trùng hợp:
nCH2=CHCN → [−CH2−CH(CN)−]n
Polymer thu được là polyacrylonitrile (PAN).
⇒ Chọn đáp án: D Đáp án: D
Quá trình trùng hợp:
nCH2=CHCN → [−CH2−CH(CN)−]n
Polymer thu được là polyacrylonitrile (PAN).
⇒ Chọn đáp án: D Đáp án: D
Câu 4 [703818]: Thực hiện các thí nghiệm sau:
Thí nghiệm 1: Điện phân dung dịch sodium chloride dư bằng điện cực trơ, không màng ngăn.
Thí nghiệm 2: Dẫn khí hydrogen sulfide vào dung dịch iron(III) chloride.
Thí nghiệm 3: Dẫn luồng khí ammonia qua ống sứ chứa copper(II) oxide nung nóng.
Thí nghiệm 4: Cho bột zinc vào dung dịch iron(III) nitrate dư.
Các thí nghiệm thu được đơn chất là
Thí nghiệm 1: Điện phân dung dịch sodium chloride dư bằng điện cực trơ, không màng ngăn.
Thí nghiệm 2: Dẫn khí hydrogen sulfide vào dung dịch iron(III) chloride.
Thí nghiệm 3: Dẫn luồng khí ammonia qua ống sứ chứa copper(II) oxide nung nóng.
Thí nghiệm 4: Cho bột zinc vào dung dịch iron(III) nitrate dư.
Các thí nghiệm thu được đơn chất là
A, (1), (2) và (3).
B, (2), (3) và (4).
C, (1), (2) và (4).
D, (1), (3) và (4).
Phản ứng của các thí nghiệm xảy ra như sau:
Thí nghiệm 1:
2NaCl + 2H2O –(đpdd)⟶ 2NaOH + Cl2↑ + H2↑
2NaOH + Cl2 ⟶ NaClO + NaCl + H2O
Thí nghiệm 2:
2FeCl3 + H2S → 2FeCl2 + 2HCl + S↓
Thí nghiệm 3:
3CuO + 2NH3 –(to)⟶ 3Cu + N2↑ + 3H2O
Thí nghiệm 4:
Zn + 2Fe(NO3)3 ⟶ Zn(NO3)2 + 2Fe(NO3)2
Các thí nghiệm thu được đơn chất là (1) (2) (3)
⇒ Chọn đáp án: A Đáp án: A
Thí nghiệm 1:
2NaCl + 2H2O –(đpdd)⟶ 2NaOH + Cl2↑ + H2↑
2NaOH + Cl2 ⟶ NaClO + NaCl + H2O
Thí nghiệm 2:
2FeCl3 + H2S → 2FeCl2 + 2HCl + S↓
Thí nghiệm 3:
3CuO + 2NH3 –(to)⟶ 3Cu + N2↑ + 3H2O
Thí nghiệm 4:
Zn + 2Fe(NO3)3 ⟶ Zn(NO3)2 + 2Fe(NO3)2
Các thí nghiệm thu được đơn chất là (1) (2) (3)
⇒ Chọn đáp án: A Đáp án: A
Câu 5 [703819]: Nguyên tử nguyên tố X có cấu hình electron là 1s22s22p4. Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố X thuộc nhóm
A, IVA.
B, VIA.
C, IIA.
D, VIIIA.
Nguyên tố X có cấu hình 1s22s22p4 thuộc nguyên tố p, có 6e lớp ngoài cùng nên thuộc nhóm VIA.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 6 [679747]: Đun nước cứng lâu ngày trong ấm nước xuất hiện một lớp cặn. Thành phần chính của lớp cặn đó là
A, CaCl2.
B, CaCO3.
C, Na2CO3.
D, CaO.
HD: Thành phần chính của lớp cặn đó là CaCO3. Nguyên nhân:
Ca(HCO3)2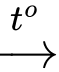 CaCO3↓ + CO2↑ + H2O.
CaCO3↓ + CO2↑ + H2O.
☆ Để làm sạch, có thể sử dụng giấm ăn:
2CH3COOH + CaCO3 → (CH3COO)2Ca + 2H2O.
⇒ Chọn đáp án B Đáp án: B
Ca(HCO3)2
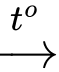 CaCO3↓ + CO2↑ + H2O.
CaCO3↓ + CO2↑ + H2O.☆ Để làm sạch, có thể sử dụng giấm ăn:
2CH3COOH + CaCO3 → (CH3COO)2Ca + 2H2O.
⇒ Chọn đáp án B Đáp án: B
Câu 7 [703820]: Phát biểu nào sau đây về phân bón SA (phân ammonium sulfate) không đúng?
A, Có thành phần chính là (NH4)2SO4.
B, Được sản xuất theo phản ứng giữa ammonia và sulfuric acid đặc.
C, Dễ làm đất bị chua do thủy phân tạo môi trường acid.
D, Phù hợp với các loại đất chua hoặc ngập mặn.
✔️ A. Đúng. Thành phần chính của phân SA là ammonium sulfate (NH4)2SO4, với tỷ lệ khoảng 21% nitrogen và 24% sulfur.
✔️ B. Đúng. Phân SA được sản xuất bằng cách cho khí NH3 phản ứng với sulfuric acid H2SO4:
2NH3 + H2SO4 → (NH4)2SO4
✔️ C. Đúng. NH4+ trong phân bón khi bị hòa tan trong đất sẽ phân li ra H+ gây nên độ chua của đất.
NH4+ ⇌ NH3 + H+
❌ D. Sai. Do dễ làm đất bị chua nên phân SA không phù hợp với các loại đất chua hoặc ngập mặn.
⇒ Chọn đáp án D Đáp án: D
✔️ B. Đúng. Phân SA được sản xuất bằng cách cho khí NH3 phản ứng với sulfuric acid H2SO4:
2NH3 + H2SO4 → (NH4)2SO4
✔️ C. Đúng. NH4+ trong phân bón khi bị hòa tan trong đất sẽ phân li ra H+ gây nên độ chua của đất.
NH4+ ⇌ NH3 + H+
❌ D. Sai. Do dễ làm đất bị chua nên phân SA không phù hợp với các loại đất chua hoặc ngập mặn.
⇒ Chọn đáp án D Đáp án: D
Câu 8 [308239]: Chất nào sau đây không phải là carbohydrate?
A, Triolein.
B, Saccharose.
C, Tinh bột.
D, Cellulose.
HD: Phân tích các đáp án:
❌ A. Triolein: (C17H33COO)3C3H5 là chất béo.
✔️ B. Saccharose: C12H22O11 là hợp chất carbohydrate (thuộc loại disaccharide).
✔️ C. Tinh bột C6H10O5 là hợp chất carbohydrate (thuộc loại polysaccharide).
✔️ D. Cellulose C6H10O5 là hợp chất carbohydrate (thuộc loại polysaccharide).
⇒ Chọn đáp án A Đáp án: A
❌ A. Triolein: (C17H33COO)3C3H5 là chất béo.
✔️ B. Saccharose: C12H22O11 là hợp chất carbohydrate (thuộc loại disaccharide).
✔️ C. Tinh bột C6H10O5 là hợp chất carbohydrate (thuộc loại polysaccharide).
✔️ D. Cellulose C6H10O5 là hợp chất carbohydrate (thuộc loại polysaccharide).
⇒ Chọn đáp án A Đáp án: A
Câu 9 [703821]: Để khinh khí cầu có thể bay được thì khí được bơm vào khinh khí cầu là hydrogen, nó sẽ bay rất cao do khí hydrogen rất nhẹ. Tuy nhiên, đã có nhiều vụ nổ thương tâm gây ra bởi khinh khí cầu hydrogen vì hydrogen tạo với oxygen hỗn hợp nổ rất mạnh.
(*) 2H2(g) + O2(g) 2H2O(l);
2H2O(l); 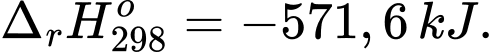
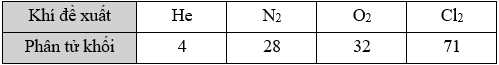
Để thay thế hydrogen, một số khí dưới đây đã được đề xuất để bơm vào khinh khí cầu:
Cho các phát biểu sau:
(a) Phản ứng (*) xảy ra tỏa nhiệt, sự giãn nở thể tích đột ngột nên gây ra sự nổ.
(b) Có thể sử dụng khí N2 thay thế cho H2 để bơm vào khinh khí cầu.
(c) Không sử dụng khí Cl2 thay thế vì Cl2 cũng phản ứng và gây nổ rất mạnh như H2.
(d) Sự nổ khí hydrogen có thể được kiểm soát bằng cách ngăn chặn khí hydrogen tuyệt đối không tiếp xúc với khí oxygen.
Các phát biểu đúng là
(*) 2H2(g) + O2(g)
 2H2O(l);
2H2O(l); 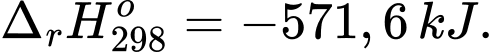
Để thay thế hydrogen, một số khí dưới đây đã được đề xuất để bơm vào khinh khí cầu:

Cho các phát biểu sau:
(a) Phản ứng (*) xảy ra tỏa nhiệt, sự giãn nở thể tích đột ngột nên gây ra sự nổ.
(b) Có thể sử dụng khí N2 thay thế cho H2 để bơm vào khinh khí cầu.
(c) Không sử dụng khí Cl2 thay thế vì Cl2 cũng phản ứng và gây nổ rất mạnh như H2.
(d) Sự nổ khí hydrogen có thể được kiểm soát bằng cách ngăn chặn khí hydrogen tuyệt đối không tiếp xúc với khí oxygen.
Các phát biểu đúng là
A, (a), (c).
B, (b), (c), (d).
C, (a), (b), (c).
D, (a), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Biến thiên enthalpy của phản ứng (*) rất âm nên đây là phản ứng tỏa nhiệt rất mạnh. Nhiệt lượng lớn giải phóng trong thời gian ngắn làm không khí xung quanh giãn nở đột ngột, dẫn đến vụ nổ.
❌ (b) Sai. Khối lượng phân tử của nitrogen (28) lớn hơn của hydrogen (2) nên lực nâng của khí N2 sẽ nhỏ, không phù hợp để bơm vào khinh khí cầu để thay thế H2.
✔️ (c) Đúng. Không sử dụng khí Cl2 thay thế được vì Cl2 là khí độc và nặng hơn không khí, ngoài ra Cl2 có thể tham gia phản ứng nguy hiểm với hydrogen nếu có mặt: H2 + Cl2 –(ánh sáng)→ 2HCl. Đây là phản ứng tỏa nhiệt mạnh, cũng có thể gây nổ.
✔️ (d) Đúng. Để ngăn chặn sự nổ, cần đảm bảo rằng hydrogen không tiếp xúc với oxygen, vì hỗn hợp này mới là nguyên nhân gây nổ. Đây là một biện pháp an toàn hợp lý và khả thi.
➥ Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án D Đáp án: D
✔️ (a) Đúng. Biến thiên enthalpy của phản ứng (*) rất âm nên đây là phản ứng tỏa nhiệt rất mạnh. Nhiệt lượng lớn giải phóng trong thời gian ngắn làm không khí xung quanh giãn nở đột ngột, dẫn đến vụ nổ.
❌ (b) Sai. Khối lượng phân tử của nitrogen (28) lớn hơn của hydrogen (2) nên lực nâng của khí N2 sẽ nhỏ, không phù hợp để bơm vào khinh khí cầu để thay thế H2.
✔️ (c) Đúng. Không sử dụng khí Cl2 thay thế được vì Cl2 là khí độc và nặng hơn không khí, ngoài ra Cl2 có thể tham gia phản ứng nguy hiểm với hydrogen nếu có mặt: H2 + Cl2 –(ánh sáng)→ 2HCl. Đây là phản ứng tỏa nhiệt mạnh, cũng có thể gây nổ.
✔️ (d) Đúng. Để ngăn chặn sự nổ, cần đảm bảo rằng hydrogen không tiếp xúc với oxygen, vì hỗn hợp này mới là nguyên nhân gây nổ. Đây là một biện pháp an toàn hợp lý và khả thi.
➥ Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án D Đáp án: D
Câu 10 [304099]: Ester E có công thức cấu tạo như hình vẽ như sau:
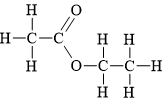
Tên gọi của ester E là

Tên gọi của ester E là
A, Ethyl acetate.
B, Methyl acetate.
C, Methyl ethanoate.
D, Ethyl propionate.
HD: Viết gọn công thức cấu tạo ester và phân tích:
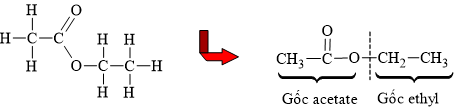
⇒ Tên gọi tương ứng của ester E là ethyl acetate
⟹ Chọn đáp án A. Đáp án: A

⇒ Tên gọi tương ứng của ester E là ethyl acetate
⟹ Chọn đáp án A. Đáp án: A
Câu 11 [703822]: “Hầu hết enzyme là …(1)… đóng vai trò …(2)… cho các phản ứng sinh hoá trong cơ thể”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, lipid, xúc tác sinh học.
B, protein, xúc tác sinh học.
C, carbohydrate, cung cấp năng lượng.
D, vitamin, vận chuyển trung gian.
- Hầu hết enzyme là các protein có cấu trúc đặc biệt, được thiết kế để thực hiện một chức năng cụ thể.
- Enzyme giúp tăng tốc độ các phản ứng sinh hóa trong cơ thể mà không bị tiêu hao trong quá trình phản ứng. Chúng hoạt động bằng cách hạ thấp năng lượng hoạt hóa cần thiết để phản ứng xảy ra. Chúng là các xúc tác sinh học.
⇒ Hầu hết enzyme là protein đóng vai trò xúc tác sinh học cho các phản ứng sinh hoá trong cơ thể.
⇒ Chọn đáp án B Đáp án: B
- Enzyme giúp tăng tốc độ các phản ứng sinh hóa trong cơ thể mà không bị tiêu hao trong quá trình phản ứng. Chúng hoạt động bằng cách hạ thấp năng lượng hoạt hóa cần thiết để phản ứng xảy ra. Chúng là các xúc tác sinh học.
⇒ Hầu hết enzyme là protein đóng vai trò xúc tác sinh học cho các phản ứng sinh hoá trong cơ thể.
⇒ Chọn đáp án B Đáp án: B
Câu 12 [703823]: Tính base yếu của aniline so với các alkylamine như methylamine có thể được giải thích như sau: Tính base phụ thuộc vào mật độ electron có trên nguyên tử N của amine. Trong cấu tạo của aniline, cặp electron trên nguyên tử N chịu ảnh hưởng của vòng phenyl và bị hút vào vòng. Từ đó, mật độ electron trên nguyên tử N giảm và tính base giảm. Cho các phát biểu sau:
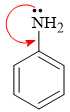
(a) Tính base của amine được gây ra do cặp electron trên nguyên tử N.
(b) Cặp electron bị hút vào vòng trên nguyên tử N là cặp electron chưa tham gia liên kết.
(c) Do ảnh hưởng của vòng phenyl nên aniline có pH lớn hơn diphenylamine.
(d) Ảnh hưởng của gốc C6H5 đến nhóm NH2 so với methylamine có thể được kiểm chứng qua thí nghiệm với quỳ tím.
Trong các phát biểu trên, những phát biểu đúng là

(a) Tính base của amine được gây ra do cặp electron trên nguyên tử N.
(b) Cặp electron bị hút vào vòng trên nguyên tử N là cặp electron chưa tham gia liên kết.
(c) Do ảnh hưởng của vòng phenyl nên aniline có pH lớn hơn diphenylamine.
(d) Ảnh hưởng của gốc C6H5 đến nhóm NH2 so với methylamine có thể được kiểm chứng qua thí nghiệm với quỳ tím.
Trong các phát biểu trên, những phát biểu đúng là
A, (a), (b), (c).
B, (a), (b), (d).
C, (b), (c), (d).
D, (a), (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Tính base của amine được gây ra bởi khả năng nhường cặp electron tự do trên nguyên tử N cho proton (H+) để tạo liên kết. Do đó, cặp electron trên N chính là nguyên nhân gây tính base.
✔️ (b) Trong aniline, cặp electron tự do trên nguyên tử N (cặp electron chưa tham gia liên kết) bị hút vào vòng. Do đó, cặp electron này làm giảm mật độ electron trên N, từ đó làm giảm tính base của aniline.
✔️ (c) Ở diphenylamine, nhóm NH2 gắn với hai gốc phenyl làm cặp electron trên N bị hút mạnh hơn, dẫn đến tính base của diphenylamine nhỏ hơn so với aniline ⬌ pH của dung dịch aniline sẽ lớn hơn pH của dung dịch diphenylamine.
✔️ (d) Đúng. Ảnh hưởng của gốc C6H5 đến nhóm NH2 so với methylamine có thể được kiểm chứng qua thí nghiệm với quỳ tím:
- Dung dịch methylamine có tính base mạnh hơn (làm quỳ tím chuyển màu xanh đậm hơn).
- Dung dịch aniline có tính base yếu hơn (làm quỳ tím chuyển màu xanh nhạt hơn hoặc không đổi màu).
➥ Cả 4 phát biểu đều đúng
⇒ Chọn đáp án D Đáp án: D
✔️ (a) Đúng. Tính base của amine được gây ra bởi khả năng nhường cặp electron tự do trên nguyên tử N cho proton (H+) để tạo liên kết. Do đó, cặp electron trên N chính là nguyên nhân gây tính base.
✔️ (b) Trong aniline, cặp electron tự do trên nguyên tử N (cặp electron chưa tham gia liên kết) bị hút vào vòng. Do đó, cặp electron này làm giảm mật độ electron trên N, từ đó làm giảm tính base của aniline.
✔️ (c) Ở diphenylamine, nhóm NH2 gắn với hai gốc phenyl làm cặp electron trên N bị hút mạnh hơn, dẫn đến tính base của diphenylamine nhỏ hơn so với aniline ⬌ pH của dung dịch aniline sẽ lớn hơn pH của dung dịch diphenylamine.
✔️ (d) Đúng. Ảnh hưởng của gốc C6H5 đến nhóm NH2 so với methylamine có thể được kiểm chứng qua thí nghiệm với quỳ tím:
- Dung dịch methylamine có tính base mạnh hơn (làm quỳ tím chuyển màu xanh đậm hơn).
- Dung dịch aniline có tính base yếu hơn (làm quỳ tím chuyển màu xanh nhạt hơn hoặc không đổi màu).
➥ Cả 4 phát biểu đều đúng
⇒ Chọn đáp án D Đáp án: D
Câu 13 [703824]: Để xác định phân tử khối của hợp chất hữu cơ, có thể sử dụng kết quả
A, đo thể tích.
B, phổ hồng ngoại (IR).
C, cân khối lượng.
D, phổ khối lượng (MS).
❌ A. Sai. Đo thể tích không thể trực tiếp xác định phân tử khối.
❌ B. Sai. Phổ IR dùng để xác định các nhóm chức trong phân tử, không trực tiếp xác định được phân tử khối.
❌ C. Sai. Cân khối lượng chỉ cung cấp khối lượng mẫu, không cho biết thông tin về phân tử khối.
✔️ D. Đúng. Phổ khối lượng là phương pháp chính xác và trực tiếp nhất để xác định phân tử khối. Máy đo khối phổ xác định tỷ lệ khối lượng trên điện tích (m/z) và cung cấp đỉnh phân tử M+, từ đó suy ra phân tử khối.
⇒ Chọn đáp án D Đáp án: D
❌ B. Sai. Phổ IR dùng để xác định các nhóm chức trong phân tử, không trực tiếp xác định được phân tử khối.
❌ C. Sai. Cân khối lượng chỉ cung cấp khối lượng mẫu, không cho biết thông tin về phân tử khối.
✔️ D. Đúng. Phổ khối lượng là phương pháp chính xác và trực tiếp nhất để xác định phân tử khối. Máy đo khối phổ xác định tỷ lệ khối lượng trên điện tích (m/z) và cung cấp đỉnh phân tử M+, từ đó suy ra phân tử khối.
⇒ Chọn đáp án D Đáp án: D
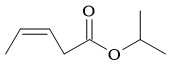
Câu 14 [703825]: Một carboxylic acid chưa bão hoà phản ứng với alcohol E tạo thành ester có công thức cấu tạo được cho như hình bên. Hãy cho biết alcohol E là alcohol bậc mấy?

A, Một.
B, Hai.
C, Ba.
D, Bốn.
Công thức cấu tạo của ester RCOOR' là CH3CH=CHCH2COOCH(CH3)CH3
- Phần gốc acid RCOO: CH3CH=CHCH2COO tạo bởi acid CH3CH=CHCH2COOH (pent-3-enoic acid)
- Phần gốc alcohol OR': OCH(CH3)CH3 tạo bởi alcohol (CH3)2CHOH (isopropyl alcohol)
⭐ Cách xác định bậc của alcohol: Bậc của alcohol là bậc của nguyên tử carbon liên kết cùng nhóm - OH (số C mà C đó liên kết)
⇒ Isopropyl alcohol là alcohol bậc hai (số liên kết carbon khác)
⇒ Chọn đáp án B
Đáp án: B
- Phần gốc acid RCOO: CH3CH=CHCH2COO tạo bởi acid CH3CH=CHCH2COOH (pent-3-enoic acid)
- Phần gốc alcohol OR': OCH(CH3)CH3 tạo bởi alcohol (CH3)2CHOH (isopropyl alcohol)
⭐ Cách xác định bậc của alcohol: Bậc của alcohol là bậc của nguyên tử carbon liên kết cùng nhóm - OH (số C mà C đó liên kết)
⇒ Isopropyl alcohol là alcohol bậc hai (số liên kết carbon khác)
⇒ Chọn đáp án B
Đáp án: B
Câu 15 [703826]: Một loại giấm ăn có chứa hàm lượng 3,5% acetic acid về thể tích. Tính khối lượng acetic acid trong một can giấm có dung tích 10 L. Biết khối lượng riêng của acetic acid là D = 1,05 g/mL.
A, 367,5 gam.
B, 612,5 gam.
C, 256,7 gam.
D, 61,3 gam.
Đổi 10L = 10000 mL
Thể tích của acetic acid trong 10L dung dịch là 10000.3,5% = 350 (ml)
Khối lượng của acetic acid là:
350.1,05 = 367,5 (gam)
⇒ Chọn đáp án A Đáp án: A
Thể tích của acetic acid trong 10L dung dịch là 10000.3,5% = 350 (ml)
Khối lượng của acetic acid là:
350.1,05 = 367,5 (gam)
⇒ Chọn đáp án A Đáp án: A
Câu 16 [703827]: Điểm đẳng điện pI là giá trị pH mà tại đó tổng điện tích của một phân tử amino acid bằng 0.
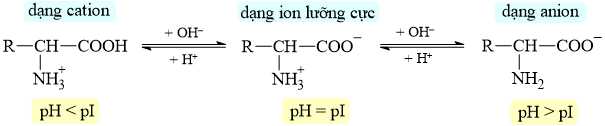
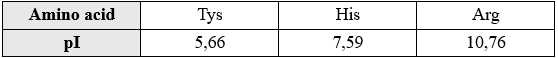
Bạn có thể yêu cầu sử dụng phương pháp điện di để tách hỗn hợp ba amino acid: arginine, histidine và tyrosine. Các giá trị pI của amino acid được cung cấp trong bảng như sau:
Biết rằng các chất di chuyển về hai phía của điện cực sẽ dễ dàng tách ra hơn. Độ pH tối ưu để sử dụng cho quá trình phân tách này là bao nhiêu?
Bạn có thể yêu cầu sử dụng phương pháp điện di để tách hỗn hợp ba amino acid: arginine, histidine và tyrosine. Các giá trị pI của amino acid được cung cấp trong bảng như sau:

Biết rằng các chất di chuyển về hai phía của điện cực sẽ dễ dàng tách ra hơn. Độ pH tối ưu để sử dụng cho quá trình phân tách này là bao nhiêu?
A, 2,0.
B, 5,7.
C, 7,6.
D, 10,8.
⭐ pI của Tys = 5,66 < pH = 7,6 → Tys có dạng anion trong dung dịch, nên sẽ di chuyển về cực dương.
⭐ pI của His = 7,59 ≈ pH = 7,6 → His có dạng ion lưỡng cực trong dung dịch, nên hầu như không di chuyển về 2 điện cực.
⭐ pI của Arg = 10,76 > pH = 7,6 → Arg có dạng cation trong dung dịch, nên sẽ di chuyển về cực âm.
⇒ Chọn đáp án C Đáp án: C
⭐ pI của His = 7,59 ≈ pH = 7,6 → His có dạng ion lưỡng cực trong dung dịch, nên hầu như không di chuyển về 2 điện cực.
⭐ pI của Arg = 10,76 > pH = 7,6 → Arg có dạng cation trong dung dịch, nên sẽ di chuyển về cực âm.
⇒ Chọn đáp án C Đáp án: C
Sử dụng đoạn thông tin dưới đây để trả lời câu 17 và câu 18:
Cho bán phản ứng và giá trị thế điện cực chuẩn như sau:
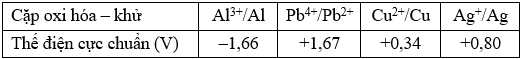

Câu 17 [703828]: Phản ứng hóa học nào sau đây không xảy ra?
A, 2Al(s) + 3Cu2+(aq)  2Al3+(aq) + 3Cu(s).
2Al3+(aq) + 3Cu(s).
 2Al3+(aq) + 3Cu(s).
2Al3+(aq) + 3Cu(s).B, Cu(s) + 2Ag+(aq)  Cu2+(aq) + 2Ag(s).
Cu2+(aq) + 2Ag(s).
 Cu2+(aq) + 2Ag(s).
Cu2+(aq) + 2Ag(s).C, 2Ag+(aq) + Pb2+(aq)  Pb4+(aq) + 2Ag(s).
Pb4+(aq) + 2Ag(s).
 Pb4+(aq) + 2Ag(s).
Pb4+(aq) + 2Ag(s).D, 2Cu(s) + Pb4+(aq)  2Cu2+(aq) + Pb2+(aq).
2Cu2+(aq) + Pb2+(aq).
 2Cu2+(aq) + Pb2+(aq).
2Cu2+(aq) + Pb2+(aq).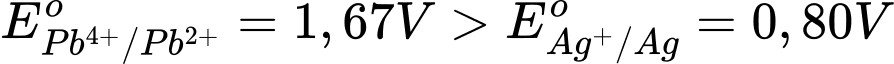
→ Theo quy tắc 𝞪, dạng oxi hóa mạnh sẽ phản ứng với dạng khử mạnh.
2Ag(s) + Pb4+(aq) ⟶ Pb2+(aq) + 2Ag+(aq).
⟹ Chọn đáp án C Đáp án: C
Câu 18 [703829]: Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa – khử trong số các cặp trên là
A, 1,67 V.
B, 4,05 V.
C, 2,46 V.
D, 3,33 V.
Cặp oxi hóa - khử tạo pin galvani có sức điện động lớn nhất là Al3+/Al và Pb4+/Pb2+.
Phản ứng trong pin galvani:
2Al(s) + 3Pb4+(aq) ⟶ 2Al3+(aq) + 3Pb2+(aq)
Cathode (-): Pb4+(aq) + 2e ⟶ Pb2+(aq)
Anode (+): Al(s) ⟶ Al3+ + 3e
→ Epin = E(+) – E(-) = 1,67 – (–1,66) = 3,33 V
⇒ Chọn đáp án D Đáp án: D
Phản ứng trong pin galvani:
2Al(s) + 3Pb4+(aq) ⟶ 2Al3+(aq) + 3Pb2+(aq)
Cathode (-): Pb4+(aq) + 2e ⟶ Pb2+(aq)
Anode (+): Al(s) ⟶ Al3+ + 3e
→ Epin = E(+) – E(-) = 1,67 – (–1,66) = 3,33 V
⇒ Chọn đáp án D Đáp án: D
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
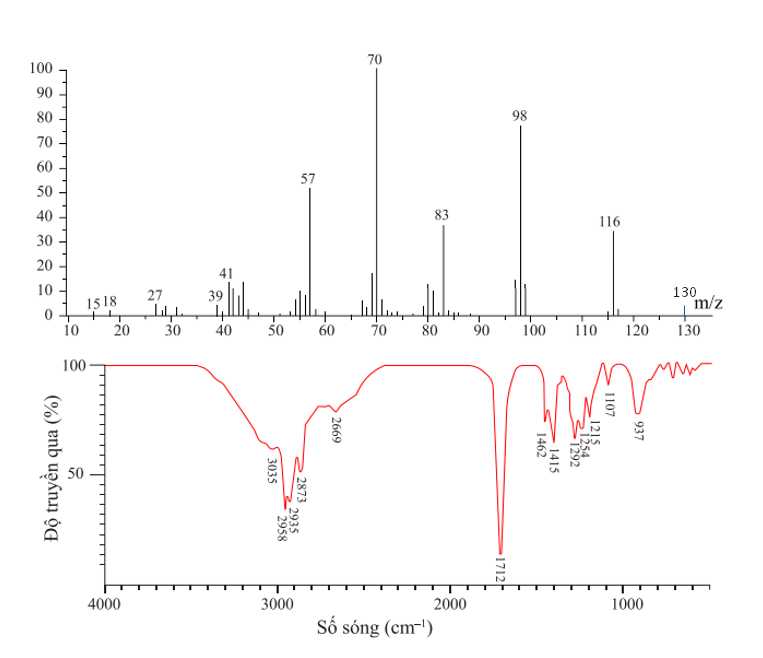
Câu 19 [703830]: Hợp chất hữu cơ X gồm 3 nguyên tố C, H, O. Kết quả phân tích nguyên tố của hợp chất hữu cơ X có mC : mH : mO = 42 : 7 : 16. X có mạch không phân nhánh, có phổ khối lượng và phổ hồng ngoại như sau:
Cho bảng số sóng đặc trưng của các liên kết ở bảng sau:
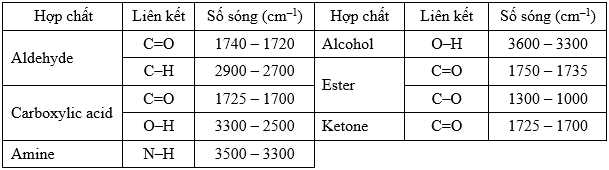

Cho bảng số sóng đặc trưng của các liên kết ở bảng sau:

Gọi công thức đơn giản nhất của X là CxHyOz → nC : nH : nO = x : y : z.
Hay: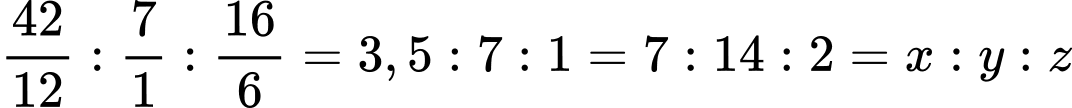
→ Công thức đơn giản nhất của X là C7H16O2
Từ phổ khối lượng → Phân tử khối của X là 130 gam/mol
Ta có:
→ Công thức đơn giản nhất của X là C7H16O2, mà MX = 130, ta có:
CTPT có dạng (C7H16O2)n = 130 ⇒ (12.7 + 16 + 16.2)n = 130 ⇒ n = 1
Vậy CTPT của X là C7H16O2
Từ kết quả phổ hồng ngoại, thấy có xuất hiện số sóng 1712 cm-1 đặc trưng cho liên kết C=O (1725-1700 cm-1), có xuất hiện số sóng đặc trưng của nhóm O-H trong vùng 3300-2500 cm-1
→ X là carboxylic acid
X có mạch C không phân phân nhánh → X có CTCT là CH3CH2CH2CH2CH2CH2COOH
Phân tích các phát biểu:
❌ a) Sai. Dựa vào công thức của X vừa tìm được ở trên, thấy X có 7 nguyên tử carbon.
❌ b) Sai. X thuộc loại hợp chất acid chứ không phải ester.
✔️ c) Đúng. X là acid, tác dụng được với muối NaHCO3 theo phản ứng:
CH3CH2CH2CH2CH2CH2COOH + NaHCO3 ⟶ CH3CH2CH2CH2CH2CH2COONa + H2O + CO2
✔️ d) Đúng. gốc R là gốc kị nước nên khi R tăng (số C tăng) thì tính kị nước tăng dẫn đến độ tan trong nước giảm.
Hay:
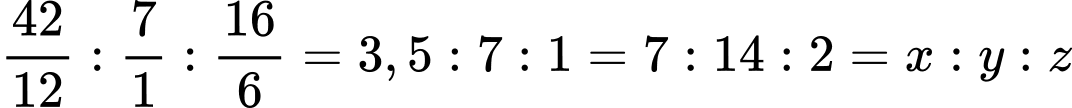
→ Công thức đơn giản nhất của X là C7H16O2
Từ phổ khối lượng → Phân tử khối của X là 130 gam/mol
Ta có:
→ Công thức đơn giản nhất của X là C7H16O2, mà MX = 130, ta có:
CTPT có dạng (C7H16O2)n = 130 ⇒ (12.7 + 16 + 16.2)n = 130 ⇒ n = 1
Vậy CTPT của X là C7H16O2
Từ kết quả phổ hồng ngoại, thấy có xuất hiện số sóng 1712 cm-1 đặc trưng cho liên kết C=O (1725-1700 cm-1), có xuất hiện số sóng đặc trưng của nhóm O-H trong vùng 3300-2500 cm-1
→ X là carboxylic acid
X có mạch C không phân phân nhánh → X có CTCT là CH3CH2CH2CH2CH2CH2COOH
Phân tích các phát biểu:
❌ a) Sai. Dựa vào công thức của X vừa tìm được ở trên, thấy X có 7 nguyên tử carbon.
❌ b) Sai. X thuộc loại hợp chất acid chứ không phải ester.
✔️ c) Đúng. X là acid, tác dụng được với muối NaHCO3 theo phản ứng:
CH3CH2CH2CH2CH2CH2COOH + NaHCO3 ⟶ CH3CH2CH2CH2CH2CH2COONa + H2O + CO2
✔️ d) Đúng. gốc R là gốc kị nước nên khi R tăng (số C tăng) thì tính kị nước tăng dẫn đến độ tan trong nước giảm.
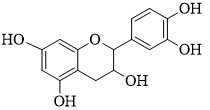
Câu 20 [703831]: Catechin là hoạt chất được tìm thấy trong trà, quả lựu và cacao. Các nghiên cứu phát hiện ra rằng catechin trong trà xanh giúp ngăn ngừa suy tim, sung huyết và tăng huyết áp bằng cách giảm stress oxy hóa. Catechin cũng ngăn ngừa viêm nhiễm và giảm tiểu cầu vón cục, giúp giảm nguy cơ đông máu và đau tim. Catechin có công thức phân tử C15H14O6 và công thức cấu tạo như hình bên.
Để tách catechin từ trà xanh, tiến hành theo các bước:
Bước 1: Cho lá trà xanh xay nhuyễn vào cốc đựng 20 mL dung dịch sodium hydroxyde.
Bước 2: Lọc bỏ tạp chất, thu lấy phần nước lọc.
Bước 3: Acid hóa phần nước lọc bằng dung dịch HCl.
Bước 4: Cho hỗn hợp vào phễu chiết, để yên. Sau khi hỗn hợp tách lớp thì thu lấy lớp chất lỏng chứa catechin.

Để tách catechin từ trà xanh, tiến hành theo các bước:
Bước 1: Cho lá trà xanh xay nhuyễn vào cốc đựng 20 mL dung dịch sodium hydroxyde.
Bước 2: Lọc bỏ tạp chất, thu lấy phần nước lọc.
Bước 3: Acid hóa phần nước lọc bằng dung dịch HCl.
Bước 4: Cho hỗn hợp vào phễu chiết, để yên. Sau khi hỗn hợp tách lớp thì thu lấy lớp chất lỏng chứa catechin.
Phân tích các phát biểu:
✔️ a) Đúng. Catechin có 5 nhóm OH trong đó có cả nhóm chức -OH của alcohol và nhóm chức OH của phenol như sau:
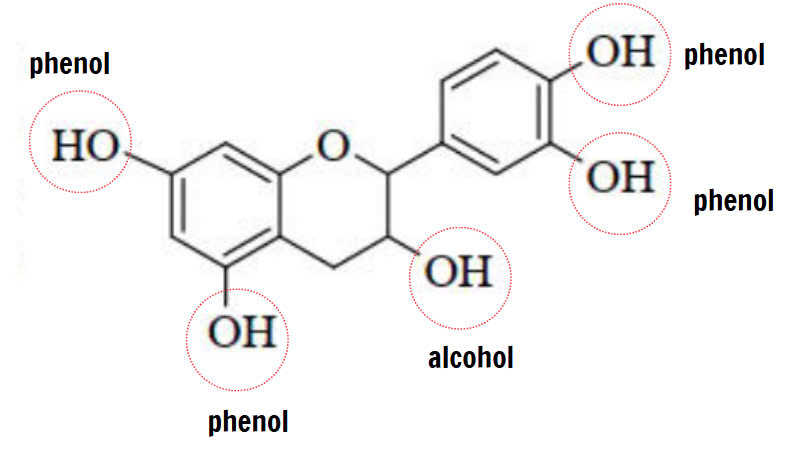
❌ b) Sai. Chỉ có OH của phenol mới tham gia phản ứng với dung dịch NaOH, còn -OH của alcohol không có phản ứng này. Quan sát thấy trên phân tử catechin có 4 nhóm OH phenol, nên phản ứng tối đa với 4 mol NaOH.
✔️ c) Đúng. Acid hóa phần nước lọc bằng dung dịch HCl là để tái tạo nhóm OH trong catechin:
C15H14O6 + 4NaOH ⟶ C15H10O2(ONa)4 + 4H2O
C15H10O2(ONa)4 + 4HCl ⟶ C15H14O6 + 4NaCl
✔️ d) Đúng. Ở bước 2 người ta đã loại bỏ tạp chất, thu lấy phần nước lọc, acid hóa phần nước lọc bằng HCl. Phần dung dịch sau acid hóa chứa lượng rất nhỏ NaCl nên khối lượng riêng sấp xỉ nước coi như là 1 gam/cm3.
Trong bước 4, nếu khối lượng riêng của catechin là 1,6 g/cm3 thì catechin sẽ nằm ở lớp chất lỏng phía dưới trong phễu chiết do nặng hơn nước.
✔️ a) Đúng. Catechin có 5 nhóm OH trong đó có cả nhóm chức -OH của alcohol và nhóm chức OH của phenol như sau:

❌ b) Sai. Chỉ có OH của phenol mới tham gia phản ứng với dung dịch NaOH, còn -OH của alcohol không có phản ứng này. Quan sát thấy trên phân tử catechin có 4 nhóm OH phenol, nên phản ứng tối đa với 4 mol NaOH.
✔️ c) Đúng. Acid hóa phần nước lọc bằng dung dịch HCl là để tái tạo nhóm OH trong catechin:
C15H14O6 + 4NaOH ⟶ C15H10O2(ONa)4 + 4H2O
C15H10O2(ONa)4 + 4HCl ⟶ C15H14O6 + 4NaCl
✔️ d) Đúng. Ở bước 2 người ta đã loại bỏ tạp chất, thu lấy phần nước lọc, acid hóa phần nước lọc bằng HCl. Phần dung dịch sau acid hóa chứa lượng rất nhỏ NaCl nên khối lượng riêng sấp xỉ nước coi như là 1 gam/cm3.
Trong bước 4, nếu khối lượng riêng của catechin là 1,6 g/cm3 thì catechin sẽ nằm ở lớp chất lỏng phía dưới trong phễu chiết do nặng hơn nước.
Câu 21 [703832]: Các phức chất chứa cùng một thành phần nguyên tử và cùng một trình tự liên kết, nhưng chỉ khác nhau về sự sắp xếp trong không gian được gọi là “đồng phân lập thể”. Đồng phân hình học, hoặc đồng phân cis – trans, cũng thuộc loại đồng phân lập thể. Đồng phân hình học xảy ra khi các nguyên tử hoặc nhóm nguyên tử có thể được sắp xếp ở hai bên của một cấu trúc. Cis có nghĩa là "cùng phía" và trans có nghĩa là “khác phía”.
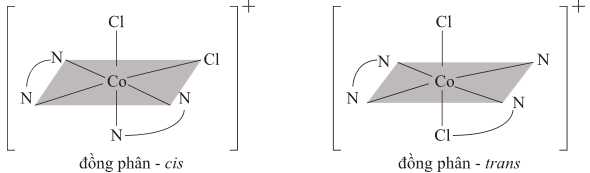
Ion dichlorobis(ethylenediamine)cobalt(III), [Co(en)2Cl2]+, tồn tại dưới dạng một cặp đồng phân cis - trans. Ethylenediamine viết tắt là “en”, được biểu diễn dưới dạng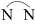 .
.
▪ Cis-dichlorobis(ethylenediamine)cobalt(III) perchlorate, [Co(en)2Cl2]ClO4 có màu tím.
▪ Trans-dichlorobis(ethylenediamine)cobalt(III) chloride, [Co(en)2Cl2]Cl có màu xanh lá cây.

Ion dichlorobis(ethylenediamine)cobalt(III), [Co(en)2Cl2]+, tồn tại dưới dạng một cặp đồng phân cis - trans. Ethylenediamine viết tắt là “en”, được biểu diễn dưới dạng
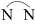 .
. ▪ Cis-dichlorobis(ethylenediamine)cobalt(III) perchlorate, [Co(en)2Cl2]ClO4 có màu tím.
▪ Trans-dichlorobis(ethylenediamine)cobalt(III) chloride, [Co(en)2Cl2]Cl có màu xanh lá cây.
Phân tích các phát biểu:
✔️ a) Đúng. Cả 2 phức chất đều có 2 phối tử en và 2 phối tử Cl–.
❌ b) Sai. Số oxi hóa của cobalt đều bằng +3 trong 2 phức, được xác định như sau:
★ [Co(en)2Cl2]ClO4 có ion phức: [Co(en)2Cl2]+ và anion ngoài phức: ClO4 − do phức chất trung hòa về điện.
- Gọi số oxi hóa của Co là x.
- Ethylenediamine (en) là phối tử trung hòa, không đóng góp vào điện tích (2 × 0 = 0).
- Hai ion chloride (Cl−) mỗi ion mang điện tích -1 (2 × (−1) = −2.
Ta có biểu thức tính điện tích của ion phức như sau:
x + 0 + (−2) = +1 ⤑ x = +3.
★ [Co(en)2Cl2]Cl có ion phức: [Co(en)2Cl2]+ và anion ngoài phức: Cl− do phức chất trung hòa về điện.
- Gọi số oxi hóa của Co là y.
- Ethylenediamine (en): 2 × 0 = 0.
- Hai ion chloride (Cl−): 2 × ( − 1 ) = −2.
Ta có biểu thức tính điện tích của ion phức như sau:
x + 0 + (−2) = +1 ⤑ x = +3.
❌ c) Sai. ở đồng phân dạng cis 4 nguyên tử N không nằm trên 1 mặt phẳng.
✔️ d) Đúng.
- Trong đồng phân cis-, hai ion Cl− nằm cùng phía, tức chúng chiếm hai vị trí liền kề trong cấu trúc bát diện. Điều này làm cho góc giữa hai ion Cl− là 90o.
- Trong đồng phân trans-, hai ion Cl− nằm đối diện nhau, tức chúng chiếm hai vị trí đối xứng qua ion cobalt trung tâm. Điều này làm cho góc giữa hai ion Cl− là 180o.
✔️ a) Đúng. Cả 2 phức chất đều có 2 phối tử en và 2 phối tử Cl–.
❌ b) Sai. Số oxi hóa của cobalt đều bằng +3 trong 2 phức, được xác định như sau:
★ [Co(en)2Cl2]ClO4 có ion phức: [Co(en)2Cl2]+ và anion ngoài phức: ClO4 − do phức chất trung hòa về điện.
- Gọi số oxi hóa của Co là x.
- Ethylenediamine (en) là phối tử trung hòa, không đóng góp vào điện tích (2 × 0 = 0).
- Hai ion chloride (Cl−) mỗi ion mang điện tích -1 (2 × (−1) = −2.
Ta có biểu thức tính điện tích của ion phức như sau:
x + 0 + (−2) = +1 ⤑ x = +3.
★ [Co(en)2Cl2]Cl có ion phức: [Co(en)2Cl2]+ và anion ngoài phức: Cl− do phức chất trung hòa về điện.
- Gọi số oxi hóa của Co là y.
- Ethylenediamine (en): 2 × 0 = 0.
- Hai ion chloride (Cl−): 2 × ( − 1 ) = −2.
Ta có biểu thức tính điện tích của ion phức như sau:
x + 0 + (−2) = +1 ⤑ x = +3.
❌ c) Sai. ở đồng phân dạng cis 4 nguyên tử N không nằm trên 1 mặt phẳng.
✔️ d) Đúng.
- Trong đồng phân cis-, hai ion Cl− nằm cùng phía, tức chúng chiếm hai vị trí liền kề trong cấu trúc bát diện. Điều này làm cho góc giữa hai ion Cl− là 90o.
- Trong đồng phân trans-, hai ion Cl− nằm đối diện nhau, tức chúng chiếm hai vị trí đối xứng qua ion cobalt trung tâm. Điều này làm cho góc giữa hai ion Cl− là 180o.
Câu 22 [703833]: Sơ đồ dưới đây là các thiết bị được sử dụng để thu thập và đo thể tích khí hydrogen thoát ra khi một mẫu kim loại nhóm IIA phản ứng với hydrochloric acid loãng:
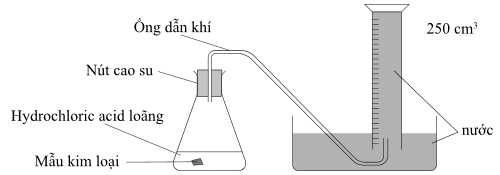
Các bước tiến hành:
▪ Bước 1: Một mẫu kim loại được cân và sau đó đặt vào bình tam giác.
▪ Bước 2: Cho một lượng acid dư vào bình tam giác, nắp bằng nút cao su có dây dẫn khí ra ngoài.
▪ Bước 3: Thu khí bằng phương pháp đẩy nước. Khi phản ứng hoàn tất và khí thu được đã nguội đến nhiệt độ phòng, ghi lại thể tích khí thu được trong ống đong chia vạch.
Giả sử 1 mol hydrogen có thể tích là 24,0 dm3 trong điều kiện thực nghiệm. Kết quả được ghi lại trong bảng sau:


Các bước tiến hành:
▪ Bước 1: Một mẫu kim loại được cân và sau đó đặt vào bình tam giác.
▪ Bước 2: Cho một lượng acid dư vào bình tam giác, nắp bằng nút cao su có dây dẫn khí ra ngoài.
▪ Bước 3: Thu khí bằng phương pháp đẩy nước. Khi phản ứng hoàn tất và khí thu được đã nguội đến nhiệt độ phòng, ghi lại thể tích khí thu được trong ống đong chia vạch.
Giả sử 1 mol hydrogen có thể tích là 24,0 dm3 trong điều kiện thực nghiệm. Kết quả được ghi lại trong bảng sau:

Phân tích các phát biểu:
✔️ a) Đúng. Có thể thay dung dịch hydrochloric acid loãng bằng dung dịch sulfuricacid loãng vì cả hai đều cung cấp ion H+ để giải phóng khí H2.
✔️ b) Đúng. Đổi 230 cm3 = 0,23 dm3
Gọi kim loại cần tìm là M.
2M + 2nHCl → 2MCln + nH2
Số mol của khí là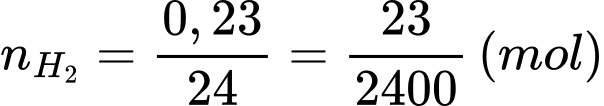
→ Số mol của M là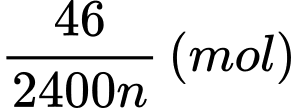
Khối lượng của kim loại là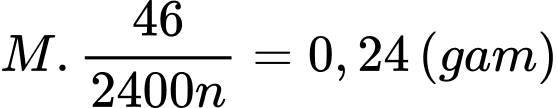 .
.
Ta có bảng sau:
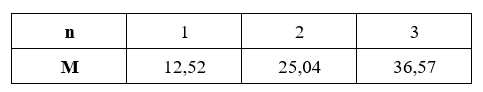
→ M có thể Mg.
❌ c) Sai. H2 nhẹ hơn không khí, nếu dùng phương pháp đẩy không khí ngửa bình thì sẽ bay hết ra ngoài.
✔️ d) Đúng. Mực nước trong trong bình chứa ống đong chia vạch tăng lên so với ban đầu do H2 được đẩy vào trong ống đong chia vạch làm nước trong ống đong đi ra ngoài bình.
✔️ a) Đúng. Có thể thay dung dịch hydrochloric acid loãng bằng dung dịch sulfuricacid loãng vì cả hai đều cung cấp ion H+ để giải phóng khí H2.
✔️ b) Đúng. Đổi 230 cm3 = 0,23 dm3
Gọi kim loại cần tìm là M.
2M + 2nHCl → 2MCln + nH2
Số mol của khí là
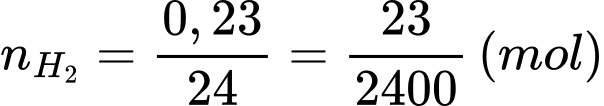
→ Số mol của M là
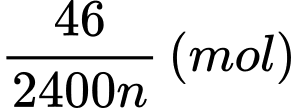
Khối lượng của kim loại là
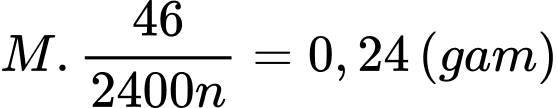 .
.Ta có bảng sau:

→ M có thể Mg.
❌ c) Sai. H2 nhẹ hơn không khí, nếu dùng phương pháp đẩy không khí ngửa bình thì sẽ bay hết ra ngoài.
✔️ d) Đúng. Mực nước trong trong bình chứa ống đong chia vạch tăng lên so với ban đầu do H2 được đẩy vào trong ống đong chia vạch làm nước trong ống đong đi ra ngoài bình.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [703834]: Quặng sắt là các khoáng vật chứa các hợp chất của sắt mà chủ yếu ở dạng các oxide. Hematite là một loại quặng chứa hàm lượng sắt cao và được dùng để trực tiếp sản xuất gang bằng cách nạp thẳng vào lò cao. Giả thiết 90% sắt trong quặng được chuyển vào gang. Từ 1000 tấn quặng hematite (có hàm lượng 69,9 % Fe) có thể sản xuất được bao nhiêu tấn gang (loại chứa 96 % Fe) (làm tròn kết quả đến hàng đơn vị)?
Khối lượng sắt có trong quặng hematite là: 1000.69,9% = 699 (tấn)
Khối lượng sắt chuyển vào gang là: 699.90% = 629,1 (tấn)
Khối lượng gang là: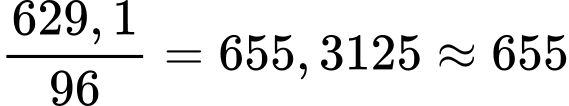 (tấn)
(tấn)
⇒ Điền đáp án: 655
Khối lượng sắt chuyển vào gang là: 699.90% = 629,1 (tấn)
Khối lượng gang là:
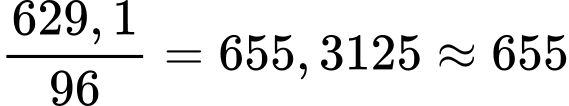 (tấn)
(tấn)⇒ Điền đáp án: 655
Câu 24 [703835]: Saccharose monolaurate là ester thu được khi cho saccharose tác dụng với lauric acid. Saccharose monolaurate là một trong những chất phụ gia có chức năng kép do khả năng nhũ hoá và hoạt tính kháng khuẩn của nó.
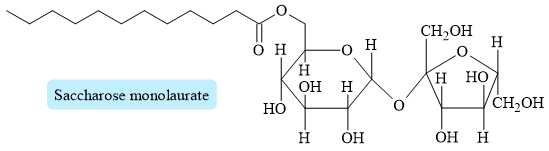
Từ cấu tạo trên, hãy cho biết phân tử lauric acid có bao nhiêu nguyên tử carbon?

Từ cấu tạo trên, hãy cho biết phân tử lauric acid có bao nhiêu nguyên tử carbon?
Saccharose monolaurate (RCOOR') là ester thu được khi cho saccharose (R'OH) tác dụng với lauric acid (RCOOH).
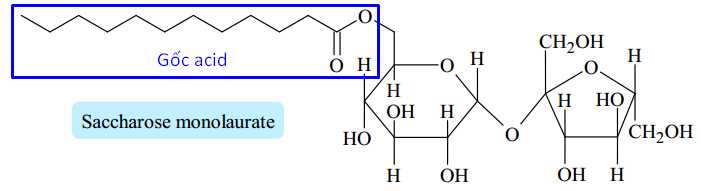
Lauric acid có công thức cấu tạo là CH3[CH2]10COOH.
⟶ Công thức phân tử của Lauric acid là C12H24O2
Phân tử có 12 nguyên tử carbon.
⇒ Điền đáp án: 12

Lauric acid có công thức cấu tạo là CH3[CH2]10COOH.
⟶ Công thức phân tử của Lauric acid là C12H24O2
Phân tử có 12 nguyên tử carbon.
⇒ Điền đáp án: 12
Câu 25 [703836]: Thuỷ phân 1 mol tetrapeptide Lys-Gly-Val-Glu trong lượng dư dung dịch NaOH, sau khi các phản ứng xảy ra hoàn toàn thì có bao nhiêu mol NaOH đã tham gia?
Khi thuỷ phân 1 mol tetrapeptide Lys-Gly-Val-Glu trong lượng dư dung dịch NaOH, phản ứng xảy ra như sau:
Lys−Gly−Val−Glu + 5NaOH → Gly−Na + Lys−Na + Val−Na + Glu−Na2 + 2H2O
⤏ Tetrapeptide phản ứng với NaOH theo tỉ lệ 1:5 nên số mol NaOH đã tham gia thuỷ phân 1 mol tetrapeptide là 5 mol.
⇒ Điền đáp án: 5
Lys−Gly−Val−Glu + 5NaOH → Gly−Na + Lys−Na + Val−Na + Glu−Na2 + 2H2O
⤏ Tetrapeptide phản ứng với NaOH theo tỉ lệ 1:5 nên số mol NaOH đã tham gia thuỷ phân 1 mol tetrapeptide là 5 mol.
⇒ Điền đáp án: 5
Câu 26 [703837]: Glucose là một loại monosaccharide với công thức phân tử C6H12O6 được tạo ra bởi thực vật và hầu hết các loại tảo trong quá trình quang hợp từ nước và CO2, sử dụng năng lượng từ ánh sáng mặt trời. Dung dịch glucose 5% (có khối lượng riêng D = 1,1 g/mL) là dung dịch đường tiêm tĩnh mạch, một loại thuốc thiết yếu quan trọng của Tổ chức Y tế Thế giới (WHO) và hệ thống y tế cơ bản. Phương trình nhiệt hóa học của phản ứng oxi hóa glucose:
C6H12O6(s) + 6O2(g) 6CO2(g) + 6H2O(g)
6CO2(g) + 6H2O(g)
Tính năng lượng tối đa mà một bệnh nhân có thể nhận được khi truyền cho bệnh nhân đó một chai 500 mL dung dịch glucose 5% (làm tròn đến hàng đơn vị). Biết các giá trị nhiệt tạo thành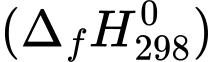 của các chất ở điều kiện chuẩn được cho trong bảng sau:
của các chất ở điều kiện chuẩn được cho trong bảng sau:
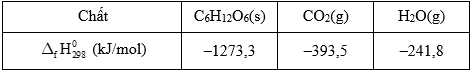
C6H12O6(s) + 6O2(g)
 6CO2(g) + 6H2O(g)
6CO2(g) + 6H2O(g)Tính năng lượng tối đa mà một bệnh nhân có thể nhận được khi truyền cho bệnh nhân đó một chai 500 mL dung dịch glucose 5% (làm tròn đến hàng đơn vị). Biết các giá trị nhiệt tạo thành
 của các chất ở điều kiện chuẩn được cho trong bảng sau:
của các chất ở điều kiện chuẩn được cho trong bảng sau: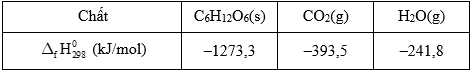
C6H12O6(s) + 6O2 ⟶ 6CO2(g) + 6H2O(g)
Biến thiên enthalpy của phản ứng là: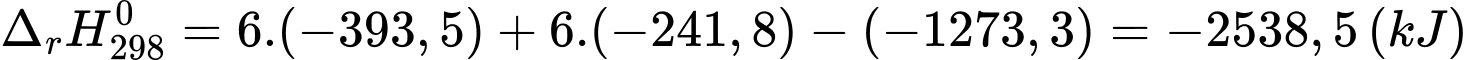
Khối lượng dung dịch glucose 5% là: 500.1,1 = 550 (gam)
Nhiệt lượng mà bệnh nhân nhận được là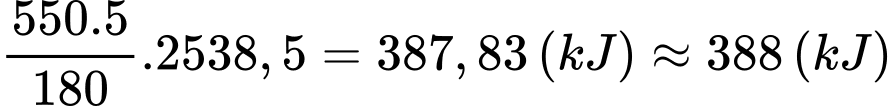
⇒ Điền đáp án: 388
Biến thiên enthalpy của phản ứng là:
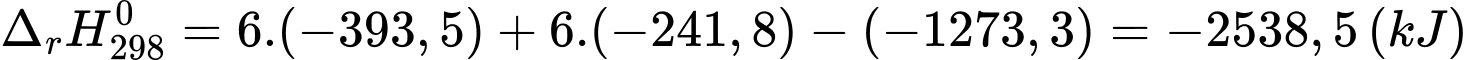
Khối lượng dung dịch glucose 5% là: 500.1,1 = 550 (gam)
Nhiệt lượng mà bệnh nhân nhận được là
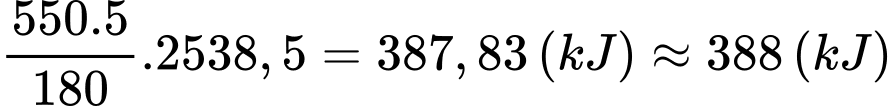
⇒ Điền đáp án: 388
Câu 27 [703838]: Hỗn hợp sau phản ứng điều chế một ester thường chứa rất nhiều chất như: alcohol dư, carboxylic acid dư, sản phẩm ester, xúc tác acid vô cơ. Để thu được sản phẩm ester, có thể thực hiện các bước trong quy trình tinh chế như sau:
(1) Thêm khoảng dung dịch Na2CO3 để trung hoà acid H2SO4, carboxylic acid dư và hòa tan alcohol. Xả và loại bỏ lớp nước phía bên dưới.
(2) Thêm lượng dung môi hữu cơ để pha loãng hỗn hợp sau phản ứng.
(3) Thu lấy lớp dung môi hữu cơ chứa ester. Tiến hành đuổi dung môi thu lấy ester tinh khiết.
(4) Cho hỗn hợp phản ứng đã pha loãng vào phễu chiết.
Hãy viết liền các số tương ứng với bốn bước theo trình tự tinh chế ester (ví dụ: 1234, 4213, ...).
(1) Thêm khoảng dung dịch Na2CO3 để trung hoà acid H2SO4, carboxylic acid dư và hòa tan alcohol. Xả và loại bỏ lớp nước phía bên dưới.
(2) Thêm lượng dung môi hữu cơ để pha loãng hỗn hợp sau phản ứng.
(3) Thu lấy lớp dung môi hữu cơ chứa ester. Tiến hành đuổi dung môi thu lấy ester tinh khiết.
(4) Cho hỗn hợp phản ứng đã pha loãng vào phễu chiết.
Hãy viết liền các số tương ứng với bốn bước theo trình tự tinh chế ester (ví dụ: 1234, 4213, ...).
Thí nghiệm tinh chế ester:
Bước 1: Thêm lượng dung môi hữu cơ để pha loãng hỗn hợp sau phản ứng. → Ứng với (2).
Bước 2: Cho hỗn hợp phản ứng đã pha loãng vào phễu chiết. → Ứng với (4).
Bước 3: Thêm dung dịch Na2CO3 để trung hòa acid H2SO4, carboxylic acid dư và hòa tan alcohol. Xả và loại bỏ lớp nước phía bên dưới. → Ứng với (1).
Bước 4: Thu lấy lớp dung môi hữu cơ chứa ester. Tiến hành đuổi dung môi thu lấy ester tinh khiết. → Ứng với (3).
⇒ Thứ tự các bước thực hiện thí nghiệm đúng là: 2413
⇒ Điền đáp án: 2413
Bước 1: Thêm lượng dung môi hữu cơ để pha loãng hỗn hợp sau phản ứng. → Ứng với (2).
Bước 2: Cho hỗn hợp phản ứng đã pha loãng vào phễu chiết. → Ứng với (4).
Bước 3: Thêm dung dịch Na2CO3 để trung hòa acid H2SO4, carboxylic acid dư và hòa tan alcohol. Xả và loại bỏ lớp nước phía bên dưới. → Ứng với (1).
Bước 4: Thu lấy lớp dung môi hữu cơ chứa ester. Tiến hành đuổi dung môi thu lấy ester tinh khiết. → Ứng với (3).
⇒ Thứ tự các bước thực hiện thí nghiệm đúng là: 2413
⇒ Điền đáp án: 2413
Câu 28 [703839]: Pyrite (FeS2) thường được dùng làm nguyên liệu thô trong sản xuất công nghiệp sulfur dạng đơn chất. Bằng cách đun nóng pyrite trong môi trường giới hạn không khí (hiệu suất chuyển hoá là 100%), tạo ra sulfur, Fe3O4 (màu đen) và một lượng nhỏ sản phẩm phụ SO2. Có thể đo lượng SO2 tạo ra bằng quy trình như sau: nung bột quặng thô trong lò ống kiểm soát nhiệt độ. Hấp thụ lượng SO2 tạo thành bằng dung dịch NaOH 2 M. Khi phản ứng hoàn tất, chuyển dung dịch vào bình định mức 500mL và thêm nước cất vào cho đến khi chạm vạch. Lấy 25,0 mL dung dịch này vào bình chứa 50,0mL dung dịch chuẩn I2 0,05M và 5mL dung dịch H2SO4 20%. Sau khi đặt bình vào trong bóng tối 5 phút, đem dung dịch đi chuẩn độ với dung dịch chuẩn Na2S2O3 0,1 M. Khi màu dung dịch chuyển sang nâu nhạt, thêm 3 mL hồ tinh bột 0,5% vào và chuẩn độ tiếp đến khi màu xanh của hệ biến mất.
Trong một thí nghiệm kiểm tra như trên bắt đầu từ pyrite, thu được 17,6 gam sulfur. Khi phân tích khí sản phẩm phụ theo quy trình trên dùng hết 18,47 mL dung dịch chuẩn Na2S2O3. Giả sử không có hợp chất chứa sulfur nào khác được tạo thành, hãy tính phần trăm sulfur trong pyrite đã hao hụt dưới dạng sản phẩm phụ (làm tròn đến hàng phần trăm). Biết các phản ứng xảy ra như sau:
(1) 3FeS2 + 2O2 ⟶ Fe3O4 + 6S;
S + O2 ⟶ SO2.
(2) SO2 + 2NaOH ⟶ Na2SO3 +H2O.
(3) Na2SO3 + I2 + H2O ⟶ Na2SO4 + 2HI.
(4) 2Na2S2O3 + I2 ⟶ Na2S4O6 + 2NaI.
Trong một thí nghiệm kiểm tra như trên bắt đầu từ pyrite, thu được 17,6 gam sulfur. Khi phân tích khí sản phẩm phụ theo quy trình trên dùng hết 18,47 mL dung dịch chuẩn Na2S2O3. Giả sử không có hợp chất chứa sulfur nào khác được tạo thành, hãy tính phần trăm sulfur trong pyrite đã hao hụt dưới dạng sản phẩm phụ (làm tròn đến hàng phần trăm). Biết các phản ứng xảy ra như sau:
(1) 3FeS2 + 2O2 ⟶ Fe3O4 + 6S;
S + O2 ⟶ SO2.
(2) SO2 + 2NaOH ⟶ Na2SO3 +H2O.
(3) Na2SO3 + I2 + H2O ⟶ Na2SO4 + 2HI.
(4) 2Na2S2O3 + I2 ⟶ Na2S4O6 + 2NaI.
Gọi số mol SO2 có trong 500 mL dung dịch là a mol, ta có:
500 mL dung dịch → a mol SO2
25 mL dung dịch → 0,05a mol SO2
Các phản ứng xảy ra như sau:
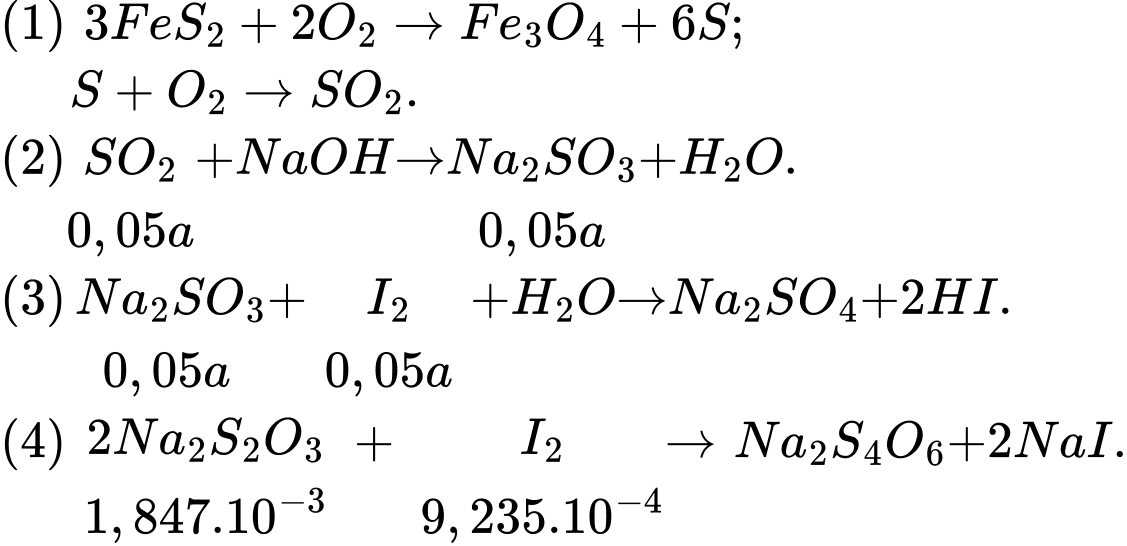
Tổng số mol I2 đã tham gia phản ứng là: 0,05a + 9,235.10-4 = 0,05 . 0,05 = 2,5.10-3 → a = 0,03153 mol
Phần trăm sulfur trong pyrite đã hao hụt dưới dạng sản phẩm phụ là:
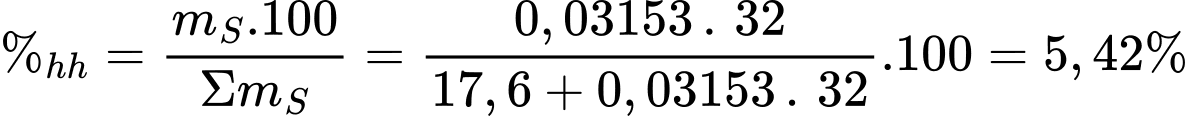
⇒ Điền đáp án: 5,42
500 mL dung dịch → a mol SO2
25 mL dung dịch → 0,05a mol SO2
Các phản ứng xảy ra như sau:
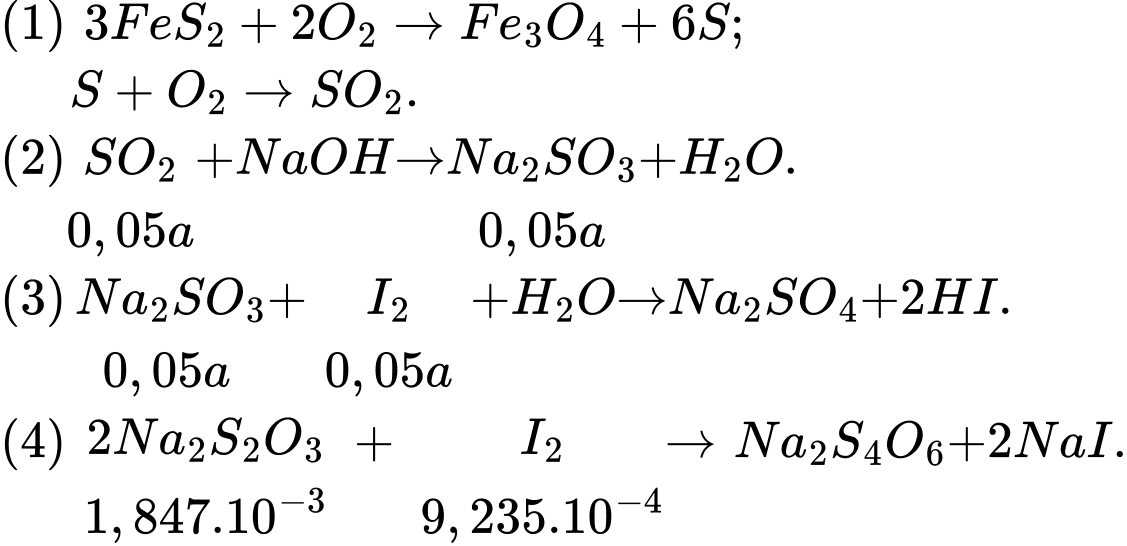
Tổng số mol I2 đã tham gia phản ứng là: 0,05a + 9,235.10-4 = 0,05 . 0,05 = 2,5.10-3 → a = 0,03153 mol
Phần trăm sulfur trong pyrite đã hao hụt dưới dạng sản phẩm phụ là:
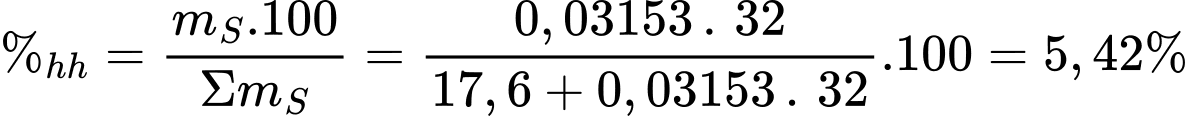
⇒ Điền đáp án: 5,42