PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [706343]: Loại phản ứng hóa học nào sau đây xảy ra trong quá trình ăn mòn kim loại?
A, Oxi hóa - khử.
B, Hóa hợp.
C, Trao đổi.
D, Phân huỷ.
Quá trình ăn mòn kim loại là quá trình trong đó kim loại bị oxi hóa bởi các chất trong môi trường, đặc biệt là oxygen và hơi nước. Đây là một dạng của phản ứng oxi hóa - khử.
Phân tích các đáp án:
✔️A. Đúng. Ăn mòn kim loại là quá trình kim loại bị oxi hóa, mất electron, trong khi các chất khác nhận electron.
❌B. Hóa hợp là quá trình hai hay nhiều chất kết hợp tạo thành một chất mới. Ăn mòn kim loại không phải là sự kết hợp mà là sự phân rã kim loại thành ion.
❌C. Phản ứng trao đổi thường xảy ra giữa hai hợp chất tạo ra chất mới nhưng không liên quan đến sự thay đổi số oxi hóa. Ăn mòn kim loại có sự thay đổi số oxi hóa nên không phải phản ứng trao đổi.
❌D. Phản ứng phân hủy là một chất bị phân tách thành nhiều chất đơn giản hơn. Ăn mòn kim loại không đơn thuần là phân hủy mà có sự oxi hóa.
⟹ Chọn đáp án A Đáp án: A
Phân tích các đáp án:
✔️A. Đúng. Ăn mòn kim loại là quá trình kim loại bị oxi hóa, mất electron, trong khi các chất khác nhận electron.
❌B. Hóa hợp là quá trình hai hay nhiều chất kết hợp tạo thành một chất mới. Ăn mòn kim loại không phải là sự kết hợp mà là sự phân rã kim loại thành ion.
❌C. Phản ứng trao đổi thường xảy ra giữa hai hợp chất tạo ra chất mới nhưng không liên quan đến sự thay đổi số oxi hóa. Ăn mòn kim loại có sự thay đổi số oxi hóa nên không phải phản ứng trao đổi.
❌D. Phản ứng phân hủy là một chất bị phân tách thành nhiều chất đơn giản hơn. Ăn mòn kim loại không đơn thuần là phân hủy mà có sự oxi hóa.
⟹ Chọn đáp án A Đáp án: A
Câu 2 [560617]: Đồng là kim loại dẫn điện tốt nhất trong các kim loại (chỉ xếp sau Ag), tuy nhiên các dây điện cao thế không được làm bằng đồng mà thường được làm bằng kim loại X. Kim loại X là
A, Fe.
B, Na.
C, Al.
D, Au.
Mặc dù khả năng dẫn điện thấp hơn Cu, tuy nhiên dây nhôm nhẹ hơn dây đồng tới hơn 3 lần nên dây điện cao thế được làm bằng nhôm để vận chuyển dễ dàng, tiết kiệm được nguyên liệu, giảm sức lực của dây điện cho các cột điện.
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C Đáp án: C
Câu 3 [706344]: Bạc và vàng thường được dùng để chế tạo thành đồ trang sức chủ yếu do chúng
A, là các kim loại quý và hiếm.
B, có ánh kim, có tính dẻo và hầu như không bị oxi hoá trong môi trường.
C, dễ dát mỏng, kéo sợi, chế tác thành đồ trang sức theo mong muốn.
D, là kim loại có ánh kim, có tính dẻo và nhẹ do có khối lượng riêng thấp.
Phân tích các đáp án:
❌A. Lý do chính để chúng được dùng làm trang sức là do chúng ít bị oxi hóa, có độ bóng cao và dễ gia công. Không phải do chúng hiếm.
✔️B. Tính dẻo cao giúp dễ dàng chế tác thành nhiều kiểu dáng khác nhau. Đặc biệt, vàng và bạc rất ít bị oxi hóa, không bị gỉ sét như sắt, nên giữ được độ bền đẹp lâu dài.
❌C. Tính dễ dát mỏng và kéo sợi giúp chế tác trang sức, nhưng yếu tố quan trọng nhất vẫn là tính chống oxi hóa.
❌D. Sai vì vàng có khối lượng riêng cao (19.3 g/cm3, nặng hơn nhiều kim loại khác).
⟹ Chọn đáp án B Đáp án: B
❌A. Lý do chính để chúng được dùng làm trang sức là do chúng ít bị oxi hóa, có độ bóng cao và dễ gia công. Không phải do chúng hiếm.
✔️B. Tính dẻo cao giúp dễ dàng chế tác thành nhiều kiểu dáng khác nhau. Đặc biệt, vàng và bạc rất ít bị oxi hóa, không bị gỉ sét như sắt, nên giữ được độ bền đẹp lâu dài.
❌C. Tính dễ dát mỏng và kéo sợi giúp chế tác trang sức, nhưng yếu tố quan trọng nhất vẫn là tính chống oxi hóa.
❌D. Sai vì vàng có khối lượng riêng cao (19.3 g/cm3, nặng hơn nhiều kim loại khác).
⟹ Chọn đáp án B Đáp án: B
Câu 4 [560481]: Một miếng kim loại nickel được thêm vào dung dịch gồm ba muối chloride khác nhau có cùng nồng độ 1,0 M: CoCl2, NiCl2 và SnCl2. Đồ thị nào sau đây thể hiện đúng nhất nồng độ ion kim loại trong dung dịch theo thời gian?
A, 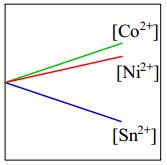

B, 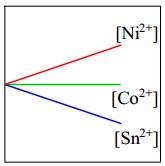

C, 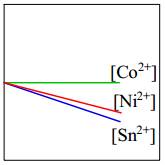

D, 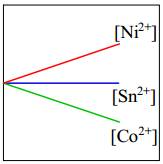

- Độ mạnh tính khử của Ni lớn hơn Sn nên xảy ra phản ứng
- Độ mạnh tính khử của Ni < Co nên Ni không thể đẩy Co2+ ra khỏi dung dịch muối.
⇒ Do đó [Co2+] giữ nguyên.
⇒ Chọn đáp án B Đáp án: B
Ni + Sn2+ → Ni2+ + Sn
⇒ [Sn2+] giảm; [Ni2+] tăng- Độ mạnh tính khử của Ni < Co nên Ni không thể đẩy Co2+ ra khỏi dung dịch muối.
⇒ Do đó [Co2+] giữ nguyên.
⇒ Chọn đáp án B Đáp án: B
Câu 5 [706345]: Nhiệt độ phân huỷ thành oxide của các muối carbonate của kim loại nhóm IIA giảm dần theo dãy
A, MgCO3, CaCO3, SrCO3, BaCO3.
B, BaCO3, SrCO3, CaCO3, MgCO3.
C, BaCO3, CaCO3, SrCO3, MgCO3.
D, MgCO3, BaCO3, SrCO3, CaCO3.
Độ ổn định nhiệt của muối kim loại nhóm IIA tăng dần theo nhóm. Điều này có nghĩa là nhiệt độ phân hủy tăng dần theo nhóm. Do đó, MgCO3 phân hủy ở nhiệt độ thấp nhất và BaCO3 phân hủy ở nhiệt độ cao nhất.
Thứ tự đúng của nhiệt độ phân hủy giảm dần là: BaCO3 > SrCO3 > CaCO3 > MgCO3.
⟹ Chọn đáp án B Đáp án: B
Thứ tự đúng của nhiệt độ phân hủy giảm dần là: BaCO3 > SrCO3 > CaCO3 > MgCO3.
⟹ Chọn đáp án B Đáp án: B
Câu 6 [706346]: M là nguyên tố kim loại chuyển tiếp dãy thứ nhất, có một số đặc điểm sau:
∎ Có nhiều số oxi hoá trong các hợp chất, trong đó có số oxi hoá +2 và +3.
∎ Nguyên tử có 4 electron độc thân.
∎ Ở dạng đơn chất, là kim loại nặng.
M là nguyên tố nào sau đây?
∎ Có nhiều số oxi hoá trong các hợp chất, trong đó có số oxi hoá +2 và +3.
∎ Nguyên tử có 4 electron độc thân.
∎ Ở dạng đơn chất, là kim loại nặng.
M là nguyên tố nào sau đây?
A, Cr.
B, Ni.
C, Fe.
D, Cu.
Phân tích các đáp án:
❌A. Cr : Cấu hình electron của Cr là [Ar]3d54s1. Tuy nhiên, Cr thường có thể thực hiện số oxy hóa +6, không phù hợp với yêu cầu có số oxy hóa +2 và +3.
❌B. Ni : Cấu hình electron của Ni là [Ar]3d84s2. Ni chủ yếu thể hiện số oxy hóa +2.
✔️C. Fe : Cấu hình electron của Fe là [Ar]3d64s2. Fe có thể thực hiện nhiều quá trình oxy hóa, bao gồm +2 và +3, và có 4 electron độc thân trong cấu hình 3d6.
❌D. Cu : Cấu hình electron của Cu là [Ar]3d104s1. Cu chủ yếu thể hiện số oxy hóa +1 và +2.
⟹ Chọn đáp án C Đáp án: C
❌A. Cr : Cấu hình electron của Cr là [Ar]3d54s1. Tuy nhiên, Cr thường có thể thực hiện số oxy hóa +6, không phù hợp với yêu cầu có số oxy hóa +2 và +3.
❌B. Ni : Cấu hình electron của Ni là [Ar]3d84s2. Ni chủ yếu thể hiện số oxy hóa +2.
✔️C. Fe : Cấu hình electron của Fe là [Ar]3d64s2. Fe có thể thực hiện nhiều quá trình oxy hóa, bao gồm +2 và +3, và có 4 electron độc thân trong cấu hình 3d6.
❌D. Cu : Cấu hình electron của Cu là [Ar]3d104s1. Cu chủ yếu thể hiện số oxy hóa +1 và +2.
⟹ Chọn đáp án C Đáp án: C
Câu 7 [706347]: Cho các phát biểu sau về soda:
(a) Soda là chất bột màu trắng, tan trong nước tạo môi trường trung tính.
(b) Soda có thể được dùng để làm mềm nước cứng.
(c) Soda bền với nhiệt hơn so với baking soda.
(d) Chất béo có thể bị thuỷ phân trong dung dịch soda tạo thành xà phòng.
(e) Có thể dùng baking soda thay cho soda trong việc tẩy rửa lớp dầu, mỡ bám vào bồn rửa.
Số phát biểu đúng là
(a) Soda là chất bột màu trắng, tan trong nước tạo môi trường trung tính.
(b) Soda có thể được dùng để làm mềm nước cứng.
(c) Soda bền với nhiệt hơn so với baking soda.
(d) Chất béo có thể bị thuỷ phân trong dung dịch soda tạo thành xà phòng.
(e) Có thể dùng baking soda thay cho soda trong việc tẩy rửa lớp dầu, mỡ bám vào bồn rửa.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các đáp án:
❌(a) .Sai. Soda tan trong nước tạo môi trường base do phản ứng thủy phân:
Na2CO3 + H2O → 2Na+ + HCO3- + OH-
✔️(b). Đúng. Soda phản ứng với các ion Ca2⁺ và Mg2⁺ trong nước cứng, tạo thành kết tủa CaCO3 và MgCO3, giúp làm mềm nước.
✔️(c) Đúng. Soda (Na2CO3) bền nhiệt hơn baking soda (NaHCO3). Baking soda dễ dàng được phân hủy nhiệt hơn.
❌(d) .Sai. Để tạo thành xà phòng chất béo cần thủy phân trong môi trường kiềm mạnh, Na2CO3 không đủ mạnh để xảy ra phản ứng.
✔️(e) Đúng. Baking soda có tính kiềm kiềm và khả năng làm sạch dầu mỡ, có thể được sử dụng thay thế soda trong một số trường hợp.
Các phát biểu đúng là (b), (c), (e)
⟹ Chọn đáp án C Đáp án: C
❌(a) .Sai. Soda tan trong nước tạo môi trường base do phản ứng thủy phân:
Na2CO3 + H2O → 2Na+ + HCO3- + OH-
✔️(b). Đúng. Soda phản ứng với các ion Ca2⁺ và Mg2⁺ trong nước cứng, tạo thành kết tủa CaCO3 và MgCO3, giúp làm mềm nước.
✔️(c) Đúng. Soda (Na2CO3) bền nhiệt hơn baking soda (NaHCO3). Baking soda dễ dàng được phân hủy nhiệt hơn.
❌(d) .Sai. Để tạo thành xà phòng chất béo cần thủy phân trong môi trường kiềm mạnh, Na2CO3 không đủ mạnh để xảy ra phản ứng.
✔️(e) Đúng. Baking soda có tính kiềm kiềm và khả năng làm sạch dầu mỡ, có thể được sử dụng thay thế soda trong một số trường hợp.
Các phát biểu đúng là (b), (c), (e)
⟹ Chọn đáp án C Đáp án: C
Câu 8 [561085]: Phức chất [Ni(OH2)6]2+ có dạng hình học bát diện như sau:
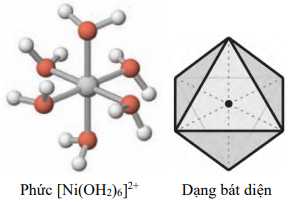
Số phối tử xung quanh nguyên tử trung tâm là

Số phối tử xung quanh nguyên tử trung tâm là
A, 2.
B, 4.
C, 6.
D, 8.
Số phối tử quanh nguyên tử trung tâm Ni2+ là các chấm màu cam => có 6 phối tử.
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C Đáp án: C
Câu 9 [244147]: Trong các sơ đồ dưới đây các gạch chéo biểu diễn kí hiệu các electron của nguyên tử oxygen, các chấm biểu diễn các electron của carbon. Sơ đồ chấm và gạch chéo nào cho thấy sự sắp xếp các electron ở lớp vỏ ngoài cùng trong phân tử của khí carbon dioxide?
A, 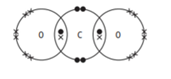

B, 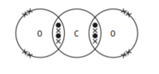

C, 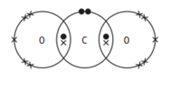

D, 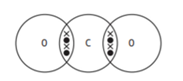

Cấu hình electron của carbon (C) và oxygen (O):
C (Z = 6): 1s22s22p2→ có 4 electron lớp ngoài cùng
O (Z = 8): 1s22s22p4 → có 6 electron lớp ngoài cùng
Theo quy tắc bát tử C cần 4 electron để đạt được cấu hình bát tử. Oxygen cần 2 electron để được cấu hình bát tử.
Suy ra mỗi nguyên tử Oxygen sẽ góp chung 2 electron và mỗi nguyên tử Carbon sẽ góp chung 4 electron chia đều cho cả hai bên.
Phân tích các phát biểu
❌Sai. A. Không đúng. Carbon không đủ liên kết
✔️Đúng. B. Carbon có 4 liên kết (4 cặp electron chia sẻ).
Oxygen có 2 liên kết (2 cặp electron chia sẻ) và 4 electron tự do (2 cặp electron không chia sẻ).
❌Sai. C. Carbon chỉ có 2 liên kết, không đủ 4 liên kết cần thiết. Oxygen cũng không đủ electron tự do.
❌Sai. D. Carbon chỉ có 2 liên kết, không đủ 4 liên kết cần thiết. Oxygen cũng không đủ electron tự do.
⟹ Chọn đáp án B Đáp án: B
C (Z = 6): 1s22s22p2→ có 4 electron lớp ngoài cùng
O (Z = 8): 1s22s22p4 → có 6 electron lớp ngoài cùng
Theo quy tắc bát tử C cần 4 electron để đạt được cấu hình bát tử. Oxygen cần 2 electron để được cấu hình bát tử.
Suy ra mỗi nguyên tử Oxygen sẽ góp chung 2 electron và mỗi nguyên tử Carbon sẽ góp chung 4 electron chia đều cho cả hai bên.
Phân tích các phát biểu
❌Sai. A. Không đúng. Carbon không đủ liên kết
✔️Đúng. B. Carbon có 4 liên kết (4 cặp electron chia sẻ).
Oxygen có 2 liên kết (2 cặp electron chia sẻ) và 4 electron tự do (2 cặp electron không chia sẻ).
❌Sai. C. Carbon chỉ có 2 liên kết, không đủ 4 liên kết cần thiết. Oxygen cũng không đủ electron tự do.
❌Sai. D. Carbon chỉ có 2 liên kết, không đủ 4 liên kết cần thiết. Oxygen cũng không đủ electron tự do.
⟹ Chọn đáp án B Đáp án: B
Câu 10 [304803]: Ester có công thức cấu tạo như hình vẽ sau đây được tạo bởi phản ứng etser hóa giữa cặp carboxylic acid và alcohol nào sau đây?
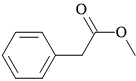

A, Formic acid và benzyl alcohol.
B, Phenylacetic acid và methyl alcohol.
C, Benzoic acid và methyl alcohol.
D, Acetic acid và benzyl alcohol.
Phân tích cấu tạo của ester:
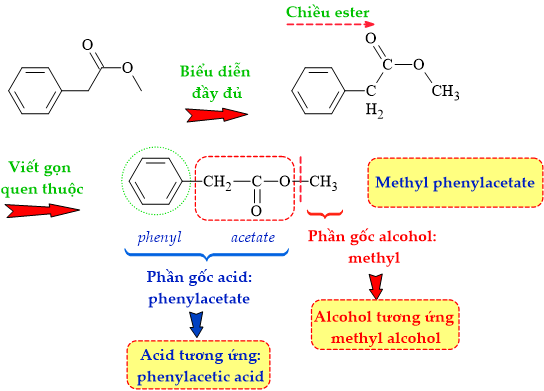
⇒ cặp acid và alcohol tương ứng là phenylacetic acid (C6H5CH2COOH) và methyl alcohol (CH3OH) ⇝ Chọn đáp án B. ♦ Đáp án: B

⇒ cặp acid và alcohol tương ứng là phenylacetic acid (C6H5CH2COOH) và methyl alcohol (CH3OH) ⇝ Chọn đáp án B. ♦ Đáp án: B
Câu 11 [305964]: Điều gì mô tả đúng nhất về thuật ngữ xà phòng hóa?
A, Sự phân cắt các phân tử ester thành muối của carboxylic acid và alcohol.
B, Phản ứng cộng H2O để chia cắt liên kết CO–O.
C, Chuyển hoá muối của acid yếu thành acid bằng cách thêm acid mạnh.
D, Tổng hợp hai nhóm alkyl để tạo thành ether.
Phản ứng thủy phân chất béo trong môi trường NaOH, KOH ⇝ muối Na, K của acid béo gọi là xà phòng
⇒ từ đó người ta gọi phản ứng này là phản ứng xà phòng hóa. Sau đó được mở rộng ra cho phản ứng thủy phân ester trong môi trường base
⟹Chọn đáp án A. Đáp án: A
⇒ từ đó người ta gọi phản ứng này là phản ứng xà phòng hóa. Sau đó được mở rộng ra cho phản ứng thủy phân ester trong môi trường base
⟹Chọn đáp án A. Đáp án: A
Câu 12 [308423]: Để phân biệt tinh bột và cellulose người ta dùng
A, glucose.
B, NaCl.
C, quỳ tím.
D, iodine.
HD: Thuốc thử iodine dùng để nhận biết tinh bột và ngược lại tinh bột dùng để nhận biết iodine bởi tinh bột có chứa phân tử amylose ở dạng vòng xoắn nên khi tương tác với iodine (I2), vòng này đã bọc (hay hấp phụ) các phân tử I2 tạo thành hợp chất có màu xanh tím.

⟹ Chọn đáp án D Đáp án: D


⟹ Chọn đáp án D Đáp án: D
Câu 13 [308732]: Glutamic acid khi phản ứng với ethanol trong môi trường acid HCl thu được sản phẩm X đã được ester hoá hoàn toàn. Công thức cấu tạo của X là
A, ClH3NC3H5(COOH)COOCH3.
B, ClH3NC3H5COOC2H5.
C, ClH3NC3H5(COOC2H5)2.
D, ClH3NC3H5(COOH)COOC2H5.
Phương trình hóa học:

⟹ Chọn đáp án C Đáp án: C

⟹ Chọn đáp án C Đáp án: C
Câu 14 [706348]: Enzyme đóng vai trò xúc tác cho nhiều phản ứng, phổ biến trong phản ứng hữu cơ, môi trường hoạt động ở nhiệt độ không cao. Sự khác nhau về năng lượng hoạt hoá của phản ứng có sử dụng và không sử dụng enzyme xúc tác như sau:
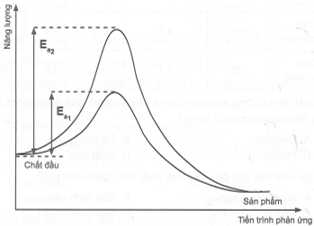
Nhận định nào sau đây không đúng?

Nhận định nào sau đây không đúng?
A, Xúc tác enzyme làm giảm năng lượng hoạt hóa của phản ứng.
B, Đường (2) có năng lượng hoạt hóa cao hơn đường (1).
C, Đường (1) biểu diễn cho phản ứng không sử dụng enzyme làm xúc tác.
D, Trạng thái năng lượng của sản phẩm khi sử dụng enzyme và không sử dụng enzyme bằng nhau.
Phân tích các đáp án:
✔️A – Đúng. Enzyme là chất xúc tác sinh học có khả năng làm giảm năng lượng hoạt hóa của phản ứng hóa học, giúp phản ứng diễn ra nhanh hơn mà không bị tiêu hao trong quá trình phản ứng.
✔️B – Đúng. Từ đồ thị, đường (2) có năng lượng hoạt hóa cao hơn đường (1).
❌C – Sai. Đường (1) biểu diễn cho phản ứng sử dụng enzyme làm xúc tác, có năng lượng hoạt hóa thấp hơn so với đường (2)
✔️D – Đúng. Enzyme chỉ làm giảm năng lượng hoạt hóa (Ea), tức là năng lượng cần thiết để phản ứng bắt đầu. Nhưng nó không ảnh hưởng đến năng lượng tự do của các chất tham gia hay sản phẩm.
⟹ Chọn đáp án C Đáp án: C
✔️A – Đúng. Enzyme là chất xúc tác sinh học có khả năng làm giảm năng lượng hoạt hóa của phản ứng hóa học, giúp phản ứng diễn ra nhanh hơn mà không bị tiêu hao trong quá trình phản ứng.
✔️B – Đúng. Từ đồ thị, đường (2) có năng lượng hoạt hóa cao hơn đường (1).
❌C – Sai. Đường (1) biểu diễn cho phản ứng sử dụng enzyme làm xúc tác, có năng lượng hoạt hóa thấp hơn so với đường (2)
✔️D – Đúng. Enzyme chỉ làm giảm năng lượng hoạt hóa (Ea), tức là năng lượng cần thiết để phản ứng bắt đầu. Nhưng nó không ảnh hưởng đến năng lượng tự do của các chất tham gia hay sản phẩm.
⟹ Chọn đáp án C Đáp án: C
Câu 15 [308425]: Cellulose diacetate (X) được dùng để sản xuất phim ảnh hoặc tơ acetate. Công thức đơn giản nhất (công thức thực nghiệm) của X là
A, C3H4O2.
B, C10H14O7.
C, C12H14O7.
D, C12H14O5.
Phân tích: trong phân tử cellulose, mỗi mắt xích C6H10O 5 có 3 nhóm hydroxy OH nên có thể viết công thức phân tử của cellulose dưới dạng [C6H7O2(OH)3]n.
Mỗi nhóm OH sẽ phản ứng với acetic anhydride (CH3CO)2O để tạo chức ester CH3COO.
• 2 nhóm OH phản ứng sẽ tạo 2 chức ester ⇝ sp gọi là cellulose diacetate.
• 3 nhóm OH phản ứng sẽ tạo 3 chức ester ⇝ sp gọi là cellulose triacetate.
Cụ thể phản ứng tạo cellulose diacetate:
[C6H7O2(OH)3]n + 2n(CH3CO)2O ––xúc tác, to→ [C6H7O2(OH)(OOCCH3)2]n + 2nCH3COOH.
⇒ sản phẩm cellulose diacetate có công thức thu gọn là (C10H14O7)n ⇒ công thức đơn giản nhất là C10H14O7
⟹Chọn đáp án B. Đáp án: B
Mỗi nhóm OH sẽ phản ứng với acetic anhydride (CH3CO)2O để tạo chức ester CH3COO.
• 2 nhóm OH phản ứng sẽ tạo 2 chức ester ⇝ sp gọi là cellulose diacetate.
• 3 nhóm OH phản ứng sẽ tạo 3 chức ester ⇝ sp gọi là cellulose triacetate.
Cụ thể phản ứng tạo cellulose diacetate:
[C6H7O2(OH)3]n + 2n(CH3CO)2O ––xúc tác, to→ [C6H7O2(OH)(OOCCH3)2]n + 2nCH3COOH.
⇒ sản phẩm cellulose diacetate có công thức thu gọn là (C10H14O7)n ⇒ công thức đơn giản nhất là C10H14O7
⟹Chọn đáp án B. Đáp án: B
Câu 16 [309495]: Cho dãy các polymer: (1) polybutadiene, (2) polyisoprene, (3) poly(methyl methacrylate), (4) poly(vinyl chloride), (5) polyacrylonitrile. Số polymer có chứa nối đôi C=C trong phân tử là
A, 3.
B, 2.
C, 4.
D, 1.
Cấu tạo của các polymer:
(1) Polybutadiene: 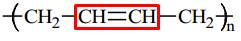
(2) Polyisoprene: 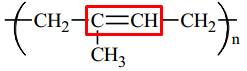
(3) Poly(methyl methacrylate): 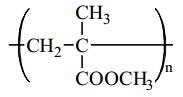
(4) Poly(vinyl chloride): 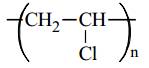
(5) Polyacrylonitrile: 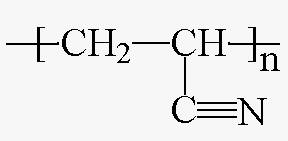
⇒ Số polymer có chứa nối đôi C=C trong phân tử là 2.
⟹ Chọn đáp án B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Kết quả sắc ký (sắc kí đồ) được phân tích và khoảng cách di chuyển của dung môi (tính từ đường cơ sở đến vạch trên của dung môi) được đo. Đối với mỗi chất trong hỗn hợp, khoảng cách mà nó đã di chuyển (tính từ đường cơ sở) được đo lại.
Giá trị Rf được tính toán bằng cách sử dụng biểu thức:

Giá trị Rf không có đơn vị vì nó là tỉ lệ của hai khoảng cách. Rf được định nghĩa là “hệ số giữ lại”. Mỗi chất có một giá trị Rf đặc trưng. Điều này có nghĩa là, về mặt lý thuyết, một chất chưa biết có thể được tìm ra bằng cách tham chiếu với bảng giá trị Rf của các chất đã biết.
Giá trị Rf được tính toán bằng cách sử dụng biểu thức:

Giá trị Rf không có đơn vị vì nó là tỉ lệ của hai khoảng cách. Rf được định nghĩa là “hệ số giữ lại”. Mỗi chất có một giá trị Rf đặc trưng. Điều này có nghĩa là, về mặt lý thuyết, một chất chưa biết có thể được tìm ra bằng cách tham chiếu với bảng giá trị Rf của các chất đã biết.
Câu 17 [706349]: Trong các phát biểu sau, phát biểu nào sau đây không đúng?
A, Theo biểu thức, Rf có giá trị cao nhất là 1.
B, Giá trị Rf của một chất không phụ thuộc vào bản chất của dung môi.
C, Khoảng cách di chuyển của dung môi là chiều cao của dung môi tính từ đường cơ sở.
D, Nếu sử dụng dung môi phân cực thì chất phân cực sẽ có giá trị Rf lớn hơn chất không phân cực.
Phân tích các phát biểu:
✔️A – Đúng. Rf thường nằm trong khoảng 0 - 1. Nếu Rf quá gần 1, có thể chất ít tương tác với pha tĩnh và bị kéo đi quá xa.
❌B – Sai. Giá trị Rf của một chất phụ thuộc vào bản chất của dung môi. Trong sắc ký lớp mỏng (TLC), pha động (dung môi) quyết định mức độ di chuyển của chất dựa vào độ phân cực. Nếu thay đổi dung môi (hoặc tỷ lệ dung môi trong hỗn hợp pha động), lực tương tác giữa chất và pha tĩnh cũng thay đổi → Giá trị Rf cũng thay đổi.
✔️C – Đúng. Trong sắc ký lớp mỏng (TLC), khoảng cách di chuyển của dung môi chính là chiều cao của dung môi tính từ đường cơ sở (nơi chấm mẫu ban đầu).
✔️D – Đúng. Dung môi phân cực sẽ kéo các chất có cùng độ phân cực đi xa hơn, làm tăng giá trị Rf của chúng. Tuy nhiên, mức độ di chuyển còn phụ thuộc vào tương tác giữa chất với pha tĩnh.
⟹ Chọn đáp án B Đáp án: B
✔️A – Đúng. Rf thường nằm trong khoảng 0 - 1. Nếu Rf quá gần 1, có thể chất ít tương tác với pha tĩnh và bị kéo đi quá xa.
❌B – Sai. Giá trị Rf của một chất phụ thuộc vào bản chất của dung môi. Trong sắc ký lớp mỏng (TLC), pha động (dung môi) quyết định mức độ di chuyển của chất dựa vào độ phân cực. Nếu thay đổi dung môi (hoặc tỷ lệ dung môi trong hỗn hợp pha động), lực tương tác giữa chất và pha tĩnh cũng thay đổi → Giá trị Rf cũng thay đổi.
✔️C – Đúng. Trong sắc ký lớp mỏng (TLC), khoảng cách di chuyển của dung môi chính là chiều cao của dung môi tính từ đường cơ sở (nơi chấm mẫu ban đầu).
✔️D – Đúng. Dung môi phân cực sẽ kéo các chất có cùng độ phân cực đi xa hơn, làm tăng giá trị Rf của chúng. Tuy nhiên, mức độ di chuyển còn phụ thuộc vào tương tác giữa chất với pha tĩnh.
⟹ Chọn đáp án B Đáp án: B
Câu 18 [706350]: Tính giá trị Rf của chất X trong sơ đồ sau:
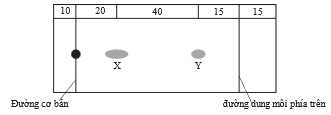

A, 0,27
B, 0,35
C, 2,83
D, 3,75
Từ hình minh họa, khoảng cách di chuyển của chất là 20; khoảng các di chuyển của dung môi là 20 + 40 + 15 = 75
Giá trị Rf là Rf = 20 ÷ 75 ≈ 0,27
Giá trị Rf là Rf = 20 ÷ 75 ≈ 0,27
⟹ Chọn đáp án A
Đáp án: APHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [706351]: Tiến hành chuẩn độ dung dịch H2C2O4 bằng dung dịch KMnO4.
∎ Bước 1: Rót dung dịch KMnO4 0,002 M vào burette (tối màu), điều chỉnh đến vạch ‘0’.
∎ Bước 2: Dùng pipette lấy 10 mL dung dịch mẫu chứa H2C2O4 (nồng độ Co M) cho vào bình định mức, sau đó cho tiếp nước cất đến vạch định mức 100 mL (lắc đều). Lấy 10 mL dung dịch từ bình định mức cho vào bình tam giác, cho thêm 5 mL dung dịch HClO4 (dùng dư so với lượng phản ứng), rồi cho thêm nước cất đến khoảng 25 mL.
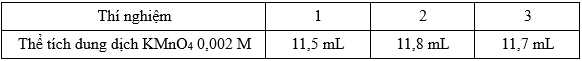
∎ Bước 3: Tiến hành chuẩn độ: Cho từ từ dung dịch KMnO4 0,002 M từ burette vào bình tam giác đã chứa hỗn hợp H2C2O4 và HClO4 ở bước 2 và lắc đều cho đến khi dung dịch ngã sang màu hồng (bền trong 30 giây) thì dừng chuẩn độ.Lặp lại thí nghiệm trên thêm 2 lần, kết quả ghi nhận được thể tích dung dịch KMnO4 0,002 M là
Ngoài ra, có hai bạn học sinh A và B có cách quan sát thể tích dung dịch KMnO4 0,002 M trên burette ở bước 1 khác nhau được thể hiện dưới đây:

∎ Bước 1: Rót dung dịch KMnO4 0,002 M vào burette (tối màu), điều chỉnh đến vạch ‘0’.
∎ Bước 2: Dùng pipette lấy 10 mL dung dịch mẫu chứa H2C2O4 (nồng độ Co M) cho vào bình định mức, sau đó cho tiếp nước cất đến vạch định mức 100 mL (lắc đều). Lấy 10 mL dung dịch từ bình định mức cho vào bình tam giác, cho thêm 5 mL dung dịch HClO4 (dùng dư so với lượng phản ứng), rồi cho thêm nước cất đến khoảng 25 mL.
∎ Bước 3: Tiến hành chuẩn độ: Cho từ từ dung dịch KMnO4 0,002 M từ burette vào bình tam giác đã chứa hỗn hợp H2C2O4 và HClO4 ở bước 2 và lắc đều cho đến khi dung dịch ngã sang màu hồng (bền trong 30 giây) thì dừng chuẩn độ.Lặp lại thí nghiệm trên thêm 2 lần, kết quả ghi nhận được thể tích dung dịch KMnO4 0,002 M là

Ngoài ra, có hai bạn học sinh A và B có cách quan sát thể tích dung dịch KMnO4 0,002 M trên burette ở bước 1 khác nhau được thể hiện dưới đây:

Phân tích các đáp án:
❌A. Sai. Bạn B đặt mắt chếch lên so với vạch chia, dẫn đến sai số thị sai. Cách quan sát đúng là đặt mắt ngang với vạch chia (như bạn A).
❌B. Sai. Thể tích trung bình KMnO4 là
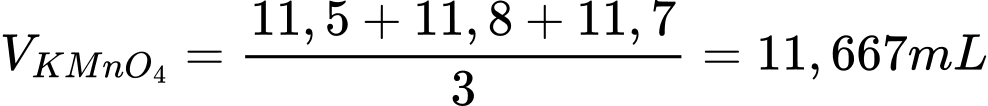
5H2C2O4 + 2MnO4- + 6H+ → 10CO2 + 2Mn2+ + 8H2O
Đổi 11,667 mL = 0,011667 L; 10 mL = 0,01 L
Số mol của KMnO4 là nKMnO4 = 0,011667.0,002 = 2,3334.10-5 mol
Theo phương trình số mol của H2C2O4 là 5,8335.10-5 mol
Nồng độ của H2C2O4 là:
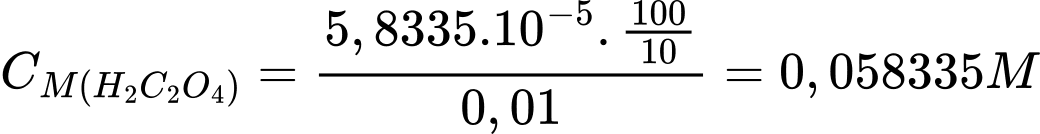
❌C. Sai. Không thể thay dung dịch HClO4 bằng dung dịch HCl hoặc HBr, nếu dùng HCl hay HBr thì sản phẩm sinh ra Cl2 hay Br2.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2KMnO4 + 16HBr → 2MnBr2 + 5Br2 + 2KBr + 8H2O
✔️D. Đúng. Do phép chuẩn độ KMnO4 có sự thay đổi màu sắc rõ rệt tại điểm tương đương nên không cần sử dụng chất chỉ thị, tại điểm tương đương thu được dung dịch có màu hồng nhạt.
❌A. Sai. Bạn B đặt mắt chếch lên so với vạch chia, dẫn đến sai số thị sai. Cách quan sát đúng là đặt mắt ngang với vạch chia (như bạn A).
❌B. Sai. Thể tích trung bình KMnO4 là
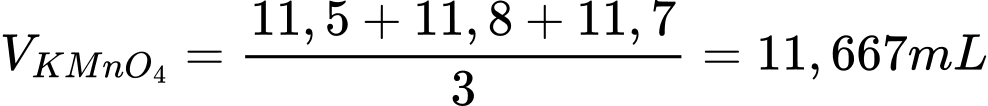
5H2C2O4 + 2MnO4- + 6H+ → 10CO2 + 2Mn2+ + 8H2O
Đổi 11,667 mL = 0,011667 L; 10 mL = 0,01 L
Số mol của KMnO4 là nKMnO4 = 0,011667.0,002 = 2,3334.10-5 mol
Theo phương trình số mol của H2C2O4 là 5,8335.10-5 mol
Nồng độ của H2C2O4 là:
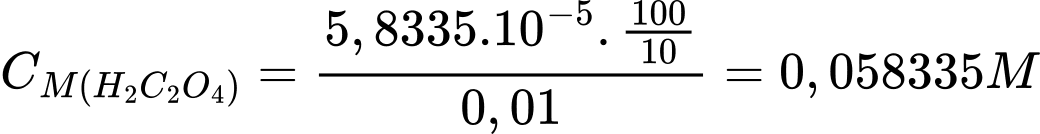
❌C. Sai. Không thể thay dung dịch HClO4 bằng dung dịch HCl hoặc HBr, nếu dùng HCl hay HBr thì sản phẩm sinh ra Cl2 hay Br2.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2KMnO4 + 16HBr → 2MnBr2 + 5Br2 + 2KBr + 8H2O
✔️D. Đúng. Do phép chuẩn độ KMnO4 có sự thay đổi màu sắc rõ rệt tại điểm tương đương nên không cần sử dụng chất chỉ thị, tại điểm tương đương thu được dung dịch có màu hồng nhạt.
Câu 20 [706352]: Aspirin được sử dụng làm thuốc giảm đau, hạ sốt. Sau khi uống, aspirin bị thuỷ phân trong cơ thể tạo thành salicylic acid. Salicylic acid ức chế quá trình sinh tổng hợp prostaglandin (chất gây đau, sốt và viêm khi nóng độ trong máu cao hơn mức bình thường). Cho phổ hồng ngoại của aspirin như sau:
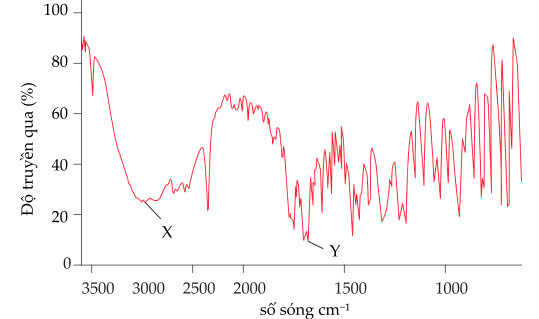

Phân tích các phát biểu:
✔️(a) – Đúng. Từ phổ hồng ngoại có tín hiệu đặc trưng trong khoảng 1700 cm-1 đặc trưng cho liên kết C=O, Aspirin có 2 liên kết C=O trong phân tử.
❌(b) – Sai. Aspirin có thể phản ứng với NaOH theo tỉ lệ 1 : 3 do có 1 nhóm COOH và 1 nhóm COO-. 1 nhóm COO- gắn trực tiếp với vòng benzene khi phản ứng với NaOH sẽ sinh ra nhóm OH của phenol, nhóm này tiếp tục phản ứng với NaOH nên aspirin có thể phản ứng với NaOH theo tỉ lệ 1 : 3 .
✔️(c) – Đúng. Từ phổ hồng ngoại có tín hiệu đặc trưng trong khoảng 3300 - 2500 cm-1 đặc trưng cho liên kết OH thuộc carboxylic acid, tín hiệu đặc trưng X là tín hiệu của liên kết O-H trong nhóm COOH.
✔️(d) – Đúng. Trên phổ IR của aspirin có một tín hiệu đặc trưng Y có số sóng 1680 cm-1 là tín hiệu của C=O trong cả hai nhóm carboxylic acid và ester.
✔️(a) – Đúng. Từ phổ hồng ngoại có tín hiệu đặc trưng trong khoảng 1700 cm-1 đặc trưng cho liên kết C=O, Aspirin có 2 liên kết C=O trong phân tử.
❌(b) – Sai. Aspirin có thể phản ứng với NaOH theo tỉ lệ 1 : 3 do có 1 nhóm COOH và 1 nhóm COO-. 1 nhóm COO- gắn trực tiếp với vòng benzene khi phản ứng với NaOH sẽ sinh ra nhóm OH của phenol, nhóm này tiếp tục phản ứng với NaOH nên aspirin có thể phản ứng với NaOH theo tỉ lệ 1 : 3 .
✔️(c) – Đúng. Từ phổ hồng ngoại có tín hiệu đặc trưng trong khoảng 3300 - 2500 cm-1 đặc trưng cho liên kết OH thuộc carboxylic acid, tín hiệu đặc trưng X là tín hiệu của liên kết O-H trong nhóm COOH.
✔️(d) – Đúng. Trên phổ IR của aspirin có một tín hiệu đặc trưng Y có số sóng 1680 cm-1 là tín hiệu của C=O trong cả hai nhóm carboxylic acid và ester.
Câu 21 [706353]: Nhóm học sinh thực hiện phản ứng trong một bình tam giác, bên dưới có đặt một chiếc cân kỹ thuật:
A(aq) → B(l) + C(g)
Tám thí nghiệm được thực hiện ở tám nhiệt độ khác nhau và đo thời gian phản ứng kết thúc:
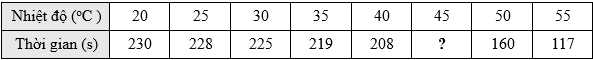
Giả sử nhiệt độ không đổi trong suốt thời gian phản ứng của tám thí nghiệm.
A(aq) → B(l) + C(g)
Tám thí nghiệm được thực hiện ở tám nhiệt độ khác nhau và đo thời gian phản ứng kết thúc:

Giả sử nhiệt độ không đổi trong suốt thời gian phản ứng của tám thí nghiệm.
Phân tích các đáp án:
❌(a) – Sai. Thời gian phản ứng kết thúc (x) ở 45 oC luôn nằm trong khoảng thời gian 280 s > x > 160 s.
✔️(b) – Đúng. Có thể nhận biết phản ứng kết thúc khi khối lượng trên cân kỹ thuật ngừng thay đổi, nhưng chỉ trong một số trường hợp nhất định.
✔️(c) – Đúng. Theo định luật bảo toàn khối lượng, nếu phản ứng không tạo ra chất khí thoát ra môi trường, thì tổng khối lượng của hệ trước và sau phản ứng sẽ không đổi.
✔️(d) – Đúng. Trong các khoảng nhiệt độ thực hiện, nhiệt độ càng cao thì thời gian để phản ứng xảy ra hoàn toàn càng ngắn. Khi nhiệt độ tăng dẫn đến tốc độ phản ứng tăng, thời gian phản ứng giảm.
❌(a) – Sai. Thời gian phản ứng kết thúc (x) ở 45 oC luôn nằm trong khoảng thời gian 280 s > x > 160 s.
✔️(b) – Đúng. Có thể nhận biết phản ứng kết thúc khi khối lượng trên cân kỹ thuật ngừng thay đổi, nhưng chỉ trong một số trường hợp nhất định.
✔️(c) – Đúng. Theo định luật bảo toàn khối lượng, nếu phản ứng không tạo ra chất khí thoát ra môi trường, thì tổng khối lượng của hệ trước và sau phản ứng sẽ không đổi.
✔️(d) – Đúng. Trong các khoảng nhiệt độ thực hiện, nhiệt độ càng cao thì thời gian để phản ứng xảy ra hoàn toàn càng ngắn. Khi nhiệt độ tăng dẫn đến tốc độ phản ứng tăng, thời gian phản ứng giảm.
Câu 22 [706354]: Nguyên tố As (Arsenic) rất nổi tiếng trong giới sát thủ ngày xưa. Các hợp chất của As có tác động độc hại đến gan, hệ thần kinh. Các dấu hiệu ngộ độc đầu tiên rất khó phát hiện vì nó tương tự như khi ngộ độc thực phẩm. Chính vì điều đó mà các hợp chất của As cũng được dùng làm độc dược để ám sát các vị vua và quý tộc. Vào thời bấy giờ, việc chứng minh các vụ ngộ độc bởi hợp chất của X vẫn là vấn đề nan giải. Vào năm 1832, một phương pháp được đề xuất để xác nhận sự ngộ độc một hợp chất của As là A (chứa 24,24 % oxygen). Dưới đây là sơ đồ thực hiện:
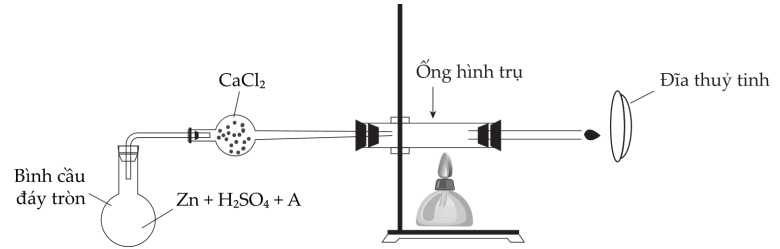
Trước tiên, cho Zn vào bình cầu đáy tròn, sau đó thêm H2SO4 loãng rồi cuối cùng là hợp chất A. Trong bình cầu sẽ diễn ra quá trình hai giai đoạn:
∎ Trước tiên là phản ứng giữa Zn và H2SO4 (phản ứng 1).
∎ Sau một thời gian mới cho hợp chất A vào, hình thành khí lưỡng nguyên tố B (phản ứng 2). Hàm lượng As trong B là 96,12%.
Hỗn hợp khí và hơi sinh ra trong bình cầu được dẫn qua một ống chứa CaCl2, sau đó tiếp tục được cho qua một ống hình trụ được đun nóng từ bên ngoài, xuất hiện một lớp gương màu đen (phản ứng 3). Ngoài ra, chất khí tiếp tục được đốt cháy ở đầu thủy tinh phía cuối, nếu đưa một bề mặt lạnh (như đĩa thủy tinh) đến gần ngọn lửa thì nó sẽ bị phủ một lớp gương màu đen (phản ứng 4).

Trước tiên, cho Zn vào bình cầu đáy tròn, sau đó thêm H2SO4 loãng rồi cuối cùng là hợp chất A. Trong bình cầu sẽ diễn ra quá trình hai giai đoạn:
∎ Trước tiên là phản ứng giữa Zn và H2SO4 (phản ứng 1).
∎ Sau một thời gian mới cho hợp chất A vào, hình thành khí lưỡng nguyên tố B (phản ứng 2). Hàm lượng As trong B là 96,12%.
Hỗn hợp khí và hơi sinh ra trong bình cầu được dẫn qua một ống chứa CaCl2, sau đó tiếp tục được cho qua một ống hình trụ được đun nóng từ bên ngoài, xuất hiện một lớp gương màu đen (phản ứng 3). Ngoài ra, chất khí tiếp tục được đốt cháy ở đầu thủy tinh phía cuối, nếu đưa một bề mặt lạnh (như đĩa thủy tinh) đến gần ngọn lửa thì nó sẽ bị phủ một lớp gương màu đen (phản ứng 4).
Phân tích các đáp án:
✔️(a) – Đúng.
Gọi công thức của A là AsxOy
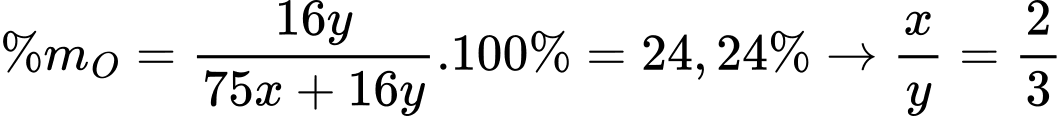
Công thức của A là As2O3.
✔️(b) – Đúng. khối lượng mol của khí B (AsxHy), trong đó As chiếm 96,12%:
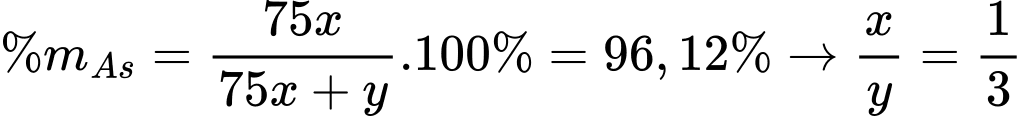
Công thức của B là AsH3.
Zn + H2SO4 → ZnSO4 + H2
6H2 + As2O3 → 2AsH3 + 3H2O
H2 đóng vai trò chất khử, As2O3 là chất oxi hóa ( bị khử ).
❌(c) – Sai. CaCl2 mục đích làm khô chất khí, không phải oxi hóa hợp chất B.
✔️(d) – Đúng. Lớp gương màu đen hình thành ở phản ứng (3) và phản ứng (4) là cùng một chất là As
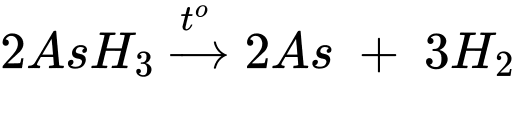
✔️(a) – Đúng.
Gọi công thức của A là AsxOy
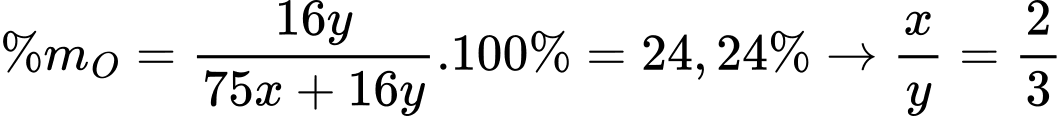
Công thức của A là As2O3.
✔️(b) – Đúng. khối lượng mol của khí B (AsxHy), trong đó As chiếm 96,12%:
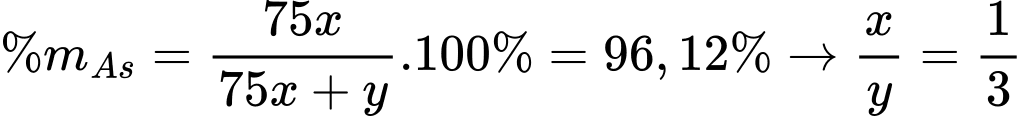
Công thức của B là AsH3.
Zn + H2SO4 → ZnSO4 + H2
6H2 + As2O3 → 2AsH3 + 3H2O
H2 đóng vai trò chất khử, As2O3 là chất oxi hóa ( bị khử ).
❌(c) – Sai. CaCl2 mục đích làm khô chất khí, không phải oxi hóa hợp chất B.
✔️(d) – Đúng. Lớp gương màu đen hình thành ở phản ứng (3) và phản ứng (4) là cùng một chất là As
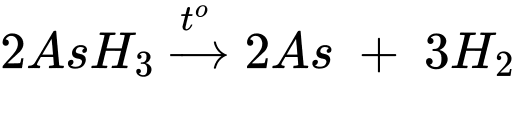
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [560951]: Tuỳ theo mục đích sử dụng, có nhiều quy ước phân loại chất tan, chất ít tan và chất không tan. Bảng dưới đây là quy ước phổ biến.
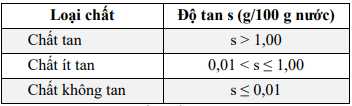
Cho bảng độ tan (g/100 g nước) của một số muối trong nước ở 20 °C như sau:

Có bao nhiêu chất ít tan trong số các chất trên?
Điền đáp án: ..........

Cho bảng độ tan (g/100 g nước) của một số muối trong nước ở 20 °C như sau:

Có bao nhiêu chất ít tan trong số các chất trên?
Điền đáp án: ..........
Chất ít tan có độ tan 0,01< s ≤ 1
=> Có 2 chất ít tan là CaSO4 ( 0,2) và SrSO4 (0,013)
⟹ Điền đáp án: 2
=> Có 2 chất ít tan là CaSO4 ( 0,2) và SrSO4 (0,013)
⟹ Điền đáp án: 2
Câu 24 [706355]: Cho các mẫu chất và dán nhãn tương ứng như sau: Methylammonium nitrate (1), saccharose (2), phenylammonium chloride (3), tinh bột (4). Tiến hành thí nghiệm với dung dịch X, Y, Z và T. Kết quả được ghi ở bảng:
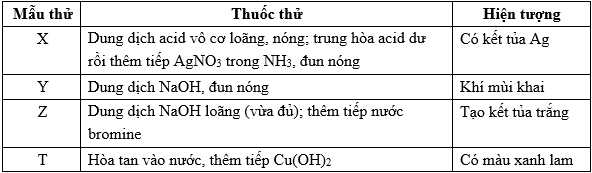
Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)
Mẫu thử X: Dung dịch acid vô cơ loãng, nóng; trung hòa acid du rồi thêm tiếp AgNO3 trong NH3, đun nóng thu được kết tủ Ag
→ Mẫu thử X là tinh bột (4)
Phản ứng thủy phân tinh bột xảy ra khi có xúc tác acid (hoặc enzyme) và diễn ra qua nhiều giai đoạn. Các giai đoạn trung gian tạo thành dextrin (C6H10O5)x (x < n) và maltose. Sản phẩm cuối cùng là glucose.
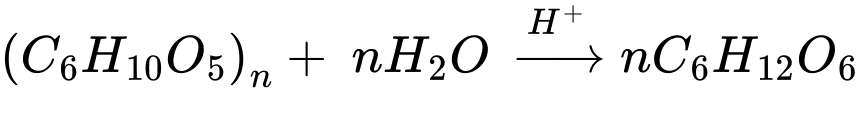
Tính chất của aldehyde: glucose tham gia phản ứng với thuốc thử Tollens tạo kết tủa bạc kim loại (phản ứng tráng gương).
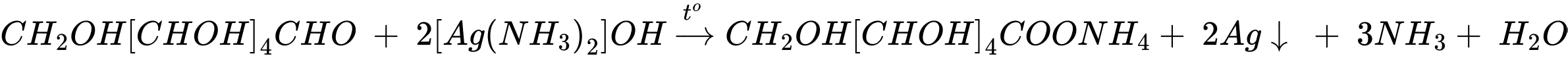
Mẫu thử Y: Dung dịch NaOH, đun nóng sinh ra khí có mùi khai
→ Mẫu thử Y là methylammonium nitrate (1)
CH3NH3NO3 + NaOH → CH3NH2 + NaNO3 + H2O
Mẫu thử Z: Dung dịch NaOH loãng (vừa đủ); thêm tiếp nước bromine tạo kết tủa trắng
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O
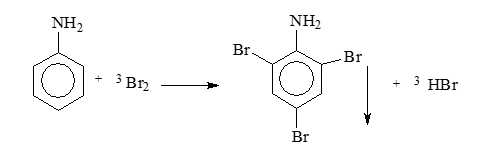
→ Mẫu thử Z là phenylammonium chloride (3)
Mẫu thử T: Hòa tan vào nước, thêm tiếp Cu(OH)2 thu được dung dịch màu xanh lam
→ mẫu thử T là saccharose (2)
Saccharose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
2C12H22O11 + Cu(OH)2 → (C12H21O11)2Cu + 2H2O
⟹ Điền đáp án : 4132
→ Mẫu thử X là tinh bột (4)
Phản ứng thủy phân tinh bột xảy ra khi có xúc tác acid (hoặc enzyme) và diễn ra qua nhiều giai đoạn. Các giai đoạn trung gian tạo thành dextrin (C6H10O5)x (x < n) và maltose. Sản phẩm cuối cùng là glucose.
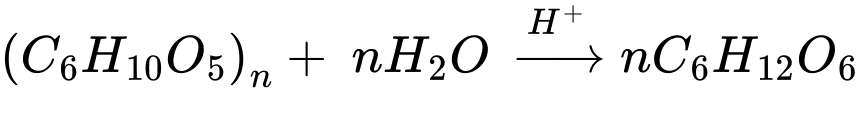
Tính chất của aldehyde: glucose tham gia phản ứng với thuốc thử Tollens tạo kết tủa bạc kim loại (phản ứng tráng gương).
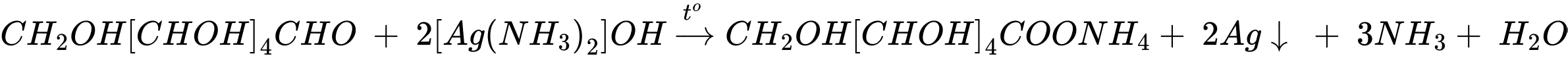
Mẫu thử Y: Dung dịch NaOH, đun nóng sinh ra khí có mùi khai
→ Mẫu thử Y là methylammonium nitrate (1)
CH3NH3NO3 + NaOH → CH3NH2 + NaNO3 + H2O
Mẫu thử Z: Dung dịch NaOH loãng (vừa đủ); thêm tiếp nước bromine tạo kết tủa trắng
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O

→ Mẫu thử Z là phenylammonium chloride (3)
Mẫu thử T: Hòa tan vào nước, thêm tiếp Cu(OH)2 thu được dung dịch màu xanh lam
→ mẫu thử T là saccharose (2)
Saccharose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
2C12H22O11 + Cu(OH)2 → (C12H21O11)2Cu + 2H2O
⟹ Điền đáp án : 4132
Câu 25 [310454]: Cho dãy gồm các polymer: (1) poly(vinyl chloride), (2) poly(hexamethylen adipamide), (3) poly(ethylen terephthalate), (4) cellulose. Polymer không bị thủy phân trong môi trường acid là
Điền đáp án: [..........]
Điền đáp án: [..........]
Sự thủy phân của polymer trong môi trường axit phụ thuộc vào loại liên kết trong cấu trúc polymer. Một số loại polymer có thể bị thủy phân trong môi trường acid như: polyester; polyamide; polysaccharide; polypeptide
Polymer không bị thủy phân trong môi trường acid là poly(vinyl chloride).
Xét từng polymer trong dãy:
✔️Poly(vinyl chloride) - PVC (1)
Cấu trúc: (-CH2-CHCl-)n
Là polymer chuỗi carbon no, không có liên kết dễ bị thủy phân.
Không bị thủy phân trong môi trường acid.
❌Poly(hexamethylen adipamide) - Nylon-6,6 (2)
Có liên kết amide (-CONH-), dễ bị thủy phân trong môi trường acid.
❌Poly(ethylen terephthalate) - PET (3)
Có liên kết ester (-COO-), bị thủy phân trong môi trường acid.
❌Cellulose (4)
Là polysaccharide với liên kết glycosid (-O-), bị thủy phân trong môi trường acid.
⟹ Điền đáp án: 1
Polymer không bị thủy phân trong môi trường acid là poly(vinyl chloride).
Xét từng polymer trong dãy:
✔️Poly(vinyl chloride) - PVC (1)
Cấu trúc: (-CH2-CHCl-)n
Là polymer chuỗi carbon no, không có liên kết dễ bị thủy phân.
Không bị thủy phân trong môi trường acid.
❌Poly(hexamethylen adipamide) - Nylon-6,6 (2)
Có liên kết amide (-CONH-), dễ bị thủy phân trong môi trường acid.
❌Poly(ethylen terephthalate) - PET (3)
Có liên kết ester (-COO-), bị thủy phân trong môi trường acid.
❌Cellulose (4)
Là polysaccharide với liên kết glycosid (-O-), bị thủy phân trong môi trường acid.
⟹ Điền đáp án: 1
Câu 26 [706356]: Cho các phát biểu sau:
(a) Dipeptide Gly-Ala có phản ứng màu biuret.
(b) Dung dịch glutamic acid đổi màu quỳ tím thành xanh.
(c) Methyl formate và glucose có cùng công thức đơn giản nhất.
(d) Methylamine có lực base mạnh hơn ammonia.
(e) Saccharose có phản ứng thủy phân trong môi trường acid.
(g) Methyl methacrylate làm mất màu dung dịch bromine.
Số phát biểu đúng là
(a) Dipeptide Gly-Ala có phản ứng màu biuret.
(b) Dung dịch glutamic acid đổi màu quỳ tím thành xanh.
(c) Methyl formate và glucose có cùng công thức đơn giản nhất.
(d) Methylamine có lực base mạnh hơn ammonia.
(e) Saccharose có phản ứng thủy phân trong môi trường acid.
(g) Methyl methacrylate làm mất màu dung dịch bromine.
Số phát biểu đúng là
Phân tích các phát biểu:
❌(a) – Sai. Trừ các dipeptide, các peptide còn lại có khả năng hoà tan Cu(OH)2 trong môi trường kiềm tạo thành phức chất tan trong nước có màu tím đặc trưng. Phản ứng này được gọi là phản ứng màu biuret.
❌(b) – Sai. Dung dịch glutamic acid đổi màu quỳ tím thành đỏ. Glutamic acid là một amino acid có tính acid do chứa nhóm -COOH (carboxylic acid) nhiều hơn nhóm -NH2 (amine)
✔️(c) – Đúng. Methyl formate (C2H4O2) và glucose (C6H12O6) có cùng công thức đơn giản nhất là CH2O
✔️(d) – Đúng. Methylamine có lực base mạnh hơn ammonia. Nhóm methyl (-CH3) có hiệu ứng cảm ứng đẩy electron làm tăng mật độ electron trên nguyên tử N → Nitrogen trong methylamine dễ nhận proton (H+) hơn.
✔️(e) – Đúng. Saccharose bị thủy phân thành glucose và fructose. Phản ứng xảy ra khi có xúc tác acid hoặc có mặt của enzyme.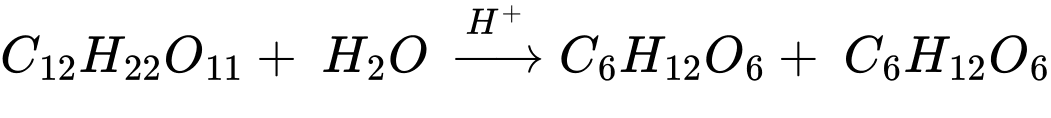
✔️(g) – Đúng. Methyl methacrylate có liên kết đôi C=C làm mất màu dung dịch bromine. CH2=C(CH3)COOCH3 + Br2 → CH2BrCBr(CH3)COOCH3
Có 4 phát biểu đúng.
⟹ Điền đáp án : 4
❌(a) – Sai. Trừ các dipeptide, các peptide còn lại có khả năng hoà tan Cu(OH)2 trong môi trường kiềm tạo thành phức chất tan trong nước có màu tím đặc trưng. Phản ứng này được gọi là phản ứng màu biuret.
❌(b) – Sai. Dung dịch glutamic acid đổi màu quỳ tím thành đỏ. Glutamic acid là một amino acid có tính acid do chứa nhóm -COOH (carboxylic acid) nhiều hơn nhóm -NH2 (amine)
✔️(c) – Đúng. Methyl formate (C2H4O2) và glucose (C6H12O6) có cùng công thức đơn giản nhất là CH2O
✔️(d) – Đúng. Methylamine có lực base mạnh hơn ammonia. Nhóm methyl (-CH3) có hiệu ứng cảm ứng đẩy electron làm tăng mật độ electron trên nguyên tử N → Nitrogen trong methylamine dễ nhận proton (H+) hơn.
✔️(e) – Đúng. Saccharose bị thủy phân thành glucose và fructose. Phản ứng xảy ra khi có xúc tác acid hoặc có mặt của enzyme.
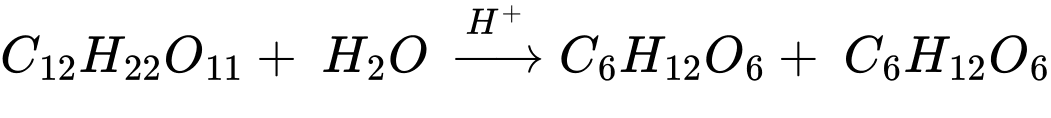
✔️(g) – Đúng. Methyl methacrylate có liên kết đôi C=C làm mất màu dung dịch bromine. CH2=C(CH3)COOCH3 + Br2 → CH2BrCBr(CH3)COOCH3
Có 4 phát biểu đúng.
⟹ Điền đáp án : 4
Câu 27 [706357]: Chlorophyll là phức chất tạo màu xanh cho lá cây, có cấu tạo như hình bên. Số liên kết quanh nguyên tử trung tâm và số phối tử trong chlorophyll lần lượt ghép thành hai chữ số là
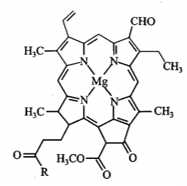

Chlorophyll là một phức chất porphyrin có vai trò quan trọng trong quang hợp của thực vật, tảo và vi khuẩn lam.
Nguyên tử trung tâm Mg2+ tạo 4 liên kết với 1 phối tử porphyrin.
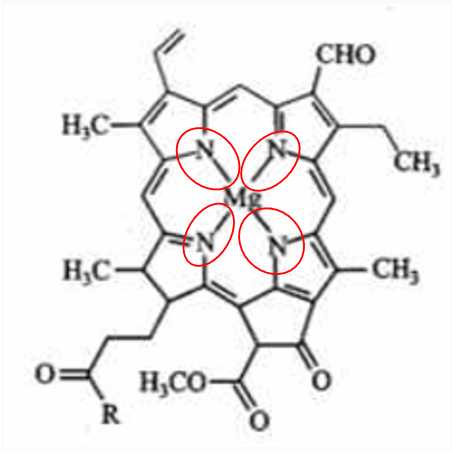
⟹ Điền đáp án: 41
Nguyên tử trung tâm Mg2+ tạo 4 liên kết với 1 phối tử porphyrin.

⟹ Điền đáp án: 41
Câu 28 [706358]: Acetic acid nồng độ 3% – 5% được ứng dụng trong việc chuẩn đoán tổn thương cổ tử cung. Để điều chế acetic acid, ngày nay thường sử dụng phản ứng giữa carbon monoxide và methanol. Tiến hành điều chế 500 gam dung dịch acetic acid 3%.
∎ Giai đoạn 1: Sử dụng phản ứng khí than ướt. Điều chỉnh phản ứng sao cho hỗn hợp chỉ gồm CO, H2 (CO lấy dư). Phản ứng khí than ướt:
C(s) + H2O(g) CO(g) + H2(g)
∎ Giai đoạn 2: Cho toàn bộ lượng H2 phản ứng với một lượng CO cần thiết để tạo methanol.
H2(g) + CO(g) CH3OH(g)
∎ Giai đoạn 3: Lấy methanol vừa thu được cho phản ứng tiếp với CO để tạo ra lượng acetic acid.
CO(g) + CH3OH(g) CH3COOH(aq)
Giả sử ba giai đoạn, mỗi giai đoạn đều có hiệu suất là 100%. Cho rằng kết thúc giai đoạn 3 thì H2 và CO đều không còn. Hãy cho biết cần bao nhiêu gam than (có 2,8% tạp chất trơ) để cho ra sản phẩm yêu cầu (làm tròn đến hàng phần trăm)?
∎ Giai đoạn 1: Sử dụng phản ứng khí than ướt. Điều chỉnh phản ứng sao cho hỗn hợp chỉ gồm CO, H2 (CO lấy dư). Phản ứng khí than ướt:
C(s) + H2O(g) CO(g) + H2(g)
∎ Giai đoạn 2: Cho toàn bộ lượng H2 phản ứng với một lượng CO cần thiết để tạo methanol.
H2(g) + CO(g) CH3OH(g)
∎ Giai đoạn 3: Lấy methanol vừa thu được cho phản ứng tiếp với CO để tạo ra lượng acetic acid.
CO(g) + CH3OH(g) CH3COOH(aq)
Giả sử ba giai đoạn, mỗi giai đoạn đều có hiệu suất là 100%. Cho rằng kết thúc giai đoạn 3 thì H2 và CO đều không còn. Hãy cho biết cần bao nhiêu gam than (có 2,8% tạp chất trơ) để cho ra sản phẩm yêu cầu (làm tròn đến hàng phần trăm)?
Ta có các phương trình:
(1) C + H2O → CO + H2
(2) 2H2 + CO → CH3OH
(3) CO + CH3OH → CH3COOH
Khối lượng acetic acid là mCH3COOH = 500.3% = 15 gam
Số mol của acetic acid là nCH3COOH = 15:60 = 0,25 mol
Bảo toàn nguyên tố C nC = 2nCH3COOH = 0,25.2 = 0,5 mol
Khối lượng C cần là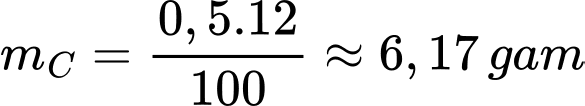
⟹ Điền đáp án: 6,17
(1) C + H2O → CO + H2
(2) 2H2 + CO → CH3OH
(3) CO + CH3OH → CH3COOH
Khối lượng acetic acid là mCH3COOH = 500.3% = 15 gam
Số mol của acetic acid là nCH3COOH = 15:60 = 0,25 mol
Bảo toàn nguyên tố C nC = 2nCH3COOH = 0,25.2 = 0,5 mol
Khối lượng C cần là
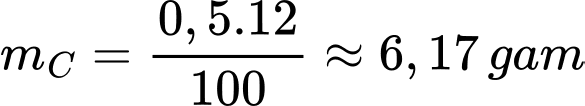
⟹ Điền đáp án: 6,17