PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [703920]: “Điện phân là quá trình ...(1)... xảy ra trên bề mặt các điện cực khi có dòng điện ...(2)... đi qua chất điện li nóng chảy hoặc dung dịch chất điện li”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, khử, một chiều.
B, oxi hoá, một chiều.
C, oxi hoá – khử, xoay chiều.
D, oxi hoá – khử, một chiều.
- Điện phân là một quá trình hóa học trong đó xảy ra sự oxi hóa (mất electron) tại anode (cực dương) và khử (nhận electron) tại cathode (cực âm).
- Để xảy ra điện phân, cần có dòng điện một chiều làm cho các ion dương (cation) di chuyển về cathode và các ion âm (anion) di chuyển về anode.
⇒ Điện phân là quá trình oxi hoá – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
⇒ Chọn đáp án D Đáp án: D
- Để xảy ra điện phân, cần có dòng điện một chiều làm cho các ion dương (cation) di chuyển về cathode và các ion âm (anion) di chuyển về anode.
⇒ Điện phân là quá trình oxi hoá – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
⇒ Chọn đáp án D Đáp án: D
Câu 2 [703921]: Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu xanh?
A, NaCl.
B, NaOH.
C, KHSO4.
D, KNO3.
- Dung dịch NaCl và KNO3 là các muối trung tính nên không làm đổi màu quỳ tím.
- KHSO4 là một muối acid, có tính acid nhẹ. Dung dịch của nó làm quỳ tím chuyển sang màu đỏ.
- NaOH là một base mạnh, tạo dung dịch có tính kiềm. Dung dịch này làm quỳ tím chuyển sang màu xanh.
⇒ Chọn đáp án B
Đáp án: B
- KHSO4 là một muối acid, có tính acid nhẹ. Dung dịch của nó làm quỳ tím chuyển sang màu đỏ.
- NaOH là một base mạnh, tạo dung dịch có tính kiềm. Dung dịch này làm quỳ tím chuyển sang màu xanh.
⇒ Chọn đáp án B
Đáp án: B
Câu 3 [703922]: Hợp chất có tên gọi nào sau đây là một polymer?
A, Buta-1,3-dien.
B, Cellulose.
C, Glycerol.
D, Hexamethylenediamine.
❌ A. Buta-1,3-dien là một monomer, không phải polymer. Buta-1,3-dien có thể tham gia phản ứng trùng hợp để tạo ra polymer như cao su buna.
✔️ B. Cellulose là một polymer tự nhiên, được cấu tạo từ các monomer glucose liên kết với nhau qua liên kết β-1,4-glycosidic:
❌ C. Glycerol là một hợp chất đơn giản, có công thức . Đây không phải là polymer mà là một hợp chất hữu cơ nhỏ được sử dụng trong nhiều phản ứng hóa học.
❌ D. Hexamethylenediamine là một hợp chất hữu cơ có hai nhóm amine (-NH2). Nó là monomer dùng để tổng hợp polymer như nylon-6,6 khi kết hợp với adipic acid.
⇒ Chọn đáp án B Đáp án: B
✔️ B. Cellulose là một polymer tự nhiên, được cấu tạo từ các monomer glucose liên kết với nhau qua liên kết β-1,4-glycosidic:
❌ C. Glycerol là một hợp chất đơn giản, có công thức . Đây không phải là polymer mà là một hợp chất hữu cơ nhỏ được sử dụng trong nhiều phản ứng hóa học.
❌ D. Hexamethylenediamine là một hợp chất hữu cơ có hai nhóm amine (-NH2). Nó là monomer dùng để tổng hợp polymer như nylon-6,6 khi kết hợp với adipic acid.
⇒ Chọn đáp án B Đáp án: B
Câu 4 [703923]: Nhôm chloride ngậm nước chứa ion phức [Al(H2O)6]3+. Câu nào sau đây là lời giải thích đúng nhất về liên kết được hình thành giữa ion Al3+ và các phân tử nước?
A, Ion Al3+ bị thu hút bởi phân tử nước mang điện tích âm.
B, Phân tử nước cho cặp electron riêng của O vào orbital trống của ion Al3+.
C, Liên kết hydrogen được hình thành giữa ion Al3+ với phân tử nước.
D, Liên kết Van der Waals được hình thành giữa ion Al3+ với phân tử nước.
H2O là phối tử trung hoà còn cặp electron chưa liên kết, cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm, hình thành liên kết cho - nhận.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 5 [575573]: Nguyên tử copper có cấu hình electron là [Ar]3d104s1. Số hiệu nguyên tử của copper là
A, 26.
B, 29.
C, 22.
D, 27.
Cấu hình electron của copper là: 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Nguyên tử của nguyên tố có 29 electron ⇒ Số hiệu nguyên tử của copper là 29.
⇒ Chọn đáp án B Đáp án: B
Nguyên tử của nguyên tố có 29 electron ⇒ Số hiệu nguyên tử của copper là 29.
⇒ Chọn đáp án B Đáp án: B
Câu 6 [982269]: Calcium sulfate là chất rắn, màu trắng, ít tan trong nước. Công thức của calcium sulfate là
A, CaSO4.
B, CaO.
C, Ca(OH)2.
D, CaCO3.
HD: Phân tích các đáp án:
⇒ Chọn đáp án A Đáp án: A
| Công thức | A. CaSO4. | B. CaO. | C. Ca(OH)2. | D. CaCO3. |
| Tên gọi | calcium sulfate | calcium oxide | calcium hydroxide | calcium carbonate |
⇒ Chọn đáp án A Đáp án: A
Câu 7 [703924]: Trên phổ IR của acetone có tín hiệu đặc trưng cho nhóm carbonyl ở vùng
A, 1740 – 1670 cm–1.
B, 1650 – 1620 cm–1.
C, 3650 – 3200 cm–1.
D, 2250 – 2150 cm–1.
Acetone: CH3-C=O-CH3
✔️ A. 1740 – 1670 cm–1 là dao động kéo dài của liên kết 1650 – 1620 cm–1 là vùng của dao động liên kết đôi , không liên quan đến nhóm carbonyl.
❌ C. 3650 – 3200 cm–1 là vùng của dao động kéo dài liên kết (như trong alcohol hoặc carboxylic acid)
❌ D. 2250 – 2150 cm–1 là vùng của dao động kéo dài liên kết ba hoặc , không xuất hiện trong acetone.
⇒ Chọn đáp án A Đáp án: A
✔️ A. 1740 – 1670 cm–1 là dao động kéo dài của liên kết 1650 – 1620 cm–1 là vùng của dao động liên kết đôi , không liên quan đến nhóm carbonyl.
❌ C. 3650 – 3200 cm–1 là vùng của dao động kéo dài liên kết (như trong alcohol hoặc carboxylic acid)
❌ D. 2250 – 2150 cm–1 là vùng của dao động kéo dài liên kết ba hoặc , không xuất hiện trong acetone.
⇒ Chọn đáp án A Đáp án: A
Câu 8 [703925]: Ester X có công thức CH3COO[CH2]7CH3. Thuỷ phân ester X trong dung dịch sodium hydroxide, đun nóng. Một trong các sản phẩm có công thức là
A, C2H4O2.
B, C2H3O2Na.
C, C8H16O.
D, C8H17O2Na.
Khi thuỷ phân ester X trong dung dịch sodium hydroxide, đun nóng thì phản ứng xảy ra như sau: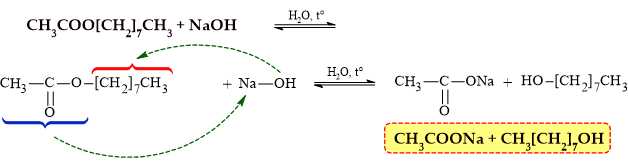
Công thức phân tử của 2 sản phẩm là: C2H3O2Na và C8H18O
⇒ Chọn đáp án B
Câu 9 [304967]: Chất nào sau đây không phải acid béo?
A, Oleic acid.
B, Stearic acid.
C, Acetic acid.
D, Palmitic acid.
4 acid béo cần nhớ trong chương trình hóa THPT để ⇒ các chất béo tương ứng gồm:
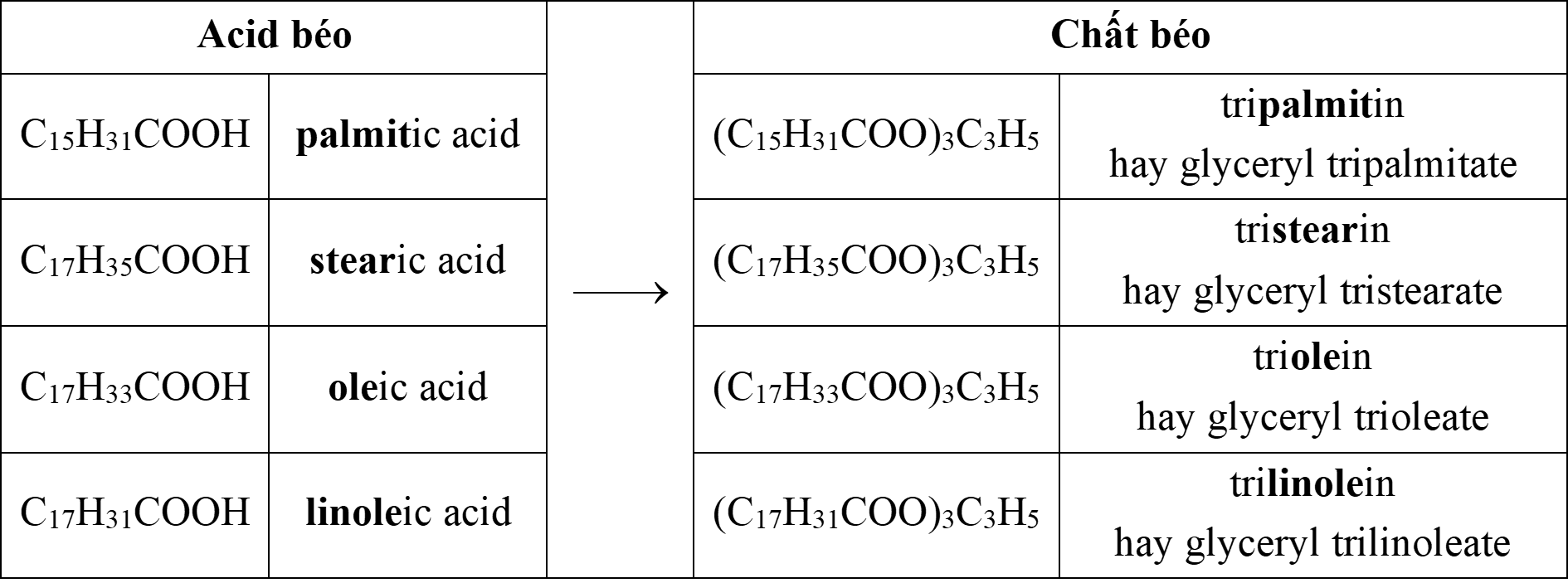
⇒ Quan sát 4 đáp án thì C. acetic acid không phải là acid béo
⟹Chọn đáp án C. Đáp án: C

⇒ Quan sát 4 đáp án thì C. acetic acid không phải là acid béo
⟹Chọn đáp án C. Đáp án: C
Câu 10 [186602]: Nguyên nhân nào dưới đây không gây ra hiện tượng phú dưỡng?
A, Nguồn nước thải chứa chất làm mềm chưa xử lí triệt để làm dư thừa hàm lượng hợp chất phosphorus đi vào hệ thống nước tự nhiên.
B, Các nguồn phân bón như NH4NO3, (NH2)2CO, (NH4)2HPO4, Ca(H2PO4)2,… dư thừa chảy vào vùng nước tù đọng.
C, Chất thải sinh hoạt, chất thải công nghiệp không được xử lí theo quy chuẩn, đi vào sông hồ gây hiện tượng phú dưỡng.
D, Sự thay đổi về điều kiện thiên nhiên do thiên tai làm thay đổi hàm lượng nitrogen và phosphorus có trong nước.
Các nguyên nhân gây hiện tượng phú dưỡng là:
- Nguồn nước thải chưa xử lí triệt để: hầu hết chất tẩy rửa đều chứa chất làm mềm từ hợp chất phosphorus, chất thải này từ máy giặt, bồn rửa đi vào hệ thống nước tự nhiên.
- Các nguồn phân bón như NH4NO3, (NH2)2CO, (NH4)2HPO4, Ca(H2PO4)2,… dư thừa chảy vào vùng nước tù đọng.
Sự thay đổi về điều kiện thiên nhiên do thiên tai không phải nguyên nhân gây ra hiện tượng phú dưỡng.
⇒ Chọn đáp án D Đáp án: D
- Nguồn nước thải chưa xử lí triệt để: hầu hết chất tẩy rửa đều chứa chất làm mềm từ hợp chất phosphorus, chất thải này từ máy giặt, bồn rửa đi vào hệ thống nước tự nhiên.
- Các nguồn phân bón như NH4NO3, (NH2)2CO, (NH4)2HPO4, Ca(H2PO4)2,… dư thừa chảy vào vùng nước tù đọng.
Sự thay đổi về điều kiện thiên nhiên do thiên tai không phải nguyên nhân gây ra hiện tượng phú dưỡng.
⇒ Chọn đáp án D Đáp án: D
Câu 11 [308765]: Số liên kết peptide có trong một phân tử Ala-Gly-Val-Gly-Ala là
A, 2.
B, 4.
C, 5.
D, 3
Số liên kêt peptide trong phân tử = số α-amino acid – 1
Vậy số liên kết peptide có trong một phân tử Ala-Gly-Val-Gly-Ala là: 5 – 1 = 4.
⇒ Chọn đáp án B Đáp án: B
Vậy số liên kết peptide có trong một phân tử Ala-Gly-Val-Gly-Ala là: 5 – 1 = 4.
⇒ Chọn đáp án B Đáp án: B
Câu 12 [308282]: Đường glucose có nhiều trong hoa quả chín, đặc biệt là nho chín. Công thức phân tử của glucose là
A, C6H10O5.
B, C6H12O6.
C, C12H22O11.
D, C18H32O16.
Cấu tạo của glucose:
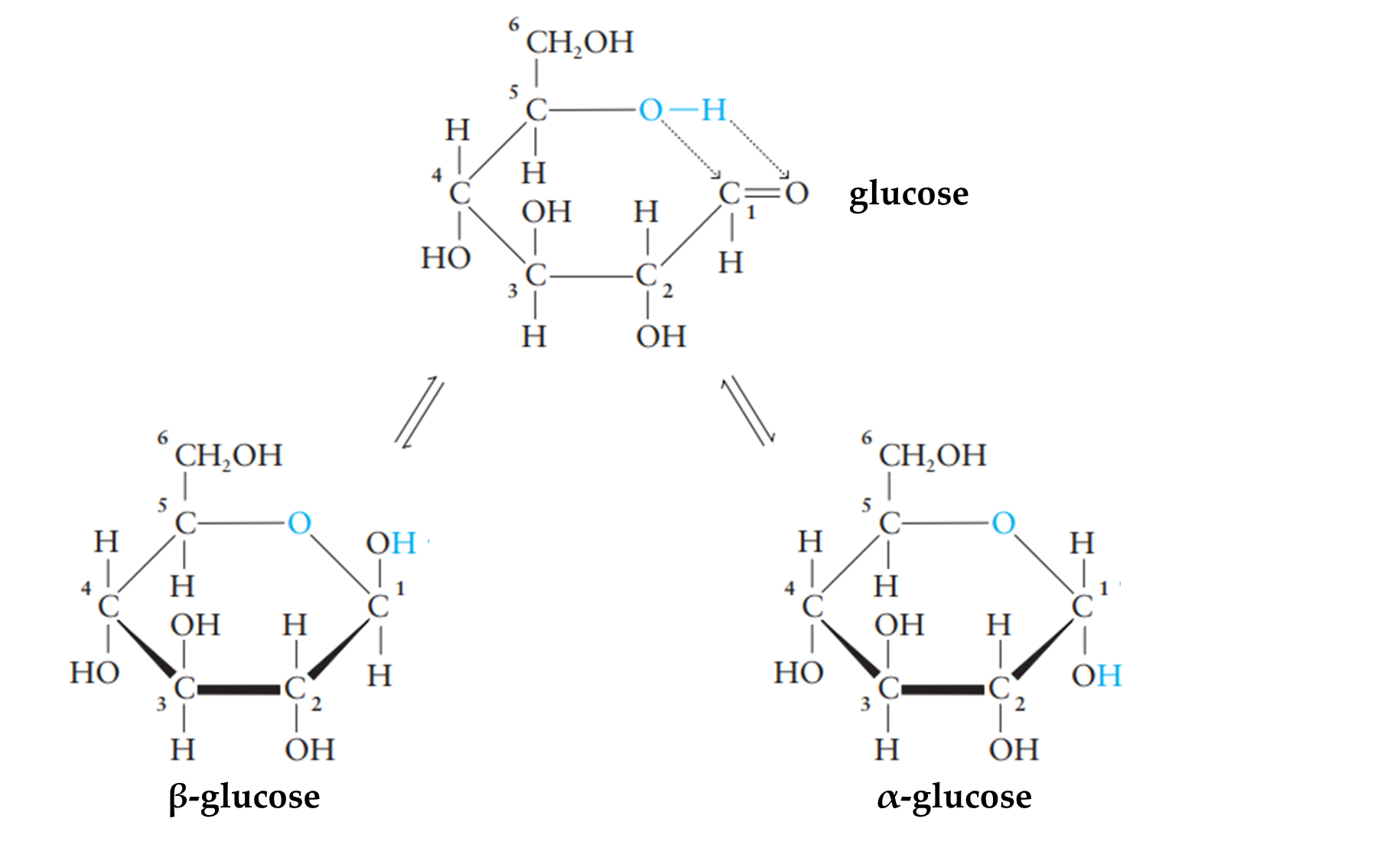
⇝ Công thức phân tử tương ứng: C6H12O6 (M = 180)
⇝ Chọn đáp án B. Đáp án: B

⇝ Công thức phân tử tương ứng: C6H12O6 (M = 180)
⇝ Chọn đáp án B. Đáp án: B
Câu 13 [703926]: Phản ứng giữa ethylene với HBr:
CH2=CH2 + HBr CH3CH2Br.
CH3CH2Br.
▪ Giai đoạn 1 của phản ứng là quá trình H+ (tác nhân electrophile(*)) phản ứng với C=C, tạo carbocation trung gian:
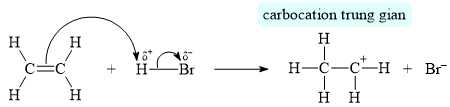
(*) tác nhân electrophile là những chất “yêu thích” electron, chúng thường là các chất mang điện tích dương hoặc có trung tâm mang một phần điện tích dương.
▪ Giai đoạn 2 là quá trình kết hợp giữa carbocation với tác nhân X:
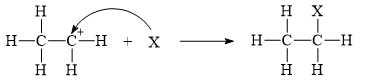
Trong các phát biểu sau, phát biểu nào đúng?
CH2=CH2 + HBr
 CH3CH2Br.
CH3CH2Br.▪ Giai đoạn 1 của phản ứng là quá trình H+ (tác nhân electrophile(*)) phản ứng với C=C, tạo carbocation trung gian:

(*) tác nhân electrophile là những chất “yêu thích” electron, chúng thường là các chất mang điện tích dương hoặc có trung tâm mang một phần điện tích dương.
▪ Giai đoạn 2 là quá trình kết hợp giữa carbocation với tác nhân X:
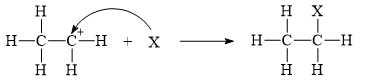
Trong các phát biểu sau, phát biểu nào đúng?
A, Hướng mũi tên cong biểu diễn sự chuyển dịch của electron.
B, Giai đoạn 1 có sự hình thành liên kết π.
C, Giai đoạn 2, tác nhân X phản ứng với carbocation là cation Br+.
D, Sản phẩm CH3CH2Br nhiều hơn chất hữu cơ ban đầu 1 liên kết σ.
Phân tích các phát biểu:
✔️ A. Đúng. Hướng mũi tên cong biểu diễn sự chuyển dịch của electron từ X (nhiều electron) sang C (ít elecrtron).
❌ B. Sai. Giai đoạn 1 không có sự hình thành liên kết π mà là sự phá vỡ liên kết π.
❌ C. Sai. Giai đoạn 2, tác nhân X phản ứng với carbocation C+ phải là tác nhân âm nên không thể là cation Br+ mà phải là anion Br-.
❌ D. Sai. Sản phẩm CH3CH2Br có 7 liên kết σ, nhiều hơn chất hữu cơ ban đầu 2 liên kết σ do chất ban đầu có 5 liên kết σ.
⇒ Chọn đáp án A Đáp án: A
✔️ A. Đúng. Hướng mũi tên cong biểu diễn sự chuyển dịch của electron từ X (nhiều electron) sang C (ít elecrtron).
❌ B. Sai. Giai đoạn 1 không có sự hình thành liên kết π mà là sự phá vỡ liên kết π.
❌ C. Sai. Giai đoạn 2, tác nhân X phản ứng với carbocation C+ phải là tác nhân âm nên không thể là cation Br+ mà phải là anion Br-.
❌ D. Sai. Sản phẩm CH3CH2Br có 7 liên kết σ, nhiều hơn chất hữu cơ ban đầu 2 liên kết σ do chất ban đầu có 5 liên kết σ.
⇒ Chọn đáp án A Đáp án: A
Câu 14 [703927]: “Phân tử saccharose được tạo bởi một đơn vị α-glucose và một đơn vị ...(1)..., liên kết với nhau qua liên kết ...(2)...”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, β-glucose, α-1,2-glycoside.
B, β-fructose, α-1,2-glycoside.
C, α-fructose, α-1,2-glycoside.
D, β-glucose, α-1,4-glycoside.
Saccharose là một disaccharide, được hình thành từ sự liên kết giữa hai monosaccharide là α-glucose và β-fructose, hình thành nhờ liên kết glycosidic giữa carbon số 1 của α-glucose và carbon số 2 của β-fructose.
⇒ Phân tử saccharose được tạo bởi một đơn vị α-glucose và một đơn vị β-fructose, liên kết với nhau qua liên kết α-1,2-glycoside.
⇒ Chọn đáp án B Đáp án: B
⇒ Phân tử saccharose được tạo bởi một đơn vị α-glucose và một đơn vị β-fructose, liên kết với nhau qua liên kết α-1,2-glycoside.
⇒ Chọn đáp án B Đáp án: B
Câu 15 [703928]: Năm 1991, người ta phát hiện ra rằng nitrous oxide (N2O) được tạo ra trong quá trình tổng hợp nylon. Hợp chất này được thải vào khí quyển, góp phần làm suy giảm tầng ozone trong tầng bình lưu và gây ra hiệu ứng nhà kính: N2O + 3O3  2NO2 + 3O2 (*)
2NO2 + 3O2 (*)
Một trong những chất trung gian trong sản xuất nylon là adipic acid (HOOC[CH2]4COOH). Khoảng 2,2 × 109 kg adipic acid được tiêu thụ mỗi năm. Người ta ước tính rằng cứ mỗi mol adipic acid được tạo ra thì sẽ tạo ra 1 mol N2O và giả sử toàn bộ lượng N2O sẽ phản ứng với O3 trong tầng bình lưu. Cho các phát biểu sau:
(a) Tỉ lệ hợp thức của N2O và O3 trong phương trình (*) là 1 : 3.
(b) Khí N2O làm suy giảm tầng ozone.
(c) Số mol O3 tối đa có thể bị phá hủy trong một năm là 1,5×1010 mol.
(d) Quá trình N2O phản ứng với O3 gián tiếp gây ra hiện tượng mưa acid.
Các phát biểu đúng là
 2NO2 + 3O2 (*)
2NO2 + 3O2 (*)Một trong những chất trung gian trong sản xuất nylon là adipic acid (HOOC[CH2]4COOH). Khoảng 2,2 × 109 kg adipic acid được tiêu thụ mỗi năm. Người ta ước tính rằng cứ mỗi mol adipic acid được tạo ra thì sẽ tạo ra 1 mol N2O và giả sử toàn bộ lượng N2O sẽ phản ứng với O3 trong tầng bình lưu. Cho các phát biểu sau:
(a) Tỉ lệ hợp thức của N2O và O3 trong phương trình (*) là 1 : 3.
(b) Khí N2O làm suy giảm tầng ozone.
(c) Số mol O3 tối đa có thể bị phá hủy trong một năm là 1,5×1010 mol.
(d) Quá trình N2O phản ứng với O3 gián tiếp gây ra hiện tượng mưa acid.
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (b), (d).
D, (a), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Tỉ lệ hợp thức của N2O và O3 chính là tỉ lệ phản ứng trong phương trình (*) và bằng 1 : 3.
✔️ (b) Đúng. Khí N2O sẽ phản ứng với O3 theo phương trình (*) làm suy giảm tầng ozone.
❌ (c) Sai. nadipic acid = (2,2×109×103) / 146 = 1,5×1010 (mol) = nN2O
→ nO3 = 3nN2O = 1,5×1010 × 3 = 4,5×1010 (mol)
Nên số mol O3 tối đa có thể bị phá hủy trong một năm là 4,5×1010 mol.
✔️ (d) Đúng. Quá trình N2O phản ứng với O3 gián tiếp gây ra hiện tượng mưa acid do sản phậm tạo thành của phản ứng là NO2, là khí gây ra hiện tượng mưa acid.
Có 3 phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Tỉ lệ hợp thức của N2O và O3 chính là tỉ lệ phản ứng trong phương trình (*) và bằng 1 : 3.
✔️ (b) Đúng. Khí N2O sẽ phản ứng với O3 theo phương trình (*) làm suy giảm tầng ozone.
❌ (c) Sai. nadipic acid = (2,2×109×103) / 146 = 1,5×1010 (mol) = nN2O
→ nO3 = 3nN2O = 1,5×1010 × 3 = 4,5×1010 (mol)
Nên số mol O3 tối đa có thể bị phá hủy trong một năm là 4,5×1010 mol.
✔️ (d) Đúng. Quá trình N2O phản ứng với O3 gián tiếp gây ra hiện tượng mưa acid do sản phậm tạo thành của phản ứng là NO2, là khí gây ra hiện tượng mưa acid.
Có 3 phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án C Đáp án: C
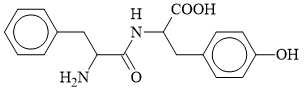
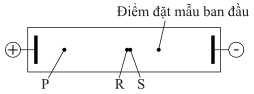
Câu 16 [703929]: Dipeptide Phe-Tyr có cấu trúc như hình bên. Hỗn hợp của dipeptide này (Phe-Tyr) và hai amino acid thành phần của nó (Phe và Tyr) đã được tiến hành điện di trong dung dịch đệm ở pH = 12. Tại điều kiện này, thông tin của ba chất được cung cấp như sau:
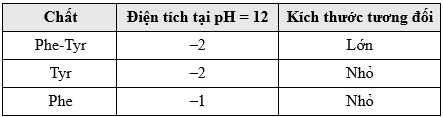
Vào cuối thí nghiệm, người ta thấy được những kết quả sau: Ba chấm P, R, S là đại diện cho ba chất Phe hoặc Tyr hoặc Phe-Tyr (không theo thứ tự). Các chấm R và S vẫn nằm rất gần nhau.
Cho các nhận định sau về quá trình điện di:
(a) Điện tích càng lớn thì khả năng di chuyển về phía điện cực càng tốt.
(b) Kích thước phân tử càng lớn thì khả năng di chuyển về phía điện cực càng kém.
(c) Amino acid Phe có khả năng di chuyển xấp xỉ với dipeptide Phe-Tyr trong điện trường.
(d) Chấm P là Tyr có điện tích lớn, kích thước nhỏ nên di chuyển tốt nhất về phía điện trường
Dựa vào thí nghiệm trên chưa thể kết luận chấm R hoặc S thuộc về Phe hay Phe-Tyr.
Các nhận định đúng là


Vào cuối thí nghiệm, người ta thấy được những kết quả sau: Ba chấm P, R, S là đại diện cho ba chất Phe hoặc Tyr hoặc Phe-Tyr (không theo thứ tự). Các chấm R và S vẫn nằm rất gần nhau.

Cho các nhận định sau về quá trình điện di:
(a) Điện tích càng lớn thì khả năng di chuyển về phía điện cực càng tốt.
(b) Kích thước phân tử càng lớn thì khả năng di chuyển về phía điện cực càng kém.
(c) Amino acid Phe có khả năng di chuyển xấp xỉ với dipeptide Phe-Tyr trong điện trường.
(d) Chấm P là Tyr có điện tích lớn, kích thước nhỏ nên di chuyển tốt nhất về phía điện trường
Dựa vào thí nghiệm trên chưa thể kết luận chấm R hoặc S thuộc về Phe hay Phe-Tyr.
Các nhận định đúng là
A, (b), (c).
B, (a), (c).
C, (b), (c), (d).
D, (a), (b), (c), (d).
Chấm P là Tyr; Chấm R và S là Phe và Phe-Tyr (không theo thứ tự).
Phân tích các phát biểu:
✔️ (a) Đúng. Điện tích càng lớn thì khả năng di chuyển về phía điện cực càng tốt.
✔️ (b) Đúng. Kích thước lớn ảnh hưởng đến khả năng di chuyển về phía các điện cực nên kích thước phân tử càng lớn thì càng khó di chuyển và ngược lại.
✔️ (c) Phe-Tyr có điện tích -2 nhưng kích cỡ lớn, Phe kích cỡ nhỏ nhưng có điện tích -1 nên khả năng di chuyển của chúng xấp xỉ nhau trong điện trường.
✔️ (d) Tys có điện tích -2 và kích cỡ nhỏ nên di chuyển tốt nhất, nên P là Tyr.
Cả 4 phát biểu đều đúng
⇒ Chọn đáp án D Đáp án: D
Phân tích các phát biểu:
✔️ (a) Đúng. Điện tích càng lớn thì khả năng di chuyển về phía điện cực càng tốt.
✔️ (b) Đúng. Kích thước lớn ảnh hưởng đến khả năng di chuyển về phía các điện cực nên kích thước phân tử càng lớn thì càng khó di chuyển và ngược lại.
✔️ (c) Phe-Tyr có điện tích -2 nhưng kích cỡ lớn, Phe kích cỡ nhỏ nhưng có điện tích -1 nên khả năng di chuyển của chúng xấp xỉ nhau trong điện trường.
✔️ (d) Tys có điện tích -2 và kích cỡ nhỏ nên di chuyển tốt nhất, nên P là Tyr.
Cả 4 phát biểu đều đúng
⇒ Chọn đáp án D Đáp án: D
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Thiết lập một pin Galvani như sau: đổ dung dịch chứa K2Cr2O7 và H2SO4 vào một cốc, ghi nhãn (1) và đổ dung dịch KI vào cốc còn lại, ghi nhãn (2). Một cầu muối được sử dụng để nối các cốc lại với nhau. Sử dụng dây dẫn kim loại không phản ứng với bất kỳ dung dịch nào (như lá bạch kim) nhúng vào mỗi dung dịch, nối hai dây dẫn này qua một vôn kế điện.
Cho thế điện cực chuẩn của các cặp oxi hóa khử như sau:
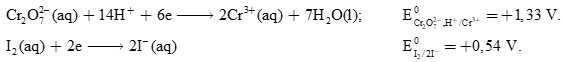
Cho thế điện cực chuẩn của các cặp oxi hóa khử như sau:
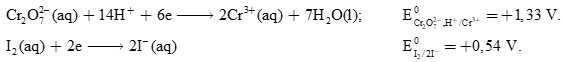
Câu 17 [703930]: Nếu các dung dịch được thiết lập ở điều kiện chuẩn thì giá trị hiển thị trên vôn kế có thể mong đợi là giá trị nào sau đây?
A, 0,54 V.
B, 0,79 V.
C, 1,33 V.
D, 1,87 V.
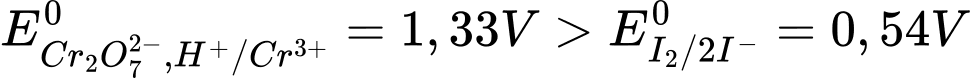
Tại cathode (+): Cr2O72-(aq) + 14H+(aq) + 6e → 2Cr3+(aq) + 7H2O(l)
Tại anode (-): 2I-(aq) → I2(s) + 2e
→
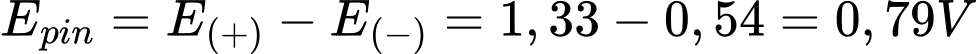
⇒ Chọn đáp án: B Đáp án: B
Câu 18 [703931]: Phát biểu nào sau đây về thí nghiệm là đúng?
A, Ở cốc (1), trên dây bạch kim xuất hiện bong bóng khí.
B, Sau phản ứng, giá trị pH của cốc (1) tăng so với ban đầu.
C, Dung dịch trong cốc (2) chuyển từ màu nâu sang không màu.
D, Các electron được chuyển qua dung dịch từ điện cực trong cốc (1) sang cốc (2).
Phản ứng xảy ra tại 2 điện cực xảy ra như sau:
Tại cathode (+): Cr2O72-(aq) + 14H+(aq) + 6e → 2Cr3+(aq) + 7H2O(l)
Tại anode (-): 2I-(aq) → I2(s) + 2e
- Ở cả 2 điện cực đều không tạo ra khí nên không xuất hiện bong bóng khí → A sai
- Trong quá trình phản ứng, ở cốc (1) H+ đã tham gia phản ứng nên nồng độ H+ giảm dần dẫn đến sau phản ứng, giá trị pH của cốc (1) tăng so với ban đầu → B đúng
- Trong cốc 2, I- không màu và I2 có màu nâu nên hiện tượng nhìn thấy phải là không màu chuyển sang màu nâu → C sai
- Electron được tạo ra ở điện cực anode nên sẽ di chuyển từ anode (cốc 2) sang cathode (cốc 1) → D sai
⇒ Chọn đáp án B
Đáp án: B
Tại cathode (+): Cr2O72-(aq) + 14H+(aq) + 6e → 2Cr3+(aq) + 7H2O(l)
Tại anode (-): 2I-(aq) → I2(s) + 2e
- Ở cả 2 điện cực đều không tạo ra khí nên không xuất hiện bong bóng khí → A sai
- Trong quá trình phản ứng, ở cốc (1) H+ đã tham gia phản ứng nên nồng độ H+ giảm dần dẫn đến sau phản ứng, giá trị pH của cốc (1) tăng so với ban đầu → B đúng
- Trong cốc 2, I- không màu và I2 có màu nâu nên hiện tượng nhìn thấy phải là không màu chuyển sang màu nâu → C sai
- Electron được tạo ra ở điện cực anode nên sẽ di chuyển từ anode (cốc 2) sang cathode (cốc 1) → D sai
⇒ Chọn đáp án B
Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [703932]: Phương pháp Volhard là phép chuẩn độ Ag(I) bởi dung dịch chuẩn potassium thiocyanate (KSCN), thường được tiến hành trong môi trường acid. Khi bạc(I) đã được kết tủa ở dạng kết tủa trắng AgSCN thì SCN– sẽ ngay lập tức phản ứng với chất chỉ thị sắt(III), tạo thành phức chất màu đỏ máu [FeSCN]2+. Có thể xác định hàm lượng bạc trong một hợp kim Ag–Cu bằng phương pháp Volhard, với quy trình như sau:
▪ Bước 1: Hòa tan hoàn toàn 0,3 gam hợp kim vào 5 mL dung dịch nitric acid đậm đặc, nồng độ 63 %.
▪ Bước 2: Dung dịch tạo thành được pha loãng 4 – 5 lần và rồi nhỏ vào vài giọt dung dịch Fe(NO3)3 đậm đặc làm chất chỉ thị.
▪ Bước 3: Tiến hành chuẩn độ với dung dịch KSCN 0,100 M từ burette cho đến khi xuất hiện màu đỏ máu trên kết tủa trắng AgSCN trong bình tam giác. Thể tích dung dịch KSCN 0,100 M đã dùng là 20 mL.
Cho biết Cu(II) không phản ứng với ion thiocyanate SCN–.
▪ Bước 1: Hòa tan hoàn toàn 0,3 gam hợp kim vào 5 mL dung dịch nitric acid đậm đặc, nồng độ 63 %.
▪ Bước 2: Dung dịch tạo thành được pha loãng 4 – 5 lần và rồi nhỏ vào vài giọt dung dịch Fe(NO3)3 đậm đặc làm chất chỉ thị.
▪ Bước 3: Tiến hành chuẩn độ với dung dịch KSCN 0,100 M từ burette cho đến khi xuất hiện màu đỏ máu trên kết tủa trắng AgSCN trong bình tam giác. Thể tích dung dịch KSCN 0,100 M đã dùng là 20 mL.
Cho biết Cu(II) không phản ứng với ion thiocyanate SCN–.
Ag+ + SCN- → AgSCN (màu trắng) (1)
Fe3+ + SCN- → Fe[SCN]2+ (màu đỏ máu) (2)
Số mol của KSCN là: 0,02 . 0,1 = 0,002 (mol)
Từ PTHH (1) số mol của Ag là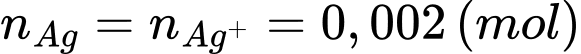
Phần trăm khối lượng của Ag trong hợp kim là
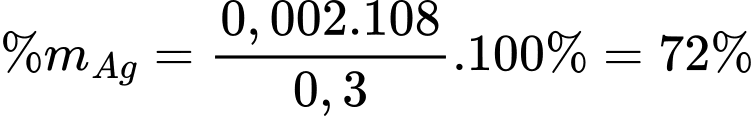
Phân tích các phát biểu:
❌ a) Sai. Mục đích của việc chuẩn độ là xác định hàm lượng bạc trong một hợp kim Ag–Cu nên khi mới xuất hiện kết tủa trắng chỉ chứng tỏ phản ứng đã xảy ra (phản ứng số 1). Lượng bạc trong hợp kim chính là lượng bạc đã phản ứng nên phải đợi phản ứng (1) xảy ra hết, khi đó tiếp tục xảy ra phản ứng (2), xuất hiện dung dịch đỏ máu thì mới dừng chuẩn độ.
✔️ b) Đúng. Phần trăm khối lượng của Ag trong hợp kim là 72,00 %.
❌ c) Sai. Khi cho OH- vào, môi trường trở nên base hơn sẽ kết hợp với Fe3+ tạo kết tủa Fe(OH)3: Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3, làm mất đi thuốc thử ion Fe3+ tự do, không còn thuốc thử để nhận biết lượng Ag đã phản ứng hết.
✔️ d) Đúng. AgSCN là dạng kết tủa bền với độ tan rất nhỏ nên được ưu tiên hình thành trước [Fe(SCN)]2+ nên anion SCN– kết hợp với cation Ag+ tạo hợp chất bền hơn khi kết hợp với cation Fe3+.
Fe3+ + SCN- → Fe[SCN]2+ (màu đỏ máu) (2)
Số mol của KSCN là: 0,02 . 0,1 = 0,002 (mol)
Từ PTHH (1) số mol của Ag là
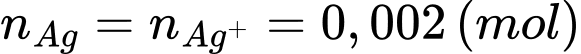
Phần trăm khối lượng của Ag trong hợp kim là
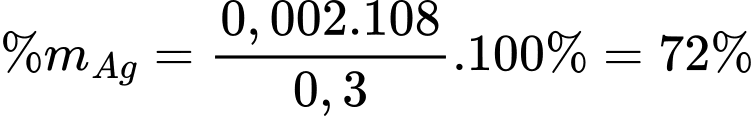
Phân tích các phát biểu:
❌ a) Sai. Mục đích của việc chuẩn độ là xác định hàm lượng bạc trong một hợp kim Ag–Cu nên khi mới xuất hiện kết tủa trắng chỉ chứng tỏ phản ứng đã xảy ra (phản ứng số 1). Lượng bạc trong hợp kim chính là lượng bạc đã phản ứng nên phải đợi phản ứng (1) xảy ra hết, khi đó tiếp tục xảy ra phản ứng (2), xuất hiện dung dịch đỏ máu thì mới dừng chuẩn độ.
✔️ b) Đúng. Phần trăm khối lượng của Ag trong hợp kim là 72,00 %.
❌ c) Sai. Khi cho OH- vào, môi trường trở nên base hơn sẽ kết hợp với Fe3+ tạo kết tủa Fe(OH)3: Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3, làm mất đi thuốc thử ion Fe3+ tự do, không còn thuốc thử để nhận biết lượng Ag đã phản ứng hết.
✔️ d) Đúng. AgSCN là dạng kết tủa bền với độ tan rất nhỏ nên được ưu tiên hình thành trước [Fe(SCN)]2+ nên anion SCN– kết hợp với cation Ag+ tạo hợp chất bền hơn khi kết hợp với cation Fe3+.
Câu 20 [703933]: Hình dưới đây cho thấy phổ khối của một hợp chất ketone pentan-3-one. Biết rằng trong quá trình đo phổ khối, một số phân tử ketone bị phá vỡ sẽ tạo thành các phân mảnh.
Các phân mảnh cũng được hiển thị tín hiệu tương ứng trên phổ khối.

Các phân mảnh cũng được hiển thị tín hiệu tương ứng trên phổ khối.

Phân tích các phát biểu:
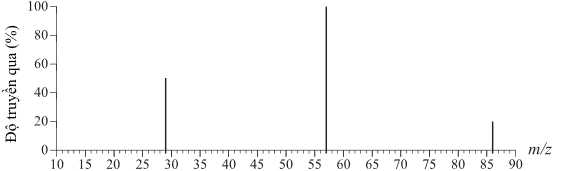
❌ a) Sai. Từ công thức cấu tạo trên biết được công thức phân tử là C5H10O nên phân tử khối bằng 86. Hoặc dựa vào phổ khối lượng MS thấy xuất hiện peak có giá trị cao nhất là 86 nên phân tử khối của hợp chất là 86.
✔️ b) Đúng. Trong quá trình đo, pentan-3-one sẽ bị phân cắt tạo ra các mảnh nhỏ. MC2H5 = 29 (g/mol)
❌ c) Sai. Khi phá vỡ liên kết (1) sẽ hình thành 2 mảnh là [CH3]+ và [C2H5COCH2]+ với tín hiệu 15 và 71.
Khi phá vỡ liên kết (2) smới hình thành 2 mảnh là [C2H5]+ và [COC2H5]+ với tín hiệu 29 và 57.
❌ d) Sai. Mảnh có giá trị m/z lớn nhất mới ứng với mảnh ion phân tử [M+] và có giá trị bằng phân tử khối của chất nghiên cứu.
❌ a) Sai. Từ công thức cấu tạo trên biết được công thức phân tử là C5H10O nên phân tử khối bằng 86. Hoặc dựa vào phổ khối lượng MS thấy xuất hiện peak có giá trị cao nhất là 86 nên phân tử khối của hợp chất là 86.
✔️ b) Đúng. Trong quá trình đo, pentan-3-one sẽ bị phân cắt tạo ra các mảnh nhỏ. MC2H5 = 29 (g/mol)
❌ c) Sai. Khi phá vỡ liên kết (1) sẽ hình thành 2 mảnh là [CH3]+ và [C2H5COCH2]+ với tín hiệu 15 và 71.
Khi phá vỡ liên kết (2) smới hình thành 2 mảnh là [C2H5]+ và [COC2H5]+ với tín hiệu 29 và 57.
❌ d) Sai. Mảnh có giá trị m/z lớn nhất mới ứng với mảnh ion phân tử [M+] và có giá trị bằng phân tử khối của chất nghiên cứu.
Câu 21 [703934]: Tinh thể ion là một hợp chất ion kết tinh. Chúng là chất rắn bao gồm các ion liên kết với nhau bằng lực hút tĩnh điện thành một mạng tinh thể đều đặn. Cấu trúc tinh thể của một hợp chất được tạo thành từ cation M và anion X được thể hiện như hình bên.

Phân tích các phát biểu:
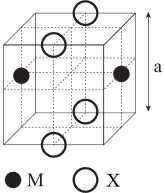
✔️ a) Đúng. Mỗi quả cầu của cation M sẽ thuộc về hai ô mạng cơ sở khác nhau.
✔️ b) Đúng. Số quả cầu M có trong 1 ô mạng là: 1/2 . 2 = 1
Số quả cầu X có trong 1 ô mạng là: 1/4 . 4 = 1
⟶ Công thức thực nghiệm của hợp chất là MX.
✔️ c) Đúng. Cation được hình thành do bớt đi electron trong khi anion thì được thêm electron ở bên ngoài nên bán kính của cation M có bán kính nhỏ hơn anion X.
✔️ d) Đúng. Tinh thể hình bên có cấu trúc lập phương như hình sau:
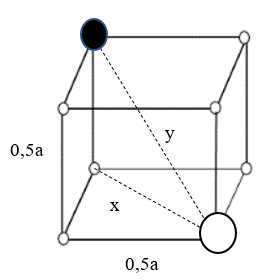
Áp dụng định lí pytago giá trị của x và y lần lượt là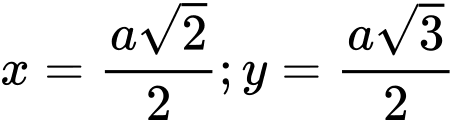
✔️ a) Đúng. Mỗi quả cầu của cation M sẽ thuộc về hai ô mạng cơ sở khác nhau.
✔️ b) Đúng. Số quả cầu M có trong 1 ô mạng là: 1/2 . 2 = 1
Số quả cầu X có trong 1 ô mạng là: 1/4 . 4 = 1
⟶ Công thức thực nghiệm của hợp chất là MX.
✔️ c) Đúng. Cation được hình thành do bớt đi electron trong khi anion thì được thêm electron ở bên ngoài nên bán kính của cation M có bán kính nhỏ hơn anion X.
✔️ d) Đúng. Tinh thể hình bên có cấu trúc lập phương như hình sau:

Áp dụng định lí pytago giá trị của x và y lần lượt là
Câu 22 [703935]: Tiến hành thí nghiệm phản ứng giữa cellulose và nitric acid như sau:
▪ Bước 1: Cho 5 mL dung dịch HNO3 vào cốc thủy tinh ngâm trong chậu nước đá. Thêm từ từ 10 mL dung dịch H2SO4 đặc vào cốc và khuấy đều. Sau đó, lấy cốc ra khỏi chậu nước đá, thêm một nhúm bông vào cốc và dùng đũa thủy tinh ấn bông ngập trong dung dịch.
▪ Bước 2: Ngâm cốc trong chậu nước nóng khoảng 10 phút. Để nguội, lấy sản phẩm thu được ra khỏi cốc, rửa nhiều lần với nước lạnh (đến khi nước rửa không làm đổi màu quỳ tím), sau đó rửa lại bằng dung dịch NaHCO3 loãng.
▪ Bước 3: Cho sản phẩm vào giữa 2 miếng giấy lọc và ép để hút nước, làm khô tự nhiên.
▪ Bước 1: Cho 5 mL dung dịch HNO3 vào cốc thủy tinh ngâm trong chậu nước đá. Thêm từ từ 10 mL dung dịch H2SO4 đặc vào cốc và khuấy đều. Sau đó, lấy cốc ra khỏi chậu nước đá, thêm một nhúm bông vào cốc và dùng đũa thủy tinh ấn bông ngập trong dung dịch.
▪ Bước 2: Ngâm cốc trong chậu nước nóng khoảng 10 phút. Để nguội, lấy sản phẩm thu được ra khỏi cốc, rửa nhiều lần với nước lạnh (đến khi nước rửa không làm đổi màu quỳ tím), sau đó rửa lại bằng dung dịch NaHCO3 loãng.
▪ Bước 3: Cho sản phẩm vào giữa 2 miếng giấy lọc và ép để hút nước, làm khô tự nhiên.
[C6H7O2(OH)3]n + 3nHNO3 ⟶ [C6H7O2(ONO2)3]n + 3nH2O
Phân tích các phát biểu:
✔️ a) Đúng. Có thể sử dụng NaHCO3 loãng để trung hoà acid dư, giúp thu được sản phẩm sạch: HCO3- + H+ ⟶ H2O + CO2
✔️ b) Đúng. H2SO4 đặc đóng vai trò là chất xúc tác.
❌ c) Sai. Không thể thay việc làm khô tự nhiên bằng việc sấy do thuốc súng không khói dễ cháy, nên khi sấy ở nhiệt độ cao có thể gây cháy.
✔️ d) Đúng. Cellulose sẽ bị thủy phân 1 phần trong môi trường acid nên sẽ thu được glucose, phản ứng được với thuốc thử Tollens.
Phân tích các phát biểu:
✔️ a) Đúng. Có thể sử dụng NaHCO3 loãng để trung hoà acid dư, giúp thu được sản phẩm sạch: HCO3- + H+ ⟶ H2O + CO2
✔️ b) Đúng. H2SO4 đặc đóng vai trò là chất xúc tác.
❌ c) Sai. Không thể thay việc làm khô tự nhiên bằng việc sấy do thuốc súng không khói dễ cháy, nên khi sấy ở nhiệt độ cao có thể gây cháy.
✔️ d) Đúng. Cellulose sẽ bị thủy phân 1 phần trong môi trường acid nên sẽ thu được glucose, phản ứng được với thuốc thử Tollens.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [703936]: Một số kim loại chuyển tiếp có trong thành phần của vật liệu siêu dẫn, là vật liệu dẫn điện với điện trở bằng 0 hoặc rất nhỏ. Hợp chất Q là vật liệu siêu dẫn chứa 13,4% Y; 41,2% Ba 28,6% Cu và 16,8% O theo khối lượng. Tổng số nguyên tử trong hợp chất Q là bao nhiêu? Biết nguyên tử khối của Y là 89.
Gọi CTPT của hợp chất Q cần tìm là YxBayCuzOt
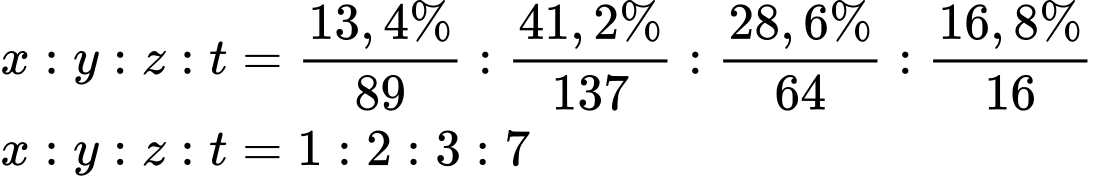
Công thức phân tử của Q là Y1Ba2Cu3O7
⟶ Tổng số nguyên tử là 1 + 2 + 3 + 7 = 13
⇒ Điền đáp án: 13
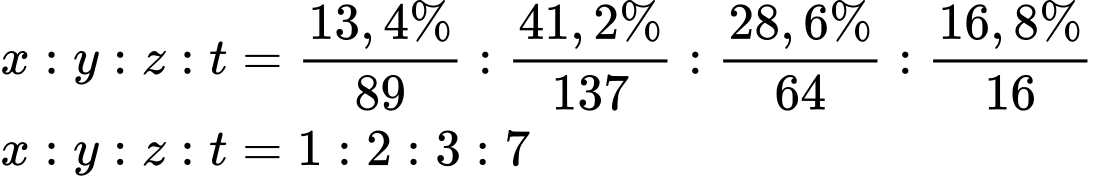
Công thức phân tử của Q là Y1Ba2Cu3O7
⟶ Tổng số nguyên tử là 1 + 2 + 3 + 7 = 13
⇒ Điền đáp án: 13
Câu 24 [703937]: Conidiogene B có nhiều hoạt tính sinh học quan trọng, trong đó Conidiogenone B thể hiện đặc tính kháng khuẩn rõ rệt với chủng Staphylococcus aureus kháng methicillin. Conidiogenone B có công thức cấu tạo như hình bên. Có bao nhiêu nhánh methyl (–CH3) có trong một phân tử Conidiogene B?

Các nhánh methyl có trong phân tử Conidiogene B ở các vị trí như sau:
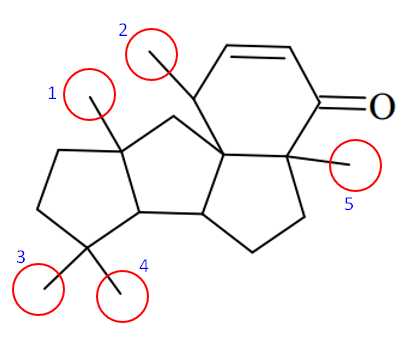
⇒ Điền đáp án: 5

⇒ Điền đáp án: 5
Câu 25 [703938]: Cho các amine có công thức cấu tạo như sau:
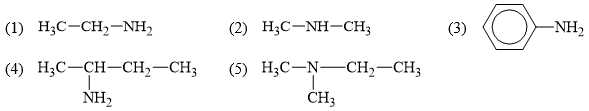
Trong các amine trên, có bao nhiêu amine bậc một?

Trong các amine trên, có bao nhiêu amine bậc một?
Amine bậc một là các amine có nhóm chức dạng –NH2 đính với một gốc hydrocarbon.
Quan sát cấu tạo của các amine, thấy các amine bậc một là (1) (3) (4)
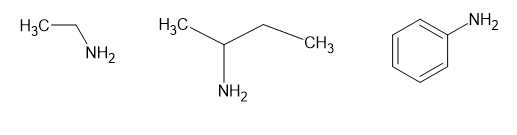
Amine số (2) là bậc hai và amine số (5) là bậc năm.
⇒ Điền đáp án: 3
Quan sát cấu tạo của các amine, thấy các amine bậc một là (1) (3) (4)

Amine số (2) là bậc hai và amine số (5) là bậc năm.
⇒ Điền đáp án: 3
Câu 26 [703939]: Một bạn học sinh tiến hành điều chế xà phòng tại nhà từ dầu thực vật theo các bước trong một quy trình như sau:
(1) Thêm từ từ dung dịch sodium hydroxide vào dầu, khuấy liên tục.
(2) Thu lấy chất rắn nổi bên trên. Rửa hai lần bằng nước cất để loại bỏ NaOH dư và thu lấy sản phẩm.
(3) Sau khoảng 30 phút, hỗn hợp sẽ trở nên đặc và giống như kem. Đổ hỗn hợp vào cốc chứa NaCl bão hòa, để nguội.
(4) Đổ dầu thực vật vào 1 cốc thủy tinh 150 mL, đun cách thủy.
Hãy viết liền các số tương ứng với bốn bước theo đúng trình của quá trình sản xuất xà phòng (ví dụ: 1234, 4213, ...).
(1) Thêm từ từ dung dịch sodium hydroxide vào dầu, khuấy liên tục.
(2) Thu lấy chất rắn nổi bên trên. Rửa hai lần bằng nước cất để loại bỏ NaOH dư và thu lấy sản phẩm.
(3) Sau khoảng 30 phút, hỗn hợp sẽ trở nên đặc và giống như kem. Đổ hỗn hợp vào cốc chứa NaCl bão hòa, để nguội.
(4) Đổ dầu thực vật vào 1 cốc thủy tinh 150 mL, đun cách thủy.
Hãy viết liền các số tương ứng với bốn bước theo đúng trình của quá trình sản xuất xà phòng (ví dụ: 1234, 4213, ...).
Quy trình điều chế xà phòng:
▫️ Bước 1: Đổ dầu thực vật vào 1 cốc thủy tinh 150 mL, đun cách thủy. → Ứng với (4).
▫️ Bước 2: Thêm từ từ dung dịch sodium hydroxide vào dầu, khuấy đều liên tục. → Ứng với (1).
▫️ Bước 3: Sau 30 phút, hỗn hợp sẽ trở lên đặc và giống như kem. Đổ hỗn hợp vào cốc chứa NaCl bão hòa, để nguội. → Ứng với (3).
▫️ Bước 4: Thu lấy chất rắn nổi bên trên. Rửa hai lần bằng nước cất để loại bỏ NaOH dư và thu lấy sản phẩm. → Ứng với (2).
⇒ Điền đáp án: 4132
▫️ Bước 1: Đổ dầu thực vật vào 1 cốc thủy tinh 150 mL, đun cách thủy. → Ứng với (4).
▫️ Bước 2: Thêm từ từ dung dịch sodium hydroxide vào dầu, khuấy đều liên tục. → Ứng với (1).
▫️ Bước 3: Sau 30 phút, hỗn hợp sẽ trở lên đặc và giống như kem. Đổ hỗn hợp vào cốc chứa NaCl bão hòa, để nguội. → Ứng với (3).
▫️ Bước 4: Thu lấy chất rắn nổi bên trên. Rửa hai lần bằng nước cất để loại bỏ NaOH dư và thu lấy sản phẩm. → Ứng với (2).
⇒ Điền đáp án: 4132
Câu 27 [703940]: Trinitroglycerin, C3H5N3O9 (thường được gọi đơn giản là nitroglycerin), đã được sử dụng rộng rãi như một chất nổ. Alfred Nobel đã sử dụng nó để chế tạo thuốc nổ vào năm 1866. Đáng ngạc nhiên hơn, nó cũng được sử dụng như một loại thuốc để làm giảm đau thắt ngực (đau ngực do động mạch đến tim bị tắc một phần) bằng cách giãn mạch máu. Ở điều kiện chuẩn, nhiệt phân hủy trinitroglycerin để tạo thành khí nitrogen, khí carbon dioxide, nước lỏng và khí oxygen là –1541,4 kJ/mol. Khi phân hủy một liều lượng chuẩn của trinitroglycerin để làm giảm đau thắt ngực là 0,60 mg thì giải phóng bao nhiêu năng lượng?
Phân hủy 1 mol trinitroglycerin giải phóng 1541,4 kJ/mol
Năng lượng giải phóng khi phân giải 0,6mg trinitroglycerin là:
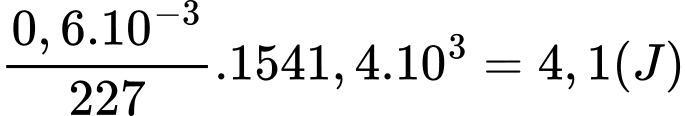
⇒ Điền đáp án: 4,1
Năng lượng giải phóng khi phân giải 0,6mg trinitroglycerin là:
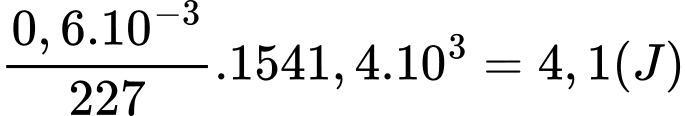
⇒ Điền đáp án: 4,1
Câu 28 [703941]: Một trong các phương pháp dùng để loại bỏ sắt (iron, Fe) trong nguồn nước nhiễm sắt (iron) là sử dụng lượng vôi tôi vừa đủ để tăng pH của nước nhằm kết tủa ion sắt khi có mặt oxygen, theo sơ đồ phản ứng:
(1) Fe3+ + OH– Fe(OH)3
Fe(OH)3
(2) Fe2+ + OH– + O2 + H2O Fe(OH)3
Fe(OH)3
Một mẫu nước có hàm lượng sắt cao gấp 42 lần so với ngưỡng cho phép quy định là 0,30 mg/L (theo QCVN 01-1:2018/BYT). Giả thiết sắt trong mẫu nước trên chỉ tồn tại ở hai dạng là Fe3+ và Fe2+ với tỉ lệ mol Fe3+: Fe2+ = 1: 3. Cần tối thiểu V lít dung dịch Ca(OH)2 0,01 M để kết tủa hoàn toàn lượng sắt trong 20 m3 mẫu nước trên. Giá trị của V là bao nhiêu (làm tròn kết quả đến phần nguyên)?
(1) Fe3+ + OH–
 Fe(OH)3
Fe(OH)3(2) Fe2+ + OH– + O2 + H2O
 Fe(OH)3
Fe(OH)3Một mẫu nước có hàm lượng sắt cao gấp 42 lần so với ngưỡng cho phép quy định là 0,30 mg/L (theo QCVN 01-1:2018/BYT). Giả thiết sắt trong mẫu nước trên chỉ tồn tại ở hai dạng là Fe3+ và Fe2+ với tỉ lệ mol Fe3+: Fe2+ = 1: 3. Cần tối thiểu V lít dung dịch Ca(OH)2 0,01 M để kết tủa hoàn toàn lượng sắt trong 20 m3 mẫu nước trên. Giá trị của V là bao nhiêu (làm tròn kết quả đến phần nguyên)?
(1) Fe3+ + 3OH- ⟶ Fe(OH)3
(2) 4Fe2+ + 8OH- + O2 + 2H2O ⟶ 4Fe(OH)3
Đổi 20 m3 = 20000 L
Hàm lượng sắt trong mẫu nước là 42.0,3 = 12,6 (mg/L)
Khối lượng sắt có trong mẫu nước là 12,6.10-3.20000 = 252 (gam)
Tổng mol của ion sắt là 252/56 = 4,5 (mol)
Đặt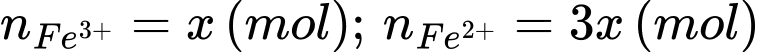
Tổng mol của ion sắt là: x + 3x = 252/56 = 4,5 (mol) → x = 1,125 (mol)
Từ PTHH (1) và (2) số mol của Ca(OH)2 phản ứng là:
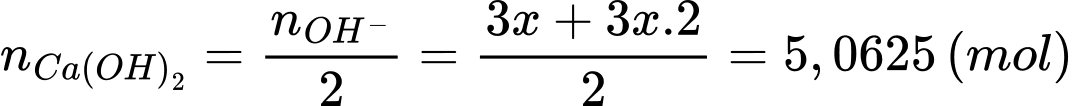
Thể tích dung dịch Ca(OH)2 tối thiểu cần dùng là: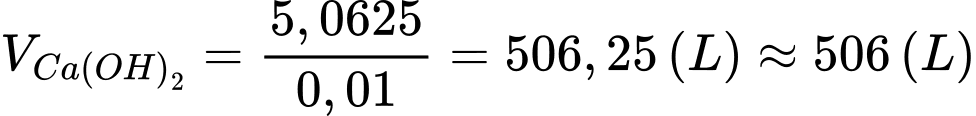
⇒ Điền đáp án: 506
(2) 4Fe2+ + 8OH- + O2 + 2H2O ⟶ 4Fe(OH)3
Đổi 20 m3 = 20000 L
Hàm lượng sắt trong mẫu nước là 42.0,3 = 12,6 (mg/L)
Khối lượng sắt có trong mẫu nước là 12,6.10-3.20000 = 252 (gam)
Tổng mol của ion sắt là 252/56 = 4,5 (mol)
Đặt
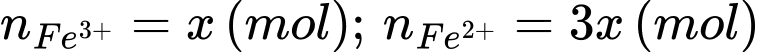
Tổng mol của ion sắt là: x + 3x = 252/56 = 4,5 (mol) → x = 1,125 (mol)
Từ PTHH (1) và (2) số mol của Ca(OH)2 phản ứng là:
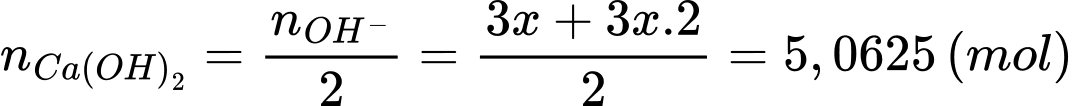
Thể tích dung dịch Ca(OH)2 tối thiểu cần dùng là:
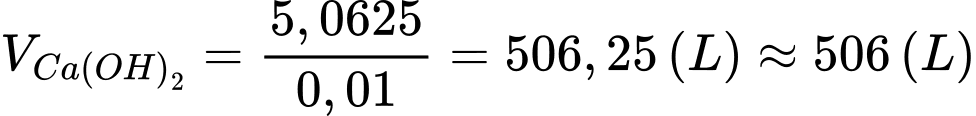
⇒ Điền đáp án: 506