PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [703942]: “Ăn mòn điện hoá là quá trình ăn mòn …(1)… do sự tạo thành …(2)…”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, hợp kim, dòng điện.
B, kim loại, môi trường điện li.
C, phi kim, dung dịch acid.
D, kim loại, pin điện hoá.
Ăn mòn điện hóa là quá trình phá hủy kim loại hoặc hợp kim do phản ứng điện hóa xảy ra khi kim loại tiếp xúc với môi trường dẫn điện (như dung dịch chất điện ly). Quá trình này xảy ra khi có sự tạo thành pin điện hóa.
⇒ Ăn mòn điện hoá là quá trình ăn mòn kim loại do sự tạo thành pin điện hoá.
⇒ Chọn đáp án D Đáp án: D
⇒ Ăn mòn điện hoá là quá trình ăn mòn kim loại do sự tạo thành pin điện hoá.
⇒ Chọn đáp án D Đáp án: D
Câu 2 [59858]: Công thức chung của oxide kim loại thuộc nhóm IA là
A, R2O3.
B, RO2.
C, R2O.
D, RO.
HD Kim loại thuộc nhóm IA có 1 electron ở lớp ngoài cùng → Oxide kim loại thuộc nhóm IA là R2O
→ Chọn đáp án C
Đáp án: C
→ Chọn đáp án C
Đáp án: C
Câu 3 [309480]: Trong thành phần hóa học của polymer nào sau đây không có nguyên tố oxygen?
A, Tơ nylon-7.
B, Tơ nylon-6.
C, Tơ olon.
D, Tơ nylon-6,6.
Các tơ nylon đều là polyamide ⇒ chứa liên kết CO-NH ⇒ chứa O
⇒ Tơ olon không chứa nguyên tố oxygen.
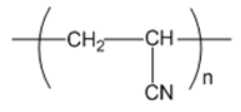
⇒ Chọn đáp án C Đáp án: C
⇒ Tơ olon không chứa nguyên tố oxygen.

⇒ Chọn đáp án C Đáp án: C
Câu 4 [560601]: Sự giống nhau giữa liên kết kim loại và liên kết ion là đều có
A, các cation kim loại.
B, các anion.
C, các electron.
D, tương tác tĩnh điện.
So sánh liên kết ion và liên kết kim loại:
★ Giống nhau: đều có tương tác tĩnh điện hình thành giữa điện tích âm và điện tích dương.
★ Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu: anion(-) và phần dương do cation kim loại hoặc NH4+ tạo thành.
+ Liên kết kim loại: do các electron tự do trong kim loại và cation kim loại.
⇒ Chọn đáp án D Đáp án: D
★ Giống nhau: đều có tương tác tĩnh điện hình thành giữa điện tích âm và điện tích dương.
★ Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu: anion(-) và phần dương do cation kim loại hoặc NH4+ tạo thành.
+ Liên kết kim loại: do các electron tự do trong kim loại và cation kim loại.
⇒ Chọn đáp án D Đáp án: D
Câu 5 [703943]: Trong cơ thể người, sự thiếu hụt nguyên tố nào sau đây có thể gây ra bệnh loãng xương?
A, Barium.
B, Magnesium.
C, Beryllium.
D, Calcium.
Canlcium là thành phần chính của xương và răng, đóng vai trò quan trọng trong việc duy trì cấu trúc xương nên sự thiếu hụt canlcium (Ca) trong cơ thể có thể gây ra bệnh loãng xương.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 6 [679600]: Dung dịch nào sau đây được dùng để xử lí lớp cặn CaCO3 bám vào ấm đun nước?
A, Muối ăn.
B, Cồn.
C, Nước vôi trong.
D, Giấm ăn.
HD: Giấm ăn chứa acetic acid: CH3COOH có khả năng hoà tan CaCO3 (thêm nữa là ấm nước dùng để sinh hoạt ăn uống nên cần hoá chất an toàn với sức khoẻ chúng ta, dùng giấm ăn hoặc chanh,... là hợp lý nhất).
Phản ứng xảy ra: 2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ + H2O.
⇒ Chọn đáp án D Đáp án: D
Phản ứng xảy ra: 2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ + H2O.
⇒ Chọn đáp án D Đáp án: D
Câu 7 [703944]: Chất nào sau đây thuộc loại chất điện li yếu?
A, Saccharose C12H22O11.
B, Ethanol C2H5OH.
C, Dimethylamine (CH3)2NH.
D, Sodium hydroxide NaOH.
Hai chất saccharose C12H22O11 và ethanol C2H5OH là hai chất không điện li.
NaOH là một base mạnh, phân li hoàn toàn ra OH- nên là chất điện li mạnh.
Dimethylamine (CH3)2NH là một base yếu nên điện li yếu.
⇒ Chọn đáp án C Đáp án: C
NaOH là một base mạnh, phân li hoàn toàn ra OH- nên là chất điện li mạnh.
Dimethylamine (CH3)2NH là một base yếu nên điện li yếu.
⇒ Chọn đáp án C Đáp án: C
Câu 8 [303862]: Công thức biểu diễn nào sau đây là của một ester?
A, 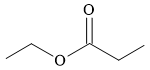

B, 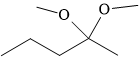

C, 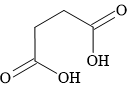

D, 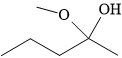

HD: Phân tích chi tiết cấu tạo các chất:
⇒ A là một ester, còn lại không phải.
⟹ Chọn đáp án A Đáp án: A

⇒ A là một ester, còn lại không phải.
⟹ Chọn đáp án A Đáp án: A
Câu 9 [304796]: Ester X được tạo bởi methyl alcohol và formic acid. Công thức của X là
A, HCOOC2H5.
B, HCOOCH3.
C, CH3COOC2H5.
D, CH3COOCH3.
Ester X được tạo bởi methyl alcohol và formic acid:
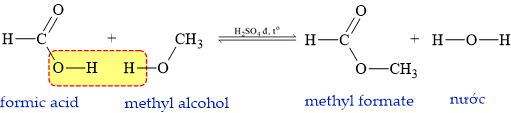
⟹ X là methyl formate có cấu tạo rút gọn là HCOOCH3
⟹ Chọn đáp án B Đáp án: B

⟹ X là methyl formate có cấu tạo rút gọn là HCOOCH3
⟹ Chọn đáp án B Đáp án: B
Câu 10 [703945]: Quy trình tái chế một kim loại thông dụng để đựng đồ uống được thực hiện như sau:
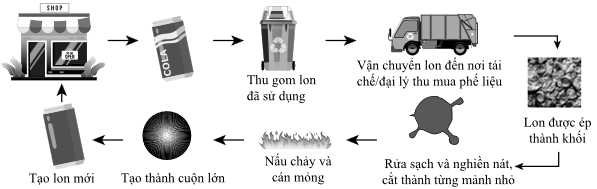
Phát biểu nào sau đây về quy trình trên đúng?

Phát biểu nào sau đây về quy trình trên đúng?
A, Kim loại được tái chế trong quy trình có thể là nhôm (aluminium).
B, Rửa sạch nguyên liệu trước khi nóng chảy giúp loại lớp sơn trên vỏ, lon.
C, Trong quá trình tái chế có sử dụng phương pháp nhiệt luyện.
D, Các giai đoạn của quy trình không làm phát thải khí gây hiệu ứng nhà kính.
Phân tích các phát biểu:
✔️ A. Đúng. Nhôm là một trong những kim loại phổ biến được dùng để sản xuất lon đồ uống nhờ nhẹ, bền và khả năng tái chế cao. Trong thực tế, nhôm từ vỏ lon đồ uống thường được tái chế để sản xuất lon mới.
❌ B. Sai. Rửa sạch trước khi nóng chảy thường chỉ nhằm loại bỏ bụi bẩn, dầu mỡ, hoặc tạp chất bề mặt. Lớp sơn hoặc lớp phủ trên lon nhôm thường được loại bỏ thông qua quá trình đốt cháy hoặc nhiệt phân trong lò nung, không phải trong bước rửa.
❌ C. Sai. Quá trình tái chế nhôm là nóng chảy nhôm phế liệu ở nhiệt độ cao và đúc lại chứ không phải nhiệt luyện.
❌ D. Sai. Quá trình tái chế nhôm, đặc biệt là giai đoạn nóng chảy, tiêu tốn năng lượng và có thể phát thải khí nhà kính như C gây hiệu ứng nhà kính.
⇒ Chọn đáp án A Đáp án: A
✔️ A. Đúng. Nhôm là một trong những kim loại phổ biến được dùng để sản xuất lon đồ uống nhờ nhẹ, bền và khả năng tái chế cao. Trong thực tế, nhôm từ vỏ lon đồ uống thường được tái chế để sản xuất lon mới.
❌ B. Sai. Rửa sạch trước khi nóng chảy thường chỉ nhằm loại bỏ bụi bẩn, dầu mỡ, hoặc tạp chất bề mặt. Lớp sơn hoặc lớp phủ trên lon nhôm thường được loại bỏ thông qua quá trình đốt cháy hoặc nhiệt phân trong lò nung, không phải trong bước rửa.
❌ C. Sai. Quá trình tái chế nhôm là nóng chảy nhôm phế liệu ở nhiệt độ cao và đúc lại chứ không phải nhiệt luyện.
❌ D. Sai. Quá trình tái chế nhôm, đặc biệt là giai đoạn nóng chảy, tiêu tốn năng lượng và có thể phát thải khí nhà kính như C gây hiệu ứng nhà kính.
⇒ Chọn đáp án A Đáp án: A
Câu 11 [703946]: Khi bón phân kali, ion K+ sẽ đẩy các ion Ca2+; Mg2+ ra khỏi keo đất, do đó bón lâu ngày, nhất là khi bón lượng nhiều thì dễ làm cho đất bị
A, chua.
B, phèn.
C, cứng.
D, khô.
Đất ít chua hay không chua, khi bón phân kali vào thì ion K+ sẽ đẩy Ca2+, Mg2+ ra khỏi keo đất, do đó bón lâu ngày, nhất là khi bón lượng nhiều thì dễ làm cho đất bị chua hóa. Vậy nên phải bón vôi khử chua, bổ sung Ca2+, Mg2+ cho đất.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 12 [703947]: Trypsin là một loại enzyme có trong phần đầu tiên của ruột non, bắt đầu quá trình tiêu hóa các phân tử protein bằng cách cắt các chuỗi dài amino acid thành các mảnh nhỏ hơn. Một điểm đặc biệt là trypsin cắt các amino acid một cách có chọn lọc, cắt đứt liên kết CO–NH (với phần carbonyl thuộc về amino acid Arg hoặc Lys).
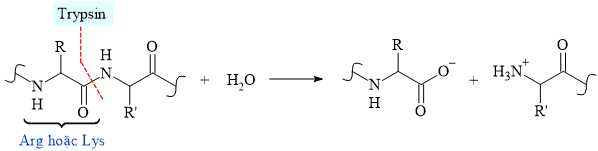
Cho chuỗi amino acid sau: Thr–Pro–Lys–Glu–His–Gly–Phe–Cys–Trp–Val–Val–Phe.
Tiến hành cắt đứt chuỗi amino acid bằng enzyme trypsin thì sản phẩm thu được có thể là

Cho chuỗi amino acid sau: Thr–Pro–Lys–Glu–His–Gly–Phe–Cys–Trp–Val–Val–Phe.
Tiến hành cắt đứt chuỗi amino acid bằng enzyme trypsin thì sản phẩm thu được có thể là
A, Thr–Pro và Lys–Glu–His–Gly–Phe–Cys–Trp–Val–Val–Phe.
B, Thr–Pro–Lys–Glu–His–Gly–Phe–Cys–Trp và Val–Val–Phe.
C, Thr–Pro–Lys và Glu–His–Gly–Phe–Cys–Trp–Val–Val–Phe.
D, Thr–Pro–Lys–Glu–His và Gly–Phe–Cys–Trp–Val–Val–Phe.
Khi tiến hành cắt đứt chuỗi amino acid bằng enzyme trypsin thì trypsin cắt các amino acid một cách có chọn lọc, nó sẽ cắt đứt liên kết CO–NH với phần carbonyl thuộc về amino acid Arg hoặc Lys nên quá trình cắt đứt xảy ra như sau:
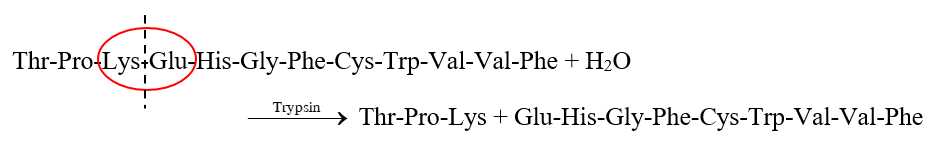
Sản phẩm thu được là Thr–Pro–Lys và Glu–His–Gly–Phe–Cys–Trp–Val–Val–Phe
⇒ Chọn đáp án C Đáp án: C
Sản phẩm thu được là Thr–Pro–Lys và Glu–His–Gly–Phe–Cys–Trp–Val–Val–Phe
⇒ Chọn đáp án C Đáp án: C
Câu 13 [308354]: Saccharose là một loại disaccharide có nhiều trong cây mía, hoa thốt nốt, củ cải đường. Công thức phân tử của saccharose là
A, C6H12O6.
B, C12H22O11.
C, (C6H10O5)n.
D, C2H4O2.
HD: ► Bộ ba công thức phân tử của nhóm chất carbohydrate cần nhớ trong chương trình THPT:
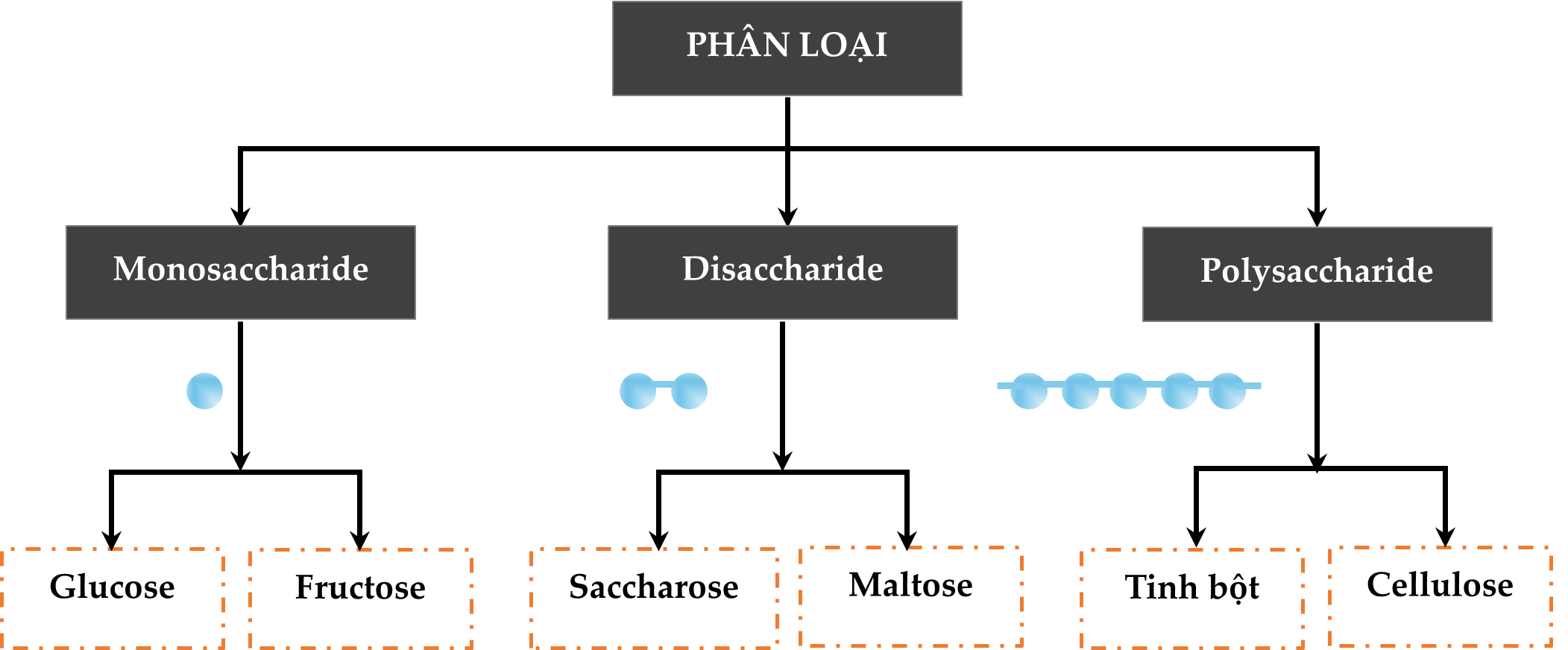
• Fructose và glucose: C6H12O6 (M = 180).
• maltose và saccharose: C12H22O11 (M = 342).
• tinh bột và celllulose: (C6H10O5)n (M = 162n).
⇒ trả lời: Công thức phân tử của saccharose là C12H22O11
⇝ Chọn đáp án B Đáp án: B

• Fructose và glucose: C6H12O6 (M = 180).
• maltose và saccharose: C12H22O11 (M = 342).
• tinh bột và celllulose: (C6H10O5)n (M = 162n).
⇒ trả lời: Công thức phân tử của saccharose là C12H22O11
⇝ Chọn đáp án B Đáp án: B
Câu 14 [703948]: Amine nào sau đây là amine bậc một?
A, 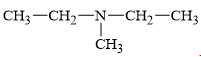
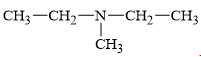
B, 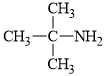

C, 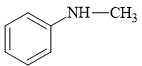

D, 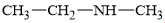
Xét các amine:
A. Amine có nhóm chức dạng ≡N đính với ba gốc hydrocarbon nên đây là amine bậc ba.
B. Amine có nhóm chức dạng –NH2 đính với một gốc hydrocarbon nên đây là amine bậc một.
C; D. 2 amine có nhóm chức dạng –NH– đính với hai gốc hydrocarbon nên đây là hai amine bậc hai.
⇒ Chọn đáp án B Đáp án: B
A. Amine có nhóm chức dạng ≡N đính với ba gốc hydrocarbon nên đây là amine bậc ba.
B. Amine có nhóm chức dạng –NH2 đính với một gốc hydrocarbon nên đây là amine bậc một.
C; D. 2 amine có nhóm chức dạng –NH– đính với hai gốc hydrocarbon nên đây là hai amine bậc hai.
⇒ Chọn đáp án B Đáp án: B
Câu 15 [703949]: Phản ứng của ethylene với H2O tạo thành ethanol như sau:
CH2=CH2 + H2O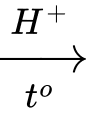 CH3–CH2–OH
CH3–CH2–OH
Phản ứng của ethylene với nước được xúc tác bằng acid. Phản ứng xảy ra theo cơ chế như sau:
▪ Bước 1: Quá trình proton hoá liên kết đôi C=C của ethylene tạo thành carbocation.
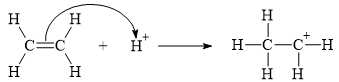
▪ Bước 2: Quá trình nước cộng hợp vào carbocation.
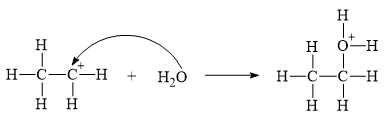
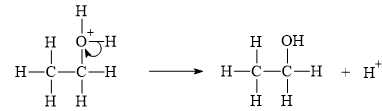
▪ Bước 3: Quá trình tách proton để tạo ra alcohol.
Trong các phát biểu sau:
(a) Trong giai đoạn 1 có sự phá vỡ liên kết π.
(b) Trong giai đoạn 2, số liên kết σ tăng thêm 1.
(c) Trong giai đoạn 3, sự tách proton tạo alcohol là tách ion H+.
(d) Trong phẩn tử sản phẩm ethanol có 6 liên kết σ.
(e) Sau phản ứng, một C nối đôi nhận nhận một H và C nối đôi còn lại sẽ nhận một nhóm OH.
Số phát biểu đúng là
CH2=CH2 + H2O
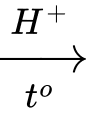 CH3–CH2–OH
CH3–CH2–OHPhản ứng của ethylene với nước được xúc tác bằng acid. Phản ứng xảy ra theo cơ chế như sau:
▪ Bước 1: Quá trình proton hoá liên kết đôi C=C của ethylene tạo thành carbocation.

▪ Bước 2: Quá trình nước cộng hợp vào carbocation.

▪ Bước 3: Quá trình tách proton để tạo ra alcohol.

Trong các phát biểu sau:
(a) Trong giai đoạn 1 có sự phá vỡ liên kết π.
(b) Trong giai đoạn 2, số liên kết σ tăng thêm 1.
(c) Trong giai đoạn 3, sự tách proton tạo alcohol là tách ion H+.
(d) Trong phẩn tử sản phẩm ethanol có 6 liên kết σ.
(e) Sau phản ứng, một C nối đôi nhận nhận một H và C nối đôi còn lại sẽ nhận một nhóm OH.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
✔️ (a) Đúng. Trong giai đoạn 1 có sự phá vỡ liên kết π ở liên kết đôi C=C.
❌ (b) Sai. Trong giai đoạn 2, số liên kết σ ở chất đầu là 6, ở sản phẩm là 9 nên đã tăng thêm 3.
✔️ (c) Đúng. Trong giai đoạn 3, sự tách proton tạo alcohol là tách ion H+.
❌ (d) Sai. Trong phân tử sản phẩm ethanol có 8 liên kết σ.
✔️ (e) Đúng. Sau phản ứng, một C nối đôi nhận một H và C nối đôi còn lại sẽ nhận một nhóm OH.
Các phát biểu đúng là (a) (c) (e)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Trong giai đoạn 1 có sự phá vỡ liên kết π ở liên kết đôi C=C.
❌ (b) Sai. Trong giai đoạn 2, số liên kết σ ở chất đầu là 6, ở sản phẩm là 9 nên đã tăng thêm 3.
✔️ (c) Đúng. Trong giai đoạn 3, sự tách proton tạo alcohol là tách ion H+.
❌ (d) Sai. Trong phân tử sản phẩm ethanol có 8 liên kết σ.
✔️ (e) Đúng. Sau phản ứng, một C nối đôi nhận một H và C nối đôi còn lại sẽ nhận một nhóm OH.
Các phát biểu đúng là (a) (c) (e)
⇒ Chọn đáp án C Đáp án: C
Câu 16 [703950]: “Các amino acid có khả năng di chuyển khác nhau trong …(1)… tuỳ thuộc vào …(2)… của môi trường”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, điện trường, pH.
B, dung dịch, nồng độ.
C, điện trường, nồng độ.
D, dung dịch, pH.
Các amino acid tồn tại ở dạng ion lưỡng cực nên khi đặt trong điện trường (như trong kỹ thuật điện di), các amino acid di chuyển về phía cực âm hoặc cực dương tùy thuộc vào điện tích của chúng trong môi trường. Điện tích của một amino acid phụ thuộc vào pH của môi trường:
⋆ Ở pH < (điểm đẳng điện): Amino acid mang điện tích dương (cation) và di chuyển về cực âm.
⋆ Ở pH > : Amino acid mang điện tích âm (anion) và di chuyển về cực dương.
⋆ Ở pH = : Amino acid trung hòa về điện tích, không di chuyển trong điện trường.
⇒ Các amino acid có khả năng di chuyển khác nhau trong điện trường tuỳ thuộc vào pH của môi trường.
⇒ Chọn đáp án A Đáp án: A
⋆ Ở pH < (điểm đẳng điện): Amino acid mang điện tích dương (cation) và di chuyển về cực âm.
⋆ Ở pH > : Amino acid mang điện tích âm (anion) và di chuyển về cực dương.
⋆ Ở pH = : Amino acid trung hòa về điện tích, không di chuyển trong điện trường.
⇒ Các amino acid có khả năng di chuyển khác nhau trong điện trường tuỳ thuộc vào pH của môi trường.
⇒ Chọn đáp án A Đáp án: A
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Cho bảng giá trị năng lượng liên kết trung bình sau:
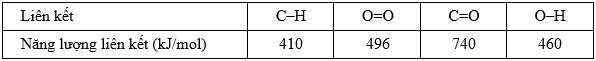

Câu 17 [703951]: Tổng năng lượng cần thiết để phá vỡ liên kết trong 1 mol phân tử CH4 là
A, 410 kJ.
B, 820 kJ.
C, 205 kJ.
D, 1640 kJ.
Công thức cấu tạo của CH4 như sau:
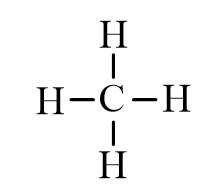
Trong phân tử có 4 liên kết C-H nên năng lượng cần thiết phá vỡ liên kết trong CH4 là: 410 x 4 = 1640 (kJ)
⇒ Chọn đáp án D Đáp án: D

Trong phân tử có 4 liên kết C-H nên năng lượng cần thiết phá vỡ liên kết trong CH4 là: 410 x 4 = 1640 (kJ)
⇒ Chọn đáp án D Đáp án: D
Câu 18 [703952]: Tính biến thiên enthalpy của phản ứng sau:
CH4(g) + 2O2(g) CO2(g) + 2H2O(g).
CO2(g) + 2H2O(g).
CH4(g) + 2O2(g)
 CO2(g) + 2H2O(g).
CO2(g) + 2H2O(g). A, –688 kJ/mol.
B, +688 kJ/mol.
C, –344 kJ/mol.
D, +344 kJ/mol.
CH4(g) + O2(g)  CO2(g) + 2H2O
CO2(g) + 2H2O
Biến thiên enthalpy của phản ứng là
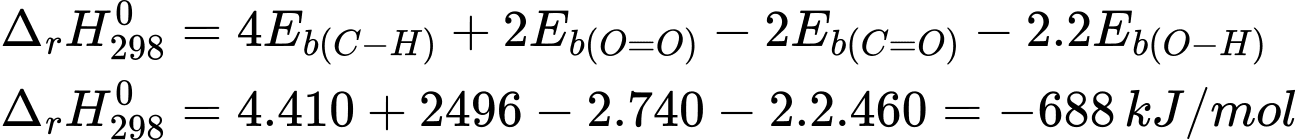
⇒ Chọn đáp án A Đáp án: A
 CO2(g) + 2H2O
CO2(g) + 2H2OBiến thiên enthalpy của phản ứng là
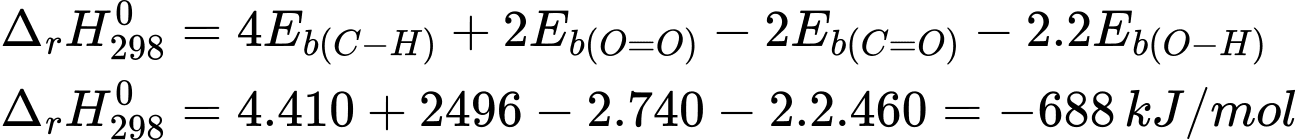
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [703953]: Phản ứng giữa potassium permanganate (KMnO4) và iron(II) sulfate (FeSO4) được acid hóa là phản ứng oxy hóa khử diễn ra như sau:
8H+(aq) + 5Fe2+(aq) + MnO4–(aq) Mn2+(aq) + 5Fe3+(aq) + 4H2O(l)
Mn2+(aq) + 5Fe3+(aq) + 4H2O(l)
Một dung dịch KMnO4 0,20 M được đặt trong buret để chuẩn độ 50,00 mL dung dịch FeSO4 có nồng độ chưa biết trong một bình tam giác. Bảng sau đây mô tả màu sắc của các ion khác nhau trong dung dịch:
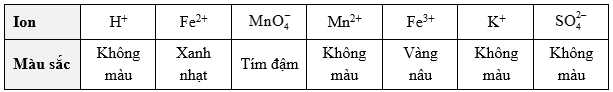
Kết thúc chuẩn độ thì thể tích dung dịch KMnO4 0,20 M đã sử dụng là 12,5 mL.
8H+(aq) + 5Fe2+(aq) + MnO4–(aq)
 Mn2+(aq) + 5Fe3+(aq) + 4H2O(l)
Mn2+(aq) + 5Fe3+(aq) + 4H2O(l)Một dung dịch KMnO4 0,20 M được đặt trong buret để chuẩn độ 50,00 mL dung dịch FeSO4 có nồng độ chưa biết trong một bình tam giác. Bảng sau đây mô tả màu sắc của các ion khác nhau trong dung dịch:

Kết thúc chuẩn độ thì thể tích dung dịch KMnO4 0,20 M đã sử dụng là 12,5 mL.
Đổi 12,5 mL = 0,0125 L; 50 mL = 0,05 L
10FeSO4 + 2KMnO4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol của KMnO4 là 0,0125.0,2 = 0,0025 (mol)
Từ PTHH số mol FeSO4 phản ứng là 0,0125 (mol) →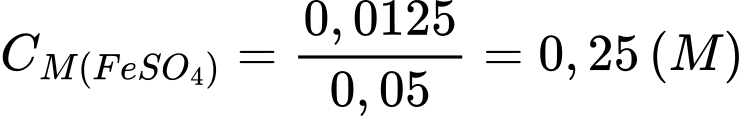
Phân tích các phát biểu:
✔️ a) Đúng. Nồng độ dung dịch FeSO4 trong bình tam giác là 0,25 M.
❌ b) Sai. Tại điểm tương đương, dung dịch chứa các ion Fe3+, Mn2+ được tạo thành và các ion ban đầu không tham gia phản ứng là K+ và SO42-.
❌ c) Sai. Tại điểm tương đương, màu của dung dịch chuyển sang màu vàng nâu, khi đó dung dịch trước phản ứng có màu xanh nhạt của Fe2+ chuyển sang màu vàng nâu của Fe3+.
❌ d) Sai. Nồng độ theo lý thuyết (50mL) của FeSO4 là 0,25M.
Nồng độ thực tế của FeSO4 khi lỗi kĩ thuật xảy ra là:
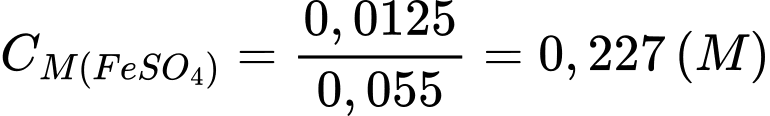
⇒ Khi thể tích dung dịch FeSO4 được thêm vào bình là 55,00 mL thay vì 50,00 mL thì kết quả tính nồng độ FeSO4 (0,25 M)sẽ lớn hơn so với thực tế (0,227 M).
10FeSO4 + 2KMnO4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol của KMnO4 là 0,0125.0,2 = 0,0025 (mol)
Từ PTHH số mol FeSO4 phản ứng là 0,0125 (mol) →
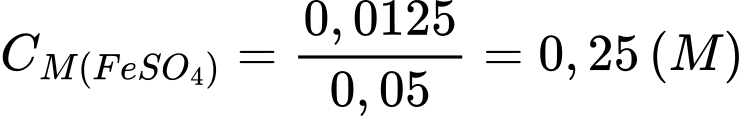
Phân tích các phát biểu:
✔️ a) Đúng. Nồng độ dung dịch FeSO4 trong bình tam giác là 0,25 M.
❌ b) Sai. Tại điểm tương đương, dung dịch chứa các ion Fe3+, Mn2+ được tạo thành và các ion ban đầu không tham gia phản ứng là K+ và SO42-.
❌ c) Sai. Tại điểm tương đương, màu của dung dịch chuyển sang màu vàng nâu, khi đó dung dịch trước phản ứng có màu xanh nhạt của Fe2+ chuyển sang màu vàng nâu của Fe3+.
❌ d) Sai. Nồng độ theo lý thuyết (50mL) của FeSO4 là 0,25M.
Nồng độ thực tế của FeSO4 khi lỗi kĩ thuật xảy ra là:
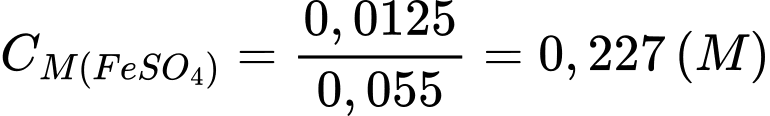
⇒ Khi thể tích dung dịch FeSO4 được thêm vào bình là 55,00 mL thay vì 50,00 mL thì kết quả tính nồng độ FeSO4 (0,25 M)sẽ lớn hơn so với thực tế (0,227 M).
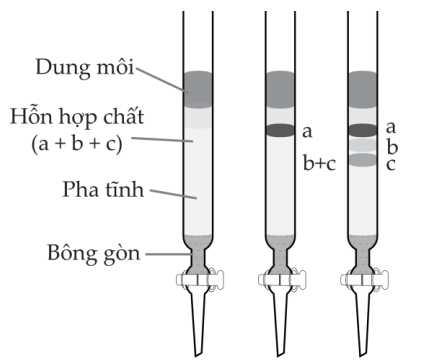
Câu 20 [703954]: Quan sát hình mô phỏng thí nghiệm sắc khí cột hình bên:

Phân tích các phát biểu:
✔️ a) Đúng. Chất a hấp phụ mạnh trên pha tĩnh và tan kém trong dung môi sẽ ra khỏi cột sắc kí sau cùng.
✔️ b) Đúng. Chất c hấp phụ kém trên pha tĩnh và tan tốt trong dung môi sẽ ra khỏi cột sắc kí trước.
❌ c) Sai. Thứ tự hòa tan tốt trong dung môi là c > b > a, vì c được tách ra trước, chất hấp phụ kém trên pha tĩnh và tan tốt trong dung môi sẽ ra khỏi cột sắc kí trước.
✔️ d) Đúng. Cơ sở của sắc kí dựa trên sự khác nhau về khả năng phân bố của mỗi chất trong dung môi thích hợp.
✔️ a) Đúng. Chất a hấp phụ mạnh trên pha tĩnh và tan kém trong dung môi sẽ ra khỏi cột sắc kí sau cùng.
✔️ b) Đúng. Chất c hấp phụ kém trên pha tĩnh và tan tốt trong dung môi sẽ ra khỏi cột sắc kí trước.
❌ c) Sai. Thứ tự hòa tan tốt trong dung môi là c > b > a, vì c được tách ra trước, chất hấp phụ kém trên pha tĩnh và tan tốt trong dung môi sẽ ra khỏi cột sắc kí trước.
✔️ d) Đúng. Cơ sở của sắc kí dựa trên sự khác nhau về khả năng phân bố của mỗi chất trong dung môi thích hợp.
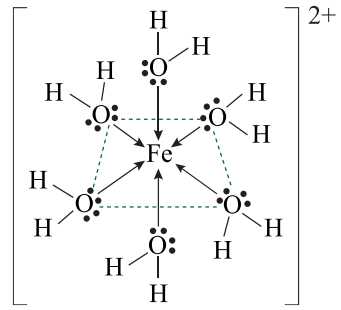
Câu 21 [703955]: Khi các ion kim loại tan trong dung dịch, chúng sẽ được bao quanh các phân tử nước và sẽ tạo ra các phức chất aqua. Xét trường hợp của phức chất aqua của sắt dưới đây:

Phân tích các phát biểu:
❌ a) Sai. Trong phức [Fe(H2O)6]2+, nguyên tử trung tâm là cation Fe2+, một ion dương có số oxi hóa +2.
✔️ b) Đúng. Liên kết trong phức chất là liên kết cho nhận (liên kết cộng hóa trị phối trí). Trong đó, các phối tử H2O dùng cặp electron chưa liên kết trên nguyên tử oxygen để tạo liên kết với ion Fe2+.
✔️ c) Đúng. Ion Fe2+ có số phối trí là 6 (do có 6 phối tử H2O liên kết), tạo dạng hình học bát diện đặc trưng.
❌ d) Sai. NH3 là phối tử trung tính, tương tự H2O, và kích thước của NH3 không đủ lớn để làm thay đổi số phối trí. Dạng hình học vẫn giữ nguyên là bát diện.
❌ a) Sai. Trong phức [Fe(H2O)6]2+, nguyên tử trung tâm là cation Fe2+, một ion dương có số oxi hóa +2.
✔️ b) Đúng. Liên kết trong phức chất là liên kết cho nhận (liên kết cộng hóa trị phối trí). Trong đó, các phối tử H2O dùng cặp electron chưa liên kết trên nguyên tử oxygen để tạo liên kết với ion Fe2+.
✔️ c) Đúng. Ion Fe2+ có số phối trí là 6 (do có 6 phối tử H2O liên kết), tạo dạng hình học bát diện đặc trưng.
❌ d) Sai. NH3 là phối tử trung tính, tương tự H2O, và kích thước của NH3 không đủ lớn để làm thay đổi số phối trí. Dạng hình học vẫn giữ nguyên là bát diện.
Câu 22 [703956]: Tiến hành thí nghiệm như sau:
▪ Bước 1: Cho một thìa thủy tinh chất rắn sodium acetate (CH3COONa) vào ống nghiệm A chứa khoảng 5 mL nước cất, lắc đều cho tan hết, rồi thêm vào ống nghiệm 2 – 3 giọt chất chỉ thị phenolphthalein, để một thời gian.
▪ Bước 2: Rót khoảng một nửa dung dịch từ ống nghiệm A sang ống nghiệm B, sau đó đặt ống nghiệm B vào một cốc nước nóng (khoảng 70oC – 80oC) thì thấy màu sắc ống nghiệm B đậm hơn. Cho biết giữa ion acetate và nước có phản ứng thuận nghịch sau:
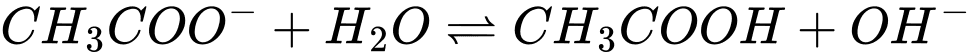
▪ Bước 1: Cho một thìa thủy tinh chất rắn sodium acetate (CH3COONa) vào ống nghiệm A chứa khoảng 5 mL nước cất, lắc đều cho tan hết, rồi thêm vào ống nghiệm 2 – 3 giọt chất chỉ thị phenolphthalein, để một thời gian.
▪ Bước 2: Rót khoảng một nửa dung dịch từ ống nghiệm A sang ống nghiệm B, sau đó đặt ống nghiệm B vào một cốc nước nóng (khoảng 70oC – 80oC) thì thấy màu sắc ống nghiệm B đậm hơn. Cho biết giữa ion acetate và nước có phản ứng thuận nghịch sau:
Phân tích các phát biểu:
❌ a) Sai. Sau bước 1 dung dịch trong ống nghiệm A vẫn có màu hồng nhạt do vẫn có phản ứng CH3COO– + H2O ⇌ CH3COOH + OH–.
✔️ b) Đúng. Cả 2 ống đều có phản ứng CH3COO– + H2O ⇌ CH3COOH + OH– tạo ra OH– nên làm đổi màu chất chỉ chị phenolphtalein (màu hồng).
✔️ c) Đúng. Khi tăng nhiệt độ màu của dung dịch chuyển sang màu đậm hơn, tức cân bằng chuyển dịch theo chiều thuận tạo nhiều OH– hơn, phản ứng trên phải là thu nhiệt.
✔️ d) Đúng. Nồng độ OH– trong ống nghiệm B lớn hơn nên màu của dung dịch sau phản ứng đậm hơn.
❌ a) Sai. Sau bước 1 dung dịch trong ống nghiệm A vẫn có màu hồng nhạt do vẫn có phản ứng CH3COO– + H2O ⇌ CH3COOH + OH–.
✔️ b) Đúng. Cả 2 ống đều có phản ứng CH3COO– + H2O ⇌ CH3COOH + OH– tạo ra OH– nên làm đổi màu chất chỉ chị phenolphtalein (màu hồng).
✔️ c) Đúng. Khi tăng nhiệt độ màu của dung dịch chuyển sang màu đậm hơn, tức cân bằng chuyển dịch theo chiều thuận tạo nhiều OH– hơn, phản ứng trên phải là thu nhiệt.
✔️ d) Đúng. Nồng độ OH– trong ống nghiệm B lớn hơn nên màu của dung dịch sau phản ứng đậm hơn.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [703957]: Docosahexaenoic acid (DHA) là loại acid béo omega-3 quan trọng nhất ở trong cơ thể con người. Nó là thành phần cấu trúc quan trọng của võng mạc mắt, não và nhiều bộ phận cơ thể khác. DHA có cấu tạo như sau:
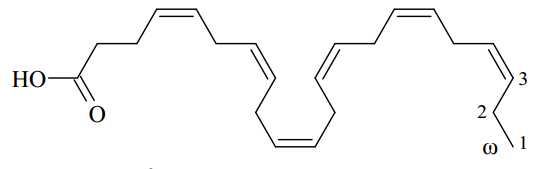
Có bao nhiêu nối đôi C=C trong cấu tạo của phân tử DHA?

Có bao nhiêu nối đôi C=C trong cấu tạo của phân tử DHA?
Trong phân tử DHA, ta quan sát thấy có 7 liên kết đôi nhưng trong đó chỉ có 6 liên kết đôi cuat C=C, còn lại 1 liên kết của C=O như sau:
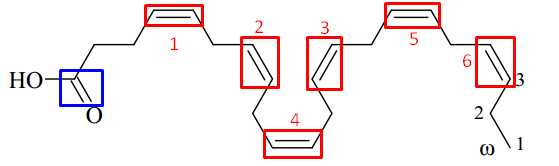
⇒ Điền đáp án: 6

⇒ Điền đáp án: 6
Câu 24 [703958]: Phân tích nguyên tố hợp chất hữu cơ X cho thấy phần trăm khối lượng ba nguyên tố C, H và O lần lượt là 64,86%; 13,51% và 21,63%. Phổ MS của X được cho như hình bên. Biết phổ hồng ngoại của X có tín hiệu hấp thụ trong vùng 3650 – 3200 cm–1. Có thể có bao nhiêu công thức cấu tạo thỏa mãn X?
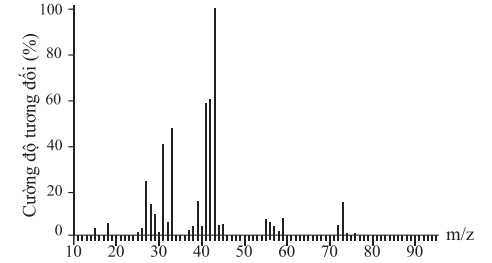

Từ phổ khối lượng, phân tử khối của chất hữu cơ X là 74 gam/mol.
Gọi công thức của X có dạng CxHyOz
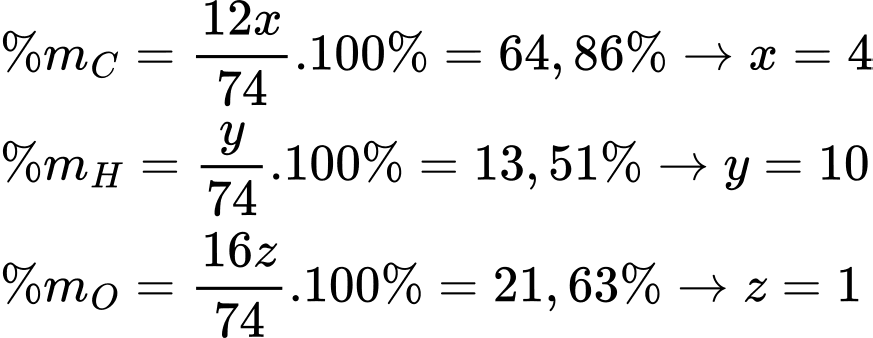
→ Công thức của X là C4H10O.
X có tín hiệu hấp thụ trong vùng 3650 – 3200 cm-1 của nhóm O-H, nên X là alcohol.
Các đồng phân có thể có của X là
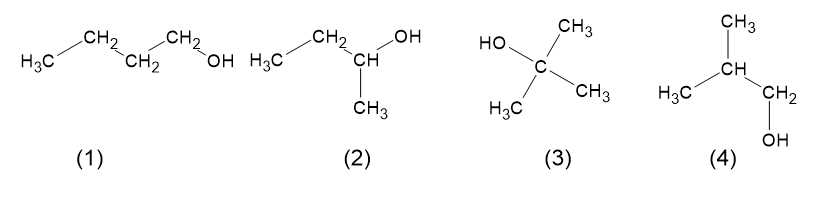
Vậy X có thể có 4 đồng phân
⇒ Điền đáp án: 4
Gọi công thức của X có dạng CxHyOz
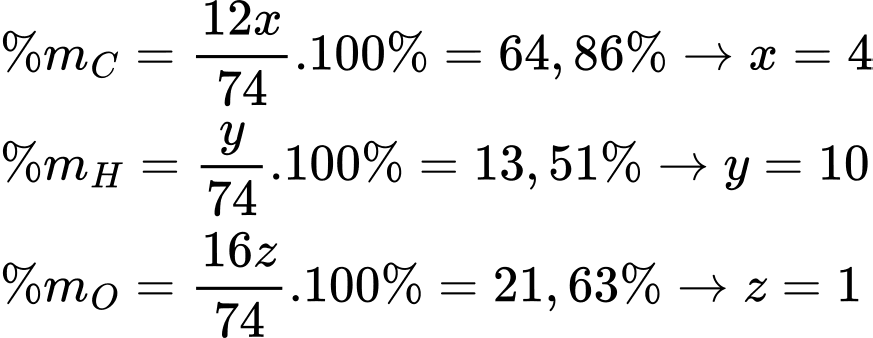
→ Công thức của X là C4H10O.
X có tín hiệu hấp thụ trong vùng 3650 – 3200 cm-1 của nhóm O-H, nên X là alcohol.
Các đồng phân có thể có của X là

Vậy X có thể có 4 đồng phân
⇒ Điền đáp án: 4
Câu 25 [703959]: Hoà tan 66,25 gam CuSO4.5H2O trong nước thu được 800 mL dung dịch X. Cần phải lấy bao nhiêu mL dung dịch X để pha được 1,00 L dung dịch CuSO4 0,100 M (làm tròn kết quả đến số nguyên)?
Số mol của CuSO4.5H2O là 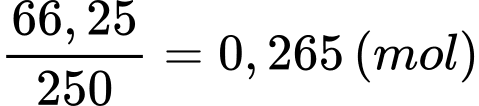
Nồng độ của dung dịch X là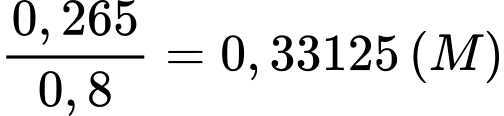
Số mol của 1,00 L dung dịch CuSO4 0,100 M là 0,1 (mol)
Thể tích dung dịch X cần lấy là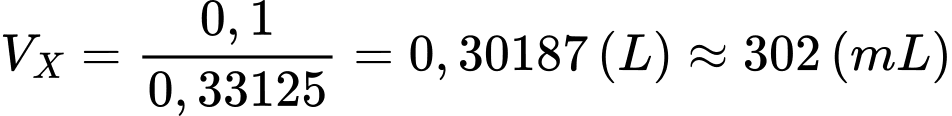
⇒ Điền đáp án: 302
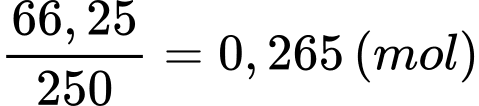
Nồng độ của dung dịch X là
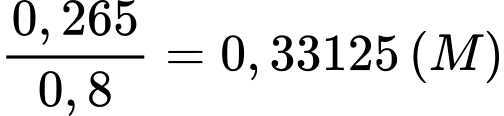
Số mol của 1,00 L dung dịch CuSO4 0,100 M là 0,1 (mol)
Thể tích dung dịch X cần lấy là
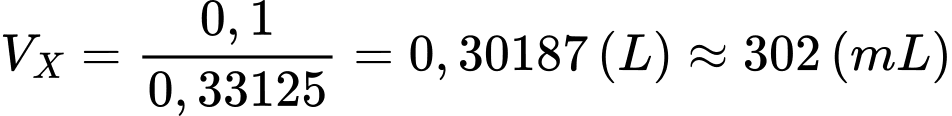
⇒ Điền đáp án: 302
Câu 26 [703960]: Alkylamine thể hiện tính chất như là một base hữu cơ. Để kiểm tra tính chất hóa học, ethylamine được chọn để tiến hành các thí nghiệm:
Thí nghiệm 1: Cho vào ống nghiệm khoảng 1 mL dung dịch ethylamine 5%. Lấy đũa thuỷ tinh nhúng vào dung dịch rồi chấm vào giấy quỳ tím.
Thí nghiệm 2: Cho vào ống nghiệm khoảng 1 mL dung dịch ethylamine 5%. Nhúng đũa thuỷ tinh sạch vào dung dịch HCl đặc rồi đưa đầu đũa thuỷ tinh vào miệng ống nghiệm.
Thí nghiệm 3: Cho vào ống nghiệm 5 giọt dung dịch CuSO4 5%. Vừa lắc vừa thêm từ từ dung dịch ethylamine 5%.
Thí nghiệm 4: Cho vào ống nghiệm 5 giọt dung dịch FeCl3 3%. Vừa lắc vừa thêm từ từ dung dịch ethylamine 5%.
Gán số thứ tự các thí nghiệm của ethylamine theo các tính chất: phản ứng với muối của kim loại có hydroxyde không tan, phản ứng với acid, làm đổi màu chất chỉ thị, phản ứng tạo phức và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234, 4321, ...).
Thí nghiệm 1: Cho vào ống nghiệm khoảng 1 mL dung dịch ethylamine 5%. Lấy đũa thuỷ tinh nhúng vào dung dịch rồi chấm vào giấy quỳ tím.
Thí nghiệm 2: Cho vào ống nghiệm khoảng 1 mL dung dịch ethylamine 5%. Nhúng đũa thuỷ tinh sạch vào dung dịch HCl đặc rồi đưa đầu đũa thuỷ tinh vào miệng ống nghiệm.
Thí nghiệm 3: Cho vào ống nghiệm 5 giọt dung dịch CuSO4 5%. Vừa lắc vừa thêm từ từ dung dịch ethylamine 5%.
Thí nghiệm 4: Cho vào ống nghiệm 5 giọt dung dịch FeCl3 3%. Vừa lắc vừa thêm từ từ dung dịch ethylamine 5%.
Gán số thứ tự các thí nghiệm của ethylamine theo các tính chất: phản ứng với muối của kim loại có hydroxyde không tan, phản ứng với acid, làm đổi màu chất chỉ thị, phản ứng tạo phức và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234, 4321, ...).
Phân tích các thí nghiệm:
⭐ Thí nghiệm 1:
Ethylamine là một base yếu, khi tiếp xúc với giấy quỳ tím, nó làm giấy quỳ chuyển sang màu xanh.
⇒ Đây là phản ứng biểu hiện tính làm đổi màu chất chỉ thị.
⭐ Thí nghiệm 2:
Khi đưa đũa thủy tinh nhúng HCl đặc vào miệng ống nghiệm chứa ethylamine, xảy ra phản ứng giữa hơi HCl và hơi C2H5NH2, tạo ra khói trắng của C2H5NH3Cl (ethylammonium chloride).
⇒ Đây là phản ứng thể hiện tính chất phản ứng với acid.
⭐ Thí nghiệm 3:
Dung dịch CuSO4 phản ứng với dung dịch ethylamine tạo ra phức chất màu xanh lam:
CuSO4 + 2C2H5NH2 + 2H2O ⟶ Cu(OH)2 + (C2H5NH3)2SO4
Cu(OH)2 + 4C2H5NH2 ⟶ [Cu(C2H5NH2)4](OH)2 (phức chất màu xanh)
⇒ Đây là phản ứng thể hiện tính phản ứng tạo phức.
⭐ Thí nghiệm 4:
Khi thêm ethylamine vào dung dịch FeCl3, ethylamine có thể tạo ra kết tủa hydroxyde không tan:
FeCl3 + 3C2H5NH2 + 3H2O ⟶ Fe(OH)3↓ + 3C2H5NH3Cl
⇒ Đây là phản ứng thể hiện tính phản ứng với muối của kim loại có hydroxide không tan.
⇒ Số thứ tự các thí nghiệm của ethylamine theo các tính chất:
4 - Phản ứng với muối của kim loại có hydroxyde không tan
2 - Phản ứng với acid
1 - Làm đổi màu chất chỉ thị
3 - Phản ứng tạo phức
⇒ Điền đáp án: 4213
⭐ Thí nghiệm 1:
Ethylamine là một base yếu, khi tiếp xúc với giấy quỳ tím, nó làm giấy quỳ chuyển sang màu xanh.
⇒ Đây là phản ứng biểu hiện tính làm đổi màu chất chỉ thị.
⭐ Thí nghiệm 2:
Khi đưa đũa thủy tinh nhúng HCl đặc vào miệng ống nghiệm chứa ethylamine, xảy ra phản ứng giữa hơi HCl và hơi C2H5NH2, tạo ra khói trắng của C2H5NH3Cl (ethylammonium chloride).
⇒ Đây là phản ứng thể hiện tính chất phản ứng với acid.
⭐ Thí nghiệm 3:
Dung dịch CuSO4 phản ứng với dung dịch ethylamine tạo ra phức chất màu xanh lam:
CuSO4 + 2C2H5NH2 + 2H2O ⟶ Cu(OH)2 + (C2H5NH3)2SO4
Cu(OH)2 + 4C2H5NH2 ⟶ [Cu(C2H5NH2)4](OH)2 (phức chất màu xanh)
⇒ Đây là phản ứng thể hiện tính phản ứng tạo phức.
⭐ Thí nghiệm 4:
Khi thêm ethylamine vào dung dịch FeCl3, ethylamine có thể tạo ra kết tủa hydroxyde không tan:
FeCl3 + 3C2H5NH2 + 3H2O ⟶ Fe(OH)3↓ + 3C2H5NH3Cl
⇒ Đây là phản ứng thể hiện tính phản ứng với muối của kim loại có hydroxide không tan.
⇒ Số thứ tự các thí nghiệm của ethylamine theo các tính chất:
4 - Phản ứng với muối của kim loại có hydroxyde không tan
2 - Phản ứng với acid
1 - Làm đổi màu chất chỉ thị
3 - Phản ứng tạo phức
⇒ Điền đáp án: 4213
Câu 27 [560515]: Thử nghiệm với hai chiếc xe ô tô tương đương, một xe chạy bằng xăng (dung tích bình chứa 4 kg xăng) và một xe chạy bằng pin nhiên liệu (thể tích bình nhiên liệu có thể quy về ứng với 400 gam hydrogen ở áp suất cao). Để di chuyển được 1 km, cần cung cấp năng lượng đủ cho mỗi xe là 106 J. Biết khi đốt cháy 1 kg xăng tỏa ra nhiệt lượng là 5 × 107 J nhưng chỉ có 40% lượng nhiệt được chuyển thành công có ích. Trong khi đó, khi sử dụng 2 gam hydrogen trong pin thì giải phóng năng lượng là 286.000 J và có 60% năng lượng này được chuyển thành công có ích. Bỏ qua các hao phí khác, quãng đường tối đa mà xe ô tô chạy bằng xăng nhiều hay ít hơn xe ô tô chạy bằng pin là bao nhiêu km?
Năng lượng có ích khi đốt cháy 4kg xăng: 4 . 5.107 . 40% = 8.107
⇒ Quãng đường tối đa xe chạy xăng đi được: 8.107 / 106 = 80 km
Năng lượng có ích khi sử dụng 400 gam hydrogen: 400/2 . 286 000 . 60% = 34 320 000 J
⇒ Quãng đường tối đa xe chạy pin đi được: 34 320 000/ 106 = 34,3 km
Vậy quãng đường xe xăng chạy nhiều hơn xe chạy bằng pin 80 - 34,3 = 45,7 km
⇒ Điền đáp án: 45,7
⇒ Quãng đường tối đa xe chạy xăng đi được: 8.107 / 106 = 80 km
Năng lượng có ích khi sử dụng 400 gam hydrogen: 400/2 . 286 000 . 60% = 34 320 000 J
⇒ Quãng đường tối đa xe chạy pin đi được: 34 320 000/ 106 = 34,3 km
Vậy quãng đường xe xăng chạy nhiều hơn xe chạy bằng pin 80 - 34,3 = 45,7 km
⇒ Điền đáp án: 45,7
Câu 28 [703961]: Có thể xác định nồng độ hypochlorite trong chất tẩy trắng bằng cách xử lí mẫu với lượng dư iodide ion trong dung dịch acid, quá trình này dẫn đến sự tạo thành triiodide ion theo phương trình: OCl–(aq) + 3I–(aq) + 2H3O+(aq) → Cl–(aq) + I3–(aq) + 3H2O(l)Sau đó, có thể chuẩn độ triiodide bởi sodium thiosulfate:
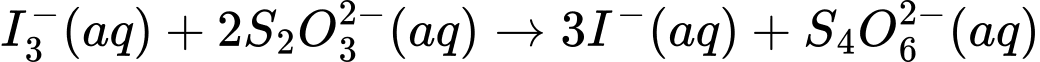
Khi xử lí 75,0 mL mẫu chất tẩy trắng dạng lỏng với lượng dư KI và acid, sau đó đem chuẩn độ với dung dịch sodium thiosulfate 0,0235 M. Quan sát được điểm cuối chuẩn độ là 21,23 mL. Nồng độ hypochlorite trong mẫu chất tẩy rửa là bao nhiêu mmol/L (mM)?
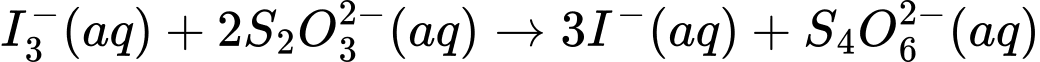
Khi xử lí 75,0 mL mẫu chất tẩy trắng dạng lỏng với lượng dư KI và acid, sau đó đem chuẩn độ với dung dịch sodium thiosulfate 0,0235 M. Quan sát được điểm cuối chuẩn độ là 21,23 mL. Nồng độ hypochlorite trong mẫu chất tẩy rửa là bao nhiêu mmol/L (mM)?
Đổi 75 mL = 0,075 mL; 21,23 mL = 0,02123 L
(1) ClO–(aq) + 3I–(aq) + 2H3O+(aq) ⟶ Cl–(aq) + I3–(aq) + 3H2O(l)
(2) I3–(aq) + 2S2O32–(aq) ⟶ 3I–(aq) + S4O62–(aq)
Số mol của sodium thiosulfate là 0,02123.0,0235 = 4,98905.10-4 (mol)
Từ phương trình (1) và (2) số mol của ClO– là 2,494525.10-4 (mol)
Nồng độ của hypochlorite là
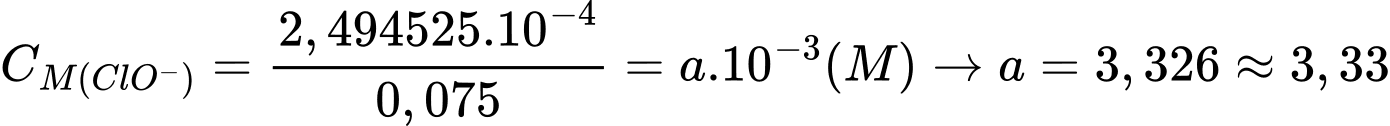
⇒ Điền đáp án: 3,33
(1) ClO–(aq) + 3I–(aq) + 2H3O+(aq) ⟶ Cl–(aq) + I3–(aq) + 3H2O(l)
(2) I3–(aq) + 2S2O32–(aq) ⟶ 3I–(aq) + S4O62–(aq)
Số mol của sodium thiosulfate là 0,02123.0,0235 = 4,98905.10-4 (mol)
Từ phương trình (1) và (2) số mol của ClO– là 2,494525.10-4 (mol)
Nồng độ của hypochlorite là
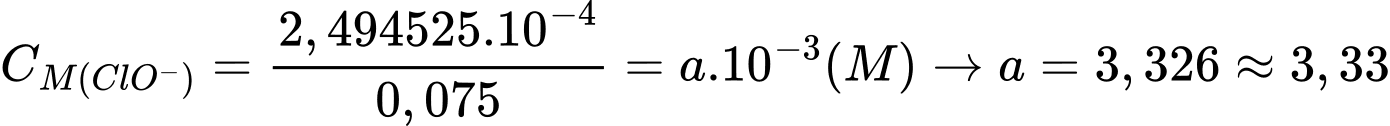
⇒ Điền đáp án: 3,33