PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [703962]: “...(1)... là vật liệu kim loại chứa một kim loại cơ bản và một số kim loại khác hoặc …(2)…”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, vật liệu tổng hợp, polymer.
B, hợp kim, khí hiếm.
C, hợp kim, phi kim.
D, chất dẻo, khí hiếm.
Để tăng độ cứng, chống ăn mòn hoặc tăng cường khả năng chịu nhiệt hoặc điện của vật liệu, người ta thường trộn một kim loại cơ bản (như sắt, đồng, hoặc nhôm) với một hoặc nhiều nguyên tố khác. Các nguyên tố bổ sung có thể là kim loại (như chromium, nickel) hoặc phi kim (như carbon, silicon)... được gọi là họp kim.
⇒ Hợp kim là vật liệu kim loại chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim.
⇒ Chọn đáp án C Đáp án: C
⇒ Hợp kim là vật liệu kim loại chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim.
⇒ Chọn đáp án C Đáp án: C
Câu 2 [560806]: Sodium chloride được dùng để làm gia vị thức ăn, điều chế sodium, xút, nước Javel. Công thức của sodium chloride là
A, Na2CO3.
B, NaCl.
C, NaHCO3.
D, KCl.
Công thức của Sodium chloride là:
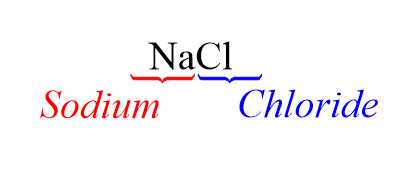
các chất còn lại có tên gọi như sau:
Na2CO3: sodium carbonate
NaHCO3: sodium bicarbonate
KCl: potassium chloride
⇒ Chọn đáp án B Đáp án: B

các chất còn lại có tên gọi như sau:
Na2CO3: sodium carbonate
NaHCO3: sodium bicarbonate
KCl: potassium chloride
⇒ Chọn đáp án B Đáp án: B
Câu 3 [309446]: Polymer là các phân tử rất lớn hình thành do sự trùng hợp các monomer. Nếu propene CH2=CHCH3 là monomer thì công thức của polymer tương ứng được biễu diễn là
A, 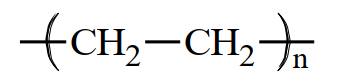
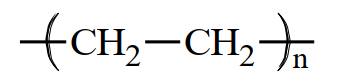
B, 
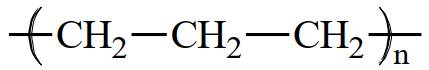
C, 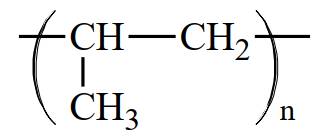
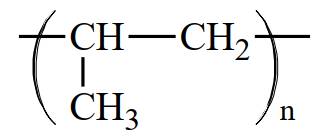
D, 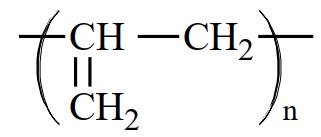
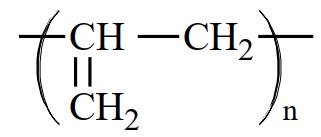
Polymer là các phân tử rất lớn hình thành do sự trùng hợp các monomer. Nếu propene CH2=CHCH3 là monomer thì công thức của polymer tương ứng được biễu diễn là ―(CH(CH3) ― CH2)n―
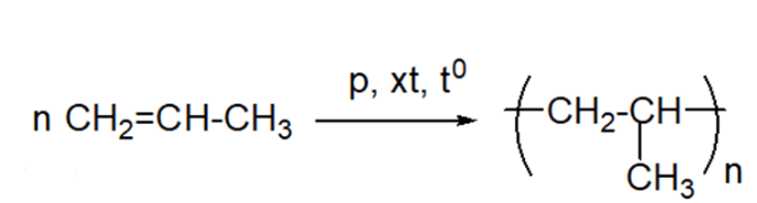
⇒ Chọn đáp án: C Đáp án: C

⇒ Chọn đáp án: C Đáp án: C
Câu 4 [560418]: Cho thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
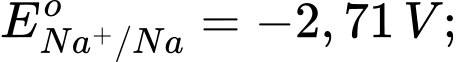
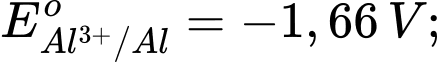
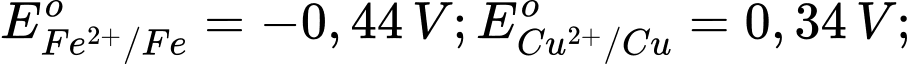
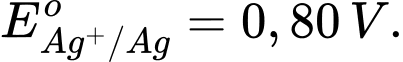
Kim loại nào sau đây có tính khử yếu nhất?
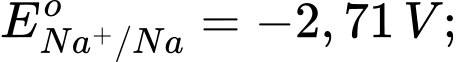
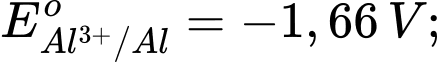
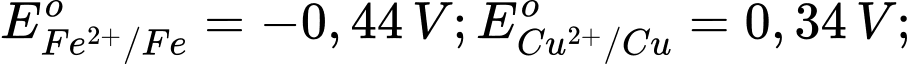
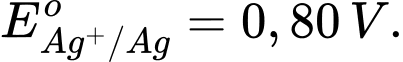
Kim loại nào sau đây có tính khử yếu nhất?
A, Ag.
B, Na.
C, Al.
D, Fe.
Tính khử của một kim loại được thể hiện qua khả năng nhường electron của nó. Kim loại có thế điện cực chuẩn Eo của cặp oxi hóa-khử Mn+/M càng lớn thì tính khử càng yếu, vì kim loại đó khó bị oxi hóa thành ion Mn+.
Phân tích các giá trị thế điện cực chuẩn:
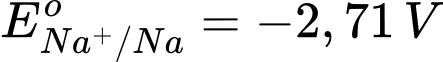 : Kim loại NaNa có tính khử mạnh nhất.
: Kim loại NaNa có tính khử mạnh nhất.
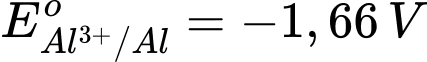 : Kim loại Al có tính khử mạnh, nhưng yếu hơn Na.
: Kim loại Al có tính khử mạnh, nhưng yếu hơn Na.
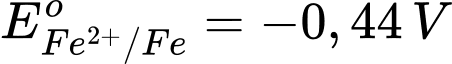 : Kim loại Fe có tính khử yếu hơn Al.
: Kim loại Fe có tính khử yếu hơn Al.
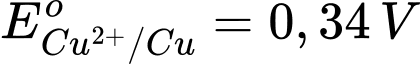 : Kim loại Cu có tính khử yếu hơn Fe.
: Kim loại Cu có tính khử yếu hơn Fe.
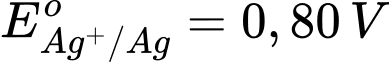 : Kim loại Ag có tính khử yếu nhất trong các kim loại này.
: Kim loại Ag có tính khử yếu nhất trong các kim loại này.
⇒ Chọn đáp án A Đáp án: A
Phân tích các giá trị thế điện cực chuẩn:
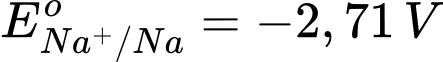 : Kim loại NaNa có tính khử mạnh nhất.
: Kim loại NaNa có tính khử mạnh nhất.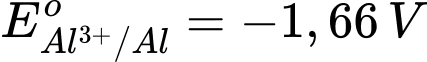 : Kim loại Al có tính khử mạnh, nhưng yếu hơn Na.
: Kim loại Al có tính khử mạnh, nhưng yếu hơn Na.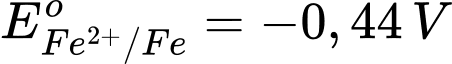 : Kim loại Fe có tính khử yếu hơn Al.
: Kim loại Fe có tính khử yếu hơn Al. 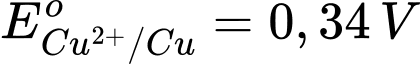 : Kim loại Cu có tính khử yếu hơn Fe.
: Kim loại Cu có tính khử yếu hơn Fe.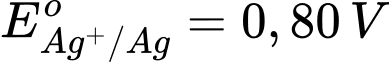 : Kim loại Ag có tính khử yếu nhất trong các kim loại này.
: Kim loại Ag có tính khử yếu nhất trong các kim loại này.⇒ Chọn đáp án A Đáp án: A
Câu 5 [560552]: Khi cần tinh chế một tấm sắt có độ tinh khiết thấp thì lắp tấm sắt này vào
A, anode trong dung dịch FeSO4.
B, cathode trong dung dịch FeSO4.
C, anode trong Fe(OH)2.
D, cathode trong Fe(OH)2.
Quá trình tinh luyện Fe bằng phương pháp điện phân:
(-) Cathode: làm bằng tấm sắt có độ tinh khiết thấp. Tại đây ion Fe2+ bị điện phân bám lên tấm sắt tạo lớp sắt tinh khiết.
(-) Cathode: làm bằng tấm sắt có độ tinh khiết thấp. Tại đây ion Fe2+ bị điện phân bám lên tấm sắt tạo lớp sắt tinh khiết.
Fe2+ + 2e ⟶ Fe
(+) Anode: làm bằng tấm sắt có độ tinh khiết thấp. Tại đây xảy ra quá trình oxi hóa Fe tạo thành Fe2+ tan vào dung dịch.Fe(s) ➝ Fe2+(aq) + 2e
Đáp án: A ⇒ Chọn đáp án A
Câu 6 [575649]: Cấu hình electron của nguyên tử calcium là 1s22s22p63s23p64s2. Vị trí của calcium trong bảng tuần hoàn là
A, ô số 20, chu kì 4, nhóm IIA.
B, ô số 18, chu kì 3, nhóm VA.
C, ô số 2, chu kì 4, nhóm IIA.
D, ô số 22, chu kì 3, nhóm IIIA.
Cấu hình electron của calcium 1s2 2s2 2p6 3s2 3p6 4s2:
- Calcium có 20e → Số hiệu nguyên tử là 20 → Ô thứ 20 trong bảng tuần hoàn.
- Calcium có 4 lớp 4 → Thuộc chu kì 4.
- Calcium thuộc nguyên tố s, có 2 electron lớp ngoài cùng → Thuộc nhóm IIA
⇒ Chọn đáp án A Đáp án: A
- Calcium có 20e → Số hiệu nguyên tử là 20 → Ô thứ 20 trong bảng tuần hoàn.
- Calcium có 4 lớp 4 → Thuộc chu kì 4.
- Calcium thuộc nguyên tố s, có 2 electron lớp ngoài cùng → Thuộc nhóm IIA
⇒ Chọn đáp án A Đáp án: A
Câu 7 [703963]: Quá trình đốt than sinh ra nhiều loại khí thải, trong đó có khí SO2. Khí SO2 mùi xốc và có khả năng gây viêm đường hô hấp. Tên gọi của SO2 là
A, sulfur trioxide.
B, sulfuric acid.
C, hydrogen sulfide.
D, sulfur dioxide.
SO2 là một acidic oxide, cách gọi tên acidic oxide theo quy tắc sau:
Đáp án: D
Số nguyên tử + Tên nguyên tố + số oxygen + oxide
⇒ SO2 là hợp chất giữa sulfur và oxygen nên tên gọi của hợp chất này là sulfur dioxide.
⇒ Chọn đáp án D
⇒ Chọn đáp án D
Đáp án: D
Câu 8 [308564]: Chất có mùi khai là
A, methylamine.
B, methyl formate.
C, aniline.
D, glycine.
✔️ A. Methylamine (CH3NH2) là một amine bậc một có mùi khai đặc trưng (tương tự như mùi ammonia nhưng nhẹ hơn). Mùi khai này là đặc trưng của các amine, do khả năng bay hơi của chúng và tính base yếu.
❌ B. Methyl formate (HCOOCH3) là một ester, thường có mùi thơm dễ chịu, không có mùi khai.
❌ C. Aniline (C6H5NH2) là một amine thơm, có mùi đặc trưng (hắc và khó chịu), nhưng không phải mùi khai.
❌ D. Glycine (H2NCH2COOH) là một amino acid không có mùi khai, mà có mùi nhẹ hoặc không mùi.
⇒ Chọn đáp án A Đáp án: A
❌ B. Methyl formate (HCOOCH3) là một ester, thường có mùi thơm dễ chịu, không có mùi khai.
❌ C. Aniline (C6H5NH2) là một amine thơm, có mùi đặc trưng (hắc và khó chịu), nhưng không phải mùi khai.
❌ D. Glycine (H2NCH2COOH) là một amino acid không có mùi khai, mà có mùi nhẹ hoặc không mùi.
⇒ Chọn đáp án A Đáp án: A
Câu 9 [703964]: Nhiệt độ ngọn lửa là nhiệt độ cao nhất có thể tạo ra bởi phản ứng cháy của chất cháy trong không khí ở áp suất khí quyển. Nhiệt độ ngọn lửa cao nhất khi cháy trong không khí của methane khoảng 1963°C. Methane trong khí gas trộn với oxygen không khí gây nổ rất mạnh do phản ứng:
(*) CH4(g) + 2O2(g) CO2(g) + 2H2O(g);
CO2(g) + 2H2O(g); 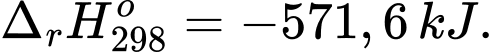
Phản ứng này toả rất nhiều nhiệt, các sản phẩm bị đốt nóng mạnh. Cho các phát biểu sau:
(a) Tổng số mol khí trước và sau phản ứng không thay đổi.
(b) Sự nổ xảy ra là do phản ứng (*) tỏa nhiều nhiệt, thể tích tăng đột ngột.
(c) CH4 kết hợp với O2 theo tỉ lệ khối lượng 1 : 2 sẽ tạo ra hỗn hợp nổ.
(d) Việc sử dụng nước để chữa cháy nhằm mục đích hạ nhiệt độ của hỗn hợp.
Các phát biểu đúng là
(*) CH4(g) + 2O2(g)
 CO2(g) + 2H2O(g);
CO2(g) + 2H2O(g); 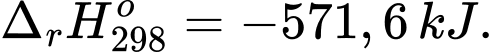
Phản ứng này toả rất nhiều nhiệt, các sản phẩm bị đốt nóng mạnh. Cho các phát biểu sau:
(a) Tổng số mol khí trước và sau phản ứng không thay đổi.
(b) Sự nổ xảy ra là do phản ứng (*) tỏa nhiều nhiệt, thể tích tăng đột ngột.
(c) CH4 kết hợp với O2 theo tỉ lệ khối lượng 1 : 2 sẽ tạo ra hỗn hợp nổ.
(d) Việc sử dụng nước để chữa cháy nhằm mục đích hạ nhiệt độ của hỗn hợp.
Các phát biểu đúng là
A, (a), (d).
B, (a), (b), (d).
C, (a), (b), (c).
D, (a), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Tổng số mol khí trước và sau phản ứng không có sự thay đổi:
Trước phản ứng số mol khí là 3: 1 mol CH4 và 2 mol O2
Sau phản ứng số mol khí vẫn là 3: 1 mol CO2 và 2 mol H2O.
✔️ (b) Đúng. Phản ứng (*) tỏa nhiệt mạnh (ΔH<0) làm sản phẩm khí bị đốt nóng, dẫn đến tăng áp suất và thể tích khí nếu không gian kín. Điều này là nguyên nhân chính gây nổ.
❌ (c) Sai. CH4 kết hợp với O2 theo tỉ lệ mol là 1 : 2 sẽ tạo ra hỗn hợp nổ (hệ số phản ứng theo phương trình)
⇒ Tỉ lệ khối lượng của CH4 và O2 phải là CH4 : 2O2 = 16 : 64 = 1 : 4.
✔️ (d) Đúng. Việc sử dụng nước để chữa cháy nhằm mục đích hạ nhiệt độ của hỗn hợp do nước có khả năng hấp thụ nhiệt lớn, làm giảm nhiệt độ của hỗn hợp cháy và ngăn phản ứng cháy tiếp diễn.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án B Đáp án: B
✔️ (a) Đúng. Tổng số mol khí trước và sau phản ứng không có sự thay đổi:
Trước phản ứng số mol khí là 3: 1 mol CH4 và 2 mol O2
Sau phản ứng số mol khí vẫn là 3: 1 mol CO2 và 2 mol H2O.
✔️ (b) Đúng. Phản ứng (*) tỏa nhiệt mạnh (ΔH<0) làm sản phẩm khí bị đốt nóng, dẫn đến tăng áp suất và thể tích khí nếu không gian kín. Điều này là nguyên nhân chính gây nổ.
❌ (c) Sai. CH4 kết hợp với O2 theo tỉ lệ mol là 1 : 2 sẽ tạo ra hỗn hợp nổ (hệ số phản ứng theo phương trình)
⇒ Tỉ lệ khối lượng của CH4 và O2 phải là CH4 : 2O2 = 16 : 64 = 1 : 4.
✔️ (d) Đúng. Việc sử dụng nước để chữa cháy nhằm mục đích hạ nhiệt độ của hỗn hợp do nước có khả năng hấp thụ nhiệt lớn, làm giảm nhiệt độ của hỗn hợp cháy và ngăn phản ứng cháy tiếp diễn.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án B Đáp án: B
Câu 10 [703965]: Biểu đồ cho thấy quang phổ hồng ngoại của một hợp chất.
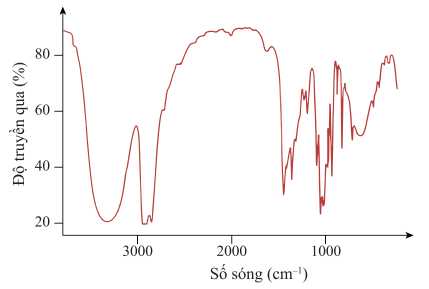
Hợp chất nào sau đây có thể tạo ra phổ hồng ngoại như trên?

Hợp chất nào sau đây có thể tạo ra phổ hồng ngoại như trên?
A, Butane.
B, Butanol.
C, Butanoic acid.
D, Butanal.
Phổ hồng ngoại xuất hiện peak sóng 3650-3200 cm-1 của nhóm OH trong alcohol:
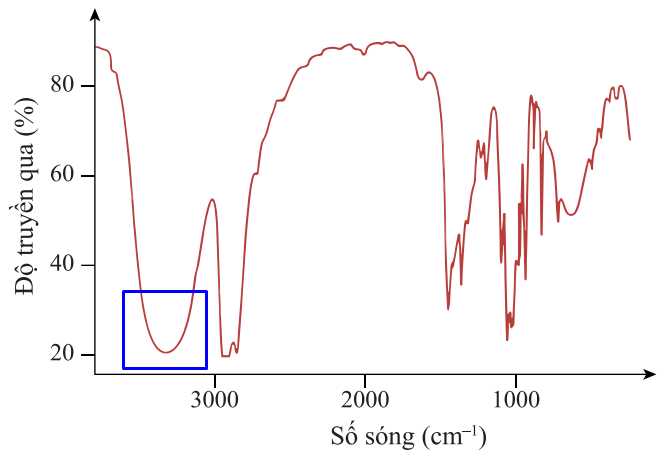
⇒ Đây là phổ hồng ngoại của butanol
⇒ Chọn đáp án B Đáp án: B

⇒ Đây là phổ hồng ngoại của butanol
⇒ Chọn đáp án B Đáp án: B
Câu 11 [304859]: Tiến hành cho ester CH2=CHCOOCH3 phản ứng cộng H2 xúc tác Ni, đun nóng thì thu được hợp chất có công thức cấu tạo nào sau đây?
A, CH3CH2COOCH3.
B, CH3COOCH3.
C, CH3CH2COOCH2CH3.
D, CH3COOCH2CH3.
HD: Phân tích phản ứng hydrogen hóa với xúc tác Ni, t°C:

⇒ Sản phẩm thu được là methyl propionate: CH3CH2COOCH3
⇝ Chọn đáp án A Đáp án: A

⇒ Sản phẩm thu được là methyl propionate: CH3CH2COOCH3
⇝ Chọn đáp án A Đáp án: A
Câu 12 [308406]: Tinh bột được tạo thành ở cây xanh nhờ phản ứng
A, thủy phân.
B, quang hợp.
C, hóa hợp.
D, phân hủy.
HD: Quá quen thuộc bên sinh học chúng ta cũng đã biết nhờ ánh sáng mặt trời + chất diệp lục ⇒ cây tổng hợp tinh bột từ CO2 và H2O, thải ra khí O2 cho môi trường ⇒ đó là quá trình quang hợp:
6nCO2 + 5nH2O ––ánh sáng, chlorophyll→ (C6H10O5)n (tinh bột) + 6nO2.
⇒ Chọn đáp án B Đáp án: B
6nCO2 + 5nH2O ––ánh sáng, chlorophyll→ (C6H10O5)n (tinh bột) + 6nO2.
⇒ Chọn đáp án B Đáp án: B
Câu 13 [703966]: Tên gọi của ester CH3COOCH(CH3)2 là
A, methyl acetate.
B, propyl acetate.
C, ethyl acetate.
D, isopropyl acetate.
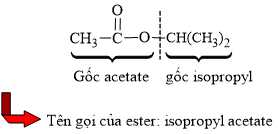
⇒ Chọn đáp án D Đáp án: D
Câu 14 [703967]: “Xà phòng là hỗn hợp muối ...(1)... của ...(2)... và các chất phụ gia”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, sodium và calcium, chất béo.
B, sodium và potassium, chất béo.
C, sodium và potassium, acid béo.
D, potassium và barium, acid béo.
Xà phòng là hỗn hợp các muối sodium và potassium của acid béo và một số chất phụ gia. Các acid béo ở đây thường là acid no như palmitic acid, stearic acid. Chất phụ gia thường dùng là chất độn làm tăng độ cứng để dễ đúc thành bánh, chất tạo màu và chất tạo hương.
⇒ Chọn đáp án C Đáp án: C
⇒ Chọn đáp án C Đáp án: C
Câu 15 [703968]: Phản ứng của ethylene với H₂O tạo thành ethanol như sau:
CH2=CH2 + H2O CH3–CH2–OH
CH3–CH2–OH
Giai đoạn (3) trong cơ chế phản ứng trên xảy ra quá trình tách proton (tách H+) để tạo ra alcohol.
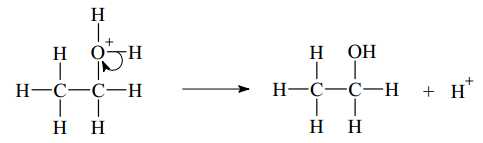
Tại sao quá trình tách H+ còn được gọi là tách proton?
CH2=CH2 + H2O
 CH3–CH2–OH
CH3–CH2–OHGiai đoạn (3) trong cơ chế phản ứng trên xảy ra quá trình tách proton (tách H+) để tạo ra alcohol.
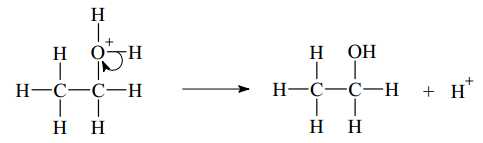
Tại sao quá trình tách H+ còn được gọi là tách proton?
A, Vì ion H+ không chứa electron và chỉ có proton.
B, Vì ion H+ không chứa proton và chỉ có electron.
C, Vì hạt nhân nguyên tử O mất proton trong quá trình tách H+.
D, Vì liên kết σ bị cắt đứt sẽ hình thành thêm hạt proton cho ion H+.
Nguyên tử có 11H electron lớp ngoài cùng và không có neutron, ở dạng H+ đã bị tách 1 electron nên chỉ còn 1 proton nên tách H+ cũng sẽ coi là tách proton.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 16 [703969]: Điểm đẳng điện pI là giá trị pH mà tại đó tổng điện tích của một phân tử amino acid bằng 0. Điểm đẳng điện pI được xác định bởi công thức:
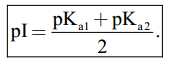
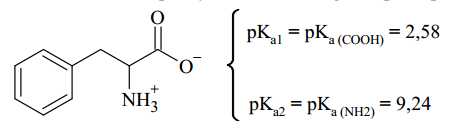
Cho công thức cấu tạo của amino acid phenylalanine và các giá trị pKa1, pKa2 như sau:
Phát biểu nào sau đây là không đúng khi nói về amino acid phenylalanine?
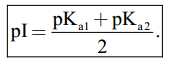
Cho công thức cấu tạo của amino acid phenylalanine và các giá trị pKa1, pKa2 như sau:

Phát biểu nào sau đây là không đúng khi nói về amino acid phenylalanine?
A, Phenylalanie là một α-amino acid.
B, Tại pH = 5,91, phenylalanine tồn tại chủ yếu ở dạng trung hòa điện.
C, Ở pH = 10,5, nhóm NH2 của phenylalanine bị chuyển hóa thành nhóm NH3+.
D, Do có nhóm carboxylic nên phenylalanine có thể tác dụng với NaOH.
Phenylalanie có giá trị điểm đẳng điện là:
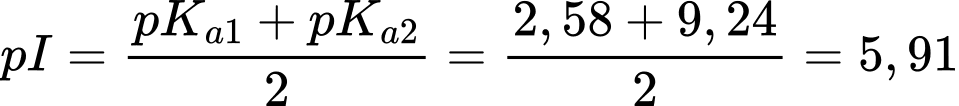
Phân tích các phát biểu:
✔️ A. Đúng. Phenylalanie là một α-amino acid do nhóm amino được gắn ở carbon số 2.
✔️ B. Đúng. Tại pH = 5,91 = pI thì phenylalanine tồn tại chủ yếu ở dạng trung hòa điện do tổng điện tích bằng 0.
❌ C. Sai. Ở pH = 10,5 > pI = 5,91 thì phenylalanine tồn tại chủ yếu ở dạng anion do nhóm COOH chuyển thành COO-.
✔️ D. Đúng. Amino acid có nhóm NH2 và nhóm COOH là chất lưỡng tính nên tác dụng được với dung dịch acid và base nên tác dụng được với NaOH.
⇒ Chọn đáp án C Đáp án: C
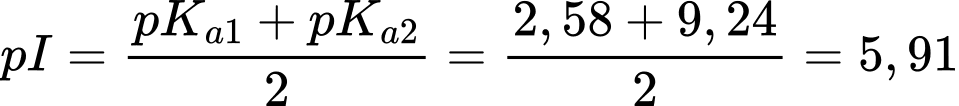
Phân tích các phát biểu:
✔️ A. Đúng. Phenylalanie là một α-amino acid do nhóm amino được gắn ở carbon số 2.
✔️ B. Đúng. Tại pH = 5,91 = pI thì phenylalanine tồn tại chủ yếu ở dạng trung hòa điện do tổng điện tích bằng 0.
❌ C. Sai. Ở pH = 10,5 > pI = 5,91 thì phenylalanine tồn tại chủ yếu ở dạng anion do nhóm COOH chuyển thành COO-.
✔️ D. Đúng. Amino acid có nhóm NH2 và nhóm COOH là chất lưỡng tính nên tác dụng được với dung dịch acid và base nên tác dụng được với NaOH.
⇒ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Trong các nghiên cứu ban đầu, người ta quan sát thấy rằng khi phức chất [Co(NH3)4Br2]Br được đặt trong nước, độ dẫn điện của dung dịch với nồng độ phức chất 0,05 M thay đổi gia tăng từ giá trị ban đầu là 191 ohm–1 thành giá trị cuối cùng là 374 ohm–1 trong khoảng thời gian khoảng một giờ.
Câu 17 [703970]: Viết phương trình hóa học mô tả cho hiện tượng trên là
A, [Co(NH3)4Br2]Br(aq) 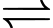 [Co(NH3)4Br2]+(aq) + Br–(aq).
[Co(NH3)4Br2]+(aq) + Br–(aq).
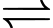 [Co(NH3)4Br2]+(aq) + Br–(aq).
[Co(NH3)4Br2]+(aq) + Br–(aq).B, [Co(NH3)4Br2]Br(aq) 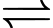 [Co(NH3)4Br]2+(aq) + 2Br–(aq).
[Co(NH3)4Br]2+(aq) + 2Br–(aq).
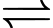 [Co(NH3)4Br]2+(aq) + 2Br–(aq).
[Co(NH3)4Br]2+(aq) + 2Br–(aq).C, [Co(NH3)4Br2]Br(aq) 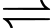 [Co(NH3)4]3+(aq) + 3Br–(aq).
[Co(NH3)4]3+(aq) + 3Br–(aq).
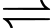 [Co(NH3)4]3+(aq) + 3Br–(aq).
[Co(NH3)4]3+(aq) + 3Br–(aq).D, [Co(NH3)4Br2]Br(aq)  [CoBr3](aq) + 4NH3(aq).
[CoBr3](aq) + 4NH3(aq).
 [CoBr3](aq) + 4NH3(aq).
[CoBr3](aq) + 4NH3(aq).
[Co(NH3)4Br2]Br(aq) ⇌ Co(NH3)4Br2]+(aq) + Br-(aq)
Sau 1 giờ phương trình phân li đặt trạng thái cân bằng nên sẽ có thêm nhiều ion trong dung dịch dẫn đến độ dẫn điện tăng.
⇒ Chọn đáp án A Đáp án: A
Sau 1 giờ phương trình phân li đặt trạng thái cân bằng nên sẽ có thêm nhiều ion trong dung dịch dẫn đến độ dẫn điện tăng.
⇒ Chọn đáp án A Đáp án: A
Câu 18 [703971]: Một dung dịch 500 mL được tạo thành bằng cách hòa tan 3,67 gam phức chất. Lấy 25,00 mL dung dịch, chuẩn độ bằng dung dịch AgNO3 0,01 M. Thể tích dung dịch dung dịch AgNO3 để kết tủa Br– tự do là bao nhiêu? Biết nguyên tử khối của Co là 59 g/mol.
A, 50 mL.
B, 25 mL.
C, 10 mL.
D, 5 mL.
Đổi 500 mL = 0,5 L; 25 mL = 0,025 L
Số mol của [Co(NH3)4Br2]Br trong 500 mL là:
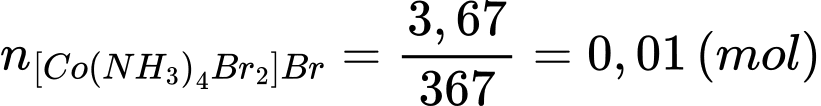
Số mol của [Co(NH3)4Br2]Br trong 25 mL là:
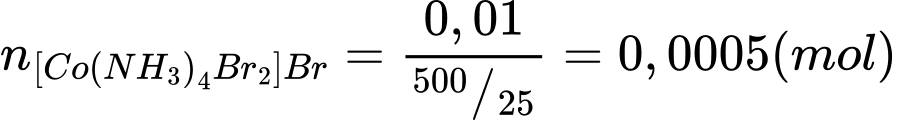
AgNO3 + [Co(NH3)4Br2]Br ⟶ AgBr↓ + [Co(NH3)4Br2]NO3
Thể tích dung dịch AgNO3 đã dùng là:
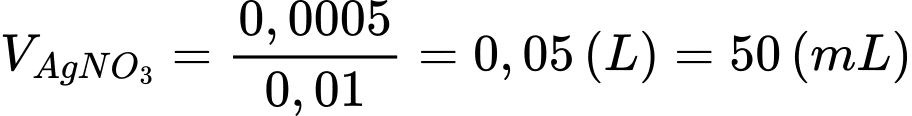
⇒ Chọn đáp án A Đáp án: A
Số mol của [Co(NH3)4Br2]Br trong 500 mL là:
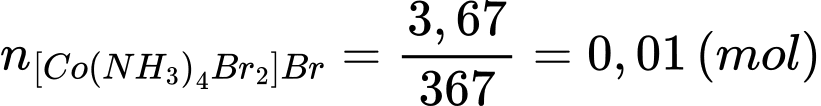
Số mol của [Co(NH3)4Br2]Br trong 25 mL là:
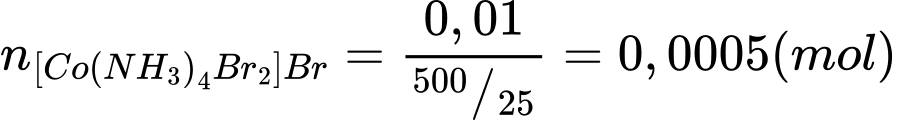
AgNO3 + [Co(NH3)4Br2]Br ⟶ AgBr↓ + [Co(NH3)4Br2]NO3
Thể tích dung dịch AgNO3 đã dùng là:
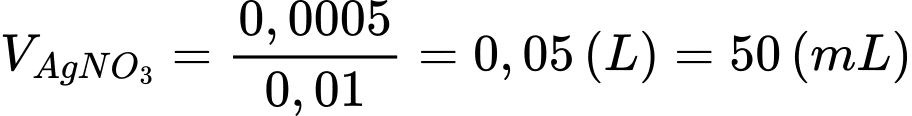
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [703972]: Trong công nghiệp copper (II) sulfate pentahydrate được sản xuất từ copper(II) oxide theo sơ đồ sau:
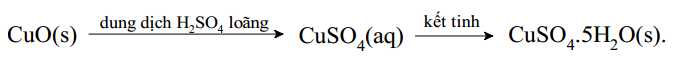
Dung dịch copper(II) sulfate ở các nồng độ thích hợp có thể giúp xử lí tảo xanh trong ao. Nếu tảo xanh phát triển quá mạnh sẽ ngăn cản oxygen khuyếch tán vào trong nước, đồng thời trong quá trình phát triển cũng sẽ lấy đi một phần oxygen. Điều này làm nồng độ oxygen hòa tan trong nước giảm và các sinh vật trong nước như tôm, cá sẽ chết. Một ao nuôi thuỷ sản có diện tích bề mặt nước là 2000 m2, độ sâu trung bình của nước trong ao là 1,0 m đang có hiện tượng phú dưỡng. Để xử lí tảo, người dân cần cho CuSO4.5H2O vào ao trong 3 ngày, mỗi ngày một lần, mỗi lần là 0,25 gam/m3 nước trong ao.
Dung dịch copper(II) sulfate ở các nồng độ thích hợp có thể giúp xử lí tảo xanh trong ao. Nếu tảo xanh phát triển quá mạnh sẽ ngăn cản oxygen khuyếch tán vào trong nước, đồng thời trong quá trình phát triển cũng sẽ lấy đi một phần oxygen. Điều này làm nồng độ oxygen hòa tan trong nước giảm và các sinh vật trong nước như tôm, cá sẽ chết. Một ao nuôi thuỷ sản có diện tích bề mặt nước là 2000 m2, độ sâu trung bình của nước trong ao là 1,0 m đang có hiện tượng phú dưỡng. Để xử lí tảo, người dân cần cho CuSO4.5H2O vào ao trong 3 ngày, mỗi ngày một lần, mỗi lần là 0,25 gam/m3 nước trong ao.
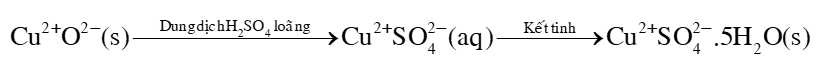
Thể tích của ao cá là 2000.1,0 = 2000 (m3)
Tổng khối lượng CuSO4.5H2O đã cho vào trong ao cá trong 3 ngày là 2000.3.0,25 = 1500 (gam) = 1,5 (kg)
Phân tích các phát biểu:
✔️ a) Đúng. Trong toàn bộ quá trình sản xuất CuSO4.5H2O số oxi hóa của nguyên tố đồng không đổi, số oxi hóa của đồng là +2.
✔️ b) Đúng. Sau khi kết tinh thu được tinh thể đồng CuSO4.5H2O màu xanh lam, CuSO4 khan có màu trắng.
❌ c) Sai. Phú dưỡng hay phú dưỡng hóa là tình trạng mà ao hồ, sông ngòi tiếp nhận các nguồn thải chứa chất dinh dưỡng như phosphorous, nitrogen một cách quá mức.
Việc dư thừa các chất dinh dưỡng trong môi trường nước làm đẩy mạnh sự phát triển của tảo, làm mất cân bằng hệ sinh thái dưới nước và làm suy giảm chất lượng nguồn nước.
❌ d) Sai. Tổng khối lượng CuSO4.5H2O đã cho vào ao trong 3 ngày là 1,5 kg.
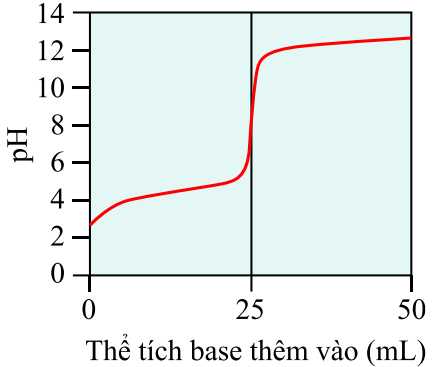
Câu 20 [703973]: Tiến trình chuẩn độ acid-base có thể được theo dõi bằng cách đo độ pH của dung dịch được chuẩn độ trong khi thêm base. Đồ thị kết quả, được gọi là đường cong chuẩn độ, là đồ thị của độ pH phụ thuộc vào thể tích của base thêm vào. Đồ thị hiển thị ở dưới đây là đường cong chuẩn độ của acid HX chưa biết nồng độ, được chuẩn độ bằng NaOH 0,100 M.

Phân tích các phát biểu:
✔️ a) Đúng. Từ đồ thị thấy rằng khi thể tích của dung dịch base dùng để chuẩn độ tăng thì pH của dung dịch tăng. Ban đầu pH dung dịch khoảng bằng 3, khi thêm thể tích đến 25 mL thì pH lên đến khoảng 12.
❌ b) Sai. Tại điểm tương đương được đánh dấu dưới đây, pH của dung dịch xác định được ở khoảng hơn 8.
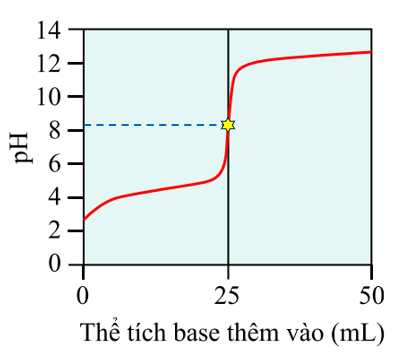
❌ c) Sai. Tại điểm tương đương đã được đánh dấu, dóng xuống thì thu được thể tích dung dịch NaOH đã dùng là 25 mL.
❌ d) Sai. Để xác định được nồng độ của acid HX thì ta cần biết số mol HX và thể tích dung dịch HX đã dùng theo công thức:
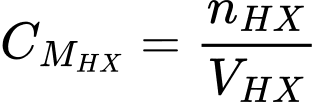
Số mol của HX có thể tính được theo số mol của NaOH theo phương trình: HX + NaOH ⟶ NaX + H2O; nên không cần biết khối lượng của HX.
✔️ a) Đúng. Từ đồ thị thấy rằng khi thể tích của dung dịch base dùng để chuẩn độ tăng thì pH của dung dịch tăng. Ban đầu pH dung dịch khoảng bằng 3, khi thêm thể tích đến 25 mL thì pH lên đến khoảng 12.
❌ b) Sai. Tại điểm tương đương được đánh dấu dưới đây, pH của dung dịch xác định được ở khoảng hơn 8.

❌ c) Sai. Tại điểm tương đương đã được đánh dấu, dóng xuống thì thu được thể tích dung dịch NaOH đã dùng là 25 mL.
❌ d) Sai. Để xác định được nồng độ của acid HX thì ta cần biết số mol HX và thể tích dung dịch HX đã dùng theo công thức:
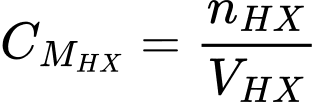
Số mol của HX có thể tính được theo số mol của NaOH theo phương trình: HX + NaOH ⟶ NaX + H2O; nên không cần biết khối lượng của HX.
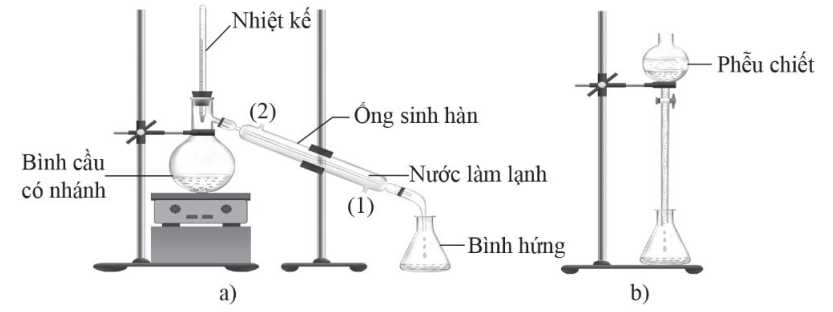
Câu 21 [703974]: Tiến hành thí nghiệm điều chế propyl acetate (chất có mùi thơm như quả lê) theo thứ tự các bước sau đây:
Bước 1: Cho khoảng 10 mL CH3CH2CH2OH, 10 mL CH3COOH và 5 mL H2SO4 đặc vào bình cầu có nhánh.
Bước 2: Tiến hành đun nóng khoảng 5 – 7 phút ở 65 – 70°C.
Bước 3: Làm lạnh bằng ống sinh hàn, thu được chất lỏng ở bình hứng.
Bước 4: Cho chất lỏng ở bình hứng vào phễu chiết, sau đó thêm dung dịch NaCl bão hòa vào phễu chiết và tách lấy ester propyl acetate.
Bước 1: Cho khoảng 10 mL CH3CH2CH2OH, 10 mL CH3COOH và 5 mL H2SO4 đặc vào bình cầu có nhánh.
Bước 2: Tiến hành đun nóng khoảng 5 – 7 phút ở 65 – 70°C.
Bước 3: Làm lạnh bằng ống sinh hàn, thu được chất lỏng ở bình hứng.
Bước 4: Cho chất lỏng ở bình hứng vào phễu chiết, sau đó thêm dung dịch NaCl bão hòa vào phễu chiết và tách lấy ester propyl acetate.

Phân tích các phát biểu:
✔️ a) Đúng. Phản ứng cần đun nóng ở 65 – 70 oC thì mới xảy ra được, dùng nhiệt kế để đảm bảo nhiệt độ trong khoảng đấy (duy trì nhiệt độ này là phù hợp vì chỉ cần đun ở nhiệt độ cao hơn, ví dụ 97 oC thì propan-1-ol đã bị bay hơi).
✔️ b) Đúng. Khi lắp ống sinh hàn thì nước phải được đi vào từ đầu thấp phía dưới và đi ra từ đầu phía trên. Nếu lắp ngược lại sẽ gây ra hiện tượng thiếu nước cho ống sinh hàn, khiến ống bị nóng và có thể gây vết nứt và làm giảm hiệu quả của sự ngưng tụ.
❌ c) Sai. Ester thường nhẹ hơn nước nên sẽ nổi trên mặt nước, phần chất lỏng phía trên là propyl acetate và phía dưới là nước.
❌ d) Sai. Chất có nhiệt độ sôi thấp hơn sẽ bay hơn trước, chất lỏng trong bình hứng có phần lớn là ester.
✔️ a) Đúng. Phản ứng cần đun nóng ở 65 – 70 oC thì mới xảy ra được, dùng nhiệt kế để đảm bảo nhiệt độ trong khoảng đấy (duy trì nhiệt độ này là phù hợp vì chỉ cần đun ở nhiệt độ cao hơn, ví dụ 97 oC thì propan-1-ol đã bị bay hơi).
✔️ b) Đúng. Khi lắp ống sinh hàn thì nước phải được đi vào từ đầu thấp phía dưới và đi ra từ đầu phía trên. Nếu lắp ngược lại sẽ gây ra hiện tượng thiếu nước cho ống sinh hàn, khiến ống bị nóng và có thể gây vết nứt và làm giảm hiệu quả của sự ngưng tụ.
❌ c) Sai. Ester thường nhẹ hơn nước nên sẽ nổi trên mặt nước, phần chất lỏng phía trên là propyl acetate và phía dưới là nước.
❌ d) Sai. Chất có nhiệt độ sôi thấp hơn sẽ bay hơn trước, chất lỏng trong bình hứng có phần lớn là ester.
Câu 22 [703975]: Một học sinh tiến hành tống hợp isoamyl acetate (thành phần chính của dầu chuối) từ acetic acid và isoamyl alcohol theo phương trình hóa học sau:
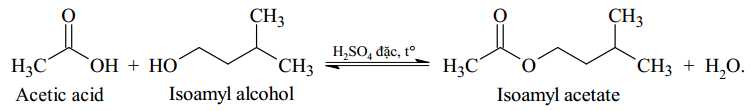
Sau thí nghiệm, tiến hành phân tách sản phẩm. Ghi phổ hồng ngoại của acetic acid, isoamyl alcohol và isoamyl acetate. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng như sau:
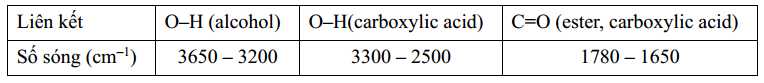
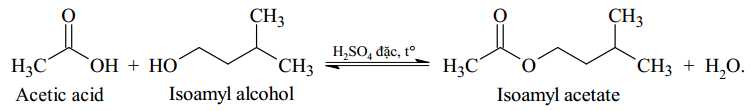
Sau thí nghiệm, tiến hành phân tách sản phẩm. Ghi phổ hồng ngoại của acetic acid, isoamyl alcohol và isoamyl acetate. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng như sau:
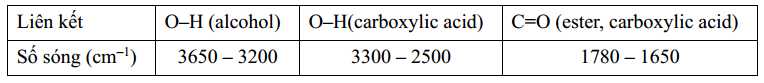
Phân tích các phát biểu:
❌ a) Sai. Phản ứng trong thí nghiệm là phản ứng ester hóa.
✔️ b) Đúng. Tín hiệu của nhóm O-H (alcohol) có số sóng hấp thụ đặc trung 3650-3200 cm-1.
✔️ c) Đúng. Isoamyl acetate, có tín hiệu đặc trưng cho liên kết C=O (ester, carboxylic acid) với số sóng 1780 - 1650 cm-1.
✔️ d) Đúng.
Isoamyl acetate, có tín hiệu đặc trưng cho liên kết C=O (ester, carboxylic acid) với số sóng 1780 - 1650 cm-1.
Isoamyl alcohol, có tín hiệu đặc trưng cho liên kết O-H (alcohol) với số sóng 3650 - 3200 cm-1.
Acetic acid, có tín hiệu đặc trưng cho liên kết C=O (ester, carboxylic acid) với số sóng 1780-1650 cm-1 và O-H (carboxylic acid) với số sóng 3300 - 2500 cm-1.
❌ a) Sai. Phản ứng trong thí nghiệm là phản ứng ester hóa.
✔️ b) Đúng. Tín hiệu của nhóm O-H (alcohol) có số sóng hấp thụ đặc trung 3650-3200 cm-1.
✔️ c) Đúng. Isoamyl acetate, có tín hiệu đặc trưng cho liên kết C=O (ester, carboxylic acid) với số sóng 1780 - 1650 cm-1.
✔️ d) Đúng.
Isoamyl acetate, có tín hiệu đặc trưng cho liên kết C=O (ester, carboxylic acid) với số sóng 1780 - 1650 cm-1.
Isoamyl alcohol, có tín hiệu đặc trưng cho liên kết O-H (alcohol) với số sóng 3650 - 3200 cm-1.
Acetic acid, có tín hiệu đặc trưng cho liên kết C=O (ester, carboxylic acid) với số sóng 1780-1650 cm-1 và O-H (carboxylic acid) với số sóng 3300 - 2500 cm-1.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [703976]: Làm mềm 10 m3 nước cứng có tổng nồng độ Mg2+ và Ca2+ là 5,5 mmol/L bằng Na2CO3, thu được nước có tổng nồng độ Mg2+ và Ca2+ là 1,5 mmol/L. Coi toàn bộ lượng Na2CO3 cho vào đều chuyển hết thành kết tủa CaCO3 và MgCO3. Khối lượng Na2CO3 đã dùng là bao nhiêu?
Đổi 10 m3 = 10000 L
Mg2+ + CO32- ⟶ MgCO3
Ca2+ + CO32- ⟶ CaCO3
Số mol Na2CO3 đã dùng để làm mềm 10 m3 nước cứng là
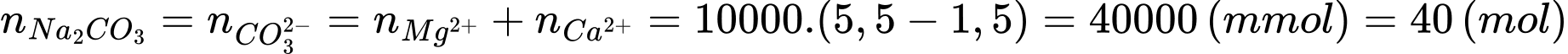
Khối lượng Na2CO3 đã dùng để làm mềm 10 m3 nước cứng là:
mNa2CO3 = 40 . 106 = 4240 (gam)
⇒ Điền đáp án: 4240
Mg2+ + CO32- ⟶ MgCO3
Ca2+ + CO32- ⟶ CaCO3
Số mol Na2CO3 đã dùng để làm mềm 10 m3 nước cứng là
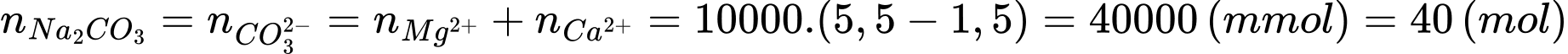
Khối lượng Na2CO3 đã dùng để làm mềm 10 m3 nước cứng là:
mNa2CO3 = 40 . 106 = 4240 (gam)
⇒ Điền đáp án: 4240
Câu 24 [703977]: Đun nóng một loại mỡ động vật với dung dịch KOH, sản phẩm thu được có chứa muối potassium stearate (C17H35COOK). Phân tử khối của potassium stearate là bao nhiêu?
Phân tử khối của potassium stearate là:
M = 12.17 + 1.35 + 12 + 16.2 + 39 = 322 (gam/mol)
⇒ Điền đáp án: 322
M = 12.17 + 1.35 + 12 + 16.2 + 39 = 322 (gam/mol)
⇒ Điền đáp án: 322
Câu 25 [703978]: Có tổng số bao nhiêu đồng phân cấu tạo amine bậc 3 ứng với công thức phân tử C5H13N?
Amine bậc ba là các amine trong phân tử có nhóm chức dạng ≡N đính với ba gốc hydrocarbon.
Có 3 đồng phân cấu tạo amine bậc 3 ứng với công thức phân tử C5H13N như sau:
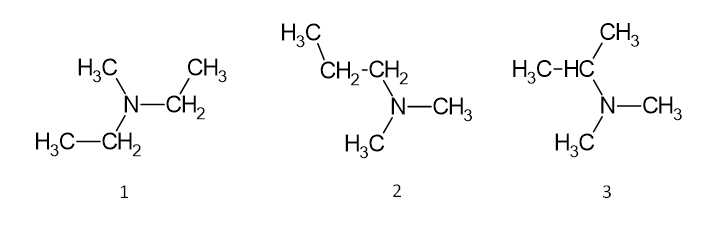
⇒ Điền đáp án: 3
Có 3 đồng phân cấu tạo amine bậc 3 ứng với công thức phân tử C5H13N như sau:

⇒ Điền đáp án: 3
Câu 26 [703979]: Năng lượng có thể được cung cấp cho cơ thể bằng cách ăn thức ăn. Các loại thực phẩm, chẳng hạn như glucose (C6H12O6), được chuyển hóa tạo thành CO2 và H2O:
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l); ΔrHo = – 2803 kJ.
Một loại thực phẩm cung cấp khoảng 5 gam glucose, giả sử toàn bộ lượng năng lượng được cơ thể hấp thụ. Tính tổng năng lượng (theo kJ, làm tròn đến hàng phần mười) mà cơ thể được nhận khi chuyển hoá loại thực phẩm này?
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l); ΔrHo = – 2803 kJ.
Một loại thực phẩm cung cấp khoảng 5 gam glucose, giả sử toàn bộ lượng năng lượng được cơ thể hấp thụ. Tính tổng năng lượng (theo kJ, làm tròn đến hàng phần mười) mà cơ thể được nhận khi chuyển hoá loại thực phẩm này?
Quan sát lại quá trình chuyển hóa:
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l); ΔrHo = – 2803 kJ.
⇒ Tỉ lệ: cứ 1 mol glucose tương ứng 180 gam glucose chuyển hóa cơ thể nhận được 2803 kJ (Δ < 0).
⇒ chuyển hóa 5 gam glucose thì cơ thể nhận được 5 × 2803 ÷ 180 ≈ 77,86 ≈ 77,9 kJ
⇒ Điền đáp án: 77,9
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l); ΔrHo = – 2803 kJ.
⇒ Tỉ lệ: cứ 1 mol glucose tương ứng 180 gam glucose chuyển hóa cơ thể nhận được 2803 kJ (Δ < 0).
⇒ chuyển hóa 5 gam glucose thì cơ thể nhận được 5 × 2803 ÷ 180 ≈ 77,86 ≈ 77,9 kJ
⇒ Điền đáp án: 77,9
Câu 27 [703980]: Phân superphosphate là hỗn hợp chủ yếu chứa calcium dihydrogen phosphate (Ca(H2PO4)2; 234,05 g/mol) và calcium sulfate (CaSO4; 136,14 g/mol). Loại phân này được sản xuất bằng cách xử lí một loại quặng fluorapatite (thành phần chính là Ca5(PO4)3F), với sulfuric acid tinh khiết ở nhiệt độ và áp suất thông thường. Phản ứng này tạo thành duy nhất một chất khí hydrogen fluoride (HF), calcium dihydrogen phosphate rắn và calcium sulfate rắn. Độ dinh dưỡng của phân lân này là bao nhiêu biết loại phân này được sản xuất từ quặng fluorapatite tinh khiết.
Giả sử có 1 mol Ca5(PO4)3F
2Ca5(PO4)3F(s) + 7H2SO4(aq) ⟶ 3Ca(H2PO4)2 + 7CaSO4(aq) + 2HF(g)
Từ tỉ lệ phương trình số mol của Ca(H2PO4)2 và CaSO4 lần lượt là nCa(H2PO4)2 = 1,5 (mol) và nCaSO4 = 3,5 (mol)
Tổng khối lượng phân bón là:
mCa(H2PO4)2 + mCaSO4 = 1,5.234,05 + 3,5.136,14 = 827,565 (g)
Bảo toàn nguyên tố phosphorus ta được:
nP2O5 = nCa(H2PO4)2 = 1,5 (mol)
Độ dinh dưỡng của phân superphosphate là:

⇒ Điền đáp án: 25,7
2Ca5(PO4)3F(s) + 7H2SO4(aq) ⟶ 3Ca(H2PO4)2 + 7CaSO4(aq) + 2HF(g)
Từ tỉ lệ phương trình số mol của Ca(H2PO4)2 và CaSO4 lần lượt là nCa(H2PO4)2 = 1,5 (mol) và nCaSO4 = 3,5 (mol)
Tổng khối lượng phân bón là:
mCa(H2PO4)2 + mCaSO4 = 1,5.234,05 + 3,5.136,14 = 827,565 (g)
Bảo toàn nguyên tố phosphorus ta được:
nP2O5 = nCa(H2PO4)2 = 1,5 (mol)
Độ dinh dưỡng của phân superphosphate là:

⇒ Điền đáp án: 25,7
Câu 28 [703981]: Sự gia tăng hàm lượng nitrate trong nước là một trong những nguyên nhân của hiện tượng phú dưỡng. Để xác định hàm lượng nitrate trong nước, người ta tiến hành các thí nghiệm như sau:
Thí nghiệm 1: Lấy 10,0 mL dung dịch muối Mohr (NH4)2SO4.FeSO4.6H2O, thêm dung dịch H2SO4 1 M vào và chuẩn độ bằng dung dịch KMnO4.
Thí nghiệm 2: Lấy 10,0 mL dung dịch muối Mohr cho vào 100 mL nước chứa ion nitrate, sau đó thêm NaOH(s) vào để đạt khoảng 28%, khi đó muối Mohr khử nitrate thành ammonia theo các phản ứng:
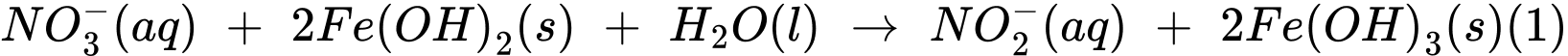
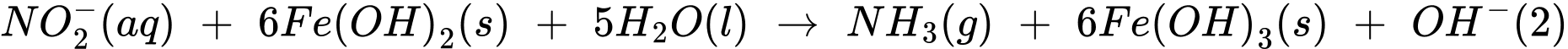
Sau khi các phản ứng (1) và (2) xảy ra hoàn toàn, lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 1M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 (Các chất và ion khác trong dung dịch không phản ứng với KMnO4). Hãy cho biết mỗi mmol KMnO4 chênh lệch giữa thí nghiệm 1 với thí nghiệm 2 sẽ tương ứng với bao nhiêu mg có trong mẫu nước (làm tròn đến hàng phần mười).
có trong mẫu nước (làm tròn đến hàng phần mười).
Thí nghiệm 1: Lấy 10,0 mL dung dịch muối Mohr (NH4)2SO4.FeSO4.6H2O, thêm dung dịch H2SO4 1 M vào và chuẩn độ bằng dung dịch KMnO4.
Thí nghiệm 2: Lấy 10,0 mL dung dịch muối Mohr cho vào 100 mL nước chứa ion nitrate, sau đó thêm NaOH(s) vào để đạt khoảng 28%, khi đó muối Mohr khử nitrate thành ammonia theo các phản ứng:
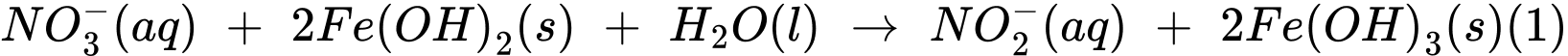
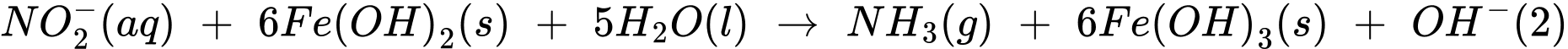
Sau khi các phản ứng (1) và (2) xảy ra hoàn toàn, lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 1M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 (Các chất và ion khác trong dung dịch không phản ứng với KMnO4). Hãy cho biết mỗi mmol KMnO4 chênh lệch giữa thí nghiệm 1 với thí nghiệm 2 sẽ tương ứng với bao nhiêu mg
 có trong mẫu nước (làm tròn đến hàng phần mười).
có trong mẫu nước (làm tròn đến hàng phần mười).
Gọi tổng số mol MnO4- cần dùng trong thí nghiệm 1 là a (mol), ta có:
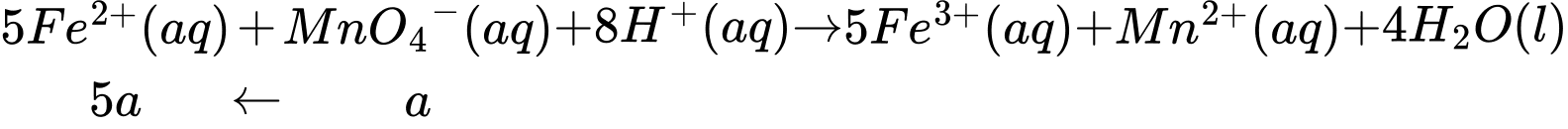
Gọi số mol NO3- đã dùng ở thí nghiệm 2 là b (mol), ta có:
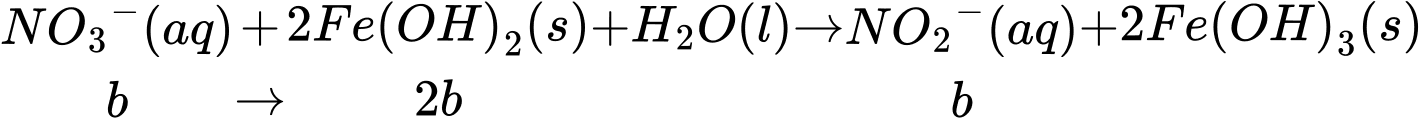
Lượng NO2- sinh ra là b (mol) tiếp tục phản ứng với Fe(OH)2
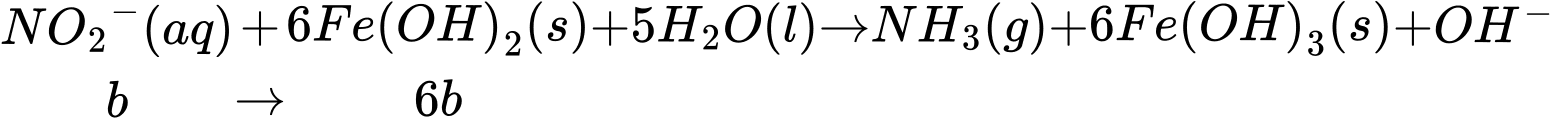
Thấy ban đầu ta có tổng số mol Fe2+ = 5a (mol), đã dùng hết (2b + 6b) mol ở thí nghiệm 2 nên lượng Fe2+ dư còn lại là:
nFe2+ dư = 5a - 8b (mol). Khi này, quá trình lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 1M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 xảy ra như sau:
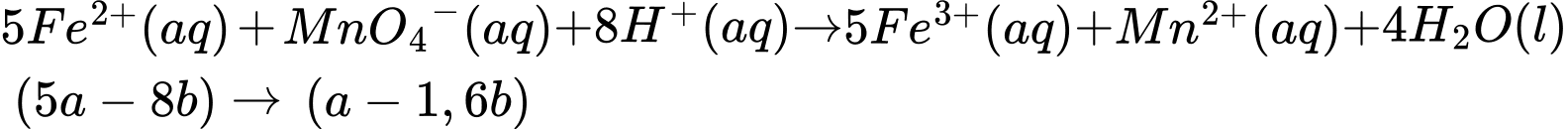
⇒ Số mol MnO4- chênh lệch là: nMnO4- (TN1) - nMnO4- (TN2) = a - (a - 1,6b) = 1,6b (mol)
Coi 1,6b (mol) = 1 (mmol) = 1x10-3 (mol) ⟶ b = 6,25x10-4 (mol)
Khối lượng NO3- có trong mẫu nước tương ứng với số mol MnO4- chênh lệch là:
mNO3- = 62.b = 62 . 6,25x10-4 = 0,03875 (g) = 38,75 (mg) ≈ 38,8 (mg)
⇒ Điền đáp án: 38,8
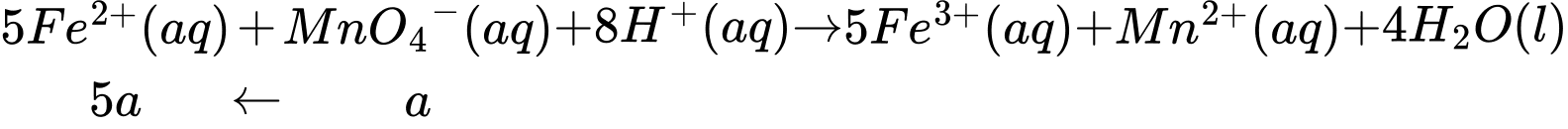
Gọi số mol NO3- đã dùng ở thí nghiệm 2 là b (mol), ta có:
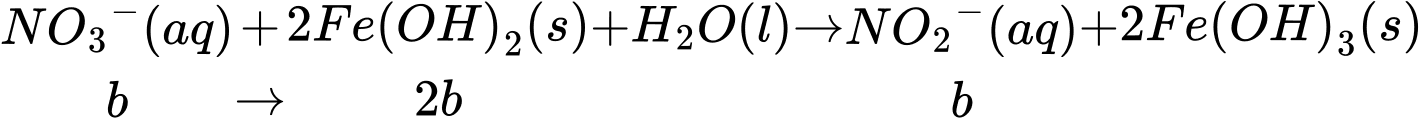
Lượng NO2- sinh ra là b (mol) tiếp tục phản ứng với Fe(OH)2
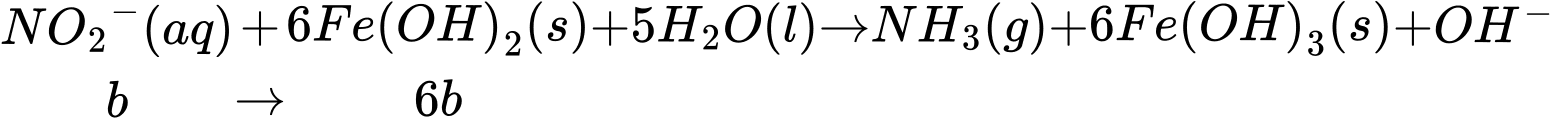
Thấy ban đầu ta có tổng số mol Fe2+ = 5a (mol), đã dùng hết (2b + 6b) mol ở thí nghiệm 2 nên lượng Fe2+ dư còn lại là:
nFe2+ dư = 5a - 8b (mol). Khi này, quá trình lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 1M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 xảy ra như sau:
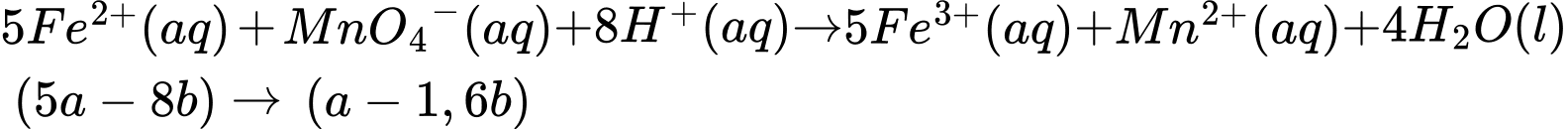
⇒ Số mol MnO4- chênh lệch là: nMnO4- (TN1) - nMnO4- (TN2) = a - (a - 1,6b) = 1,6b (mol)
Coi 1,6b (mol) = 1 (mmol) = 1x10-3 (mol) ⟶ b = 6,25x10-4 (mol)
Khối lượng NO3- có trong mẫu nước tương ứng với số mol MnO4- chênh lệch là:
mNO3- = 62.b = 62 . 6,25x10-4 = 0,03875 (g) = 38,75 (mg) ≈ 38,8 (mg)
⇒ Điền đáp án: 38,8