PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [703982]: “Các kim loại nhóm IA có độ cứng ...(1)... do có liên kết kim loại ...(2)...”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, cao, mạnh.
B, cao, yếu.
C, thấp, yếu.
D, thấp, mạnh.
Kim loại nhóm IA (kim loại kiềm) có một electron hóa trị duy nhất trong phân lớp s, dẫn đến mật độ electron tự do thấp.
Liên kết kim loại trong các kim loại này yếu vì số electron tham gia vào liên kết ít và cấu trúc mạng tinh thể lỏng lẻo.
Điều này khiến các kim loại nhóm IA mềm, có độ cứng thấp do có liên kết kim loại yếu.
⇒ Chọn đáp án C Đáp án: C
Liên kết kim loại trong các kim loại này yếu vì số electron tham gia vào liên kết ít và cấu trúc mạng tinh thể lỏng lẻo.
Điều này khiến các kim loại nhóm IA mềm, có độ cứng thấp do có liên kết kim loại yếu.
⇒ Chọn đáp án C Đáp án: C
Câu 2 [309471]: Loại tơ nào sau đây khi đốt cháy hoàn toàn chỉ thu được CO2 và H2O?
A, Tơ olon.
B, Tơ lapsan.
C, Tơ nylon-6,6.
D, Tơ tằm.
Phân tích các đáp án:
❌A. Tơ olon có công thức cấu tạo là [-CH2-CH(CN)-]n ⇒ đốt cháy thu được N2, CO2 và H2O.
✔️B. Tơ lapsan là [-OC2H4OOCC6H4COO-]n ⇒ đốt cháy thu được CO2 và H2O.
❌C. Tơ nylon-6,6 là [-HN(CH2)6NHOC(CH2)4CO-]n ⇒ đốt cháy thu được N2, CO2 và H2O.
❌D. Tơ tằm có bản chất là protein ⇒ đốt cháy thu được N2, CO2 và H2O.
⇒ Chọn đáp án B Đáp án: B
❌A. Tơ olon có công thức cấu tạo là [-CH2-CH(CN)-]n ⇒ đốt cháy thu được N2, CO2 và H2O.
✔️B. Tơ lapsan là [-OC2H4OOCC6H4COO-]n ⇒ đốt cháy thu được CO2 và H2O.
❌C. Tơ nylon-6,6 là [-HN(CH2)6NHOC(CH2)4CO-]n ⇒ đốt cháy thu được N2, CO2 và H2O.
❌D. Tơ tằm có bản chất là protein ⇒ đốt cháy thu được N2, CO2 và H2O.
⇒ Chọn đáp án B Đáp án: B
Câu 3 [703983]: Để lợp nhà, các tấm tôn (thép mỏng mạ kẽm) được gắn với nhau bởi các đinh thép. Theo thời gian, các tấm tôn bị ăn mòn. Cho các nhận định sau:
(a) Vị trí đóng đinh thép dễ xảy ra ăn mòn hơn các vị trí khác.
(b) Tấm tôn bị ăn mòn từ trong ra ngoài do thép bị ăn mòn trước kẽm.
(c) Sắt trong tấm tôn không bị ăn mòn theo thời gian.
(d) Lớp tráng kẽm bị ăn mòn trước.
Trong các nhận định trên, những nhận định nào đúng?
(a) Vị trí đóng đinh thép dễ xảy ra ăn mòn hơn các vị trí khác.
(b) Tấm tôn bị ăn mòn từ trong ra ngoài do thép bị ăn mòn trước kẽm.
(c) Sắt trong tấm tôn không bị ăn mòn theo thời gian.
(d) Lớp tráng kẽm bị ăn mòn trước.
Trong các nhận định trên, những nhận định nào đúng?
A, (a), (b).
B, (a), (d).
C, (b), (c).
D, (a), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Vị trí đóng đinh thép dễ xảy ra ăn mòn hơn vị trí khác vì tại vị trí đinh thép tiếp xúc giữa Fe-C-Zn để lâu ngày trong không khí ẩm sẽ bị ăn mòn điện hóa. Các vị trí khác do được tráng kẽm nên bị ăn mòn chậm hơn.
❌ (b) Sai. Zn có độ hoạt động hóa học mạnh hơn Fe và Zn phủ bên ngoài thép nên Zn bị ăn điện hóa trước mòn trước.
❌ (c) Sai. Sau thời gian dài sắt cũng sẽ bị ăn mòn theo thời gian.
✔️ (d) Đúng. Zn có độ hoạt động hóa học mạnh hơn Fe và Zn phủ bên ngoài thép nên Zn bị ăn điện hóa trước mòn trước.
Có 2 phát biểu đúng là (a) (d)
⇒ Chọn đáp án B Đáp án: B
✔️ (a) Đúng. Vị trí đóng đinh thép dễ xảy ra ăn mòn hơn vị trí khác vì tại vị trí đinh thép tiếp xúc giữa Fe-C-Zn để lâu ngày trong không khí ẩm sẽ bị ăn mòn điện hóa. Các vị trí khác do được tráng kẽm nên bị ăn mòn chậm hơn.
❌ (b) Sai. Zn có độ hoạt động hóa học mạnh hơn Fe và Zn phủ bên ngoài thép nên Zn bị ăn điện hóa trước mòn trước.
❌ (c) Sai. Sau thời gian dài sắt cũng sẽ bị ăn mòn theo thời gian.
✔️ (d) Đúng. Zn có độ hoạt động hóa học mạnh hơn Fe và Zn phủ bên ngoài thép nên Zn bị ăn điện hóa trước mòn trước.
Có 2 phát biểu đúng là (a) (d)
⇒ Chọn đáp án B Đáp án: B
Câu 4 [243433]: Nguyên tố calcium có số hiệu nguyên tử là 20. Khi calcium tham gia phản ứng tạo hợp chất ion thì cấu hình electron của cation là
A, 1s22s22p63s23p64s1.
B, 1s22s22p6.
C, 1s22s22p63s23p6.
D, 1s22s22p63s23p63d10.
Nguyên tố calcium có số hiệu nguyên tử là 20 nên khi tham gia phản ứng sẽ có xu hướng nhường đi 2 electron để đạt cấu hình của nguyên tử khí hiếm gần nhất là Argon (Z = 18), tạo thành cation Ca2+.
→ Cấu hình electron của cation Ca2+ là: 1s22s22p63s23p6.
⇒ Chọn đáp án C Đáp án: C
→ Cấu hình electron của cation Ca2+ là: 1s22s22p63s23p6.
⇒ Chọn đáp án C Đáp án: C
Câu 5 [679845]: Chất nào sau đây được dùng để làm mềm nước có tính cứng tạm thời?
A, CaCO3.
B, MgCl2.
C, NaOH.
D, Fe(OH)2.
Nước cứng tạm thời chứa Ca(HCO3)2 và Mg(HCO3)2, khi sử dụng NaOH:
• 2NaOH + Ca(HCO3)2 → CaCO3↓ + Na2CO3 + 2H2O.
• 2NaOH + Mg(HCO3)2 → MgCO3↓ + Na2CO3 + 2H2O.
Kết tủa các cation Mg2+ và Ca2+ ⇝ làm mềm nước.
⇒ Chọn đáp án C Đáp án: C
• 2NaOH + Ca(HCO3)2 → CaCO3↓ + Na2CO3 + 2H2O.
• 2NaOH + Mg(HCO3)2 → MgCO3↓ + Na2CO3 + 2H2O.
Kết tủa các cation Mg2+ và Ca2+ ⇝ làm mềm nước.
⇒ Chọn đáp án C Đáp án: C
Câu 6 [703984]: Phát biểu nào sau đây là không đúng?
A, Ngoài làm phân bón, ammonium chloride còn được sử dụng trong pin.
B, Các muối ammonium khi phân huỷ đều toả nhiều nhiệt và dễ gây cháy nổ.
C, Một lượng lớn ammonia được sử dụng để điều chế phân đạm ammonium.
D, Trong công nghiệp, ammonia có thể được dùng như chất làm lạnh.
Phân tích các phát biểu:
✔️ A. Đúng. Ammonium chloride (NH4Cl) được dùng trong pin khô và làm phân bón.
❌ B. Sai. Phần lớn muối ammonium, như NH4Cl và (NH4)2SO4 khi phân hủy thường hấp thụ nhiệt và không dễ cháy nổ. Chỉ một số ít muối như NH4NO3 hoặc NH4ClO4 có thể gây cháy nổ trong điều kiện đặc biệt.
✔️ C. Đúng. Ammonia là nguyên liệu chính để sản xuất phân đạm như NH4NO3 và (NH4)2SO4.
✔️ D. Đúng. Ammonia có nhiệt độ hóa hơi thấp, được sử dụng làm chất làm lạnh trong các hệ thống lạnh công nghiệp.
⇒ Chọn đáp án B Đáp án: B
✔️ A. Đúng. Ammonium chloride (NH4Cl) được dùng trong pin khô và làm phân bón.
❌ B. Sai. Phần lớn muối ammonium, như NH4Cl và (NH4)2SO4 khi phân hủy thường hấp thụ nhiệt và không dễ cháy nổ. Chỉ một số ít muối như NH4NO3 hoặc NH4ClO4 có thể gây cháy nổ trong điều kiện đặc biệt.
✔️ C. Đúng. Ammonia là nguyên liệu chính để sản xuất phân đạm như NH4NO3 và (NH4)2SO4.
✔️ D. Đúng. Ammonia có nhiệt độ hóa hơi thấp, được sử dụng làm chất làm lạnh trong các hệ thống lạnh công nghiệp.
⇒ Chọn đáp án B Đáp án: B
Câu 7 [308680]: Công thức của glycine là
A, CH3NH2.
B, H2NCH(CH3)COOH.
C, H2NCH2COOH.
D, C2H5NH2.
Glycine là amino acid đơn giản nhất, thuộc nhóm amino acid không phân cực, có một nhóm amine (−NH2) gắn vào nguyên tử carbon số 2 và một nhóm carboxyl (−COOH).
Công thức của glycine là H2NCH2COOH.
⇒ Chọn đáp án C Đáp án: C
Công thức của glycine là H2NCH2COOH.
⇒ Chọn đáp án C Đáp án: C
Câu 8 [308416]: Thủy phân hoàn toàn cellulose trong môi trường acid vô cơ thu được
A, glucose.
B, saccharose.
C, maltose.
D, fructose.
Tương tự tinh bột, cellulose cũng được tạo nên từ các mắt xích glucose - monosaccharide ⇒ thủy phân đến cùng (hoàn toàn) thì sẽ thu được tương ứng sản phẩm là glucose thôi:
(C6H10O5)n (cellulose) + nH2O ––H+, to→ nC6H12O6 (glucose)
⇝ Chọn đáp án A Đáp án: A
(C6H10O5)n (cellulose) + nH2O ––H+, to→ nC6H12O6 (glucose)
⇝ Chọn đáp án A Đáp án: A
Câu 9 [703985]: Hợp chất X có công thức phân tử C3H6O. Trên phổ khối lượng của X có các tín hiệu dao động hoá trị tại khoảng tần số 1740 – 1670 cm–1. Phát biểu nào sau đây là không đúng về X?
A, X thuộc loại hợp chất carbonyl, phân tử có chứa nhóm chức C=O.
B, X thuộc loại hợp chất no, mạch carbon không phân nhánh.
C, X có 1 đồng phân ketone duy nhất.
D, X là hợp chất alcohol không no.
X có công thức phân tử C3H6O và có tín hiệu đặc trưng 1740 – 1670 cm-1 của C=O nên X là hợp chất carbonyl.
Các đồng phân của hợp chất carbonyl của X gồm có 1 đồng phân ketone và 1 đồng phân aldehyde:
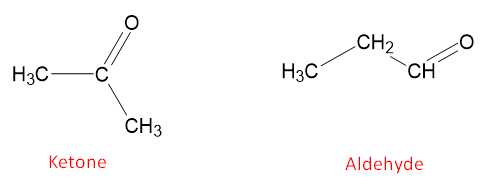
⇒ X không phải hợp chất alcohol không no.
⇒ Chọn đáp án D Đáp án: D
Các đồng phân của hợp chất carbonyl của X gồm có 1 đồng phân ketone và 1 đồng phân aldehyde:

⇒ X không phải hợp chất alcohol không no.
⇒ Chọn đáp án D Đáp án: D
Câu 10 [703986]: Một trong những hóa chất quan trọng nhất được sản xuất và sử dụng trên toàn thế giới là sulfuric acid. Sulfuric acid được sử dụng trong sản xuất kim loại, sản xuất sơn, phân bón, ắc quy ô tô, chất tẩy rửa, thuốc nhuộm và sợi và trong nông nghiệp. Quá trình dưới đây cho phép sản xuất sulfuric acid nồng độ cao với số lượng lớn.
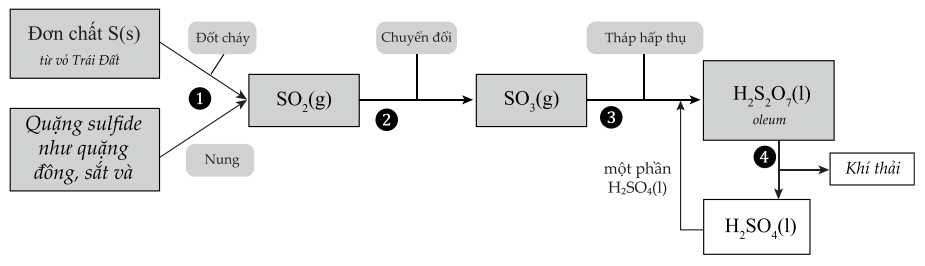
Trong các phát biểu sau:
(a) S trong các nguồn quặng có số oxi hóa 0.
(b) Số oxi hóa của sulfur có xu hướng tăng trong quá trình sản xuất.
(c) Để tăng hiệu suất chuyển hóa trong giai đoạn (2) có thể sử dụng xúc tác V2O5.
(d) Nồng độ của sulfuric acid có thể được tăng lên trong giai đoạn (3).
Các phát biểu đúng là

Trong các phát biểu sau:
(a) S trong các nguồn quặng có số oxi hóa 0.
(b) Số oxi hóa của sulfur có xu hướng tăng trong quá trình sản xuất.
(c) Để tăng hiệu suất chuyển hóa trong giai đoạn (2) có thể sử dụng xúc tác V2O5.
(d) Nồng độ của sulfuric acid có thể được tăng lên trong giai đoạn (3).
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (b), (c).
D, (b), (c), (d).
Phân tích các phát biểu:
❌ (a) Sai. Đơn chất S có số oxi hóa là 0, nhưng các quặng sulfide như FeS2, MoS2,… S đều có các trặng thái oxi hóa khác.
✔️ (b) Đúng. Số oxi hóa của Sulfur là 0 và các quặng sulfide có số oxi -1 tăng dần lên +6 trong H2SO4.
✔️ (c) Đúng. V2O5 là chất xúc tác cho quá trình từ SO2 thành SO3.
✔️ (d) Đúng. Giai đoạn (3) tháp hấp thụ nSO3 bằng dung dịch H2SO4 tạo thành oleum (H2SO4.nSO3), pha loãng oleum thành H2SO4 với một lượng nước phù hợp thu được các dung dịch H2SO4 với các nồng độ mong muốn.
Các phát biểu đúng là (b), (c), (d)
⇒ Chọn đáp án D Đáp án: D
❌ (a) Sai. Đơn chất S có số oxi hóa là 0, nhưng các quặng sulfide như FeS2, MoS2,… S đều có các trặng thái oxi hóa khác.
✔️ (b) Đúng. Số oxi hóa của Sulfur là 0 và các quặng sulfide có số oxi -1 tăng dần lên +6 trong H2SO4.
✔️ (c) Đúng. V2O5 là chất xúc tác cho quá trình từ SO2 thành SO3.
✔️ (d) Đúng. Giai đoạn (3) tháp hấp thụ nSO3 bằng dung dịch H2SO4 tạo thành oleum (H2SO4.nSO3), pha loãng oleum thành H2SO4 với một lượng nước phù hợp thu được các dung dịch H2SO4 với các nồng độ mong muốn.
Các phát biểu đúng là (b), (c), (d)
⇒ Chọn đáp án D Đáp án: D
Câu 11 [560621]: Wolfram được dùng để chế tạo dây tóc cho bóng đèn sợi đốt là do kim loại này có
A, độ cứng cao.
B, tính ánh kim.
C, khả năng dẫn điện tốt.
D, nhiệt độ nóng chảy cao.
Wolfram, còn gọi là Tungsten hoặc Vonfram, là một nguyên tố hóa học có ký hiệu là W. Trong tất cả kim loại nguyên chất, wolfram có điểm nóng chảy cao nhất (3422 oC), áp suất hơi thấp nhất, (ở nhiệt độ trên 1650 oC).
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 12 [304115]: Chất X có cấu tạo CH3CH2COOCH3. Tên gọi của X là
A, Ethyl acetate.
B, Methyl propionate.
C, Methyl acetate.
D, Propyl acetate.
Phân tích cấu tạo hợp chất:
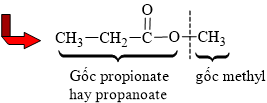
⟹ Gọi tên: Methyl propionate
⟹ Chọn đáp án B Đáp án: B

⟹ Gọi tên: Methyl propionate
⟹ Chọn đáp án B Đáp án: B
Câu 13 [703987]: “Saccharose và …(1)… là hai disaccharide, có cùng công thức phân tử là …(2)…”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, maltose, C6H12O6.
B, glucose, C6H12O6.
C, maltose, C12H22O11.
D, cellulose, (C6H10O5)n.
Saccharose và maltose là disaccharide có công thức phân tử chung là C12H22O11, là đồng phân của nhau.
- Saccharose = 1 gốc -glucose +1 gốc -fructose qua nguyên tử O bởi liên kết -1,2-glycoside
- Maltose = 2 gốc glucose qua nguyên tử O bởi liên kết -1,4-glycoside
⇒ Chọn đáp án C Đáp án: C
- Saccharose = 1 gốc -glucose +1 gốc -fructose qua nguyên tử O bởi liên kết -1,2-glycoside
- Maltose = 2 gốc glucose qua nguyên tử O bởi liên kết -1,4-glycoside
⇒ Chọn đáp án C Đáp án: C
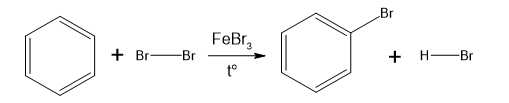
Câu 14 [703988]: Chlorine và bromine phản ứng với benzene tạo thành halogenobenzene tương ứng. Phản ứng xảy ra khi có mặt FeCl3 hoặc FeBr3, làm xúc tác.
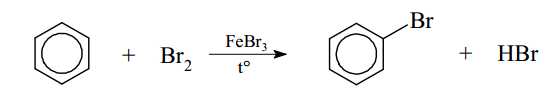
Cơ chế của phản ứng như sau:
▪ Giai đoạn 1: Quá trình hoạt hoá tác nhân Br2 bằng FeBr3.
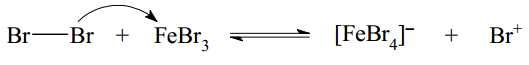
▪ Giai đoạn 2: Quá trình tương tác giữa benzene và tác nhân Br+.
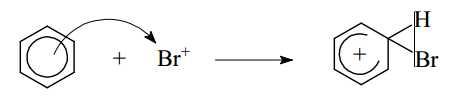
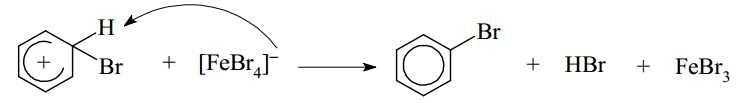
▪ Giai đoạn 3: Quá trình tách proton để tạo sản phẩm.
Phát biểu nào sau đây không đúng?
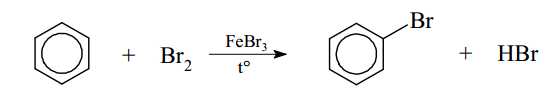
Cơ chế của phản ứng như sau:
▪ Giai đoạn 1: Quá trình hoạt hoá tác nhân Br2 bằng FeBr3.

▪ Giai đoạn 2: Quá trình tương tác giữa benzene và tác nhân Br+.
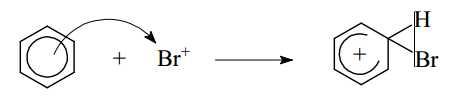
▪ Giai đoạn 3: Quá trình tách proton để tạo sản phẩm.

Phát biểu nào sau đây không đúng?
A, Phản ứng bromine hóa benzene là phản ứng cộng.
B, 3 liên kết π trong benzene phân bố đều trên cả 6 liên kết C–C.
C, Trong giai đoạn 2, sản phẩm tạo thành chứa 2 liên kết π.
D, Lượng FeBr3 không thay đổi trong quá trình phản ứng.
Phân tích các phát biểu:
❌ A. Sai. Phản ứng bromine hóa benzene là phản ứng thế , trong đó một nguyên tử H trên vòng benzene bị thay thế bởi nguyên tử Br, không phải phản ứng cộng.
✔️ B. Đúng. Benzene có cấu trúc cộng hưởng, trong đó 3 liên kết π được phân bố đều trên cả 6 liên kết C–C, tạo nên một vòng thơm ổn định.
✔️ C. Đúng. Trong giai đoạn 2, benzene mất đi một liên kết π để tạo carbocation, do đó sản phẩm tạm thời chỉ còn 2 liên kết π.
✔️ D. Đúng. FeBr3 chỉ đóng vai trò chất xúc tác, tham gia vào việc hoạt hóa Br2 nên không thay đổi trong quá trình phản ứng.
⇒ Chọn đáp án A Đáp án: A
❌ A. Sai. Phản ứng bromine hóa benzene là phản ứng thế , trong đó một nguyên tử H trên vòng benzene bị thay thế bởi nguyên tử Br, không phải phản ứng cộng.

✔️ B. Đúng. Benzene có cấu trúc cộng hưởng, trong đó 3 liên kết π được phân bố đều trên cả 6 liên kết C–C, tạo nên một vòng thơm ổn định.
✔️ C. Đúng. Trong giai đoạn 2, benzene mất đi một liên kết π để tạo carbocation, do đó sản phẩm tạm thời chỉ còn 2 liên kết π.
✔️ D. Đúng. FeBr3 chỉ đóng vai trò chất xúc tác, tham gia vào việc hoạt hóa Br2 nên không thay đổi trong quá trình phản ứng.
⇒ Chọn đáp án A Đáp án: A
Câu 15 [304798]: Có thể tạo ra một hợp chất ester có mùi thơm giống quả táo từ sự kết hợp của methanol và butanoic acid. Công thức phân tử của ester X là
A, C4H10O2.
B, C3H6O2.
C, C2H10O2.
D, C5H10O2.
Ester X tạo ra từ methanol và butanoic acid:
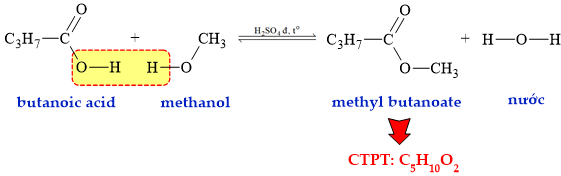
⇒ X là methyl butanoate có công thức phân tử C5H10O2
⟹ Chọn đáp án D Đáp án: D

⇒ X là methyl butanoate có công thức phân tử C5H10O2
⟹ Chọn đáp án D Đáp án: D
Câu 16 [703989]: Dynorphin là một nhóm peptide đóng vai trò quan trọng trong những thay đổi ở não liên quan đến nghiện cocaine. Một trong những peptide này, dynorphin A, chứa trình tự amino acid như sau: Tyr─Gly─Gly─Phe─Leu─Arg─Arg─Ile─Arg─Pro─Lys─Leu─Lys Chymotrypsin là một loại enzyme đặc biệt có khả năng cắt mạch amino acid một cách có chọn lọc, cắt đứt liên kết CO–NH (với phần carbonyl thuộc về amino acid Phe, Tyr hoặc Trp).
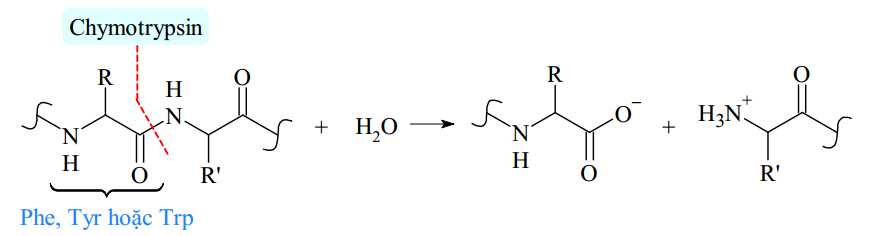
Tiến hành cắt đứt chuỗi amino acid bằng enzyme chymotrypsin đến khi hoàn toàn thì trong các chất sản phẩm, amino acid thu được có số mắt xích lớn nhất có thể là bao nhiêu?

Tiến hành cắt đứt chuỗi amino acid bằng enzyme chymotrypsin đến khi hoàn toàn thì trong các chất sản phẩm, amino acid thu được có số mắt xích lớn nhất có thể là bao nhiêu?
A, 3.
B, 5.
C, 9.
D, 12.
Khi tiến hành cắt đứt chuỗi amino acid bằng enzyme chymotrypsin thì chymotrypsin cắt các amino acid một cách có chọn lọc, nó sẽ cắt đứt liên kết CO–NH với phần carbonyl thuộc về amino acid Phe, Tyr hoặc Trp nên quá trình cắt đứt xảy ra như sau:( cắt tại vị trí Tyr, Phe )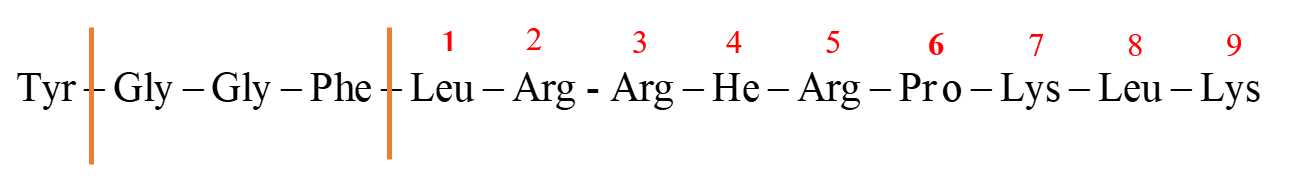
Sản phẩm thu được có số mắt xích lớn nhất là 9: Leu-Arg-Arg-Ile-Arg-Pro-Lys-Leu-Lys.
⤏ Amino acid thu được có số mắt xích lớn nhất là 9.
⇒ Chọn đáp án C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Phản ứng sau xảy ra trong dung dịch nước của Cd2+:
[Cd(H2O)6]2+ + 4CH3NH2 → [Cd(CH3NH2)4(H2O)2]2+ + 4H2O
[Cd(H2O)6]2+ + 4CH3NH2 → [Cd(CH3NH2)4(H2O)2]2+ + 4H2O
Câu 17 [703990]: Trong hai phức chất ở phương trình trên, số oxi hóa của nguyên tử trung tâm là bao nhiêu?
A, +4.
B, +2.
C, +6.
D, +3.
⭐ Trong [Cd(H2O)6]2+, H2O là phối tử trung hòa (không làm thay đổi số oxi hóa của nguyên tử trung tâm). Do đó, số oxi hóa của Cd là +2 để cân bằng điện tích tổng cộng của phức là +2.
⭐ Trong [Cd(CH3NH2)4(H2O)2]2+, cả CH3NH2 và H2O đều là phối tử trung hòa. Vì vậy, số oxi hóa của Cd vẫn là +2.
⇒ Chọn đáp án B Đáp án: B
⭐ Trong [Cd(CH3NH2)4(H2O)2]2+, cả CH3NH2 và H2O đều là phối tử trung hòa. Vì vậy, số oxi hóa của Cd vẫn là +2.
⇒ Chọn đáp án B Đáp án: B
Câu 18 [703991]: Phát biểu nào sau đây không đúng?
A, Trong phức chất [Cd(CH3NH2)4(H2O)2]2+ chỉ có một loại phối tử.
B, CH3NH2 tạo liên kết với Cd qua nguyên tử nitrogen.
C, H2O tạo liên kết với Cd qua nguyên tử oxygen.
D, Nguyên tử Cd tạo bốn liên kết sigma với các phối tử.
Phân tích các phát biểu:
❌ A. Sai. Phức chất này có hai loại phối tử: CH3NH2 (methylamine) và H2O (nước).
✔️ B. Đúng. Trong CH3NH2, nguyên tử N có cặp electron tự do, nên tạo liên kết phối trí với ion Cd2+.
✔️ C. Đúng. Nguyên tử O trong H2O có cặp electron tự do, nên tạo liên kết phối trí với ion Cd2+.
✔️ D. Đúng. Cd liên kết với 4 phân tử CH3NH2 và 2 phân tử H2O, tổng cộng là 6 liên kết sigma.
⇒ Chọn đáp án A Đáp án: A
❌ A. Sai. Phức chất này có hai loại phối tử: CH3NH2 (methylamine) và H2O (nước).
✔️ B. Đúng. Trong CH3NH2, nguyên tử N có cặp electron tự do, nên tạo liên kết phối trí với ion Cd2+.
✔️ C. Đúng. Nguyên tử O trong H2O có cặp electron tự do, nên tạo liên kết phối trí với ion Cd2+.
✔️ D. Đúng. Cd liên kết với 4 phân tử CH3NH2 và 2 phân tử H2O, tổng cộng là 6 liên kết sigma.
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [703992]: Một nhóm học sinh thực hành lắp một pin điện đơn giản theo các bước sau:
Bước 1: Chuẩn bị bốn quả chanh. Rửa sạch lá đồng và lá kẽm bằng chất tẩy rửa nhẹ để đảm bảo bề mặt của chúng sạch sẽ.
Bước 2: Có thể lăn quả chanh trên bàn bằng một lực nhẹ.
Bước 3: Cắm lá đồng và lá kẽm vào quả chanh như hình dưới đây thì thấy bóng đèn phát sáng.
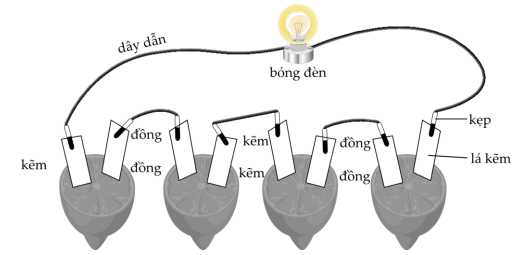
Bước 1: Chuẩn bị bốn quả chanh. Rửa sạch lá đồng và lá kẽm bằng chất tẩy rửa nhẹ để đảm bảo bề mặt của chúng sạch sẽ.
Bước 2: Có thể lăn quả chanh trên bàn bằng một lực nhẹ.
Bước 3: Cắm lá đồng và lá kẽm vào quả chanh như hình dưới đây thì thấy bóng đèn phát sáng.

Bên trong quả chanh có chứa citric acid C6H8O7 phân li ra các ion C6H7O7- và H+ nên nước chanh có thể dẫn điện.
C6H8O7 ⇌ C6H7O7- + H+
Trong pin điện hóa trên, xảy ra các phản ứng trên các điện cực
Anode (-) Zn ⟶ Zn2+ + 2e
Cathode (+) 2H+ + 2e ⟶ H2
Khi nối hai cực của pin với mạch ngoài (máy đo) do chênh lệch điện thế giữa cực âm Zn và cực dương Cu sẽ có một dòng các electron tự do dịch chuyển từ cực âm Zn (thừa e) qua cực dương Cu (thiếu e) tạo ra dòng điện giữa hai cực của viên pin chanh.
Phân tích các phát biểu:
✔️ a) Đúng. Trong nước chanh có chứa các chất điện li nên có thể dẫn điện.
✔️ b) Đúng. Bước 2 lăn quả chanh mục đích tiết thêm nước chanh để thêm dung dịch chất điện li cho quá trình hoạt động của pin điện hóa.
✔️ c) Đúng. Bóng đèn sáng, dòng điện là dòng electron di chuyển từ cực âm Zn sang cực dương Cu.
✔️ d) Đúng. Suất điện động của một viên pin điện hóa tùy thuộc vào chất hóa học ở bên trong viên pin điện hóa thông thường là 1,5V; 6V; 9V … có thể ghép nối tiếp nhiều viên pin để thu được nguồn điện có suất điện động phù hợp.
C6H8O7 ⇌ C6H7O7- + H+
Trong pin điện hóa trên, xảy ra các phản ứng trên các điện cực
Anode (-) Zn ⟶ Zn2+ + 2e
Cathode (+) 2H+ + 2e ⟶ H2
Khi nối hai cực của pin với mạch ngoài (máy đo) do chênh lệch điện thế giữa cực âm Zn và cực dương Cu sẽ có một dòng các electron tự do dịch chuyển từ cực âm Zn (thừa e) qua cực dương Cu (thiếu e) tạo ra dòng điện giữa hai cực của viên pin chanh.
Phân tích các phát biểu:
✔️ a) Đúng. Trong nước chanh có chứa các chất điện li nên có thể dẫn điện.
✔️ b) Đúng. Bước 2 lăn quả chanh mục đích tiết thêm nước chanh để thêm dung dịch chất điện li cho quá trình hoạt động của pin điện hóa.
✔️ c) Đúng. Bóng đèn sáng, dòng điện là dòng electron di chuyển từ cực âm Zn sang cực dương Cu.
✔️ d) Đúng. Suất điện động của một viên pin điện hóa tùy thuộc vào chất hóa học ở bên trong viên pin điện hóa thông thường là 1,5V; 6V; 9V … có thể ghép nối tiếp nhiều viên pin để thu được nguồn điện có suất điện động phù hợp.
Câu 20 [703993]: Hợp chất hữu cơ (X) chứa 77,92%C; 11,69%H; còn lại là oxygen. Phươngpháp phân tích phổ khối lượng (phổ MS) của (X) xác định được giá trị m/z của peak [M+] là154. X có cấu tạo đối xứng hai bên và có bộ khung carbon như sau:
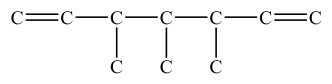
Phổ IR của (X) như sau:
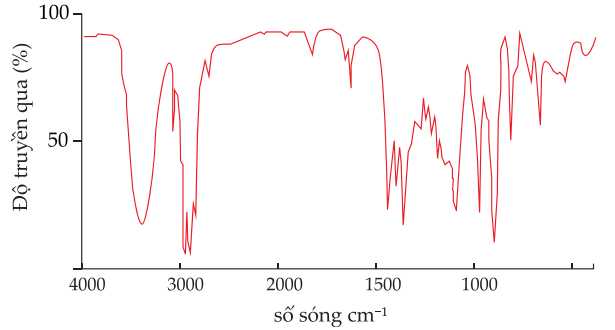

Phổ IR của (X) như sau:

Gọi công thức của X có dạng CxHyOz
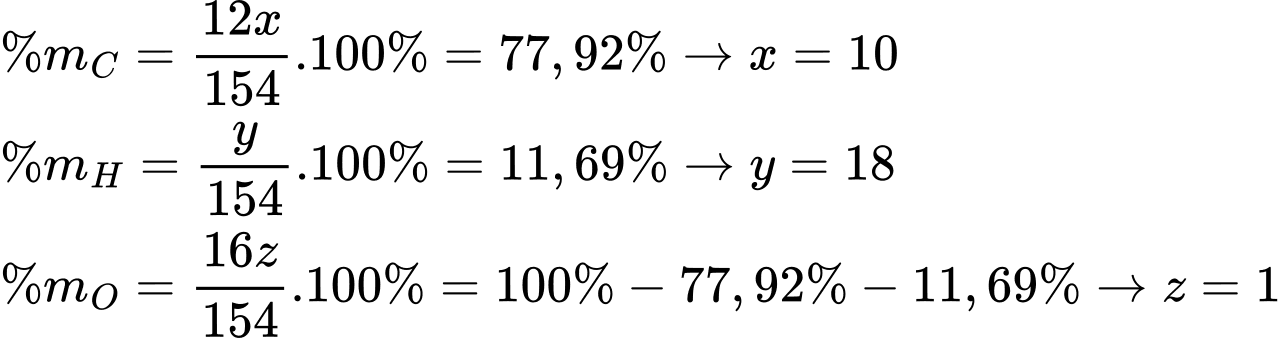
Công thức phân tử của X là C10H18O
Từ tín hiệu trên phổ IR, thấy xuất hiện peak trong khoảng 3650 – 3200 cm-1 nên trong phân tử X có nhóm OH
X có cấu tạo đối xứng hai bên nên X có các đồng phân cấu tạo như sau:
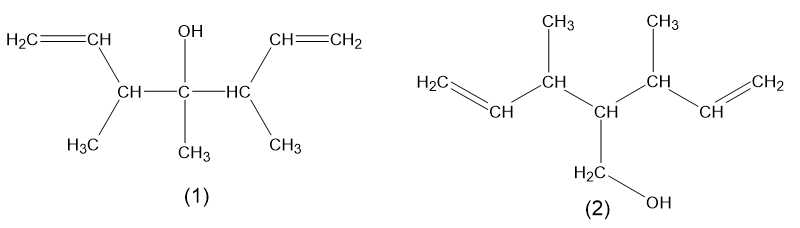
Phân tích các phát biểu:
✔️ a) Đúng. (X) có công thức phân tử C10H18O.
❌ b) Sai. Đồng phân (1) có 3 nhóm CH3 và 2 nhóm CH2 nhưng đồng phân (2) chỉ có 2 nhóm CH3 và 3 nhóm CH2.
✔️ c) Đúng. Dựa vào công thức cấu tạo của (X) thấy (X) có 2 liên kết đôi C=C cách nhau 4 liên kết đơn.
❌ d) Sai. Đồng phân (1) là alcohol bậc 3 nhưng đồng phân (2) là alcohol bậc 1.
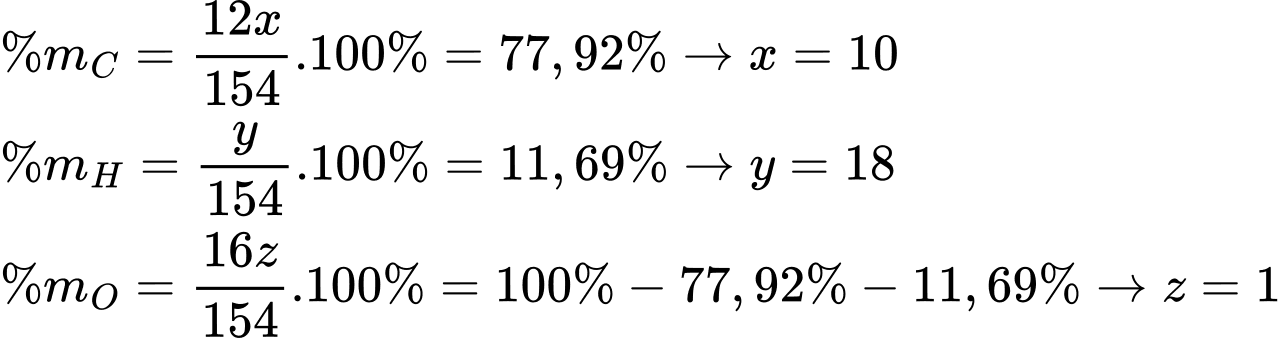
Công thức phân tử của X là C10H18O
Từ tín hiệu trên phổ IR, thấy xuất hiện peak trong khoảng 3650 – 3200 cm-1 nên trong phân tử X có nhóm OH
X có cấu tạo đối xứng hai bên nên X có các đồng phân cấu tạo như sau:

Phân tích các phát biểu:
✔️ a) Đúng. (X) có công thức phân tử C10H18O.
❌ b) Sai. Đồng phân (1) có 3 nhóm CH3 và 2 nhóm CH2 nhưng đồng phân (2) chỉ có 2 nhóm CH3 và 3 nhóm CH2.
✔️ c) Đúng. Dựa vào công thức cấu tạo của (X) thấy (X) có 2 liên kết đôi C=C cách nhau 4 liên kết đơn.
❌ d) Sai. Đồng phân (1) là alcohol bậc 3 nhưng đồng phân (2) là alcohol bậc 1.
Câu 21 [703994]: Người ta nghi ngờ rằng có hiện tượng làm giả tiền xu bạc. Một mẫu tiền xu được cho là giả đã được phân tích để xác định tỉ lệ phần trăm bạc. Một mẫu 10,00 g tiền xu có chứa bạc được hòa tan trong nitric acid dư và thể tích dung dịch được tạo thành là 100,0 mL được đặt trong cốc (1). Lấy 25,00 mL dung dịch này cho vào cốc (2), chuẩn độ bằng dung dịch sodium chloride 1,00 M. Cần 10,45 mL để kết tủa tất cả các ion bạc. Tiền xu bạc thật sẽ có phần trăm bạc lớn hơn 90%.
Đổi 10,45 mL = 0,01045 L
(1) 3Ag + 4HNO3 ⟶ 3AgNO3 + NO↑ + 2H2O
(2) AgNO3 + NaCl ⟶ AgCl↓ + NaNO3
Số mol NaCl phản ứng là 0,01045.1 = 0,01045 (mol)
Từ phương trình (1) và (2) ⟶ số mol Ag là 0,01045 (mol)
Phần trăm khối lượng bạc có trong 10 gam tiền xu trên là:
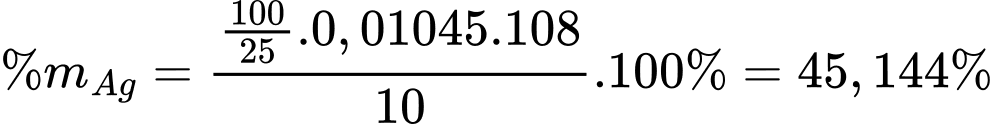
Phân tích các phát biểu:
❌ a) Sai. Ion silver (Ag+) tạo kết tủa với ion chloride (Cl-) tạo thành kết tủa AgCl.
✔️ b) Đúng. Nồng độ Ag trong cốc (1) bằng với cốc (2) trước chuẩn độ
❌ c) Sai. Phần trăm khối lượng của Ag trong tiền xu là 45,144%
✔️ d) Đúng. Tiền xu bạc thật sẽ có phần trăm bạc lớn hơn 90%, nên dựa vào phần trăm bạc trong tiền xu có thể kết luận rằng tiền xu này là thật hay giả.
(1) 3Ag + 4HNO3 ⟶ 3AgNO3 + NO↑ + 2H2O
(2) AgNO3 + NaCl ⟶ AgCl↓ + NaNO3
Số mol NaCl phản ứng là 0,01045.1 = 0,01045 (mol)
Từ phương trình (1) và (2) ⟶ số mol Ag là 0,01045 (mol)
Phần trăm khối lượng bạc có trong 10 gam tiền xu trên là:
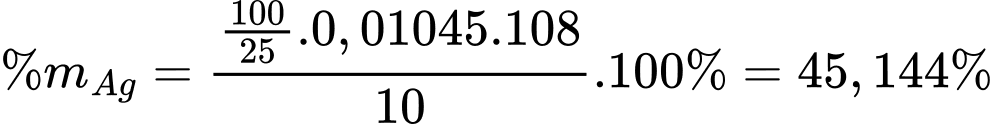
Phân tích các phát biểu:
❌ a) Sai. Ion silver (Ag+) tạo kết tủa với ion chloride (Cl-) tạo thành kết tủa AgCl.
✔️ b) Đúng. Nồng độ Ag trong cốc (1) bằng với cốc (2) trước chuẩn độ
❌ c) Sai. Phần trăm khối lượng của Ag trong tiền xu là 45,144%
✔️ d) Đúng. Tiền xu bạc thật sẽ có phần trăm bạc lớn hơn 90%, nên dựa vào phần trăm bạc trong tiền xu có thể kết luận rằng tiền xu này là thật hay giả.
Câu 22 [703995]: Hàm lượng glucose có trong mẫu dược phẩm có thể được xác định bằng phương pháp chuẩn độ với iodine như sau:
Bước 1: Cho 20,00 mL một mẫu dung dịch chứa glucose vào 15,00 mL dung dịch iodine 0,10 M dư.
C6H12O6(aq) + I2(aq) + H2O(aq) → C6H12O7(aq) + 2HI(aq)
Bước 2: Sau đó, thêm vào dung dịch sau phản ứng vài giọt dung dịch X, rồi vừa lắc vừa nhỏ từ từ dung dịch sodium thiosulfate (Na2S2O3) 0,05 M vào dung dịch ở trên đến khi mất màu xanh thì dừng lại.
I2(aq) + 2Na2S2O3(aq) → 2NaI(aq) + Na2S4O6(aq)
Lặp lại 2 lần, thể tích dung dịch sodium thiosulfate đã dùng được ghi lại.
Bước 1: Cho 20,00 mL một mẫu dung dịch chứa glucose vào 15,00 mL dung dịch iodine 0,10 M dư.
C6H12O6(aq) + I2(aq) + H2O(aq) → C6H12O7(aq) + 2HI(aq)
Bước 2: Sau đó, thêm vào dung dịch sau phản ứng vài giọt dung dịch X, rồi vừa lắc vừa nhỏ từ từ dung dịch sodium thiosulfate (Na2S2O3) 0,05 M vào dung dịch ở trên đến khi mất màu xanh thì dừng lại.
I2(aq) + 2Na2S2O3(aq) → 2NaI(aq) + Na2S4O6(aq)
Lặp lại 2 lần, thể tích dung dịch sodium thiosulfate đã dùng được ghi lại.
Thể tích trung bình của Na2S2O3 sau 3 lần chuẩn độ là:
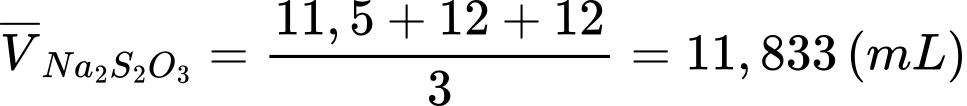
Đổi 11,833 mL = 11,833.10-3 L; 15 mL = 0,015 L; 20 mL = 0,02L
(1) C6H12O6 + I2 + H2O ⟶ C6H12O7 + 2HI
(2) I2 + 2Na2S2O3 ⟶ Na2S4O6 + 2NaI
Số mol của I2 tham gia phản ứng (2) là:
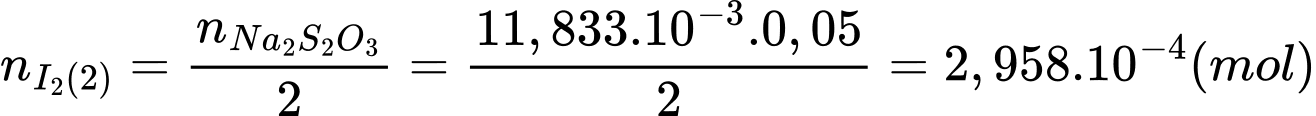
Số mol của I2 ban đầu là:
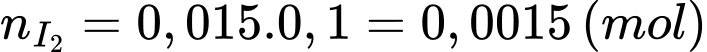
Lượng I2 tham gia phản ứng với glucose là:
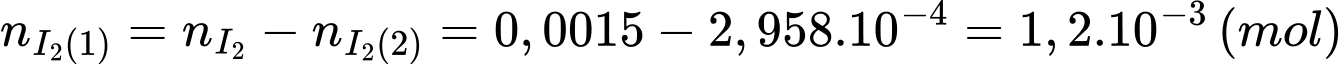
Nồng độ của glucose trong là:
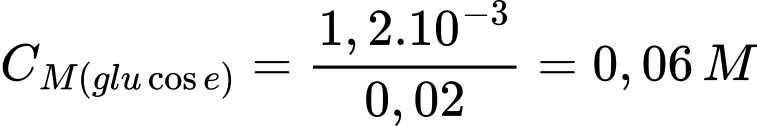
Phân tích các phát biểu:
✔️ a) Đúng. Chuẩn độ oxi hóa - khử là dùng phản ứng oxi hóa - khử giữa chất phân tích và dung dịch chuẩn độ. Trong phản ứng trên I2 là chất oxi hóa và Na2S2O3 là chất khử.
✔️ b) Đúng. Hồ tinh bột được dùng là chất chỉ thị nhận biết được khi nào I2 phản ứng hết, hiện tượng chuẩn độ dung dịch cho đến khi hết màu xanh thì dừng lại.
✔️ c) Đúng. Nồng độ glucose trong mẫu dung dịch ban đầu là 0,06 M.
❌ d) Sai. Khi tăng nồng độ lên gấp đôi thì thể tích Na2S2O3 giảm một nửa là 6 mL.
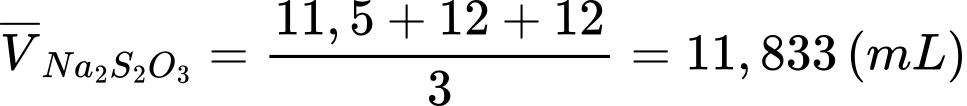
Đổi 11,833 mL = 11,833.10-3 L; 15 mL = 0,015 L; 20 mL = 0,02L
(1) C6H12O6 + I2 + H2O ⟶ C6H12O7 + 2HI
(2) I2 + 2Na2S2O3 ⟶ Na2S4O6 + 2NaI
Số mol của I2 tham gia phản ứng (2) là:
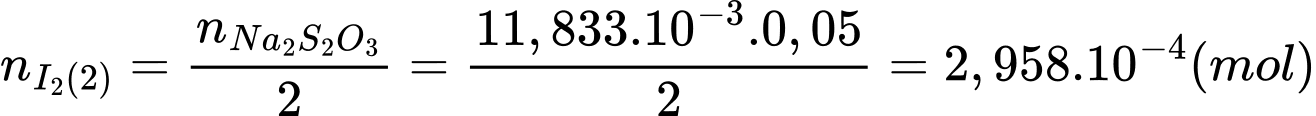
Số mol của I2 ban đầu là:
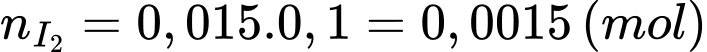
Lượng I2 tham gia phản ứng với glucose là:
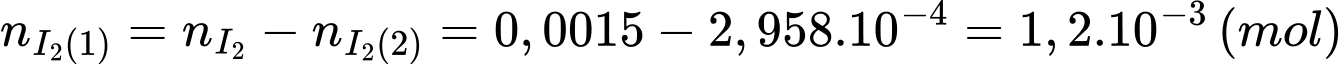
Nồng độ của glucose trong là:
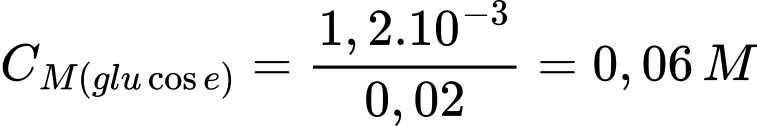
Phân tích các phát biểu:
✔️ a) Đúng. Chuẩn độ oxi hóa - khử là dùng phản ứng oxi hóa - khử giữa chất phân tích và dung dịch chuẩn độ. Trong phản ứng trên I2 là chất oxi hóa và Na2S2O3 là chất khử.
✔️ b) Đúng. Hồ tinh bột được dùng là chất chỉ thị nhận biết được khi nào I2 phản ứng hết, hiện tượng chuẩn độ dung dịch cho đến khi hết màu xanh thì dừng lại.
✔️ c) Đúng. Nồng độ glucose trong mẫu dung dịch ban đầu là 0,06 M.
❌ d) Sai. Khi tăng nồng độ lên gấp đôi thì thể tích Na2S2O3 giảm một nửa là 6 mL.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [703996]: Một loại bột khử mùi chân có chứa kẽm. Kẽm trong mẫu bột được kết tủa thành muối kép, ZnNH3PO4. Nung nóng 1,080 gam muối này, tạo ra 0,368 gam Zn2P2O7. Tính phần trăm theo khối lượng kẽm trong bột khử mùi chân (làm tròn đến hàng phần mười).
2ZnNH4PO4  Zn2P2O7 + H2O + 2NH3
Zn2P2O7 + H2O + 2NH3
Số mol của Zn2P2O7 là: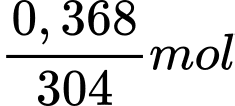
Phần trăm khối lượng Zn trong bột khử mùi chân là:

⇒ Điền đáp án: 14,6
 Zn2P2O7 + H2O + 2NH3
Zn2P2O7 + H2O + 2NH3
Số mol của Zn2P2O7 là:
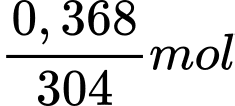
Phần trăm khối lượng Zn trong bột khử mùi chân là:

⇒ Điền đáp án: 14,6
Câu 24 [703997]: Nhằm đạt lợi ích kinh tế, một số trang trại chăn nuôi heo đã dùng Salbutamol để giúp heo lớn nhanh, ti lệ nạc cao, màu sắc thịt đỏ hơn. Nếu con người ăn phải thịt heo được nuôi có sử dụng Salbutamol thì sẽ gây ra nhược co, giảm vận động của cơ. Salbutamol có công thức cấu tạo thu gọn như hình bên.
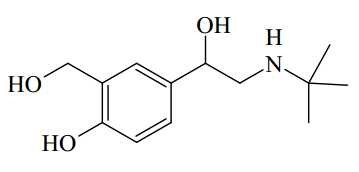
Có bao nhiêu nhóm chức OH (alcohol) có trong cấu tạo một phân tử Salbutamol?

Có bao nhiêu nhóm chức OH (alcohol) có trong cấu tạo một phân tử Salbutamol?
Trong một phân tử Salbutamol có 3 nhóm -OH, trong đó có 2 nhóm chức là -OH (alcohol) được gắn với carbon no ở hình dưới, nhóm -OH còn lại là nhóm chức phenol do -OH gắn với vòng thơm.
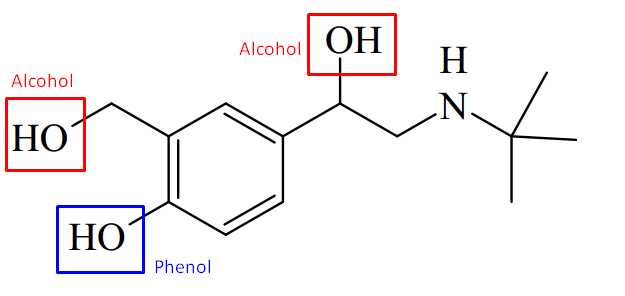
⇒ Điền đáp án: 2

⇒ Điền đáp án: 2
Câu 25 [703998]: Thuỷ phân hoàn toàn 1 mol peptide có cấu tạo như sau:
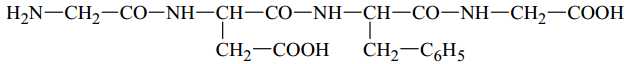
Kết quả thu được tối đa bao nhiêu mol α-amino acid?
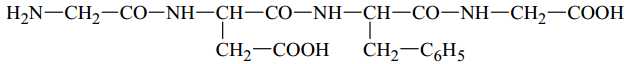
Kết quả thu được tối đa bao nhiêu mol α-amino acid?
Peptide X có 3 liên kết peptide nên khi thủy phân thuy được 4 - amino acid. Thủy phân hoàn toàn một mol X thu được 4 mol - amino acid.
⇒ Điền đáp án: 4
⇒ Điền đáp án: 4
Câu 26 [703999]: Nồng độ đạm (hay còn gọi là độ đạm) là nồng độ phần trăm về khối lượng của nitrogen có trong thực phẩm. Một số loại thực phẩm được công bố tiêu chuẩn về nồng độ đạm như sữa, nước mắm. Tháng 9 năm 2008, cơ quan chức năng phát hiện một số loại sữa dành cho trẻ em sản xuất tại Trung Quốc có nhiễm chất melamine. Melamine có công thức phân tử C3H6N6. Ăn melamine có thể dẫn đến tác hại về sinh sản, sỏi bàng quang hoặc suy thận và sỏi thận. Do tham lợi nhuận, có người cho thêm nước vào sữa tươi làm cho nồng độ đạm không đạt tiêu chuẩn quy định. Để tránh bị phát hiện, họ cho thêm melamine vào sữa để làm cho nồng độ đạm tăng lên. Khi xét nghiệm xác định nồng độ đạm, người ta không phân biệt được đâu là nitrogen tự nhiên trong sữa và đâu là nitrogen của melamine.
Một nhà sản xuất vì tham lợi nhuận đã pha loãng và cho melamine vào sữa. Với 500 lít sữa loại có nồng độ đạm là 17% (khối lượng riêng của loại sữa này là 1,1 gam/mL), họ đã pha thêm 10 lít nước để được hỗn hợp có thể tích 510 lít. Tính khối lượng melamine nhà sản xuất đã cho vào 510 lít sữa để đạt tiêu chuẩn (có độ đạm 17%). Cho khối lượng riêng của nước là 1,0 gam/mL.
Một nhà sản xuất vì tham lợi nhuận đã pha loãng và cho melamine vào sữa. Với 500 lít sữa loại có nồng độ đạm là 17% (khối lượng riêng của loại sữa này là 1,1 gam/mL), họ đã pha thêm 10 lít nước để được hỗn hợp có thể tích 510 lít. Tính khối lượng melamine nhà sản xuất đã cho vào 510 lít sữa để đạt tiêu chuẩn (có độ đạm 17%). Cho khối lượng riêng của nước là 1,0 gam/mL.
Đổi 500 L = 500000 mL; 10 L = 10000 ml
Gọi số mol malemine đã thêm vào là x (mol)
Nồng độ đạm trong 500 L sữa là 17% thì theo 10 L dung dịch melamine 17% sẽ thu được 510 L sữa có nồng độ đạm 17%.
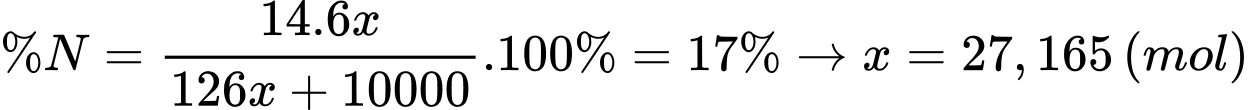
Khối lượng melamine đã thêm là:
mmelamine = 27,165 . 126 = 3422,79 ≈ 3423 (gam)
⇒ Điền đáp án: 3423
Gọi số mol malemine đã thêm vào là x (mol)
Nồng độ đạm trong 500 L sữa là 17% thì theo 10 L dung dịch melamine 17% sẽ thu được 510 L sữa có nồng độ đạm 17%.
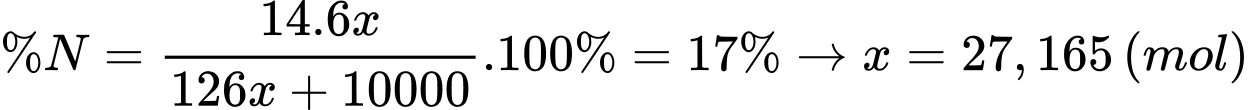
Khối lượng melamine đã thêm là:
mmelamine = 27,165 . 126 = 3422,79 ≈ 3423 (gam)
⇒ Điền đáp án: 3423
Câu 27 [704000]: Kim loại không tan trong nước và có giá trị thế điện cực chuẩn nhỏ hơn thường tác dụng được với dung dịch muối của kim loại có giá trị thế điện cực chuẩn lớn hơn ở điều kiện chuẩn. 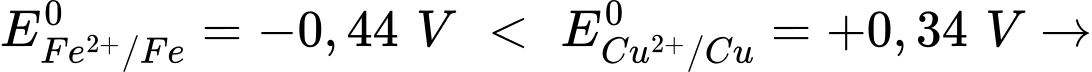 Kim loại Fe có thể phản ứng với dung dịch muối CuSO4. Để kiểm tra tính chất này, một nhóm học sinh đã tiến hành các bước thí nghiệm kiểm chứng như sau:
Kim loại Fe có thể phản ứng với dung dịch muối CuSO4. Để kiểm tra tính chất này, một nhóm học sinh đã tiến hành các bước thí nghiệm kiểm chứng như sau:
(1) Sau đó, làm sạch một chiếc đinh sắt.
(2) Cho lượng muối CuSO4. 5H2O thích hợp vào nước để tạo thành dung dịch CuSO4 1 M.
(3) Cho đinh sắt vào cốc thuỷ tinh chứa dung dịch CuSO4 1 M.
(4) Sau một thời gian, kim loại Cu sinh ra sẽ hình thành một lớp kim loại màu nâu bám trên đinh sắt.
Hãy gắn số thứ tự các bước theo trình tự dãy bốn số để thực hiện thí nghiệm trên (ví dụ: 1234, 4321, ...).
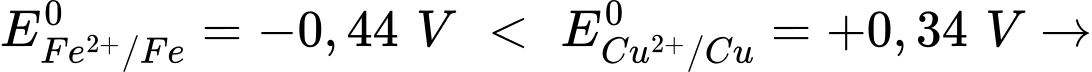 Kim loại Fe có thể phản ứng với dung dịch muối CuSO4. Để kiểm tra tính chất này, một nhóm học sinh đã tiến hành các bước thí nghiệm kiểm chứng như sau:
Kim loại Fe có thể phản ứng với dung dịch muối CuSO4. Để kiểm tra tính chất này, một nhóm học sinh đã tiến hành các bước thí nghiệm kiểm chứng như sau:(1) Sau đó, làm sạch một chiếc đinh sắt.
(2) Cho lượng muối CuSO4. 5H2O thích hợp vào nước để tạo thành dung dịch CuSO4 1 M.
(3) Cho đinh sắt vào cốc thuỷ tinh chứa dung dịch CuSO4 1 M.
(4) Sau một thời gian, kim loại Cu sinh ra sẽ hình thành một lớp kim loại màu nâu bám trên đinh sắt.
Hãy gắn số thứ tự các bước theo trình tự dãy bốn số để thực hiện thí nghiệm trên (ví dụ: 1234, 4321, ...).
Các bước tiến hành thí nghiệm diễn ra như sau:
Bước 1: Cho lượng muối CuSO4.5H2O thích hợp vào nước tạo thành dung dịch CuSO4 1M → ứng với (2)
Bước 2: Sau đó, làm sạch 1 chiếc đinh sắt. → ứng với (1)
Bước 3: Cho đinh sắt vào cốc thủy tinh chứa dung dịch CuSO4 1M → ứng với (3)
Bước 4: Sau một thời gian, kim loại Cu sinh ra sẽ hình thành một lớp kim loại màu nâu bám trên đinh sắt → ứng với (4)
Bước 1: Cho lượng muối CuSO4.5H2O thích hợp vào nước tạo thành dung dịch CuSO4 1M → ứng với (2)
Bước 2: Sau đó, làm sạch 1 chiếc đinh sắt. → ứng với (1)
Bước 3: Cho đinh sắt vào cốc thủy tinh chứa dung dịch CuSO4 1M → ứng với (3)
Bước 4: Sau một thời gian, kim loại Cu sinh ra sẽ hình thành một lớp kim loại màu nâu bám trên đinh sắt → ứng với (4)
Fe + CuSO4 ⟶ FeSO4 + Cu
⇒ Điền đáp án: 2134
Câu 28 [704001]: Hòa tan 56,75 gam muối ngậm nước của một sulfate kim loại vào nước rồi pha loãng đến 500 mL. Lấy hai mẫu 20,0 mL của dung dịch này để tiến hành phân tích. Một mẫu được trộn với lượng dư dung dịch ammonia 0,1 M còn mẫu kia được trộn với lượng dư dung dịch barium chloride 0,05 M. Trong cả hai trường hợp, đều có kết tủa được tạo thành. Lọc tách các kết quả, đem nung nóng đến khối lượng không đổi. Sau cùng, chất rắn thu được từ mẫu đầu tiên là 0,348 gam, còn từ mẫu thứ hai là 2,381 gam. Trong công thức muối ngậm nước ban đầu; cứ 1 phân tử muối sulfate kim loại thì ngậm bao nhiêu phân tử nước?
Gọi công thức cần tìm của muối là M2(SO4)n.aH2O
Mẫu I: Sơ đồ phản ứng:
Mẫu II: Ba2+ + SO42- ⟶ BaSO4
Số mol của BaSO4 là: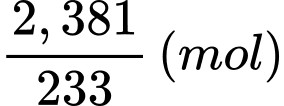
Số mol của M2(SO4)n.aH2O trong 20 mL dung dịch là: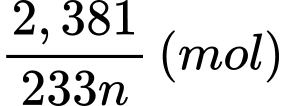
Bảo toàn nguyên tố M, số mol của M2Ox là: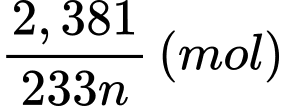
⭐ TH1: M có đa hóa trị hóa trị cố định trong hợp chất → n ≠ x
Khối lượng của M2Ox là: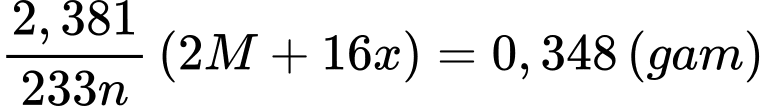
Ta có bảng sau:
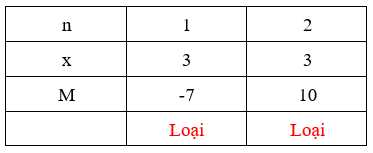
⭐ TH2: M có hóa trị cố định trong hợp chất → n = x
Khối lượng của M2Ox là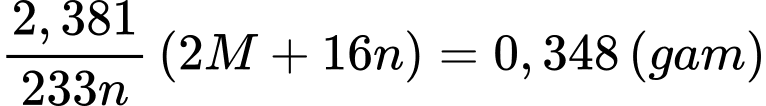
Ta có bảng sau:
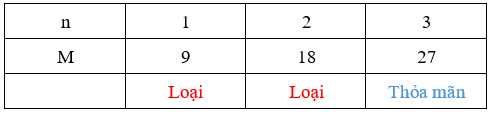
→ M là Al (aluminum)
Khối lượng muối ban đầu là
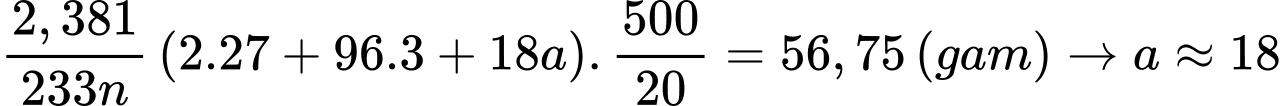
Công thức của muối là Al2(SO4)3.18H2O
Trong công thức muối ngậm nước ban đầu; cứ 1 phân tử muối sulfate kim loại thì ngậm 18 phân tử nước.
⇒ Điền đáp án: 18
Mẫu I: Sơ đồ phản ứng:

Mẫu II: Ba2+ + SO42- ⟶ BaSO4
Số mol của BaSO4 là:
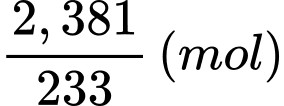
Số mol của M2(SO4)n.aH2O trong 20 mL dung dịch là:
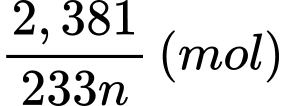
Bảo toàn nguyên tố M, số mol của M2Ox là:
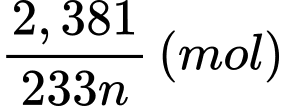
⭐ TH1: M có đa hóa trị hóa trị cố định trong hợp chất → n ≠ x
Khối lượng của M2Ox là:
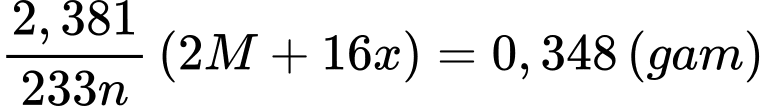
Ta có bảng sau:

⭐ TH2: M có hóa trị cố định trong hợp chất → n = x
Khối lượng của M2Ox là
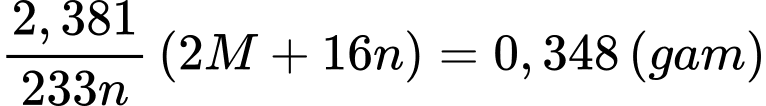
Ta có bảng sau:

→ M là Al (aluminum)
Khối lượng muối ban đầu là
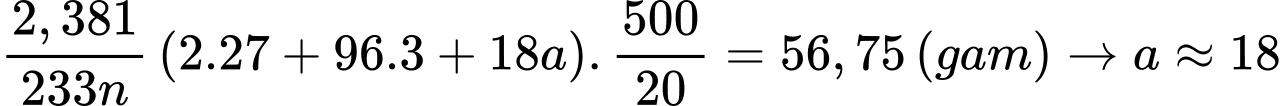
Công thức của muối là Al2(SO4)3.18H2O
Trong công thức muối ngậm nước ban đầu; cứ 1 phân tử muối sulfate kim loại thì ngậm 18 phân tử nước.
⇒ Điền đáp án: 18