Dạng 1. TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.
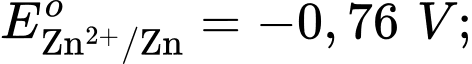
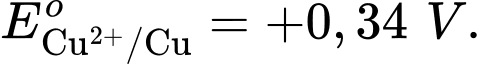 Anode của pin là điện cực của cặp oxi hóa – khử nào?
Anode của pin là điện cực của cặp oxi hóa – khử nào? 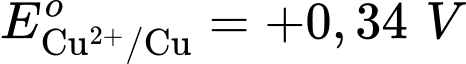 là cathode.
là cathode.Cặp oxi hoá – khử có thế điện cực nhỏ hơn sẽ là anode ⇝ Điện cực
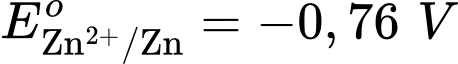 là anode.
là anode.⟹ Chọn đáp án B Đáp án: B
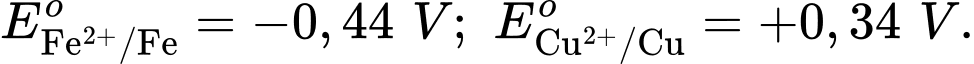 Cathode của pin là điện cực của cặp oxi hóa – khử nào?
Cathode của pin là điện cực của cặp oxi hóa – khử nào? 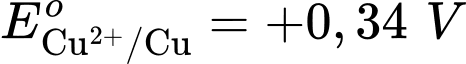 là cathode.
là cathode.Cặp oxi hoá – khử có thế điện cực nhỏ hơn sẽ là anode ⇝ Điện cực
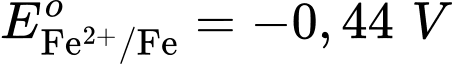 là anode.
là anode.⟹ Chọn đáp án A Đáp án: A
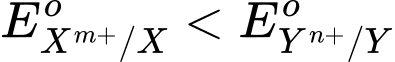 ) trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.
) trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.Anode (-): X → Xm+ + me
Cathode (+) Yn+ + ne → Y
- Sức điện động chuẩn của pin (Eopin) tạo từ hai cặp oxi hoá – khử Xm+/X và Yn⁺/Y (trong đó
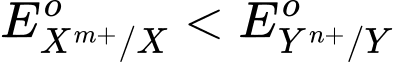 ) được tính theo công thức sau:
) được tính theo công thức sau: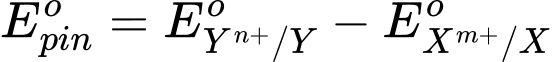
⇒ Chọn đáp án C Đáp án: C
 Fe2+(aq) +2e.
Fe2+(aq) +2e. Fe(s).
Fe(s). Ag(s).
Ag(s). Ag+(aq) + 1e.
Ag+(aq) + 1e.Trong pin điện hoá, cực âm là anode, xảy ra quá trình nhường electron.
Vậy quá trình xảy ra ở cực âm khi pin hoạt động là:Fe(s) → Fe2+(aq) + 2e.
⟹ Chọn đáp án A
⟹ Chọn đáp án C Đáp án: C
 M(s).
M(s). M(s).
M(s). Mn+(aq) + ne.
Mn+(aq) + ne. M+(aq) + 1e.
M+(aq) + 1e.Mn+(aq) + ne ⟶ M(s).
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B
Đáp án: B
Dây dẫn có vai trò quan trọng trong công việc kết nối cực dương và cực âm, tạo thành mạch kín cho phép dòng electron chuyển từ cực âm sang cực dương.
⟹Chọn đáp án B Đáp án: B
- Duy trì tính trung hòa điện
- Đóng mạch điện
- Ngăn chặn sự trộn lẫn các dịch chuyển.
⟹Chọn đáp án B Đáp án: B

Viên pin có ghi thông số 1,5 V con số này có nghĩa là sức điện động của pin là 1,5V.
Chọn đáp án A Đáp án: A
❌ B: Hai thanh Al (aluminium) cùng loại nên không tạo thành pin điện hóa.
❌C: Thanh nhựa và thanh thủy tinh không phải kim loại dẫn điện nên không tạo suất điện động.
❌D: Cu và Zn có tính chất điện hóa khác nhau, nhưng nước nguyên chất không phải chất điện ly mạnh nên không tạo ra suất điện động đáng kể. Đáp án: A
 Pb2+ + Zn2+.
Pb2+ + Zn2+. Pb + Zn.
Pb + Zn. Pb + Zn2+.
Pb + Zn2+. Pb2+ + Zn.
Pb2+ + Zn.Tại anode: Zn ⟶ Zn 2+ + 2e
Tại cathode: Pb2+ +2e ⟶ Pb
Phản ứng hoá học xảy ra khi pin hoạt động:
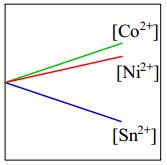
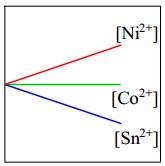
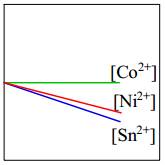
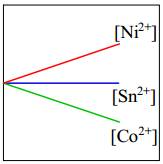
- Độ mạnh tính khử của Ni < Co nên Ni không thể đẩy Co2+ ra khỏi dung dịch muối.
⇒ Do đó [Co2+] giữ nguyên.
⇒ Chọn đáp án B Đáp án: B
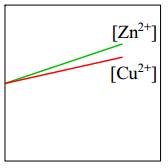
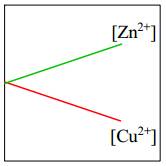
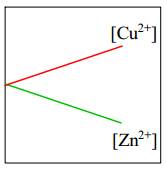

=> Eo Cu2+/Cu > Eo Zn+2/Zn
=> Cu2+/Cu là điện cực dương (cathode) và Zn2+/Zn là điện cực âm (anode).Tại cathode (+): Zn → Zn2+ + 2e ∣ Tại anode (-) : Cu2+ + 2e → Cu
Dựa vào phản ứng tại điện cực: [Zn2+] tăng dần
[Cu2+] giảm dần
⇒ Chọn đáp án B
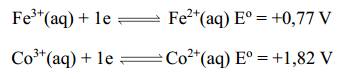
Giá trị suất điện động của pin Fe – Co là
⇒ Chọn đáp án B Đáp án: B
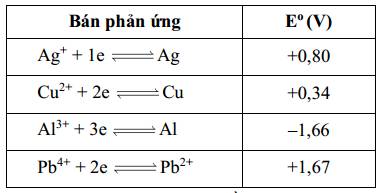
Pin điện hóa nào dưới đây có giá trị sức điện động bằng 0,87 V.
★ Trong pin điện hóa: Eo lớn hơn là cathode, Eo bé hơn là anode.
Xét pin Ag – Pb2+ :
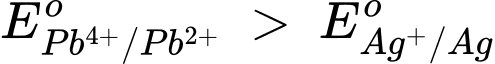
⇒ Pb4+/Pb2+ là cathode, Ag+/Ag là anode
⇒ Epin= 1,67 - 0,80 = 0,87 (V)
⇒ Chọn đáp án A Đáp án: A
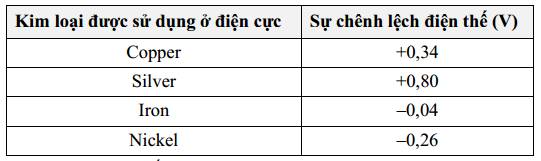
Cặp kim loại nào dưới đây khi lắp thành pin Galvani sẽ cho giá trị sức điện động của pin là lớn nhất?
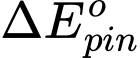 = 0,8 - (-0,26) = 1,06 V
= 0,8 - (-0,26) = 1,06 VB.
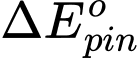 = 0,8 - (-0,04) = 0,84 V
= 0,8 - (-0,04) = 0,84 VC.
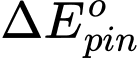 = 0,8 - 0,34 = 0,46 V
= 0,8 - 0,34 = 0,46 VD.
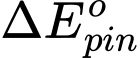 = 0,34 - (-0,26) = 0,6 V
= 0,34 - (-0,26) = 0,6 V⟶ Cặp kim loại nickel và silver khi lắp thành pin Galvani sẽ cho giá trị sức điện động của pin là lớn nhất.
(sức điện động của pin lớn nhất khi thế điện cực chuẩn ở cathode lớn nhất và thế điện cực ở anode nhỏ nhất.) Đáp án: A
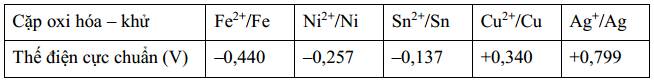
Biết sức điện động chuẩn của pin điện hoá gồm hai điện cực M2+/M và Ag+/Ag bằng 1,056 V. Kim loại nào sau đây phù hợp với M?
➝ Epin = Eo M2+/M - Eo Ag+/Ag
➝ Eo M2+/M = Eo Ag+/Ag + Epin = 0,799 + 1,056 = 1,855 (V)
➝ Không có giá trị Eo thỏa mãn.
TH2: Ag+/Ag đóng vai trò là điện cực dương (cathode)
➝ Epin = Eo Ag+/Ag - Eo M2+/M
➝ Eo M2+/M = Eo Ag+/Ag - Epin = 0,799 - 1,056 = -0,257 (V)
➝ Cặp oxh- khử Ni2+/ Ni thỏa mãn ➝ Chọn C Đáp án: C
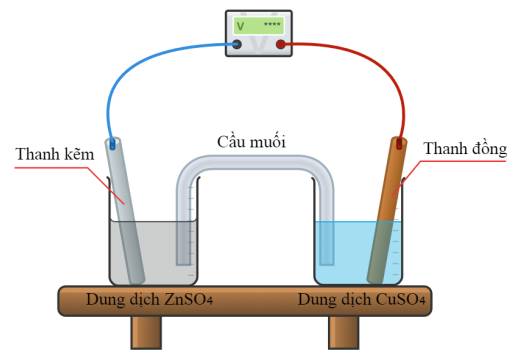
Phát biểu nào sau đây là đúng?
Ta có: Eo Cu2+/Cu = 0,34 (V); Eo Zn2+/Zn = -0,763 (V)
➝ Cu2+/Cu là điện cực dương (cathode); Zn2+/Zn là điện cực âm (anode)
❌ a. Sai. Quá trình xảy ra ở cathode là: Cu2+ +2e ➝ Cu.
❌ b. Sai. Quá trình xảy ra ở anode là: Zn ➝ Zn2+ +2e.
✔️ c. Đúng. Epin = Eo Cu2+/Cu - Eo Zn+/Zn = 0,34 - (- 0,763) = 1,103 (V)
❌ d. Sai. Sau phản ứng thấy xuất hiện kim loại Cu (đồng đỏ) bám lên bề mặt thanh copper ở cathode sau quá trình khử. Kim loại màu xám thường là zinc, nhưng nó không bám trên thanh copper mà có thể bị hòa tan ở anode (thanh zinc).
• Ni(s)
 Ni2+(aq) + 2e (điện cực Ni)
Ni2+(aq) + 2e (điện cực Ni)• Cu2+(aq) + 2e
 Cu(s) (điện cực Cu)
Cu(s) (điện cực Cu)Mô tả nào sau đây mô tả chính xác nhất những gì đang xảy ra trong nửa pin chứa điện cực Cu và dung dịch Cu2+?
+ Điện cực Cu tăng dần khối lượng khi ion Cu2+ bị khử thành Cu rắn.
+ cực dương là Cu ( do có sự nhận e ).
=> cation di chuyển từ cầu muối vào.
=> Chọn đáp án B
Đáp án: B
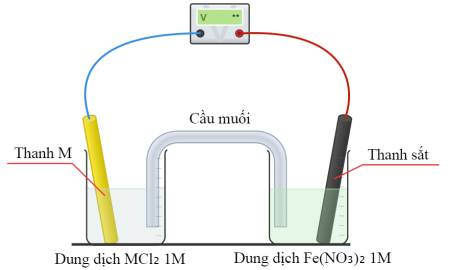
Trong mỗi pin điện, một nửa pin chứa dung dịch Fe(NO3)2(aq) 1,0 M với điện cực Fe. Thành phần của nửa pin còn lại như sau:
• Pin 1: Dung dịch CuCl2(aq) 1,0 M với điện cực Cu.
• Pin 2: Dung dịch NiCl2(aq) 1,0 M với điện cực Ni.
• Pin 3: Dung dịch ZnCl2(aq) 1,0 M với điện cực Zn.
Sắt đóng vai trò là cực dương trong (các) pin điện nào?
⇒ Điện cực anode phải có Eo bé hơn Eo Fe2+/Fe = -0,44
Biết: Eo Cu2+/Cu = +0,34 (V);
Eo Ni2+/Ni = -0,257 (V);
Eo Zn2+/Zn = -0,76 (V)
➝ Nhận thấy Eo Zn2+/Zn < Eo Fe2+/Fe
➝ Pin 3 là đáp án đúng.
⇒ Chọn đáp án C Đáp án: C
Vòng đời sử dụng được kéo dài do có thể nạp lại để tái sử dụng mà không cần phải thay thế viên pin.
* Nhược điểm:
Chi phí sản xuất acquy thường lớn hơn so với pin thông thường; acquy cũ, hỏng không được thu gom và xử lí đúng cách sẽ gây ô nhiễm môi trường bởi các thành phần kim loại, hoá chất cũng như lớp vỏ của acquy (làm bằng nhựa khó phân huỷ). Đáp án: C
Chọn đáp án A Đáp án: A
- Tạo điện năng trực tiếp từ phản ứng hoá học nên có hiệu suất chuyển hoá từ nhiên liệu sang điện năng cao.
- Pin nhiên liệu hydrogen không tạo ra các sản phẩm gây ô nhiễm môi trường.
*Nhược điểm:
Giá thành pin nhiên liệu cao vì cấu tạo
phức tạp của pin (gồm các điện cực phủ xúc
tác, lớp màng đặc biệt giữa hai điện cực, dung
dịch trong pin,...) cũng như phải có bộ phận
lưu trữ nhiên liệu đặc biệt là hydrogen. Đáp án: C
Sử dụng nguồn năng lượng vô tận là
ánh sáng mặt trời, không tạo ra bất cứ sản
phẩm hoá học nào trong quá trình hoạt
động nên thân thiện với môi trường.
*Nhược điểm:
Chỉ sinh ra dòng điện khi có ánh sáng mặt trời,
công suất dòng điện tỉ lệ với cường độ ánh sáng.
Khi pin hết hạn sử dụng, việc xử lí không đúng
cách sẽ gây ô nhiễm môi trường đất. Đáp án: C
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.
a. Phản ứng hoá học xảy ra trong pin Galvani là phản ứng tự diễn biến.
b. Trong pin Galvani, điện cực âm là nơi xảy ra quá trình khử.
c. Sức điện động của pin Galvani là hiệu điện thế giữa hai điện cực.
d. Pin Galvani tạo ra dòng điện từ quá trình vật lí.
✔️ a. Đúng. Phản ứng hoá học xảy ra trong pin Galvani là phản ứng tự diễn biến.
❌ b. Sai. Trong pin Galvani, điện cực âm là nơi xảy ra quá trình oxi hoá.
❌ c. Sai. Sức điện động của pin Galvani là hiệu thế điện cực chuẩn của cặp oxi hóa – khử.
❌ d. Sai. Pin Galvani tạo ra dòng điện từ quá trình hóa học, thông qua các phản ứng oxi hóa - khử tại hai điện cực.
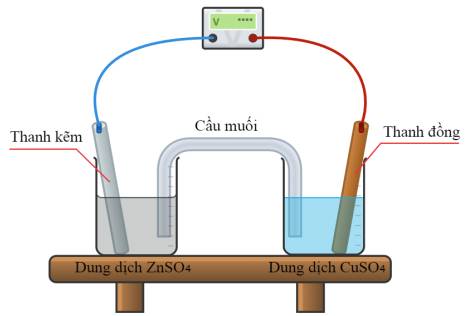
a. Quá trình xảy ra ở cathode là: Zn ⟶ Zn2+ + 2e.
b. Quá trình xảy ra ở anode là: Cu2+ + 2e ⟶ Cu.
c. Sức điện động chuẩn của pin là 1,102 V.
d. Sau phản ứng thấy xuất hiện kim loại màu xám bám trên bề mặt thanh copper.
❌ a. Sai. Quá trình xảy ra ở cathode là: Cu2+ + 2e ⟶ Cu.
❌ b. Sai. Quá trình xảy ra ở anode là: Zn ⟶ Zn2+ + 2e.
✔️ c. Đúng. Sức điện động chuẩn của pin là 1,102 V.
❌ d. Sai. Sau phản ứng thấy xuất hiện kim loại Cu (đồng đỏ) sẽ bám lên bề mặt thanh copper ở cathode sau quá trình khử. Kim loại màu xám thường là zinc, nhưng nó sẽ không bám trên thanh copper mà có thể bị hòa tan ở anode (thanh zinc).
A2+(aq) + 2e
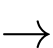 A(s);
A(s); 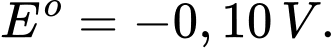
B2+(aq) + 2e
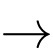 B(s);
B(s); 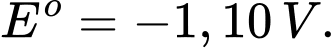
Hình vẽ dưới đây là mô hình pin chưa hoàn chỉnh, cần bổ sung thêm một số thứ để tạo ra một pin ở điều kiện chuẩn (các điện cực đang được nhúng chìm trong nước).
a. Để có pin ở điều kiện chuẩn, cần bổ sung vào cốc chứa điện cực A
dung dịch A2+(aq) 1 M.
b. Để có pin ở điều kiện chuẩn, cần bổ sung cầu muối chứa NaNO3.
c. Trong pin ở điều kiện chuẩn, các electron chuyển động trong mạch
ngoài từ anode sang cathode.
d. Trong pin ở điều kiện chuẩn, điện cực A đóng vai trò là cathode (cực
dương).
✔️a. Đúng. Bổ sung dung dịch A2+ vào cốc điện cực kim loại A tương ứng tạo ra đúng một điện cực.
❌ b. Sai. Cần bổ sung cầu muối chứa NaNO3
✔️ c. Đúng. Các electron chuyển động trong mạch ngoài từ anode(-) sang cathode(+), từ nơi có điện năng cao đến nơi có điện năng thấp
✔️ d. Đúng. Vì EoB2+/B < EoA2+/A => Dựa trên quy tắc alpha ta xác định được phản ứng là A2+ + B ➝ A + B2+ => xảy ra quá trình khử A2+ nên A2+/A là điện cực cathode(+).
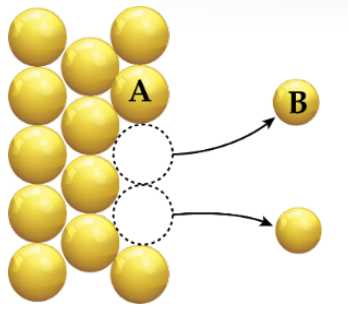
Phát biểu nào sau đây không đúng?
✔️a. Đúng. Sơ đồ thể hiện sự biến đổi A ➝ B + ne => quá trình oxi hóa, đây là điện cực âm (anode).
❌ b. Sai. Điện cực này là điện cực âm (anode).
✔️ c. Đúng. Các hạt A nhường electron tạo cation B.
✔️ d. Đúng. Hạt A trong điện cực nhường electron tạo hạt B trong dung dịch nên kích thước hạt A lớn hơn hạt B trong dung dịch.
⇒ Chọn đáp án B Đáp án: B
✔️ a. Đúng. Vì giá trị thế điện cực của Ag+/Ag lớn hơn Cu2+/Cu nên Ag đóng vai trò là cathode (cực dương) xảy ra quá trình khử ion Ag+ tạo kim loại Ag làm khối lượng điện cực tăng lên.
✔️ b. Đúng. Điện cực đồng (anode) xảy ra quá trình oxi hóa kim loại nên làm khối lượng điện cực giảm.
❌ c. Sai. Khi pin hoạt động, xảy ra quá trình khử ion Ag+ tạo kim loại Ag nên nồng độ Ag+ giảm.
✔️ d. Đúng. Quá trình xảy ra trong pin là quá trình tự diễn biến.
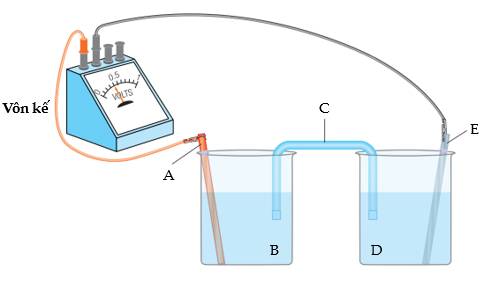
Cho các phát biểu sau:
(a) A là thanh điện cực anode, E là thanh điện cực cathode, C là cầu muối.
(b) Nếu A là Zn thì B có thể là ZnSO4.
(c) Nếu C chứa KNO3 thì ion K+ được chuyển từ C vào D.
(d) Chiều dòng điện ở mạch ngoài từ A sang E.
Trong số các phát biểu trên, các phát biểu đúng là
Phân tích các phát biểu sau:
❌ a. Sai. Trong pin Galvani thì cathode A là thanh Cu (thanh kim loại màu đậm ), anode E là thanh Zn, C là cầu muối.
✔️ b. Đúng. Nếu A là Zn thì B có thể là ZnSO4.
❌ c. Sai. Vì tại cathode A xảy ra: Cu2+ + 2e ⟶ Cu. Nồng độ Cu2+ giảm nên K+ di chuyển vào B để duy trì tính trung hoà điện của B.
✔️ d. Đúng. Chiều dòng điện từ A sang E (ngược với dòng chuyển dời e).
⇒ Chọn đáp án B Đáp án: B
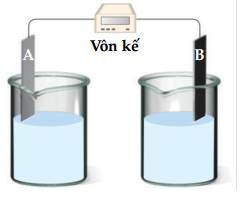
Một pin điện hoá Zn – H2 được thiết lập ở các điều kiện như hình vẽ sau: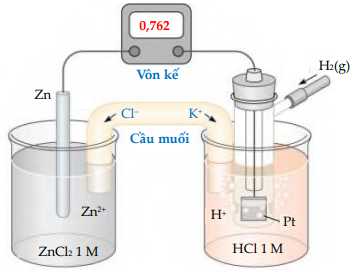
a. Giá trị thế điện cực chuẩn của cặp oxi hoá - khử Zn2+/Zn là 0,762V.
b. Quá trình khử xảy ra ở cathode là: 2H+ + 2e ⟶ H2.
c. Chất điện li trong cầu muối là KCl.
d. Phản ứng hoá học xảy ra trong pin là: Zn + 2H+ ⟶ Zn2+ + H2.
❌ a. Sai. Sức điện động pin là Epin= Ecathode - Eanode= EH2/H+ - EZn2+/Zn= 0,762. Mà EH+/H2= 0 nên EZn2+/Zn= -0,762.
✔️ b. Đúng. Quá trình khử xảy ra ở cathode là: 2H+ + 2e ⟶ H2.
✔️ c. Đúng. Chất điện li trong cầu muối là KCl.
✔️ d. Đúng. Phản ứng hóa học xảy ra trong pin là:
Zn + 2H+ ⟶ Zn2+ + H2.
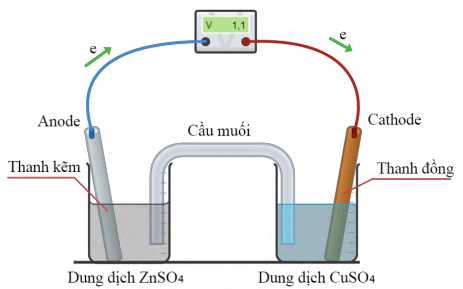
✔️ a. Đúng. Sức điện động của pin bằng thế chênh lệch giữa cực dương và cực âm.
✔️ c. Đúng. Pin Galvani cung cấp nguồn điện hóa học.
❌ d. Sai. Sức điện động của pin Galvani luôn dương vì Ecathode > Eanode => Epin luôn dương.
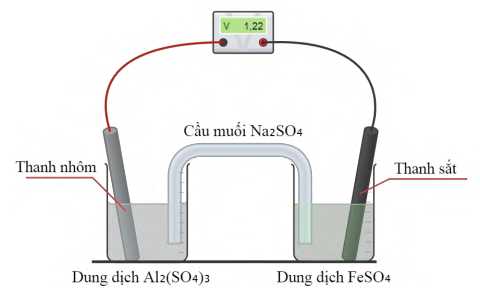
Một nửa pin bao gồm một thanh sắt được đặt trong dung dịch FeSO4 và nửa còn lại có một thanh nhôm được đặt trong dung dịch Al2(SO4)3. Phản ứng tổng thể của pin là
2Al(s) + 3Fe2+(aq)
 3Fe(s) + 2Al3+(aq)
3Fe(s) + 2Al3+(aq)a. Al là chất khử, Fe2+ là chất oxi hoá.
b. Điện cực Fe đóng vai trò là cathode (cực dương).
c. Electron di chuyển từ điện cực sắt sang điện cực nhôm.
d. Các cation Na+ trong cầu muối di chuyển về phía cốc đựng thanh nhôm.
✔️ a. Đúng. Theo phương trình phản ứng xảy ra trong pin, Al là chất khử, Fe2+ là chất oxi hóa.
✔️ b. Đúng. Điện cực sắt xảy ra quá trình khử ion Fe2+ => Cathode (cực dương).
❌ c. Sai. Điện cực anode có Al nhường electron => Electron di chuyển từ điện cực nhôm sang điện cực sắt.
❌ d. Sai. Các anion SO42- trong cầu muối di chuyển về phía cốc đựng thanh Al, cation Na+ di chuyển về điện cực sắt.
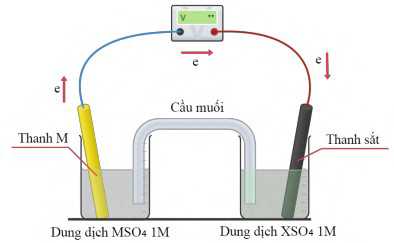
Biết
✔️ a. Đúng. Vì ENi2+/Ni > EZn2+/Zn nên khả năng oxi hóa của Ni2+ mạnh hơn Zn2+ => Điện cực X (nhận e) là Ni; điện cực M (nhường e) là Zn.
✔️ b. Đúng. Điện cực Zn2+/Zn đóng vai trò là anode (xảy ra quá trình oxi hóa thanh Zn).
❌ c. Sai. Sức điện động của pin là Epin = ENi2+/Ni - EZn2+/Zn = -0,25 - (-0,76)= 0,51V.
✔️ d. Đúng. Khi loại bỏ cầu muối thì điện tích ở 2 điện cực không được trung hòa dẫn đến sự tích tụ điện tích quá mức và làm dừng phản ứng oxi hóa khử. Do đó, sức điện động của pin sẽ bằng 0.
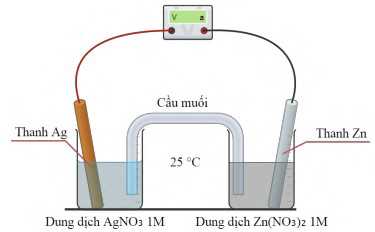
Biết
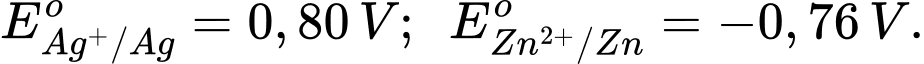
✔️ a. Đúng. Vì EAg+/Ag > EZn2+/Zn nên khả năng oxi hóa của Ag+ mạnh hơn Zn2+
=> Phương trình ion thu gọn: Zn + 2Ag+ ⟶ Zn2+ + 2Ag.
❌ b. Sai. Sức điện động chuẩn của pin đo được bằng vôn kế có giá trị là 1,56V.
❌ c. Sai. Thanh Ag đóng vai trò là cực dương (cathode); thanh Zn đóng vai trò là cực âm (anode).
❌ d. Sai. Nếu thêm KI vào điện cực Ag+/Ag thì sức điện động của pin giảm. Vì ion I- tạo kết tủa với ion Ag+ trong dung dịch.
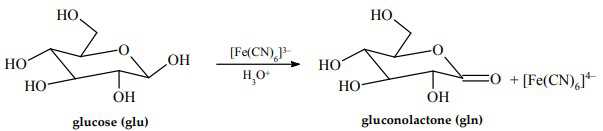
Cho biết
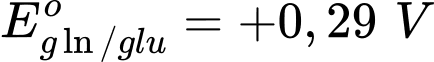 và
và 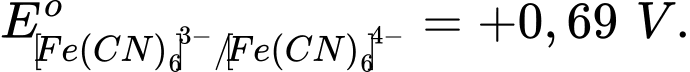
a. Trong phản ứng pin, Fe có số oxi hoá +2 bị oxi hoá thành +3.
b. Phản ứng xảy ra trong pin là phản ứng tự diễn biến.
c. Sức điện động chuẩn Eo pin là 0,40V.
d. Khi nồng độ glucose tăng, sức điện động của pin tăng.
❌ a. Sai. Trong phản ứng pin, Fe có số oxi hóa +3 bị khử thành +2.
✔️ b. Đúng. Phản ứng trong pin là phản ứng tự diễn biến.
✔️ c. Đúng. Sức điện động của pin là Epin = Ecathode- Eanode= 0,69 - 0,29 = 0,4V.
✔️ d. Đúng. Tăng nồng độ glucose ở cực âm (anode) sẽ làm thế điện cực của gln/glu giảm, dẫn đến làm tăng sức điện động của pin.
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
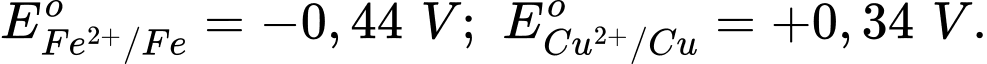 Sức điện động chuẩn của pin điện hoá trên là bao nhiêu vôn?
Sức điện động chuẩn của pin điện hoá trên là bao nhiêu vôn?Điền đáp án: ..........
+ Cặp oxi hóa- khử có thế điện cực nhỏ hơn sẽ là anode ⟶ Điện cực Fe2+/Fe là anode.
=> Sức điện động chuẩn của pin là:

Nếu M là một trong số các kim loại: Fe, Ni, Sn, Cu thì sức điện động chuẩn lớn nhất của pin bằng bao nhiêu vôn?
Điền đáp án: ..........
=> Điện cực Ag+/Ag là cathode. Điện cực còn lại là anode
=> Epin= 0,799 - (-0,440) = 1,24 V
=> Điền đáp án: 1,24
2Cr + 3Cu2+
 2Cr3+ + 3Cu.
2Cr3+ + 3Cu.Biết
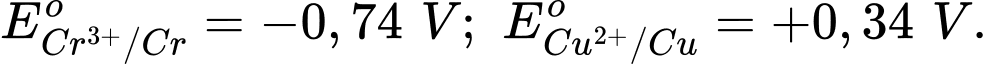 Sức điện động Eo của pin điện hoá là
Sức điện động Eo của pin điện hoá làĐiền đáp án: ..........
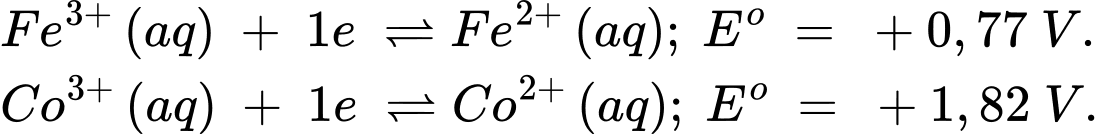
Giá trị sức điện động chuẩn của pin Fe–Co là
Điền đáp án: ..........

Giá trị sức điện động chuẩn của pin Fe – Cu là
Điền đáp án: ..........

Một pin điện dựa trên phản ứng: 2Eu2+(aq) + Ni2+(aq)
 2Eu3+(aq) + Ni(s) tạo thành pin có sức điện động là
2Eu3+(aq) + Ni(s) tạo thành pin có sức điện động là 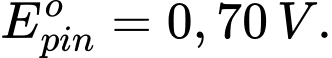 Cho thế khử chuẩn của Ni2+/Ni là –0,25 V. Thế khử chuẩn của phản ứng Eu3+(aq) + e
Cho thế khử chuẩn của Ni2+/Ni là –0,25 V. Thế khử chuẩn của phản ứng Eu3+(aq) + e  Eu2+(aq) bằng bao nhiêu vôn?
Eu2+(aq) bằng bao nhiêu vôn?Điền đáp án: ..........
=> Điền đáp án: -0,95
• Điện cực 1: Zn2+(aq) + 2e
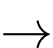 Zn(s);
Zn(s); 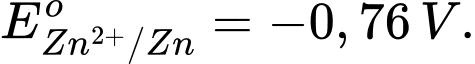
• Điện cực 2: Fe2+(aq) + 2e
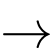 Fe(s);
Fe(s); 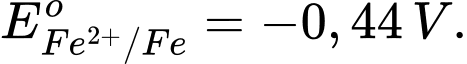
• Điện cực 3: Cu2+(aq) + 2e
 Cu(s);
Cu(s); 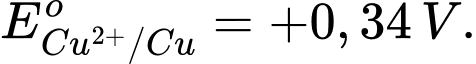
Tiến hành lắp pin điện từ hai trong ba điện cực để tạo thành pin thì giá trị sức điện động lớn nhất có thể thu được là bao nhiêu vôn?
Điền đáp án: ..........

Bán phản ứng của pin cúc áo lithium/iodine như sau:
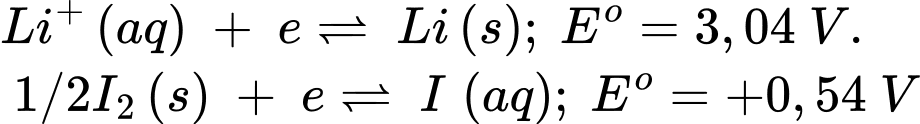
Sức điện động chuẩn của pin lithium/iodine bằng bao nhiêu vôn?
Điền đáp án: ..........
⇒ Quãng đường tối đa xe chạy xăng đi được: 8.107 / 106 = 80 km
Năng lượng có ích khi sử dụng 400 gam hydrogen: 400/2 . 286 000 . 60% = 34 320 000 J
⇒ Quãng đường tối đa xe chạy pin đi được: 34 320 000/ 106 = 34,3 km
Vậy quãng đường xe xăng chạy nhiều hơn xe chạy bằng pin 80 - 34,3 = 45,7 km
⇒ Điền đáp án: 45,7
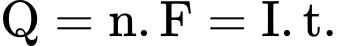 Trong đó: Q là điện lượng (C), n là số mol electron đi qua dây dẫn, I là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (96500 C/mol).
Trong đó: Q là điện lượng (C), n là số mol electron đi qua dây dẫn, I là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (96500 C/mol).Điền đáp án: ..........
Q = n.F = I.t
<=> 0,2. 2. 96500 = 0,04 . t
=> t = 965000 giây = 268 giờ
=> Điền đáp án: 268
• Cd(OH)2(s) + 2e
 Cd(s) + 2OH–(aq)
Cd(s) + 2OH–(aq) 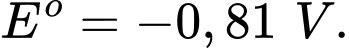
• Ni(OH)3(s) + e
 Ni(OH)2(s) + OH–(aq)
Ni(OH)2(s) + OH–(aq) 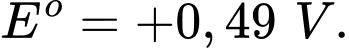
Sức điện động chuẩn
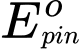 của pin nicad bằng bao nhiêu vôn?
của pin nicad bằng bao nhiêu vôn?Điền đáp án: ..........
PbO2(s) + CO(g) + H2SO4(aq)
 PbSO4(s) + CO2(g) + H2O.
PbSO4(s) + CO2(g) + H2O.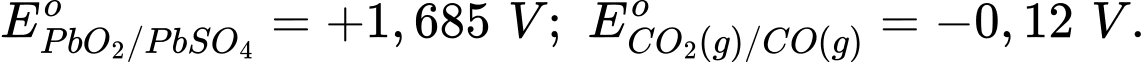
Nếu khối lượng riêng của dung dịch sulfuric acid trong acquy giảm từ 1,3 g/mL (40% H2SO4 theo khối lượng) xuống 1,2 g/mL (20% H2SO4 theo khối lượng) trong quá trình sử dụng, hãy xác định điện lượng của acquy đã tạo ra theo đơn vị ampere.giờ. Biết thể tích của acquy là 3,0 lít và thể tích thay đổi không đáng kể.
Điền đáp án: ..........
mH2SO4 ban đầu = V.D.C%= 3000. 1,3.40% = 1560
mH2SO4 sau phản ứng=V.D.C%=3000. 1,2. 20%= 720
=> ∆m = 1560 - 720= 840 g
=> nH2SO4= 8,57
=> ne trao đổi= 2.nH2SO4= 17,14 mol
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó
Một ví dụ về pin nồng độ được biểu diễn trong Hình (a) dưới đây. Một nửa pin bao gồm một thanh kim loại nickel được ngâm trong dung dịch Ni2+(aq) 1,00×10–3 M. Nửa pin còn lại cũng là điện cực Ni(s), nhưng nó được ngâm trong dung dịch Ni2+(aq) 1,00 M. Hai nửa pin được nối với nhau bằng cầu muối và bằng dây dẫn bên ngoài chạy qua vôn kế. Các phản ứng trong nửa pin là nghịch đảo của nhau:
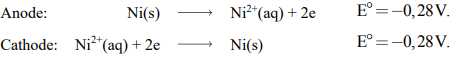
Mặc dù sức điện động chuẩn của pin này bằng 0 V.
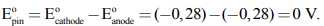
Tuy nhiên, nếu quan sát kĩ có thể thấy pin hoạt động trong điều kiện không chuẩn vì nồng độ Ni2+(aq) không phải là 1 M ở cả hai nửa pin. Trên thực tế, pin hoạt động cho đến khi nồng độ ion Ni2+ (anode) bằng nồng độ ion Ni2+ (cathode). Quá trình oxy hóa Ni(s) xảy ra trong nửa pin nào chứa nồng độ dung dịch loãng hơn, đây là anode của pin. Quá trình khử Ni2+(aq) xảy ra trong nửa pin chứa nồng độ dung dịch đậm đặc hơn, đây là cathode của pin. Do đó phản ứng tổng thể của tế bào là
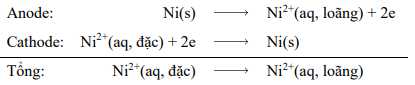
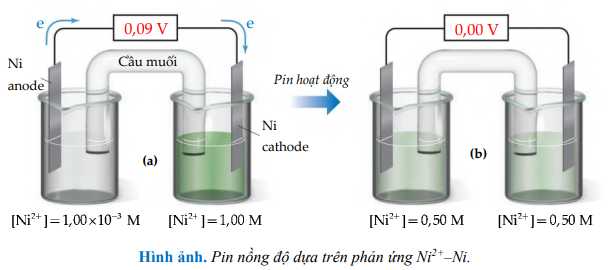
Hình ảnh. Pin nồng độ dựa trên phản ứng Ni2+–Ni.
(a) Nồng độ Ni2+(aq) trong hai nửa pin không bằng nhau và pin tạo ra dòng điện và điện áp.
(b) Pin hoạt động cho đến khi nồng độ ion Ni2+ bằng nhau ở hai nửa pin, lúc đó pin đã đạt đến trạng thái cân bằng và sức điện động bằng 0.
Chúng ta có thể tính sức điện động của một pin nồng độ bằng cách sử dụng phương trình Nernst.
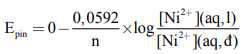
Trong đó: Epin là sức điện động của pin trong điều kiện không chuẩn (V).
n là số electron trao đổi trong các bán phản ứng.
[Ni2+](aq,l) là nồng độ ion Ni2+(aq) trong dung dịch loãng.
[Ni2+](aq,đ) là nồng độ ion Ni2+(aq) trong dung dịch đặc.
Đối với trường hợp cụ thể này, chúng ta thấy rằng n = 2. Do đó, sức điện động ở 298 K là
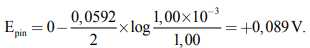

Lươn điện sử dụng các tế bào gọi là tế bào điện dựa trên nguyên tắc tương tự để tạo ra các xung điện ngắn nhưng cường độ cao nhằm làm choáng váng con mồi và ngăn cản kẻ thù. Sự khác biệt về nồng độ ion, chủ yếu là Na+ và K+, tạo ra sức điện động ở mức 0,1 V. Bằng cách kết nối hàng nghìn tế bào này thành chuỗi, những loài cá Nam Mỹ này có thể tạo ra các xung điện ngắn cao tới 500 V.
Trong pin nồng độ, hai điện cực thường được làm từ cùng một kim loại, nhưng nhúng vào dung dịch điện phân có nồng độ khác nhau.
Do sự chênh lệch nồng độ, xảy ra phản ứng oxy hóa ở cực âm và phản ứng khử ở cực dương .Ion kim loại di chuyển từ dung dịch có nồng độ cao sang dung dịch có nồng độ thấp, tạo ra một hiệu điện thế giữa hai điện cực.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án A Đáp án: A
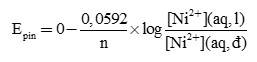
n là số electron trao đổi trong các bán phản ứng.
[Ni2+](aq,l) là nồng độ ion Ni2+(aq) trong dung dịch loãng.
[Ni2+](aq,đ) là nồng độ ion Ni2+(aq) trong dung dịch đặc.
Đối với trường hợp cụ thể này, chúng ta thấy rằng n = 2. Do đó, sức điện động ở 298 K là
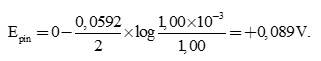
⟶ n = 2
Một pin nồng độ được tạo bởi hai điện cực Fe với nồng độ của ion Fe2+(aq) trong hai dung dịch lần lượt là 2,00 × 10–3 M và 5,00 × 10–2 M.
Sức điện động mà pin nồng độ này tạo ra là:
Epin =
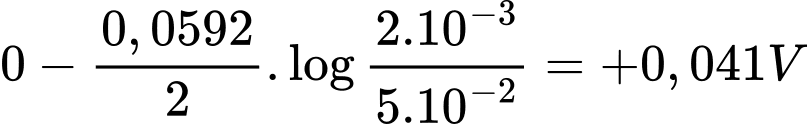
⇒ Chọn đáp án C Đáp án: C
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 55 đến 57
Thành tế bào là màng có tính thấm thay đổi đối với một số ion quan trọng về mặt sinh lý (đặc biệt là các ion Na+, K+ và Ca2+). Nồng độ của các ion này khác nhau đối với chất lỏng bên trong tế bào (dịch nội bào kí hiệu ICF) và bên ngoài tế bào (dịch ngoại bào kí hiệu ECF). Ví dụ, trong tế bào cơ tim, nồng độ K+ trong ICF và ECF lần lượt là khoảng 135 milimol (mM) và 4 mM. Tuy nhiên, đối với Na+, sự chênh lệch nồng độ giữa ICF và ECF lại ngược lại so với K+; thông thường, [Na+]ICF = 10 mM và [Na+]ECF = 145 mM.
Màng tế bào ban đầu có tính thấm đối với ion K+ nhưng lại ít hơn đối với ion Na+ và Ca2+. Sự khác biệt về nồng độ ion K+ giữa ICF và ECF tạo ra một pin nồng độ. Mặc dù các ion giống nhau hiện diện ở cả hai phía của màng, nhưng có một sự khác biệt về nồng độ. Ở nhiệt độ sinh lý 37oC, một điện thế tồn tại trên màng do nồng độ ion K+ không đồng đều
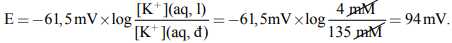
Vào cuối những năm 1800, các nhà khoa học phát hiện ra rằng các xung điện gây ra sự co bóp của cơ tim đủ mạnh để có thể phát hiện được trên bề mặt cơ thể. Quan sát này đã hình thành cơ sở cho điện tâm đồ, theo dõi tim không xâm lấn bằng cách sử dụng một dãy điện cực phức tạp trên da để đo sự thay đổi điện áp trong nhịp tim. Một điện tâm đồ điển hình được thể hiện trong Hình 20.17. Điều đáng chú ý là, mặc dù chức năng chính của tim là bơm máu cơ học, nhưng nó lại được theo dõi dễ dàng nhất bằng cách sử dụng các xung điện được tạo ra bởi các tế bào điện cực nhỏ.
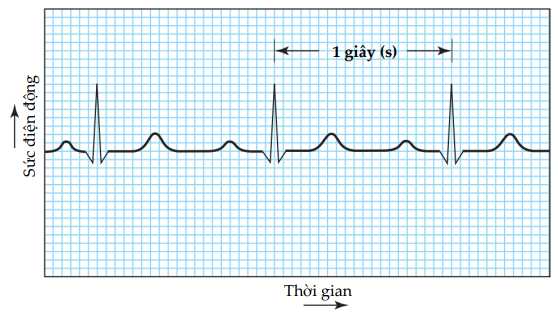
Hình ảnh. Một điện tâm đồ điển hình.
Chọn đáp án C Đáp án: C
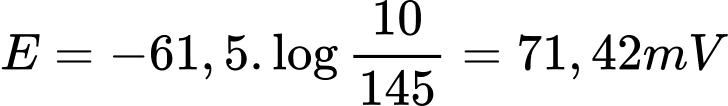
Chọn đáp án B Đáp án: B
Nếu độ chênh lệch nồng độ ECF và ICF càng lớn thì E càng lớn=> điện thế tồn tại trên màng tế bào càng lớn.
Chọn đáp án A Đáp án: A
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 58 đến 60
Sự hình thành rỉ sét trên sắt (Fe) cần có oxygen (O2) và nước. Mặc dù các phản ứng liên quan khá phức tạp và chưa được hiểu đầy đủ nhưng các bước chính được cho là như sau. Một vùng bề mặt kim loại đóng vai trò là anode, nơi xảy ra quá trình oxy hóa sau:
Fe(s) → Fe2+(aq) + 2e
Các electron bị sắt nhường lại sẽ khử oxygen trong khí quyển thành nước ở cathode, đây là một vùng khác trên cùng bề mặt kim loại:
O2(g) + 4H+(aq) + 4e → 2H2O(l)
Phản ứng oxi hóa khử tổng thể là:
2Fe(s) + O2(g) + 4H+(aq) → 2Fe2+(g) + 2H2O(l)
Lưu ý rằng phản ứng này xảy ra trong môi trường acid. Các ion H+ được cung cấp một phần nhờ phản ứng của carbon dioxide trong khí quyển với nước để tạo thành acid yếu, carbonic acid (H2CO3). Các ion Fe2+ hình thành ở anode tiếp tục bị oxy hóa bởi oxygen như sau:
4Fe2+(aq) + O2(g) + (4 + 2x)H2O(l) → 2Fe2O3.xH2O(s) + 8H+(aq)
Dạng sắt(III) oxide ngậm nước Fe2O3 .xH2O được gọi là rỉ sét. Lượng nước kết hợp với sắt(III) oxide thay đổi nên chúng ta biểu diễn công thức là Fe2O3.xH2O.
Hình vẽ dưới thể hiện cơ chế hình thành rỉ sét. Mạch điện được hoàn thành nhờ sự di chuyển của các electron và ion; đây là lý do tại sao hiện tượng rỉ sét xảy ra rất nhanh trên vỏ tàu khi ở trong nước biển. Ở vùng khí hậu lạnh, muối (NaCl hoặc CaCl2) được rắc trên mặt đường để hạn chế việc nước đóng băng trên mặt đường làm trơn trượt nhưng nó cũng là nguyên nhân chính hình thành rỉ sét trên ô tô.
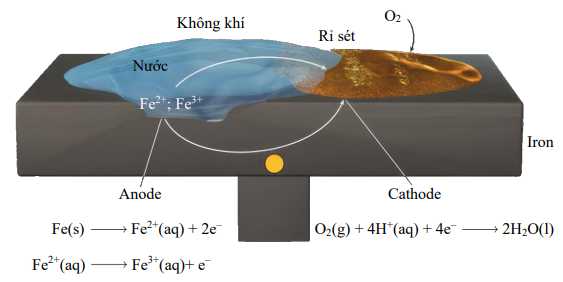
Hình vẽ. Quá trình ăn mòn điện hóa liên quan đến sự hình thành rỉ sét
4Fe2+(aq) + O2(g) + (4 + 2x)H2O(l) → 2Fe2O3.xH2O(s) + 8H+(aq)
Chọn đáp án A Đáp án: A
Chọn đáp án A Đáp án: A
(i) Khi xảy ra hiện tượng ăn mòn, electron di chuyển tử cathode về anode.
(ii) Trong quá trình ăn mòn, môi trường acid chủ yếu do carbonic acid cung cấp.
(iii) Lắp thêm tấm kim loại Zn trên vỏ tàu để bảo vệ vỏ tàu được lâu hơn.
(iv) Hiện tượng rỉ sét xảy ra rất nhanh trong nước biển.Số phát biểu đúng là
❌(i)Sai. Khi xảy ra hiện tượng ăn mòn, electron di chuyển từ anode về cathode
❌(ii)Sai. Trong quá trình ăn mòn, carbonic acid chỉ cung cấp 1 phần H+ để tạo thành môi trường acid, không phải là nguồn chính tạo môi trường acid.
✔️(iii) Đúng. Lắp thêm tấm kim loại Zn trên vỏ tàu để bảo vệ vỏ tàu được lâu hơn do Zn bị ăn mòn trước.
✔️(iv)Đúng. Hiện tượng rỉ sét xảy ra rất nhanh trong nước biển do có sự hình thành mạch điện từ dòng electron di chuyển. Đáp án: B