Dạng 1. TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.
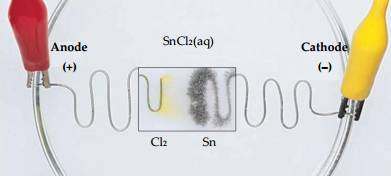
 Fe2+(aq) +2e.
Fe2+(aq) +2e. Fe(s).
Fe(s). Cl2(g) + 2e.
Cl2(g) + 2e. 2Cl–(aq).
2Cl–(aq).Trong bình điện phân FeCl2, anode là cực dương (+) là nơi các ion âm (Cl-) tiến về.
Tại đây xảy ra quá trình oxi hóa ion Cl- :
2Cl- ➝ Cl2 + 2e
Đáp án: CAnode là điện cực xảy ra quá trình oxi hóa.
⟹ Chọn đáp án C Đáp án: C
Ở anode xảy ra quá trình
2Cl- ➝ Cl2 + 2e Đáp án: A
Phương trình điện phân: 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2.
⟹ Chọn đáp án B
★ Cation không bị điện phân: Na+; K+ (nước sẽ bị điện phân)
★ Cation bị điện phân: Cu2+; H+
Cu2+ + 2e ➝ Cu
H+ + 2e ➝ H2
⟹ Dung dịch CuCl2 sẽ thu được kim loại ở cathode.
⟹ Chọn đáp án C Đáp án: C
Cation Cu2+ bị điện phân: Cu2+ + 2e ➝ Cu.
⇒ Chọn đáp án D Đáp án: D
Phương trình điện phân: 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2.
⟹ Chọn đáp án D Đáp án: D
⟹ Chọn đáp án D Đáp án: D
⋆ 2CuSO4 + H2O ➝ 2Cu + 2O2 + H2SO4
⋆ 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2
⋆ Điện phân K2SO4, KNO3 thực chất là điện phân H2O : H2O ➝ H2 + O2
⟹ Chọn đáp án B
⋆ H2O ➝ H2 + O2 ➝ Ở cả 2 điện cực có khí thoát ra ngay lúc mới bắt đầu điện phân.
⟹ Chọn đáp án C
+ Cathode (cực âm) là nơi xảy ra quá trình khử
+ Anode (cực dương) là nơi xảy ra quá trình oxi hóa
Phản ứng điện cực:
Cathode (-): Na+ không bị điện phân => H2O bị khử 2H2O + 2e ➝ H2 + 2OH-
Anode (+): Cl- bị oxi hóa => 2Cl- ➝ Cl2 + 2e.
⟹ Chọn đáp án A Đáp án: A
2Cl- ➝ Cl2 + 2e
⟹ Chọn đáp án A Đáp án: A
Na+ + 1e ➝ Na
⟹ Chọn đáp án D Đáp án: D
2C + O2 ➝ 2CO
C + O2 ➝ CO2
⟹Ngoài O2 thì hỗn hợp khí thoát ra ở anode có thêm CO và CO2.
⟹ Chọn đáp án C Đáp án: C
(-) Cathode: Li+ + 1e ➝ Li (Eo Li+/Li= - 3,05 V)
(+) Anode: 2Cl- ➝ Cl2 + 2e (EoCl2/2Cl-= 1,36 V)
=> U = Eo (+) - Eo (-) = 1,36 - (-0,35) = 4,41 V
=> Đáp án A
Đáp án: A(-) Cathode: Cu2+ + 2e ➝ Cu (Eo Cu2+/Cu= 0,34 V)
(+) Anode: 2Br- ➝ Br2 + 2e (EoBr2/2Br-= 1,07 V)
=> U = Eo (+) - Eo (-) = 1,07 - 0,34 = 0,73 V
=> Đáp án C
Đáp án: C★ Các ion K+, Al3+, Mg2+ không bị điện phân trong dung dịch. Có thể điều chế K, Al, Mg bằng điện phân nóng chảy.
⇒ Chọn đáp án A Đáp án: A
=> Loại đáp án B, C, D vì có chứa Li, Ca, Al.
⇒ Chọn đáp án A Đáp án: A
⭐ Điều chế Na bằng phương pháp điện phân nóng chảy.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
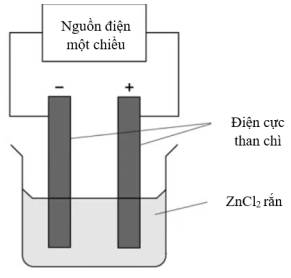
Lý do nào làm quá trình điện phân không xảy ra?
=> Chọn đáp án A Đáp án: A
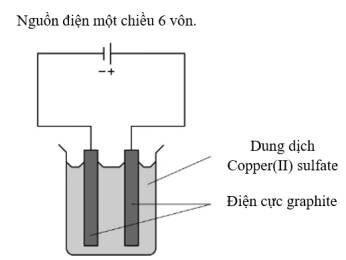
Những chất nào được tạo thành ở điện cực âm (cathode) và điện cực dương (anode)?
=> Chọn đáp án B Đáp án: B
⇒ Chọn đáp án A Đáp án: A
⭒ Al2O3 bền nhiệt hơn rất nhiều nên có thể tồn tại ở dạng nóng chảy
❌A sai: Nhiệt độ nóng chảy của AlCl3 thấp hơn Al2O3.
❌C sai: Điện phân AlCl3 nóng chảy vẫn tạo ra Cl2, nhưng đây không phải là lý do chính khiến người ta không sử dụng nó để điều chế Al.
❌D sai: Điện phân Al2O3 nóng chảy tạo ra Al có độ tinh khiết cao, nhưng đây không phải là yếu tố quyết định duy nhất. Tính chất thăng hoa của AlCl3 mới là lý do chính.
⟹ Chọn đáp án B Đáp án: B
⭐ Làm giảm nhiệt độ nóng chảy của hỗn hợp (từ 2072oC xuống khoảng 1000o)
⭐Làm tăng độ dẫn điện của hỗn hợp nóng chảy ➝ Làm tăng hiệu suất điện phân.
⭐ Tạo một lớp xỉ ngăn nhôm sinh ra không tiếp xúc với về mặt và không bị oxi hóa bởi O2 trong không khí. Đáp án: D
✔ B. Anode (cực dương) gắn với kim loại. Cu ➝ Cu2+ + 2e => Hiện tượng dương cực tan.
✔ C. Hai điện cực được ngâm trong dung dịch CuSO4.
✖ D. Nồng độ Cu2+ không đổi nhờ 2 quá trình xảy ra đồng thời tại anode và cathode. Đáp án: D
(-) Cathode: làm bằng tấm sắt có độ tinh khiết thấp. Tại đây ion Fe2+ bị điện phân bám lên tấm sắt tạo lớp sắt tinh khiết.
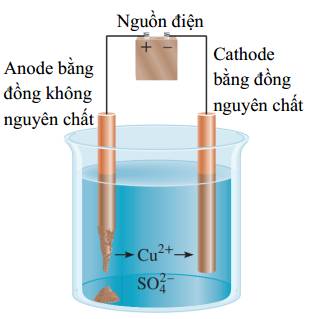
Giải thích cho hiện tượng này là
t= 3 (h) = 10 800 (s)
ne trao đổi của Ca = 2
Áp dụng định luật Faraday:
mCa = (MCa x I x t) / (F x ne trao đổi) = (40 x 1,12 x 10 800) / (96 500 x 2) = 2,51 (gam)
=> Đáp án A Đáp án: A
Tại anode (+): 2H2O ➝ O2 + 4H++ 4e => Số e trao đổi để tạo ra O2 là 4e.
Áp dụng định luật Faraday:
nO2 = (I x t) / (F x ne trao đổi) = (0,995 x t) / (96 500 x 4)
=> t ≈ 21595(s) ≈ 6 (h) Đáp án: A
I = 1,93A
Theo định luật Faraday, khối lượng Na thu được là:
mNa = (M x I x t) / (F x ne trao đổi)= (23 x 1,93 x 400) / (96 500 x 1) = 0,184 gam
Trong khi đó khối lượng Na thực tế thu được là 0,1472 gam
=> H% = (mthực tế / mlý thuyết) x 100%
= (0,1472/ 0,184) x 100% = 80%
=> Đáp án B Đáp án: B
Tính toán theo phương trình hóa học: nCl2= 1/71 => n NaCl = 2/71
=> mNaCl phản ứng= n x M = (2/71) x 58,5 = 1,648 (tấn)
=> H% = (mNaCl phản ứng / mNaCl cần dùng) x 100%
= (1,648 / 1,735) x 100% = 94,99%
=> Đáp án D Đáp án: D
I= 200 000 A
Phương trình xảy ra tại cathode(-):
Al3+ + 3e ➝ Al => số e trao đổi là 3
=> mAl = (MAl x I x t) / (F x n)
= (27 x 200 000 x 86 400) / (96 500 x 3)
= 1612 (kg) Đáp án: C
Khí O2 sinh ra đốt cháy điện cực anode làm bằng than chì thành CO và CO2.
Xét 24,79 lít khí X (đkc) : O2 x (mol)
CO y (mol)
CO2 z (mol)
(1) x + y + z = 1
(2) 32x + 28y + 44z = mX= MX . nx = 32,4
Khi cho X vào nước vôi trong dư, chỉ có CO2 bị hấp thụ
=> nCO2 = nkết tủa = nCaCO3 = 4/100 = 0,04 (mol)
Thay z = 0,04 vào 2 phương trình trên, suy ra: x= 0,94; y= 0,02 (mol).
Trong X: nO= 2nO2 + 2nCO2 + nCO = 1,98 (mol)
=> nAl = 2/3 nO = 1,32 (mol)
mAl = 1,32 x 27 = 35,64 (gam) là khối lượng Al sinh ra trong 1,32 giây.
=> Trong 24 giờ (86400 giây): mAl= 35,64 x (86 400/1,32) = 2 332 800 gam= 2332,8 kg
Sau t phút, ở cathode(-) chưa có bọt khí => chỉ có Cu2+ bị khử
=> Áp dụng định luật Faraday ta có:
t = (mCu x F x n) / (MCu x I) = (1,92 x 96500 x 2) / (64 x 1,93) = 3 000 (s) = 50 phút
Đáp án: AnCuSO4= 0,3. 0,1 = 0,03 (mol)
Dung dịch mất màu xanh chứng tỏ đã điện phân hết Cu2+ trong dung dịch => nCu= 0,03 (mol)
Áp dụng định luật Faraday ta có:
nCu = (I x t) / (F x ne trao đổi )
<=> 0,03 = (1,93 x t) / (96500 x 2)
Tính được t = 3 000 giây = 50 phút => Đáp án D
Đáp án: D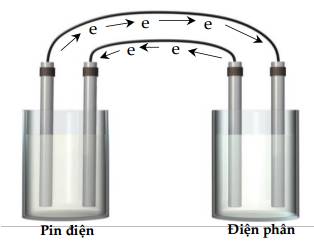
Dựa vào sơ đồ ta nhận thấy điện cực thứ nhất (từ trái sang phải) nhường electron ⇒ Anode.
Tương tự thế, ta có thứ tự điện cực: Anode, cathode, anode, cathode.
⇒ Chọn đáp án C Đáp án: C
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.
a. Nếu lead bromide ở trạng thái rắn (chưa nóng chảy) thì bóng đèn không sáng.
b. Các hạt chì màu bạc hình thành bên dưới cực âm.
c. Khí bromine màu nâu thoát ra ở anode.
d. Cực dương bằng than chì tan dần theo thời gian điện phân.
✔️a. Đúng. Lead bromide ở trạng thái rắn nên dòng điện chưa truyền qua được.
❌ b. Sai. Cực âm (cathode) xảy ra quá trình khử Pb2+ thành các hạt Pb bám lên trên điện cực.
✔️ c. Đúng. Tại anode(+) 2Br- ➝ Br2 + 2e => Có khí Br2 thoát ra.
❌ b. Sai. Cực dương bằng than chì giữ nguyên theo thời gian điện phân.
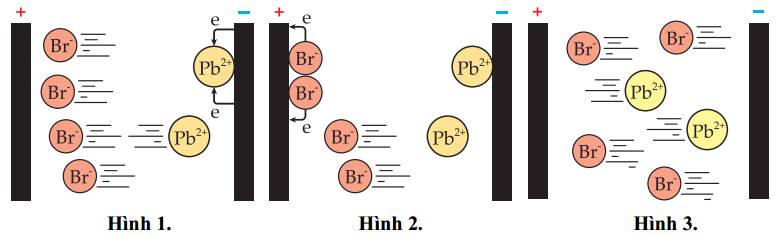
a. Ở hình 1, các ion ở trạng thái nóng chảy di chuyển về các điện cực.
b. Trong hình 2, cứ 1 ion Br− nhận 2 electron ở cực anode.
c. Trong hình 3, xuất hiện kim loại chì ở điện cực cathode.
d. Phản ứng xảy ra trong quá trình điện phân là phản ứng oxi hóa khử.
✔️ a. Đúng. Ở trạng thái nóng chảy, ion Br- di chuyển về điện cực anode(+) và ion Pb2+ di chuyển về điện cực cathode(-).
❌ b. Sai. Vì 2Br- ➝ Br2 + 2e => ion Br- nhường 2 electron.
✔️ c. Đúng. Tại cathode(-) xảy ra phản ứng: Pb2+ + 2e ➝ Pb.
✔️ d. Đúng. Phản ứng oxi hóa khử vì tại anode xảy ra quá trình oxi hóa, tại cathode xảy ra quá trình khử.
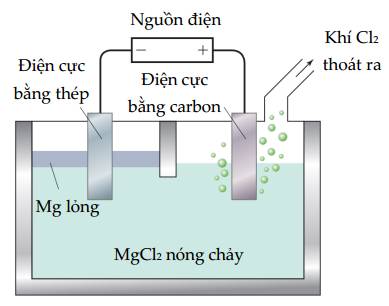
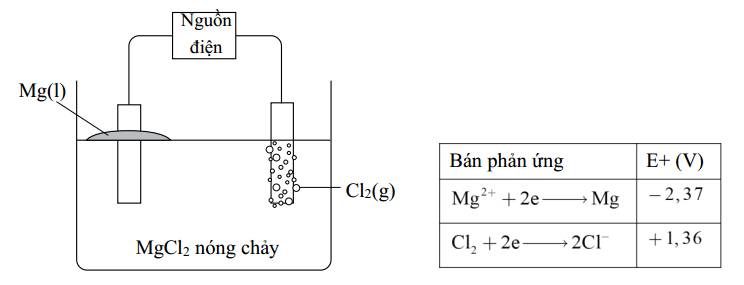
Cho
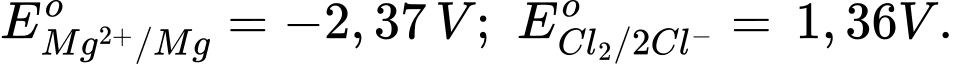
a. Khí chlorine bắt đầu thoát ra khi có điện áp tối thiểu đặt vào pin là
3,73 V.
b. Anode xảy ra quá trình oxi hóa ion Cl–.
c. Cathode thu được kim loại Mg nóng chảy.
d. Phản ứng xảy ra trong bình điện phân là phản ứng tự diễn biến.
✔️ a. Đúng. Điện áp tối thiểu đặt vào pin U=│Eo cathode - Eo anode│=│-2,37 - 1,36│= 3,73 (V)
✔️ b. Đúng. Tại anode(+): 2Cl- ➝ Cl2 + 2e
✔️ c. Đúng. Tại cathode(-): Mg2+ + 2e ➝ Mg
❌ d. Sai. Phản ứng trong bình điện phân không phải là phản ứng tự diễn biến mà cần có sự can thiệp của dòng điện.
a. Cathode xảy ra quá trình khử Al3+.
b. Ở anode xuất hiện khí CO và CO2.
c. Na3AlF6 được thêm vào sẽ nổi lên trên, bảo vệ nhôm nóng chảy khỏi bị oxi hóa bởi O2 không khí.
d. Trong quá trình điện phân, cực âm luôn phải được thay mới do điện cực làm bằng than chì.
✔️ a. Đúng. Tại cathode (-) xảy ra quá trình khử: Al3+ + 3e ➝ Al.
✔️ b. Đúng. Do điện cực anode làm bằng than chì, khí O2 sinh ra đốt cháy dần carbon thành CO và CO2
✔️ c. Đúng. Na3AlF6 tạo một lớp xỉ ngăn nhôm sinh ra không tiếp xúc với bề mặt và không bị oxi hóa trong không khí.
❌ d. Sai. Sau một thời gian điện phân thì điện cực anode than chì bị mòn- lúc này mới phải thay thế bằng điện cực mới.
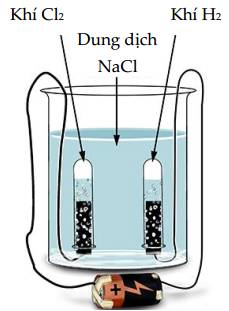
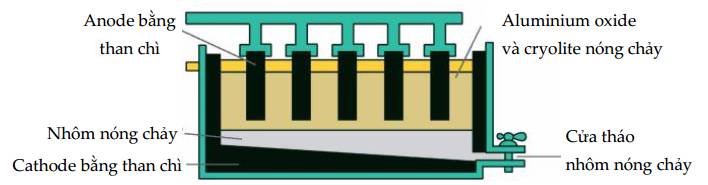
a. Ở cathode thu được khí H2.
b. Nếu không có màng ngăn, khí Cl2 sinh ra phản ứng với NaOH tạo thành nước Javel.
c. Theo thời gian, nồng độ ion Na+ giảm dần.
d. Phản ứng xảy ra trong bình điện phân là quá trình không tự diễn biến.
✔️ a. Đúng. Ở cathode (-): ion Na+ không bị điện phân, H2O bị điện phân (Phương trình phản ứng: 2H2O + 2e ➝ H2 + 2OH-)
✔️ b. Đúng. Không có màng ngăn, NaOH sinh ra ở cathode sẽ phản ứng với khí Cl2 sinh ra ở anode => sinh ra dung dịch (NaOCl, NaCl) gọi là nước Javel.
❌ c. Sai. Ion Na+ không bị điện phân nên nồng độ không đổi.
✔️ d. Đúng. Phản ứng trong điện phân là quá trình không tự diễn biến mà cần có sự can thiệp của dòng điện.
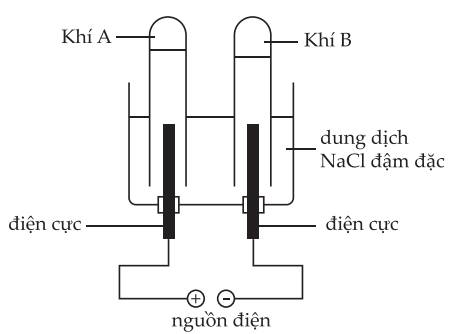
a. Hai khí A và B đều nhẹ hơn không khí.
b. Cả 2 điện cực có thể được làm bằng carbon.
c. Xảy ra quá trình điện phân nước ở cả hai điện cực.
d. Ống nghiệm thu khí A không màu; còn ống nghiệm thu khí B có màu vàng nhạt.
❌ a. Sai. Quá trình điện phân NaCl tạo ra 2 khí là H2 và Cl2. Trong đó, H2 nhẹ hơn không khí và Cl2 nặng hơn không khí
✔️ b. Đúng. Điện cực carbon có đặc tính trơ và ổn định => có thể dùng để điện phân dung dịch NaCl.
❌ c. Sai. Lúc bắt đầu điện phân, ở anode điện phân ion Cl-, cathode điện phân H2O. Đến khi ion Cl- hết thì cả 2 điện cực mới xảy ra điện phân H2O.
❌ d. Sai. Điện cực dương (anode) sinh ra khí Cl2 (khí A màu vàng nhạt); Điện cực âm (cathode) sinh ra khí H2 (khí B không màu).
a. Có khí thoát ra ở cả hai điện cực.
b. Phía bên cực anode dung dịch có màu hồng; còn phía bên cực cathodedung dịch không đổi màu.
c. Sau khi ngừng điện phân, dung dịch của hai nửa pin được trộn lẫn thìmàu hồng của dung dịch trở nên đậm hơn.
d. Phương trình điện phân là 2H2O ⟶ 2H2 + O2 cho thấy Na2SO4không có đóng góp gì trong quá trình điện phân.
✔️ a. Đúng. Ion Na+ và ion SO42- không bị điện phân nên H2O ở 2 điện cực bị điện phân sinh ra khí ở cả 2 điện cực.
❌ b. Sai. Tại anode(+): 2H2O ➝ O2 + 4H+ + 4e. Tại cathode(-): 2H2O + 2e ➝ H2 + 2OH- => Cathode (tạo ion OH-) làm đổi màu dung dịch phenolphtalein.
❌ c. Sai. Trộn dung dịch 2 nửa pin thì mất màu hồng vì ion H+ trung hòa hết lượng ion OH-.
❌ d. Sai. Na2SO4 phân li ra các ion dẫn điện => làm giảm điện trở của bình điện phân ⇒ tăng hiệu suất quá trình điện phân.
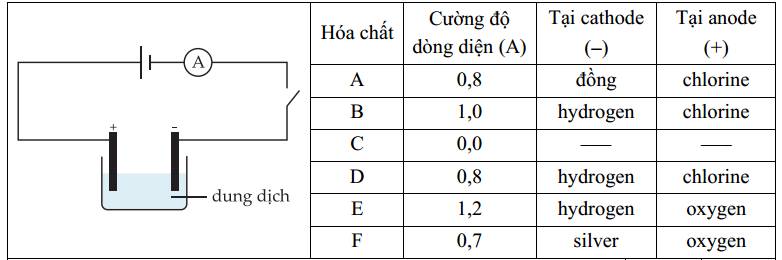
✔️a. Đúng. Tại cathode thu được kim loại Cu, anode thu được khí chlorine => hóa chất A có thể là CuCl2.
Cathode ( - ) : Cu2+ + 2e ⟶ Cu
Anode ( + ) : 2Cl- ⟶ Cl2 + 2e
✔️ b. Đúng. Vì cường độ dòng điện bằng 0 nên chất C không dẫn diện, không có khả năng phân li thành ion trong dung dịch => Saccharose là đúng.
❌ c. Sai. Tại anode (+) thu được khí oxygen (nước bị điện phân) nên anion trong dung dịch không bị điện phân. Tuy nhiên có nhiều loại anion không bị điện phân như SO42-, NO3-, ClO4-,... => Dung dịch E và F có thể chứa khác loại anion.
Anode (+) 2H2O ⟶ 4H+ + O2 + 4e
❌d. Sai. Điện phân dung dịch B, D, E tại cathode có thể là điện phân nước và H+ để tạo H2
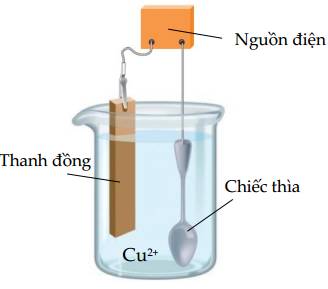
a. Chiếc thìa được lắp vào anode.
b. Miếng đồng được lắp vào cathode.
c. Sau khi điện phân, thấy hiện tượng dương cực tan.
d. Nồng độ ion Cu2+ trong dung dịch không đổi.
❌ a. Sai. Vật cần mạ (chiếc thìa) được gắn vào cực âm nguồn điện (cathode).
❌ b. Sai. Anode (cực dương) gắn với miếng kim loại đồng dùng để mạ.
✔️ c. Đúng. Điện cực Cu (anode) bị tan ra do Cu chuyển thành ion Cu2+ hay còn gọi là hiện tượng dương cực tan.
✔️ d. Đúng. Nồng độ ion Cu2+ trong dung dịch không đổi.
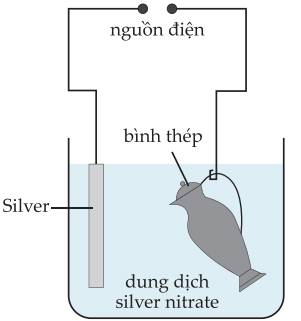
Mạ điện là một công nghệ điện phân. Quá trình tổng quát là:
– Trên anode xảy ra quá trình hòa tan kim loại:
M – ne ⟶ Mn+
– Trên cathode xảy ra quá trình cation phóng điện trở thành kim loại mạ:
Mn+ + ne → M
Phân tích các phát biểu:
✔️a) Đúng. Trong quá trình mạ điện, vật cần mạ (bình thép) được gắn với cực âm cathode, kim loại mạ (silver) gắn với cực dương anode của nguồn điện trong dung dịch điện phân.
❌b) Sai. Trên anode xảy ra quá trình hòa tan kim loại: Ag(s) – e ⟶ Ag+(aq)
✔️c) Đúng. Trên anode xảy ra quá trình hòa tan kim loại
❌d) Sai. Ion Ag+ di chuyển về cathode (cực âm), bị khử thành kim loại Ag và phủ lên bề mặt của bình thép.

a. Đồng có độ tinh khiết thấp được lắp vào cực dương.
b. Theo thời gian, khối lượng đồng ở anode giảm dần.
c. Cathode thu được đồng có độ tinh khiết cao không lẫn tạp chất.
d. Các tạp chất không bị oxi hóa sẽ rơi xuống đáy bình tạo thành bùndương cực.
✔️a. Đúng. Cực dương (anode) làm bằng tấm đồng có độ tinh khiết thấp. Tại đây xảy ra quá trình oxi hóa Cu tạo thành ion Cu2+ tan vào trong dung dịch.
✔️ b. Đúng. Cu bị oxi hóa tại anode nên khối lượng giảm dần: Cu ➝ Cu2+ + 2e
✔️ c. Đúng. Tại cực âm (cathode) ion Cu2+ bị điện phân, Cu bám lên điện cực tạo lớp đồng tinh khiết đến 99,95%.
✔️ d. Đúng. Các tạp chất không bị oxi hóa sẽ rơi xuống đáy bình tạo thành bùn dương cực.
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
MgCl2(l)
 Mg(l) + Cl2(g)
Mg(l) + Cl2(g)Nếu sử dụng cường độ dòng điện 500 A thì cần bao nhiêu giờ để chuyển toàn bộ 1000 kg MgCl2 thành Mg kim loại?
Điền đáp án: ..........
nMg = nMgCl2 = 10526,3 (mol)
Quá trình khử: Mg2+ + 2e ➝ Mg => Số e trao đổi bằng 2e.
Áp dụng định luật Faraday:
Tính ra t= 4 063 151 giây= 1129 giờ
=> Điền đáp án: 1129
Điền đáp án: ..........
Đổi t= 8h = 28 800s ; I= 25mA = 0,025A
➝ nH2= (I.t) / (F.ne trao đổi) = (0,025. 28800) / (96500. 2) = 3,73. 10-3 mol
➝ nOH- = 2.nH2= 7,46. 10-3
Dung dịch trở thành màu hồng khi ion H+ trong dung dịch bị trung hòa hết
=> nH+ = nOH- = 7,46. 10-3
➝ CM= n/ V= 7,46. 10-3/ 0,01 ≈ 0,75 M
=> Điền đáp án: 0,75
Điền đáp án: ..........
Đổi: I = 20 kA = 20 000A
Vì tạo thành monobromo phenol nên tỉ lệ phản ứng là 1 Br2 : 1 phenol
➝ nBr2 thoát ra= nphenol =
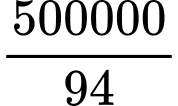 = 5319,15 (mol)
= 5319,15 (mol)Áp dụng định luật Faraday:
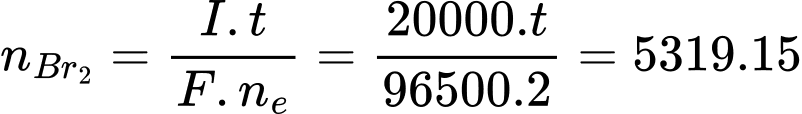
=> t= 51330 giây = 855,496 phút
=> Điền đáp án: 855
Điền đáp án: .........
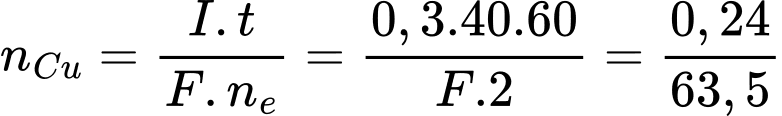
=> F= 95250 (C/mol) = 9,53. 104=> a= 9,53
=> Điền đáp án: 9,53
(làm tròn đến số nguyên)
Điền đáp án: ..........
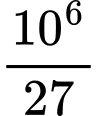
Phương trình phản ứng: 2Al2O3 ➝ 4Al + 3O2 => nO2 =
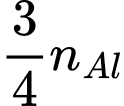 =
= 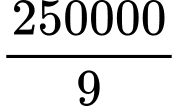
Điện cực than chì phản ứng với O2 theo 2 phương trình:
=> Số mol O2 phản ứng= 0,5x + x = 1,5x = 250000/9
=> x= 500000/27
=> nC phản ứng = 2.x= 1000000/27 => mC= 0,44 tấn
=> Điền đáp án: 0,44
(làm tròn đến số nguyên)
Điền đáp án: ..........
nMg= 10/24 = nMgCl2
=> mMgCl2 = 10/24.95= 39,583 tấn
=> Chi phí cần thiết là 39,583 . 155 = 6135 USD
=> Điền đáp án: 6135
(làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
Theo định luật Faraday, tại bình chứa dung dịch AgNO3:
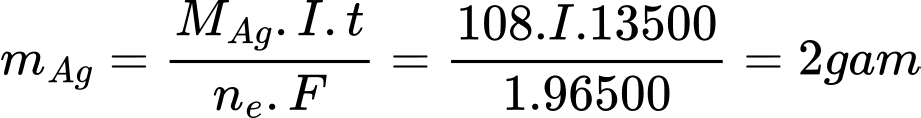
=> I = 0,132 A
=> Khối lượng đồng trong bình điện phân 2 là:
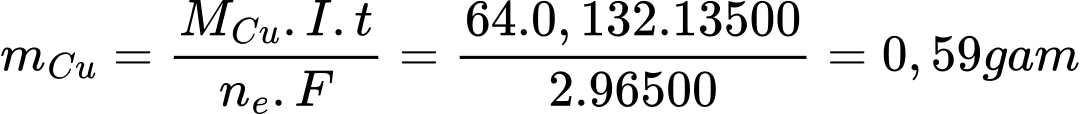
=> Điền đáp án: 0,59
(làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
Áp dụng định luật Faraday, khối lượng khí chlorine lý thuyết thu được là:
![]()
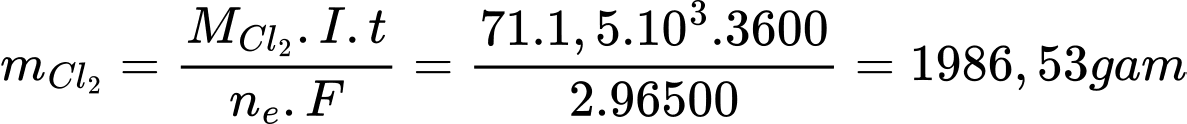
Biết Hpứ = 93% => Khí Cl2 thực tế thu được là 1986,53 . 93% = 1847,5 gam = 1,85 kg
=> Điền đáp án: 1,85
Cr2O72−(aq) + 12e + 14H+(aq)
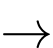 2Cr(s) + 7H2O(l)
2Cr(s) + 7H2O(l)Để mạ được lớp chromium dày 1,0×10−2 mm cho thanh cản ô tô có diện tích bề mặt 0,25 m2 trong một bình điện phân có cường độ dòng điện 25,0 A thì cần bao nhiêu thời gian (tính bằng giờ) biết khối lượng riêng của chromium là 7,19 g/cm3
(làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
V lớp mạ Cr = 10-3.2500 = 2,5 cm3
=> Khối lượng Cr:
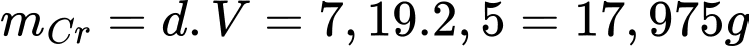
Từ phương trình phản ứng ta xác định được ne trao đổi = 6e
Áp dụng định luật Faraday:
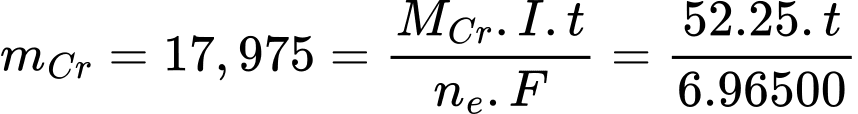
=> t= 8006 giây = 2,22 giờ
=> Điền đáp án: 2,22
(làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
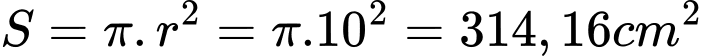
=> Thể tích lớp Ag cần mạ là V= 314,16. 0,01 . 10-1 = 0,314 cm-3
Khối lượng Ag: 10,5. 0,314 =
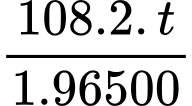
=> t= 1473 giây = 0,41 giờ
=> Điền đáp án: 0,41
(làm tròn đến số nguyên)
Điền đáp án: ..........
=> Diện tích toàn phần của miếng đồng = (5+ 1).2.0,1 + 2.5.1 = 11,2 cm2
Vì tất cả các mặt đều được mạ bằng bạc đến độ dày 1 micrometer (10-4 cm) => Thể tích lớp Ag: V= 11,2.10-4= 1,12.10-3 cm3
=> Khối lượng Ag cần mạ là m = D.V= 10,5. 1,12.10-3 =0,01176 gam
Áp dụng định luật Faraday:
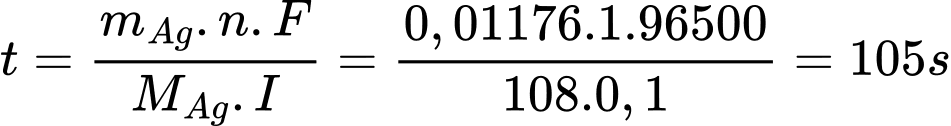
=> Điền đáp án: 105
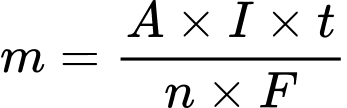
Trong đó m : Khối lượng chất thu được ở điện cực, tính bằng gam.
A : Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
1 : Cường độ dòng điện, tính bằng ampe (A).
t : Thời gian điện phân, tính bằng giây (s).
F : Hằng số Faraday (F = 96500 culông/mol).
(làm tròn đến hai đơn vị)
Điền đáp án: ..........
Với hiệu suất điện phân là 90% thì khối lượng aluminium thực thế cần điện phân ra là 120.100/90 = 133.33 gam
Từ định luật Faraday, ta có:
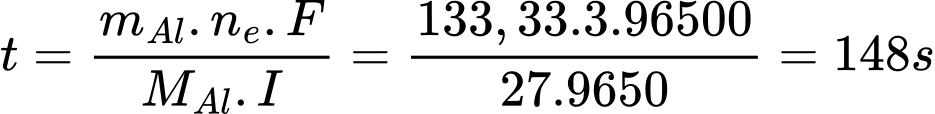
=> Điền đáp án: 148
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó

⇒ Chọn đáp án B Đáp án: B
Anode (quá trình oxi hóa): 2F- ⟶ F2 + 2e
Cathode (quá trình khử): 2HF ⟶ H2 + F2
→ Phản ứng: 2HF ⟶ H2 + F2
Fluorine được điều chế bằng cách điện phân hydrogen fluoride (HF) lỏng có chứa potassium fluoride (KF) để tăng độ dẫn điện.
→ D sai vì ở cathode xảy ra quá trình khử.
⇒ Chọn đáp án D
Đáp án: D
n = (500 x 1,7 x 5) / (19 x2 x 100) = 1,1179 (mol)
Quá trình điều chế F2:
CaF2(s) + H2SO4(l) → 2HF(g) + CaSO4(s)
2HF(l) → F2(g) + H2(g)
→ nF2 = nCaF2 = 1,1179 (mol)
→ mCaF2 = 1,1179 x 78 = 87,2 g
⇒ Chọn đáp án A Đáp án: A
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 65 đến 67


(a) Cathode thu được khí H2 và dung dịch NaOH.
(b) Anode thu được khí Cl2.
(c) Màng ngăn cho phép ion Cl– di chuyển qua.
(d) Theo thời gian, nồng độ ion Na+ giảm dần.
(e) Điện phân không có màng ngăn thì ở anode thu được khí Cl2.
Số phát biểu đúng là
(c) sai vì màng ngăn không cho phép ion Cl− di chuyển qua, nhằm giữ Cl− ở phía anode để tạo khí Cl2 .
(d) sai vì ion Na+ không bị khử và cũng không rời khỏi dung dịch. Thay vào đó, nó kết hợp với ion OH− để tạo dung dịch NaOH. Nồng độ ion Na+ không giảm mà có thể tăng lên. Đáp án: C
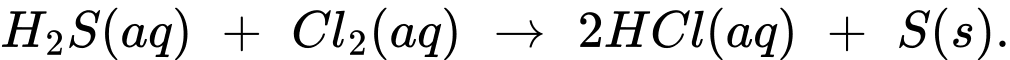
Nếu hàm lượng hydrogen sulfide trong nước bị ô nhiễm là 22 ppm theo khối lượng. Tính lượng Cl2 (theo đơn vị gam) cần thiết để loại bỏ tất cả lượng hydrogen sulfide ra khỏi 757,00 lít nước.
Khối lượng nước là: 757,0 x 1000 = 757 000 (g)
Khối lượng H2S trong nước là: (22/106) . 757 000 = 16,654 (g)
→ nH2S = 16,654 / 34 = 0,4898 (mol)
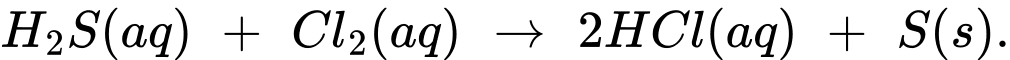
nCl2 = nH2S = 0,4898 (mol)
→ mCl2 = 0,4898 x 71 = 34,78 (g) Đáp án: A
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 68 đến 70
=> Chọn đáp án B Đáp án: B
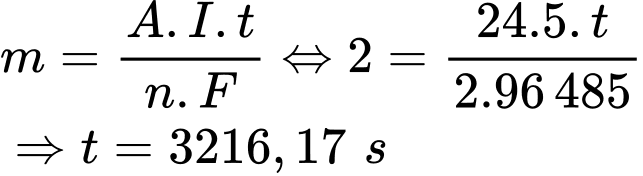 Đáp án: D
Đáp án: D