Dạng 1: TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.
Câu 1 [58946]: Quá trình oxi hóa khử, các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường là sự
A, ăn mòn.
B, ăn mòn hóa học.
C, ăn mòn điện hóa.
D, ăn mòn kim loại.
Ăn mòn hóa học là quá trình oxi hóa khử, các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường, không có xuất hiện dòng điện.
Ăn món điện hóa là quá trình oxi hóa khử, các electron của kim loại được chuyển trong dung dịch chất điện ly .
⇒ Chọn đáp án B Đáp án: B
Ăn món điện hóa là quá trình oxi hóa khử, các electron của kim loại được chuyển trong dung dịch chất điện ly .
⇒ Chọn đáp án B Đáp án: B
Câu 2 [59008]: Phản ứng hóa học xảy ra trong quá trình ăn mòn kim loại thuộc loại
A, phản ứng thủy phân.
B, phản ứng trao đổi.
C, phản ứng oxi hóa-khử.
D, phản ứng phân hủy.
HD:
Phản ứng hóa học xảy ra trong quá trình ăn mòn kim loại thuộc phản ứng oxi hóa-khử vì luôn xảy ra quá trình oxi hóa kim loại.
⇒ Chọn đáp án C
Đáp án: C
Phản ứng hóa học xảy ra trong quá trình ăn mòn kim loại thuộc phản ứng oxi hóa-khử vì luôn xảy ra quá trình oxi hóa kim loại.
⇒ Chọn đáp án C
Đáp án: C
Câu 3 [59025]: Loại phản ứng hoá học nào sau đây xảy ra trong qúa trình ăn mòn kim loại?
A, Oxi hoá - khử.
B, Hoá hợp.
C, Thế.
D, Phân huỷ.
Ăn mòn kim loại thì chắc chắn xảy ra phản ứng oxi hóa khử
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 4 [560775]: Để lợp mái nhà, các tấm tôn (là tấm thép mỏng thường được mạ kẽm) được gắn vào nhau nhờ các đinh vít bằng thép. Vị trí nào trên mái tôn dễ xảy ra hiện tượng ăn mòn điện hoá?
A, Tại vị trí tiếp nối giữa đinh vít và tấm tôn.
B, Tại mặt trên của tấm tôn.
C, Tại mặt dưới của tấm tôn.
D, Như nhau ở các vị trí.
Tại vị trí tiếp nối giữa đinh vít và tấm tôn vì tại vị trí đó có 2 kim loại (Zn và Fe) khác nhau được tiếp xúc trực tiếp với nhau và cùng tiếp xúc với không khí (dung dịch chất điện li).
=> Dễ xảy ra ăn mòn điện hóa hơn.
Đáp án: A => Dễ xảy ra ăn mòn điện hóa hơn.
Câu 5 [237933]: Cho lá Al vào dung dịch HCl, có khí thoát ra. Thêm vài giọt dung dịch CuSO4 vào thì
A, phản ứng ngừng lại.
B, tốc độ thoát khí không đổi.
C, tốc độ thoát khí giảm.
D, tốc độ thoát khí tăng.
ban đầu Al tiếp xúc trực tiệp với ion H+ , Al bị ăn mòn hóa học theo pt: Al + 3H+ → Al3+ + 1,5H2
H2 sinh ra bám vào bề mặt Al, ngăn cản quá trình tiếp xúc giữa Fe và H+ giảm tốc độ phản ứng
Khi nhỏ thêm dung dịch CuSO4 xảy ra phản ứng : 2Al+ 3Cu2+→ 2Al3+ + 3Cu
Khi đó Cu bám vào Al, hình thành pin điện hóa Al-Cu.
Cực âm (Al) : Al → Al3+ + 3e
Cực dương (Cu): H+ + 2e → H2
Khí H2 thoát ra ở cực Cu, nên Al bị ăn mòn nhanh hơn,=. Tốc độ thoát khí tăng.
⇒ Chọn đáp án D Đáp án: D
H2 sinh ra bám vào bề mặt Al, ngăn cản quá trình tiếp xúc giữa Fe và H+ giảm tốc độ phản ứng
Khi nhỏ thêm dung dịch CuSO4 xảy ra phản ứng : 2Al+ 3Cu2+→ 2Al3+ + 3Cu
Khi đó Cu bám vào Al, hình thành pin điện hóa Al-Cu.
Cực âm (Al) : Al → Al3+ + 3e
Cực dương (Cu): H+ + 2e → H2
Khí H2 thoát ra ở cực Cu, nên Al bị ăn mòn nhanh hơn,=. Tốc độ thoát khí tăng.
⇒ Chọn đáp án D Đáp án: D
Câu 6 [36076]: Một vật làm bằng sắt tráng thiếc (sắt tây), trên bề mặt vết sây sát tới lớp sắt. Khi vật này tiếp xúc với không khí ẩm thì
A, Fe bị oxi hóa.
B, Sn bị oxi hóa.
C, Fe bị khử.
D, Sn bị khử.
HD:
Vết sây sát tới lớp sắt ⇒ cả 2 kim loại đều tiếp xúc với không khí ẩm ⇒ xuất hiện ăn mòn điện hóa ⇒ Fe mạnh hơn, Fe bị oxi hóa.
⇒ Chọn đáp án A
Đáp án: A
Vết sây sát tới lớp sắt ⇒ cả 2 kim loại đều tiếp xúc với không khí ẩm ⇒ xuất hiện ăn mòn điện hóa ⇒ Fe mạnh hơn, Fe bị oxi hóa.
⇒ Chọn đáp án A
Đáp án: A
Câu 7 [59034]: Một dây phơi quần áo gồm một đoạn dây đồng nối với một đoạn dây thép. Hiện tượng nào sau đây xảy ra ở chỗ nối hai đoạn dây khi để lâu ngày?
A, Đồng bị ăn mòn.
B, Đồng và sắt đều không bị ăn mòn.
C, Sắt bị ăn mòn.
D, Đồng và sắt đều bị ăn mòn.
Trong ăn mòn điện hóa kim loại nào có tính khử mạnh hơn sẽ bị ăn mòn trước
Tính khử của Fe mạnh hơn đồng → sắt bị ăn mòn.
⇒ Chọn đáp án C
Đáp án: C
Tính khử của Fe mạnh hơn đồng → sắt bị ăn mòn.
⇒ Chọn đáp án C
Đáp án: C
Câu 8 [58974]: Trường hợp nào sau đây thép (Fe – C) bị ăn mòn nhanh nhất?
A, Ngâm trong nước cất.
B, Để ngoài không khí ẩm.
C, Để ngoài không khí khô.
D, Ngâm trong nước biển.
HD:
Thép để ngoài không khí ẩm hay ngâm trong nước biển đều xảy ra ăn mòn điện hóa, tuy nhiên tốc độ ăn mòn khi ngâm trong nước biển chắc chắn nhanh hơn việc để ngoài không khí ẩm do nước biển chứa nhiều ion muối (Na+, Cl–, SO42–,...) giúp tăng tốc độ phản ứng điện hóa giữa sắt và oxygen.
⇒ Chọn đáp án D
Đáp án: D
⇒ Chọn đáp án D
Đáp án: D
Câu 9 [58983]: Ngâm một đinh sắt trong dung dịch HCl, tốc độ khí thoát ra chậm. Để tốc độ khí thoát ra nhanh hơn, cần thêm tiếp vào dung dịch một vài giọt dung dịch nào sau đây?
A, NaCl.
B, FeCl3.
C, H2SO4.
D, Cu(NO3)2.
Thoát khí nhanh hơn ⇒ ăn mòn điện hóa ⇒ phải thêm muối của kim loại yếu hơn
⇒ Chọn đáp án D
Đáp án: D
⇒ Chọn đáp án D
Đáp án: D
Câu 10 [14998]: Trong phòng thí nghiệm, khí H2 được điều chế bằng phản ứng giữa Zn và dung dịch H2SO4 loãng. Khí H2 sẽ thoát ra nhanh hơn khi thêm vào hệ phản ứng vài giọt dung dịch nào sau đây?
A, MgSO4.
B, CuSO4.
C, Al2(SO4)3.
D, Na2SO4.
![596472[LG].png](https://asset.moon.vn/img/ai/Teachers/rongden_167/ProS2018/TAPIII/596472[LG].png)
Đáp án: B
Câu 11 [58997]: Nhúng một thanh Zn vào dung dịch gồm muối T và H2SO4 loãng thì có xảy ra sự ăn mòn điện hóa của Zn.
Muối nào sau đây phù hợp với T?

Muối nào sau đây phù hợp với T?
A, CuSO4.
B, Na2SO4.
C, Al2(SO4)3.
D, MgSO4.
HD:
Nếu nhúng Zn vào các muối Na2SO4, Al2(SO4)3, MgSO4 thì không có kim loại mới được tạo thành ⇒ không có 2 điện cực ⇒ không xảy ra ăn mòn điện hóa.
Khi nhúng thanh Zn vào dung dịch CuSO4 thì:
Zn + CuSO4 → ZnSO4 + Cu.
Đồng sinh ra bám vào thanh kẽm ⇒ có 2 điện cực nhúng trong dung dịch H2SO4 ⇒ ăn mòn điện hóa, Zn bị ăn mòn trước.
Đáp án: A
Nếu nhúng Zn vào các muối Na2SO4, Al2(SO4)3, MgSO4 thì không có kim loại mới được tạo thành ⇒ không có 2 điện cực ⇒ không xảy ra ăn mòn điện hóa.
Khi nhúng thanh Zn vào dung dịch CuSO4 thì:
Zn + CuSO4 → ZnSO4 + Cu.
Đồng sinh ra bám vào thanh kẽm ⇒ có 2 điện cực nhúng trong dung dịch H2SO4 ⇒ ăn mòn điện hóa, Zn bị ăn mòn trước.
Đáp án: A
Câu 12 [59004]: Đặt một đinh sắt vào đĩa thủy tinh:

Cần rót dung dịch nào sau đây vào đĩa thủy tinh để xảy ra sự ăn mòn điện hóa học của đinh sắt?

Cần rót dung dịch nào sau đây vào đĩa thủy tinh để xảy ra sự ăn mòn điện hóa học của đinh sắt?
A, CuSO4 và H2SO4 loãng.
B, Fe(NO3)3.
C, HNO3 loãng.
D, HCl và H2SO4 loãng.
HD: Phản ứng: Fe + CuSO4 → FeSO4 + Cu.
Cu sinh ra bám vào đinh sắt, tạo pin điện Fe-Cu trong dung dịch
⇝ xảy ra ăn mòn điện hóa của sắt. ❒ Đáp án: A
Cu sinh ra bám vào đinh sắt, tạo pin điện Fe-Cu trong dung dịch
⇝ xảy ra ăn mòn điện hóa của sắt. ❒ Đáp án: A
Câu 13 [39716]: Nối một đinh sắt với một tấm kim loại X bằng một sợi dây sắt rồi đặt vào đĩa thủy tinh:
Khi rót dung dịch H2SO4 loãng vào đĩa thủy tinh thì xảy ra sự ăn mòn điện hóa của đinh sắt. Kim loại thỏa mãn tính chất của X là

Khi rót dung dịch H2SO4 loãng vào đĩa thủy tinh thì xảy ra sự ăn mòn điện hóa của đinh sắt. Kim loại thỏa mãn tính chất của X là
A, Zn.
B, Mg.
C, Al.
D, Cu.
HD: Điều kiện xảy ra sự ăn mòn điện hóa:
![596474[LG].png](https://asset.moon.vn/img/ai/Teachers/rongden_167/ProS2018/TAPIII/596474[LG].png)
► Chú ý: trong quá trình xảy ra ăn mòn điện hóa, kim loại mạnh hơn bị ăn mòn.
⇒ để đinh sắt (Fe) bị ăn mòn thì kim loại X phải yếu hơn Fe.
⇒ trong 4 đáp án, thỏa mãn yêu cầu là đáp án D. Cu. ♠. Đáp án: D
![596474[LG].png](https://asset.moon.vn/img/ai/Teachers/rongden_167/ProS2018/TAPIII/596474[LG].png)
► Chú ý: trong quá trình xảy ra ăn mòn điện hóa, kim loại mạnh hơn bị ăn mòn.
⇒ để đinh sắt (Fe) bị ăn mòn thì kim loại X phải yếu hơn Fe.
⇒ trong 4 đáp án, thỏa mãn yêu cầu là đáp án D. Cu. ♠. Đáp án: D
Câu 14 [59009]: Có những cặp kim loại sau đây tiếp xúc với nhau, khi xảy ra sự ăn mòn điện hóa thì trong cặp nào sắt không bị ăn mòn
A, Fe-Sn.
B, Fe-Zn.
C, Fe-Cu.
D, Fe-Pb.
HD:
Trong ăn mòn điện hóa, kim loại mạnh hơn sẽ bị ăn mòn trước.
⇒ Khi xảy ra ăn mòn điện hóa thì trong cặp Fe-Zn, Fe sẽ không bị ăn mòn.
⇒ Chọn đáp án B
Đáp án: B
Trong ăn mòn điện hóa, kim loại mạnh hơn sẽ bị ăn mòn trước.
⇒ Khi xảy ra ăn mòn điện hóa thì trong cặp Fe-Zn, Fe sẽ không bị ăn mòn.
⇒ Chọn đáp án B
Đáp án: B
Câu 15 [58980]: Sợi dây đồng được dùng để làm dây phơi quần áo, để ngoài không khí ẩm lâu ngày bị đứt. Để nối lại mối đứt đó, ta nên dùng kim loại nào để dây được bền nhất?
A, Al.
B, Cu.
C, Fe.
D, Mg.
HD: ☆ Khi sử dụng kim loại Cu nối vào thì lúc này dây Cu chỉ bị ăn mòn hóa học (quá trình ăn mòn xảy ra chậm) nên dây sẽ bền hơn. Nếu sử dụng kim loại khác như Zn, Mg, Fe thì sẽ tạo thành một cặp điện cực, lâu ngày trong không khí ẩm sẽ xảy ra quá trình ăn mòn điện hóa (quá trình xảy ra nhanh hơn) ⇝ điểm nối nhanh hỏng. ❒
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 16 [58996]: Trong không khí ẩm, các công trình xây dựng và vật dụng bằng thép bị ăn mòn tạo thành lớp gỉ sắt. Thành phần chủ yếu của gỉ sắt là
A, Fe(OH)2.
B, Fe2O3.nH2O.
C, FeS2.
D, FeCO3.
Fe2+ tiếp tục bị oxi hóa bởi oxygen trong không khí tạo gỉ sắt Fe2O3.nH2O
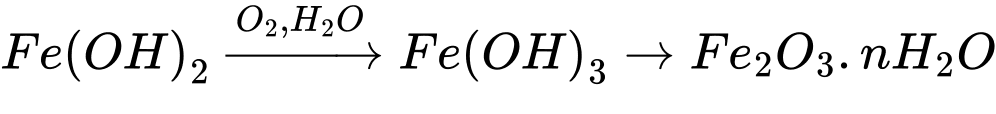
Thành phần chủ yếu của gỉ sắt là Fe2O3.nH2O.
⇒ Chọn đáp án B
Đáp án: B
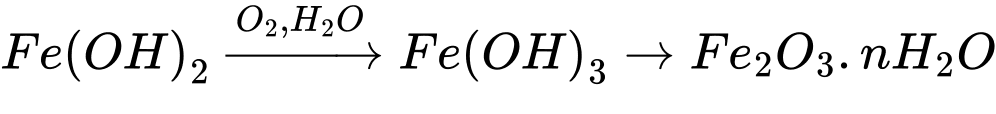
Thành phần chủ yếu của gỉ sắt là Fe2O3.nH2O.
⇒ Chọn đáp án B
Đáp án: B
Câu 17 [560776]: Xét thí nghiệm sau:
Giai đoạn 1: Cho mẩu kẽm vào ống nghiệm số 1 chứa dung dịch sulfuric acid loãng.
Giai đoạn 2: Tiếp tục cho vài giọt dung dịch copper(II) sulfate vào ống nghiệm số 1 bên trên thì các bọt khí được tạo thành nhanh hơn.
Nhận định nào sau đây không đúng?
Giai đoạn 1: Cho mẩu kẽm vào ống nghiệm số 1 chứa dung dịch sulfuric acid loãng.
Giai đoạn 2: Tiếp tục cho vài giọt dung dịch copper(II) sulfate vào ống nghiệm số 1 bên trên thì các bọt khí được tạo thành nhanh hơn.
Nhận định nào sau đây không đúng?
A, Giai đoạn 1 chỉ xảy ra ăn mòn hóa học.
B, Giai đoạn 2 chỉ xảy ra ăn mòn điện hóa học.
C, Giai đoạn 2 xảy ra cả ăn mòn hóa học và ăn mòn điện hóa học.
D, Khi xảy ra ăn mòn điện hóa học thì tốc độ thoát khí sẽ nhanh hơn.
Giai đoạn 1:
Zn(s) + H2SO4(aq) ⟶ ZnSO4(aq) + H2(g)
Giai đoạn 2:
CuSO4(aq) + Zn(s) ⟶ ZnSO4(aq) + Cu(s)
Đồng sinh ra bám trên bề mặt mẩu kẽm tạo thành pin điện hóa Zn - Cu với Zn là điện cực âm (anode), Cu là điện cực dương (cathode).
Trong đó:
- Tại anode: Zn(s) ⟶ Zn2+(aq) + 2e
- Tại cathode: 2H+(aq) + 2e ⟶ H2(g)
Phân tích các phát biểu:
✔️ A. Đúng. Chỉ có phản ứng hóa học giữa kẽm và acid.
❌ B. Sai. Giai đoạn 2 xảy ra cả ăn mòn hóa học (kẽm phản ứng với H2SO4) và ăn mòn điện hóa học (hình thành cặp Zn - Cu).
✔️ C. Đúng. Hai quá trình này xảy ra đồng thời khi thêm CuSO4.
✔️ D. Đúng. Sự ăn mòn điện hóa học làm tăng tốc độ oxi hóa kẽm và khử ion H+, nên tốc độ thoát khí H2 tăng. Đáp án: B
Zn(s) + H2SO4(aq) ⟶ ZnSO4(aq) + H2(g)
Giai đoạn 2:
CuSO4(aq) + Zn(s) ⟶ ZnSO4(aq) + Cu(s)
Đồng sinh ra bám trên bề mặt mẩu kẽm tạo thành pin điện hóa Zn - Cu với Zn là điện cực âm (anode), Cu là điện cực dương (cathode).
Trong đó:
- Tại anode: Zn(s) ⟶ Zn2+(aq) + 2e
- Tại cathode: 2H+(aq) + 2e ⟶ H2(g)
Phân tích các phát biểu:
✔️ A. Đúng. Chỉ có phản ứng hóa học giữa kẽm và acid.
❌ B. Sai. Giai đoạn 2 xảy ra cả ăn mòn hóa học (kẽm phản ứng với H2SO4) và ăn mòn điện hóa học (hình thành cặp Zn - Cu).
✔️ C. Đúng. Hai quá trình này xảy ra đồng thời khi thêm CuSO4.
✔️ D. Đúng. Sự ăn mòn điện hóa học làm tăng tốc độ oxi hóa kẽm và khử ion H+, nên tốc độ thoát khí H2 tăng. Đáp án: B
Câu 18 [58977]: Ở thí nghiệm nào sau đây Fe chỉ bị ăn mòn hoá học?
A, Cho đinh Fe vào dung dịch AgNO3.
B, Đốt cháy dây sắt trong không khí khô.
C, Để mẫu gang lâu ngày trong không khí ẩm.
D, Cho hợp kim Fe-Cu vào dung dịch HCl.
❌A.Cho đinh Fe vào dung dịch AgNO3: Đây là ăn mòn điện hóa. Fe đóng vai trò là cực âm, Ag+ trong dung dịch đóng vai trò là cực dương theo PT:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
✔️B. Đốt cháy dây sắt trong không khí khô: Đây là ăn mòn hóa học. Sắt tác dụng trực tiếp với oxi trong không khí ở nhiệt độ cao theo PT:
3Fe + 2O2 → Fe3O4
❌C. Để mẫu gang lâu ngày trong không khí ẩm: Đây là ăn mòn điện hóa. Gang là hợp kim của Fe và C, trong môi trường ẩm (có hơi nước và chất điện ly), Fe đóng vai trò cực âm, C đóng vai trò cực dương, hình thành pin điện hóa và gây ăn mòn Fe.
❌D. Cho hợp kim Fe-Cu vào dung dịch HCl: Đây là ăn mòn điện hóa. Fe đóng vai trò cực âm, Cu đóng vai trò cực dương trong môi trường dung dịch HCl.
Phương trình phản ứng: Fe + 2HCl → FeCl2 + H2 Đáp án: B
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
✔️B. Đốt cháy dây sắt trong không khí khô: Đây là ăn mòn hóa học. Sắt tác dụng trực tiếp với oxi trong không khí ở nhiệt độ cao theo PT:
3Fe + 2O2 → Fe3O4
❌C. Để mẫu gang lâu ngày trong không khí ẩm: Đây là ăn mòn điện hóa. Gang là hợp kim của Fe và C, trong môi trường ẩm (có hơi nước và chất điện ly), Fe đóng vai trò cực âm, C đóng vai trò cực dương, hình thành pin điện hóa và gây ăn mòn Fe.
❌D. Cho hợp kim Fe-Cu vào dung dịch HCl: Đây là ăn mòn điện hóa. Fe đóng vai trò cực âm, Cu đóng vai trò cực dương trong môi trường dung dịch HCl.
Phương trình phản ứng: Fe + 2HCl → FeCl2 + H2 Đáp án: B
Câu 19 [237970]: Trường hợp nào xảy ra ăn mòn điện hóa :
A, Sợi dây bạc nhúng trong dung dịch axit HNO3.
B, Đốt lá sắt trong khí chlorine.
C, Thanh nhôm nhúng trong axit H2SO4 loãng .
D, Thanh kẽm nhúng trong dung dịch CuSO4.
HD: A. xảy ra phản ứng oxi hoá khử.
B. phản ứng thiếu điện cực + dung môi dẫn điện.
C. Thiếu một điện cực.
D. thoả mãn: Zn đẩy Cu tạo ra 2 điện cực Cu và Zn. dung môi có SO4^(2-) dẫn điện.
Vậy D thoả mãn là TH xảy ra ăn mòn điện hoá. Chọn D.
Đáp án: D
B. phản ứng thiếu điện cực + dung môi dẫn điện.
C. Thiếu một điện cực.
D. thoả mãn: Zn đẩy Cu tạo ra 2 điện cực Cu và Zn. dung môi có SO4^(2-) dẫn điện.
Vậy D thoả mãn là TH xảy ra ăn mòn điện hoá. Chọn D.
Đáp án: D
Câu 20 [679549]: Thí nghiệm nào sau đây có xảy ra ăn mòn điện hóa học?
A, Nhúng thanh Zn vào dung dịch hỗn hợp gồm CuSO4 và H2SO4.
B, Nhúng thanh Cu vào dung dịch HNO3 loãng.
C, Nhúng thanh Fe vào dung dịch HCl.
D, Đốt dây Mg trong bình đựng khí O2.
HD: ► Điều kiện xảy ra ăn mòn điện hóa là phải thỏa mãn đồng thời cả 3 điều kiện sau:
• Các điện cực phải khác nhau về bản chất, có thể là cặp 2 kim loại khác nhau hoặc cặp kim loại với phi kim,…
• Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
• Các điện cực cùng tiếp xúc với một dung dịch chất điện li.
Khi nhúng Zn vào, đầu tiên Zn + CuSO4 → ZnSO4 + Cu
⇝ tạo 2 điện cực Cu-Zn, lúc đó cả 3 điều kiện trên đều thỏa mãn nên xảy ra ăn mòn điện hóa, còn lại các trường hợp khác không thỏa mãn ⇝ Chọn đáp án A. ♥ Đáp án: A
• Các điện cực phải khác nhau về bản chất, có thể là cặp 2 kim loại khác nhau hoặc cặp kim loại với phi kim,…
• Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
• Các điện cực cùng tiếp xúc với một dung dịch chất điện li.
Khi nhúng Zn vào, đầu tiên Zn + CuSO4 → ZnSO4 + Cu
⇝ tạo 2 điện cực Cu-Zn, lúc đó cả 3 điều kiện trên đều thỏa mãn nên xảy ra ăn mòn điện hóa, còn lại các trường hợp khác không thỏa mãn ⇝ Chọn đáp án A. ♥ Đáp án: A
Câu 21 [679610]: Thí nghiệm nào sau đây có xảy ra ăn mòn điện hóa học?
A, Nhúng thanh Cu vào dung dịch Fe2(SO4)3.
B, Nhúng thanh Fe vào dung dịch CuCl2.
C, Nhúng dây Mg vào dung dịch HCl.
D, Đốt dây thép trong bình đựng khí Cl2.
HD: Điều kiện xảy ra ăn mòn điện hoá:
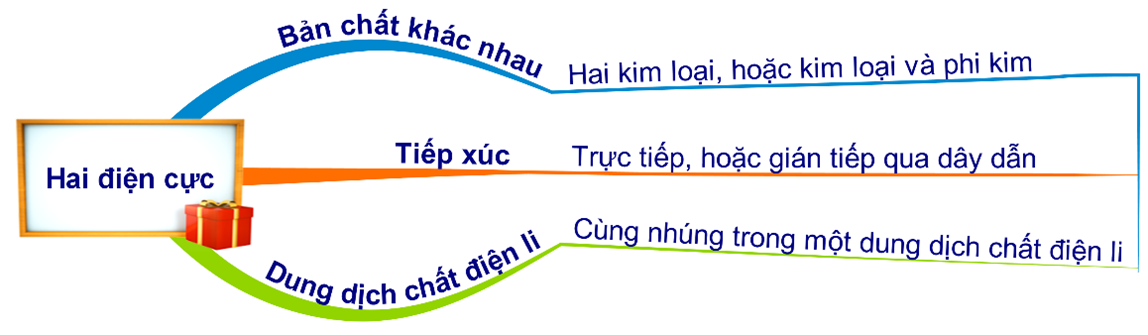
Khi nhúng Fe và dung dịch CuCl2 thì đầu tiên xảy ra:
Fe + CuCl2 → FeCl2 + Cu
⇝ Cu sinh ra bám vào Fe tạo thành cặp cực Fe-Cu trong dung dịch CuCl2 (dung dịch điện li) ⇝ xảy ra ăn mòn điện hoá sau đó ⇝ Chọn đáp án B. ♦ Đáp án: B

Khi nhúng Fe và dung dịch CuCl2 thì đầu tiên xảy ra:
Fe + CuCl2 → FeCl2 + Cu
⇝ Cu sinh ra bám vào Fe tạo thành cặp cực Fe-Cu trong dung dịch CuCl2 (dung dịch điện li) ⇝ xảy ra ăn mòn điện hoá sau đó ⇝ Chọn đáp án B. ♦ Đáp án: B
Câu 22 [679452]: Tiến hành các thí nghiệm sau:
(a) Nhúng thanh đồng nguyên chất vào dung dịch FeCl3.
(b) Cắt miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm.
(c) Nhúng thanh kẽm vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4.
(d) Quấn sợi dây đồng vào đinh sắt rồi nhúng vào cốc nước muối.
Trong các thí nghiệm trên, số thí nghiệm chỉ xảy ra ăn mòn hóa học là
(a) Nhúng thanh đồng nguyên chất vào dung dịch FeCl3.
(b) Cắt miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm.
(c) Nhúng thanh kẽm vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4.
(d) Quấn sợi dây đồng vào đinh sắt rồi nhúng vào cốc nước muối.
Trong các thí nghiệm trên, số thí nghiệm chỉ xảy ra ăn mòn hóa học là
A, 2.
B, 3.
C, 4.
D, 1.
HD: ► Điều kiện xảy ra ăn mòn điện hoá:

⇝ Phân tích các thí nghiệm tiến hành:
✔️ (a) Cu + FeCl3 → 2FeCl2 + CuCl2: chỉ xảy ra ăn mòn hoá học.
❌ (b) Cặp cực Fe-Sn tiếp xúc nhau, không khí ẩm là điều kiện dung dịch điện ly ⇒ xảy ra ăn mòn điện hoá học.
❌ (c) đầu tiên: Zn + CuSO4 → ZnSO4 + Cu; Cu sinh ra bám vào Zn tạo thành cặp cực trong dung dịch H2SO4 ⇒ xảy ra ăn mòn điện hoá.
❌ (d) Fe-Cu là cặp cực tiếp xúc nhau trong dung dịch điện ly là muối ⇒ xảy ra ăn mòn điện hoá.
⇝ chỉ có 1/4 thí nghiệm thoả mãn yêu cầu
⇒ Chọn đáp án D Đáp án: D

⇝ Phân tích các thí nghiệm tiến hành:
✔️ (a) Cu + FeCl3 → 2FeCl2 + CuCl2: chỉ xảy ra ăn mòn hoá học.
❌ (b) Cặp cực Fe-Sn tiếp xúc nhau, không khí ẩm là điều kiện dung dịch điện ly ⇒ xảy ra ăn mòn điện hoá học.
❌ (c) đầu tiên: Zn + CuSO4 → ZnSO4 + Cu; Cu sinh ra bám vào Zn tạo thành cặp cực trong dung dịch H2SO4 ⇒ xảy ra ăn mòn điện hoá.
❌ (d) Fe-Cu là cặp cực tiếp xúc nhau trong dung dịch điện ly là muối ⇒ xảy ra ăn mòn điện hoá.
⇝ chỉ có 1/4 thí nghiệm thoả mãn yêu cầu
⇒ Chọn đáp án D Đáp án: D
Câu 23 [59272]: Kim loại nào sau đây được mạ lên sắt để bảo vệ sắt và dùng để chế tạo thép không gỉ (dùng làm thìa, dao, dụng cụ y tế)?
A, Na.
B, Mg.
C, Cr.
D, Ca.
HD: Thép không gỉ (inox) là một hợp kim của sắt, có hàm lượng crom (Cr) tối thiểu 10,5% và tối đa 1,2% carbon theo khối lượng.
► Ngoài ra người ta còn mạ crom lên các kim loại để bảo vệ do crom bền, đẹp.
 Đáp án: C
Đáp án: C
► Ngoài ra người ta còn mạ crom lên các kim loại để bảo vệ do crom bền, đẹp.
 Đáp án: C
Đáp án: C
Câu 24 [15112]: Để bảo vệ ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) bằng phương pháp điện hóa, người ta gắn vào mặt ngoài của ống thép những tấm kim loại
A, chì.
B, đồng.
C, kẽm.
D, bạc.
Bảo vệ kim loại bằng phương pháp điện hóa: Gắn kim loại cần bảo vệ (Fe) với một kim loại mạnh hơn (Zn) để kim loại đó bị ăn mòn thay (do kẽm hoạt động hoá học mạnh hơn sắt nên đóng vai trò là anode và bị ăn mòn trước).
⇒ Chọn đáp án C Đáp án: C
⇒ Chọn đáp án C Đáp án: C
Câu 25 [233803]: Để bảo vệ vỏ tàu biển làm bằng thép, người ta thường gắn vào vỏ tàu (phấn chìm dưới nước) các khối kim loại nào sau đây?
A, Ag.
B, Zn.
C, Na.
D, Cu.
HD: ☆ Phương pháp điện hóa
Nguyên tắc: Trong quá trình ăn mòn điện hóa, kim loại mạnh hơn bị ăn mòn.
Biện pháp: Nối kim loại cần bảo vệ với kim loại hoạt động mạnh hơn để kim loại đó bị ăn mòn thay.
Để bảo vệ vỏ tàu biển bằng thép, những tấm kẽm đã được gắn vào mặt ngoài vỏ tàu (phần chìm dưới nước) để Zn bị ăn mòn, còn thép được bảo vệ. ❒
⇒ Chọn đáp án B Đáp án: B
Nguyên tắc: Trong quá trình ăn mòn điện hóa, kim loại mạnh hơn bị ăn mòn.
Biện pháp: Nối kim loại cần bảo vệ với kim loại hoạt động mạnh hơn để kim loại đó bị ăn mòn thay.
Để bảo vệ vỏ tàu biển bằng thép, những tấm kẽm đã được gắn vào mặt ngoài vỏ tàu (phần chìm dưới nước) để Zn bị ăn mòn, còn thép được bảo vệ. ❒
⇒ Chọn đáp án B Đáp án: B
Câu 26 [560777]: Trong thực tế, cách nào sau đây không được dùng để bảo vệ kim loại sắt khỏi bị ăn mòn?
A, Gắn kim loại đồng với sắt.
B, Tráng kẽm lên bề mặt sắt.
C, Phủ một lớp sơn lên bề mặt sắt.
D, Tráng thiếc lên bề mặt sắt.
- B, C, D dùng phương pháp phủ bề mặt để bảo vệ kim loại sắt khỏi bị ăn mòn.
- A gắn kim loại đồng yếu hơn sắt nên sẽ không bảo vệ sắt khỏi bị ăn mòn được.
⇒ Chọn đáp án A Đáp án: A
- A gắn kim loại đồng yếu hơn sắt nên sẽ không bảo vệ sắt khỏi bị ăn mòn được.
⇒ Chọn đáp án A Đáp án: A
Câu 27 [560778]: Cách nào dưới đây có thể sử dụng để bảo vệ kim loại khỏi bị gỉ?
A, Sử dụng máy hút ẩm và mạ.
B, Sử dụng máy hút ẩm và phun nước.
C, Đặt kim loại trong môi trường chân không.
D, Thêm nhiều dầu vào cạnh và sơn phủ.
✔️A. Sử dụng máy hút ẩm và mạ: Đây là cách hợp lý. Máy hút ẩm giúp giảm độ ẩm - yếu tố gây ra ăn mòn kim loại. Mạ là biện pháp tạo lớp bảo vệ bề mặt, ngăn chặn ăn mòn.
❌B. Sử dụng máy hút ẩm và phun nước: Điều này mâu thuẫn, vì phun nước sẽ tăng độ ẩm, không bảo vệ kim loại.
❌C. Đặt kim loại trong môi trường chân không: Đúng về mặt kỹ thuật, nhưng thường không khả thi trong thực tế với chi phí cao.
❌D. Thêm nhiều dầu vào cạnh và sơn phủ: Phủ dầu và sơn là cách hiệu quả để bảo vệ kim loại, nhưng không phải luôn cần "thêm nhiều dầu vào cạnh". Đáp án: A
❌B. Sử dụng máy hút ẩm và phun nước: Điều này mâu thuẫn, vì phun nước sẽ tăng độ ẩm, không bảo vệ kim loại.
❌C. Đặt kim loại trong môi trường chân không: Đúng về mặt kỹ thuật, nhưng thường không khả thi trong thực tế với chi phí cao.
❌D. Thêm nhiều dầu vào cạnh và sơn phủ: Phủ dầu và sơn là cách hiệu quả để bảo vệ kim loại, nhưng không phải luôn cần "thêm nhiều dầu vào cạnh". Đáp án: A
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.
Câu 28 [560779]: Nhúng thanh sắt và thanh đồng vào cốc chứa dung dịch H2SO4 0,5 M. Dùng dây dẫn điện nối thanh sắt và thanh đồng với bóng đèn như hình dưới đây:
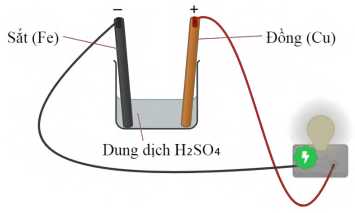
a. Khi chưa nối dây điện, bọt khí chỉ xuất hiện trên thanh sắt.
b. Khi nối dây điện, bóng đèn phát sáng do có dòng điện chạy qua.
c. Khi nối dây điện, chỉ xuất hiện bọt khí trên thanh đồng.
d. Khi nối dây điện, electron chạy từ cực âm sang cực dương.

a. Khi chưa nối dây điện, bọt khí chỉ xuất hiện trên thanh sắt.
b. Khi nối dây điện, bóng đèn phát sáng do có dòng điện chạy qua.
c. Khi nối dây điện, chỉ xuất hiện bọt khí trên thanh đồng.
d. Khi nối dây điện, electron chạy từ cực âm sang cực dương.
Phân tích các phát biểu sau:
✔️ a. Đúng. Khi chưa nối dây điện, chỉ xảy ra ăn mòn hóa học do Fe phản ứng với H2SO4 trong dung dịch tạo ra bọt khí trên thanh sắt.
✔️ b. Đúng. Khi nối dây điện, xảy ra ăn mòn điện hóa nên có dòng điện chạy qua làm bóng đèn phát sáng.
❌ c. Sai. Khi nối dây điện, bọt khí xuất hiện ở cả hai thanh kim loại. Lúc này ăn mòn điện hóa chiếm ưu thế nên bọt khí xuất hiện ở trên thanh đồng nhiều hơn.
✔️ d. Đúng. Khi nối dây điện, electron chạy từ cực âm sang cực dương. Fe (cực âm) nhường e, H+ (cực dương) nhận e.
✔️ a. Đúng. Khi chưa nối dây điện, chỉ xảy ra ăn mòn hóa học do Fe phản ứng với H2SO4 trong dung dịch tạo ra bọt khí trên thanh sắt.
✔️ b. Đúng. Khi nối dây điện, xảy ra ăn mòn điện hóa nên có dòng điện chạy qua làm bóng đèn phát sáng.
❌ c. Sai. Khi nối dây điện, bọt khí xuất hiện ở cả hai thanh kim loại. Lúc này ăn mòn điện hóa chiếm ưu thế nên bọt khí xuất hiện ở trên thanh đồng nhiều hơn.
✔️ d. Đúng. Khi nối dây điện, electron chạy từ cực âm sang cực dương. Fe (cực âm) nhường e, H+ (cực dương) nhận e.
Câu 29 [560780]: Biện pháp bảo vệ bề mặt kim loại được sử dụng tương ứng trong hình sau:

a. Hình (a) là bôi dầu mỡ.
b. Hình (b) là nhúng trong dung dịch chất điện li.
c. Hình (c) là sơn phủ.
d. Cả ba cách đều nhằm mục đích cách li kim loại với môi trường.

a. Hình (a) là bôi dầu mỡ.
b. Hình (b) là nhúng trong dung dịch chất điện li.
c. Hình (c) là sơn phủ.
d. Cả ba cách đều nhằm mục đích cách li kim loại với môi trường.
Phân tích các phát biểu sau:
✔️ a. Đúng. Hình (a) dùng biện pháp bôi dầu mỡ.
❌ b. Sai. Hình (b) là phương pháp mạ điện.
✔️ c. Đúng. Hình (c) là sơn phủ.
✔️ d. Đúng. Cả ba cách trên đều nhằm mục đích cách li kim loại với môi trường.
✔️ a. Đúng. Hình (a) dùng biện pháp bôi dầu mỡ.
❌ b. Sai. Hình (b) là phương pháp mạ điện.
✔️ c. Đúng. Hình (c) là sơn phủ.
✔️ d. Đúng. Cả ba cách trên đều nhằm mục đích cách li kim loại với môi trường.
Câu 30 [561204]: Trong tự nhiên, sự ăn mòn kim loại gây tổn thất to lớn về tài nguyên và chi phí sửa chữa, thay thế nhiều chi tiết của máy móc, thiết bị vì vậy bảo vệ kim loại không bị ăn mòn là cần được thực hiện.
a. Phủ lên bề mặt của kim loại một lớp sơn, dầu, mỡ, chất dẻo hoặc tráng,
mạ bằng một kim loại khác là những các cách chống ăn mòn kim loại
theo phương pháp phủ bề mặt.
b. Nối kim loại cần bảo vệ với một kim loại hoạt động hoá học mạnh hơn
là cách chống ăn mòn kim loại theo phương pháp điện hoá.
c. Quấn một dây kẽm quanh đinh sắt là cách để chống ăn mòn kẽm trong
môi trường có chất điện li.
d. Đồ trang sức bằng bạc có thể bị chuyển sang màu đen do có phản ứng
giữa bạc với O2 và H2S trong không khí để tạo thành Ag2S và hơi nước.
Đây là sự ăn mòn hoá học đối với đồ trang sức bằng bạc.
a. Phủ lên bề mặt của kim loại một lớp sơn, dầu, mỡ, chất dẻo hoặc tráng,
mạ bằng một kim loại khác là những các cách chống ăn mòn kim loại
theo phương pháp phủ bề mặt.
b. Nối kim loại cần bảo vệ với một kim loại hoạt động hoá học mạnh hơn
là cách chống ăn mòn kim loại theo phương pháp điện hoá.
c. Quấn một dây kẽm quanh đinh sắt là cách để chống ăn mòn kẽm trong
môi trường có chất điện li.
d. Đồ trang sức bằng bạc có thể bị chuyển sang màu đen do có phản ứng
giữa bạc với O2 và H2S trong không khí để tạo thành Ag2S và hơi nước.
Đây là sự ăn mòn hoá học đối với đồ trang sức bằng bạc.
Phân tích các phát biểu sau:
✔️ a. Đúng. Phủ lên bề mặt kim loại một lớp sơn, dầu, mỡ hoặc tráng, mạ bằng một kim loại khác là những cách chống ăn mòn kim loại theo phương pháp phủ bề mặt.
✔️ b. Đúng. Nối kim loại cần bảo vệ với một kim loại hoạt động hóa học mạnh hơn là cách chống ăn mòn kim loại theo phương pháp điện hóa.
❌ c. Sai. Quấn dây kẽm quanh đinh sắt là cách để chống ăn mòn đinh sắt theo phương pháp điện hóa. Kẽm hoạt động hoá học mạnh hơn sắt nên sẽ bị ăn mòn trước, bảo vệ cho sắt.
✔️ d. Đúng. Đồ trang sức bằng bạc có thể bị chuyển sang màu đen là sự ăn mòn hóa học.
✔️ a. Đúng. Phủ lên bề mặt kim loại một lớp sơn, dầu, mỡ hoặc tráng, mạ bằng một kim loại khác là những cách chống ăn mòn kim loại theo phương pháp phủ bề mặt.
✔️ b. Đúng. Nối kim loại cần bảo vệ với một kim loại hoạt động hóa học mạnh hơn là cách chống ăn mòn kim loại theo phương pháp điện hóa.
❌ c. Sai. Quấn dây kẽm quanh đinh sắt là cách để chống ăn mòn đinh sắt theo phương pháp điện hóa. Kẽm hoạt động hoá học mạnh hơn sắt nên sẽ bị ăn mòn trước, bảo vệ cho sắt.
✔️ d. Đúng. Đồ trang sức bằng bạc có thể bị chuyển sang màu đen là sự ăn mòn hóa học.
Câu 31 [561205]: Ăn mòn kim loại là quá trình phá hủy kim loại hoặc hợp kim dưới tác dụng của môi trường. Ăn mòn kim loại được phân thành ăn mòn điện hóa và ăn mòn hóa học.
a. Trong ăn mòn kim loại luôn xảy ra quá trình oxi hóa khử.
b. Trong ăn mòn điện hóa, quá trình ăn mòn kim loại xảy ra do sự tạo thành
pin điện hóa.
c. Thép bị gỉ khi để trong không khí ẩm chỉ xảy ra quá trình ăn mòn hóa học.
d. Cho lá kim loại Zn vào ống nghiệm có chứa lượng dư dung dịch CuSO4.
Trong ống nghiệm chỉ xảy ra quá trình ăn mòn điện hóa.
a. Trong ăn mòn kim loại luôn xảy ra quá trình oxi hóa khử.
b. Trong ăn mòn điện hóa, quá trình ăn mòn kim loại xảy ra do sự tạo thành
pin điện hóa.
c. Thép bị gỉ khi để trong không khí ẩm chỉ xảy ra quá trình ăn mòn hóa học.
d. Cho lá kim loại Zn vào ống nghiệm có chứa lượng dư dung dịch CuSO4.
Trong ống nghiệm chỉ xảy ra quá trình ăn mòn điện hóa.
Phân tích các phát biểu sau:
✔️ a. Đúng. Quá trình ăn mòn
kim loại, dù là ăn mòn hóa học hay điện hóa, đều liên quan đến phản ứng oxi hóa
khử. Trong đó, kim loại bị oxi hóa (mất electron) và môi trường hoặc chất khác
nhận electron.
✔️ b. Đúng. Ăn mòn điện hóa xảy ra khi hai điện cực (các kim loại hoặc hợp kim khác nhau) tiếp xúc qua dung dịch chất điện ly, tạo ra một pin điện hóa. Kim loại có tính khử mạnh hơn sẽ bị oxi hóa.
❌ c. Sai. Ngoài ăn mòn hóa học, thép bị gỉ trong không khí ẩm còn xảy ra ăn mòn điện hóa vì trong thép có Fe và C tiếp xúc trực tiếp trong không khí ẩm (dung dịch chất điện li) tạo ra pin điện hóa.
❌ d. Sai. Phản ứng chính là phản ứng hóa học giữa Zn và Cu2+:
Zn + CuSO4⟶ZnSO4 + Cu
Đây là ăn mòn điện hóa, đồng thời cũng là phản ứng oxi hóa khử, vì vậy nói " chỉ " xảy ra ăn mòn điện hóa là sai.
✔️ a. Đúng. Quá trình ăn mòn
kim loại, dù là ăn mòn hóa học hay điện hóa, đều liên quan đến phản ứng oxi hóa
khử. Trong đó, kim loại bị oxi hóa (mất electron) và môi trường hoặc chất khác
nhận electron.
✔️ b. Đúng. Ăn mòn điện hóa xảy ra khi hai điện cực (các kim loại hoặc hợp kim khác nhau) tiếp xúc qua dung dịch chất điện ly, tạo ra một pin điện hóa. Kim loại có tính khử mạnh hơn sẽ bị oxi hóa.
❌ c. Sai. Ngoài ăn mòn hóa học, thép bị gỉ trong không khí ẩm còn xảy ra ăn mòn điện hóa vì trong thép có Fe và C tiếp xúc trực tiếp trong không khí ẩm (dung dịch chất điện li) tạo ra pin điện hóa.
❌ d. Sai. Phản ứng chính là phản ứng hóa học giữa Zn và Cu2+:
Zn + CuSO4⟶ZnSO4 + Cu
Đây là ăn mòn điện hóa, đồng thời cũng là phản ứng oxi hóa khử, vì vậy nói " chỉ " xảy ra ăn mòn điện hóa là sai.
Câu 32 [561206]: Tôn là loại vật liệu phổ biến được sử dụng trong các ngành xây dựng.
a. Tôn là sắt được tráng thiếc.
b. Các tấm tôn thường thường bị gỉ sét nhanh hơn tại các vị trí cố định
bằng đinh thép.
c. Trong quá trình tôn bị gỉ sét, các đinh thép đóng vai trò như anode làm
cho quá trình ăn mòn diễn ra nhanh hơn.
d. Việc tráng lớp mỏng kim loại lên bề mặt sắt để tạo ra tôn là cách bảo
vệ sắt theo phương pháp điện hóa.
a. Tôn là sắt được tráng thiếc.
b. Các tấm tôn thường thường bị gỉ sét nhanh hơn tại các vị trí cố định
bằng đinh thép.
c. Trong quá trình tôn bị gỉ sét, các đinh thép đóng vai trò như anode làm
cho quá trình ăn mòn diễn ra nhanh hơn.
d. Việc tráng lớp mỏng kim loại lên bề mặt sắt để tạo ra tôn là cách bảo
vệ sắt theo phương pháp điện hóa.
Phân tích các phát biểu sau:
❌ a. Sai. Tôn là sắt được tráng kẽm.
✔️ b. Đúng. Các tấm tôn thường thường bị gỉ sét nhanh hơn tại các vị trí cố định bằng đinh thép.Vì những vị trí này thường mất lớp mạ, để lộ sắt bên trong nên tốc độ gỉ nhanh hơn các vị trí khác.
❌c. Sai. Trong quá trình tôn bị gỉ sét, sắt đóng vai trò là anode còn đinh thép đóng vai trò là cathode.
❌ d. Sai. Việc tráng lớp mỏng kim loại lên bề mặt sắt để tạo ra tôn là cách bảo vệ sắt theo phương pháp phủ bề mặt.
❌ a. Sai. Tôn là sắt được tráng kẽm.
✔️ b. Đúng. Các tấm tôn thường thường bị gỉ sét nhanh hơn tại các vị trí cố định bằng đinh thép.Vì những vị trí này thường mất lớp mạ, để lộ sắt bên trong nên tốc độ gỉ nhanh hơn các vị trí khác.
❌c. Sai. Trong quá trình tôn bị gỉ sét, sắt đóng vai trò là anode còn đinh thép đóng vai trò là cathode.
❌ d. Sai. Việc tráng lớp mỏng kim loại lên bề mặt sắt để tạo ra tôn là cách bảo vệ sắt theo phương pháp phủ bề mặt.
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
Câu 33 [911565]: Tiến hành các thí nghiệm sau:
(a) Cho gang tác dụng với dung dịch H2SO4 loãng.
(b) Cho Fe tác dụng với dung dịch Fe(NO3)3.
(c) Cho Al tác dụng với dung dịch hỗn hợp gồm HCl và CuSO4.
(d) Cho Fe tác dung với dung dịch Cu(NO3)2.
(e) Cho Al và Fe tác dụng với khí Cl2 khô.
Trong các thí nghiệm trên, số thí nghiệm có hiện tượng ăn mòn điện hóa học là
Điền đáp án: ..........
(a) Cho gang tác dụng với dung dịch H2SO4 loãng.
(b) Cho Fe tác dụng với dung dịch Fe(NO3)3.
(c) Cho Al tác dụng với dung dịch hỗn hợp gồm HCl và CuSO4.
(d) Cho Fe tác dung với dung dịch Cu(NO3)2.
(e) Cho Al và Fe tác dụng với khí Cl2 khô.
Trong các thí nghiệm trên, số thí nghiệm có hiện tượng ăn mòn điện hóa học là
Điền đáp án: ..........
A,
B,
C,
D,
HD: Điều kiện xảy ra ăn mòn điện hóa:
![596474[LG].png](https://asset.moon.vn/img/ai/Teachers/rongden_167/ProS2018/TAPIII/596474[LG].png)
Theo đó, phân tích các thí nghiệm:
(a) gang chứa cặp cặp Fe-C tiếp xúc nhau, dung dịch H2SO4 điện li ⇝ thỏa mãn.
(b) Fe + 2Fe(NO3)3 → 3Fe(NO3)2: điều kiện cặp cực không thỏa mãn.
(c) 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
⇒ tạo thành cặp cực Al-Cu tiếp xúc nhau, dung dịch HCl điện ly ⇝ thỏa mãn.
(d) Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
⇒ tạo thành cặp cực Fe-Cu tiếp xúc nhau, dung dịch Cu(NO3)2 điện ly ⇝ thỏa mãn.
(e) khí Cl2 không, không có dung dịch điện ly nên không thỏa mãn.
⇒ Có 3 thí nghiệm xảy ra hiện tượng ăn mòn điện hóa học.
=> Điền đáp án: 3 Đáp án: D
![596474[LG].png](https://asset.moon.vn/img/ai/Teachers/rongden_167/ProS2018/TAPIII/596474[LG].png)
Theo đó, phân tích các thí nghiệm:
(a) gang chứa cặp cặp Fe-C tiếp xúc nhau, dung dịch H2SO4 điện li ⇝ thỏa mãn.
(b) Fe + 2Fe(NO3)3 → 3Fe(NO3)2: điều kiện cặp cực không thỏa mãn.
(c) 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
⇒ tạo thành cặp cực Al-Cu tiếp xúc nhau, dung dịch HCl điện ly ⇝ thỏa mãn.
(d) Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
⇒ tạo thành cặp cực Fe-Cu tiếp xúc nhau, dung dịch Cu(NO3)2 điện ly ⇝ thỏa mãn.
(e) khí Cl2 không, không có dung dịch điện ly nên không thỏa mãn.
⇒ Có 3 thí nghiệm xảy ra hiện tượng ăn mòn điện hóa học.
=> Điền đáp án: 3 Đáp án: D
Câu 34 [560781]: Cho những thí nghiệm sau:
(a) Cho một mẩu sodium vào dung dịch copper(II) sulfate.
(b) Nhúng một thanh kẽm vào dung dịch silver nitrate.
(c) Nhúng một thanh sắt vào dung dịch iron(III) chloride.
(d) Cho nước vào hỗn hợp bột magnesium, sắt và muối ăn.
(đ) Trộn bột Zn vào bột CuSO4.
Có bao nhiêu trường hợp nào sau đây có xảy ra ăn mòn điện hoá?
Điền đáp án: ..........
(a) Cho một mẩu sodium vào dung dịch copper(II) sulfate.
(b) Nhúng một thanh kẽm vào dung dịch silver nitrate.
(c) Nhúng một thanh sắt vào dung dịch iron(III) chloride.
(d) Cho nước vào hỗn hợp bột magnesium, sắt và muối ăn.
(đ) Trộn bột Zn vào bột CuSO4.
Có bao nhiêu trường hợp nào sau đây có xảy ra ăn mòn điện hoá?
Điền đáp án: ..........
(a) Cho một mẩu sodium vào dung dịch copper(II) sulfate => ăn mòn hóa học.
(b) Nhúng một thanh kẽm vào dung dịch silver nitrate => ăn mòn điện hóa.
(c) Nhúng một thanh sắt vào dung dịch iron(III) chloride => ăn mòn hóa học.
(d) Cho nước vào hỗn hợp bột magnesium, sắt và muối ăn => ăn mòn điện hóa.
(đ) Trộn bột Zn vào bột CuSO4 => chưa đủ điều kiện xảy ra ăn mòn điện hóa.
=> Có 2 trường hợp xảy ra ăn mòn điện hóa.
=> Điền đáp án: 2
(b) Nhúng một thanh kẽm vào dung dịch silver nitrate => ăn mòn điện hóa.
(c) Nhúng một thanh sắt vào dung dịch iron(III) chloride => ăn mòn hóa học.
(d) Cho nước vào hỗn hợp bột magnesium, sắt và muối ăn => ăn mòn điện hóa.
(đ) Trộn bột Zn vào bột CuSO4 => chưa đủ điều kiện xảy ra ăn mòn điện hóa.
=> Có 2 trường hợp xảy ra ăn mòn điện hóa.
=> Điền đáp án: 2
Câu 35 [59291]: Có 4 dung dịch riêng biệt: HCl, FeCl2, AgNO3, CuSO4. Nhúng vào mỗi dung dịch một thanh sắt nguyên chất. Số trường hợp xuất hiện ăn mòn hóa học là
Điền đáp án: ..........
Điền đáp án: ..........
A,
B,
C,
D,
HD:Các trường hợp xuất hiện ăn mòn hóa học: HCl, AgNO3, CuSO4.
Trường hợp nhúng thanh sắt vào dung dịch AgNO3 và CuSO4, ban đầu ăn mòn hóa học, sau là ăn mòn điện hóa.
=> Điền đáp án: 3 Đáp án: D
Trường hợp nhúng thanh sắt vào dung dịch AgNO3 và CuSO4, ban đầu ăn mòn hóa học, sau là ăn mòn điện hóa.
=> Điền đáp án: 3 Đáp án: D
Câu 36 [560782]: Để mạ một lớp kim loại chromium dày 0,15 mm lên một bộ phận của khung ô tô có tổng diện tích bề mặt cần mạ là 0,40 m2 từ dung dịch chứa ion CrO42– cần tốn thời gian bao nhiêu giây? Biết khối lượng riêng của kim loại chromium là 7,20 g/cm3, cường độ dòng điện là 50 A, nguyên tử khối của chromium là 52 g/mol và hằng số Faraday là 96500 (C/mol).(làm tròn đến số nguyên)
Điền đáp án: ..........
Điền đáp án: ..........
Đổi: S= 0,4 m2 = 4000 cm2 ; độ dày 0,15 mm = 0,015 cm
Ta có thể tích lớp chromium cần mạ là 4000.0,015 = 60 cm3
=> Khối lượng Cr: m=D.V = 7,2.60 = 432 gam
Từ định luật Faraday:
t=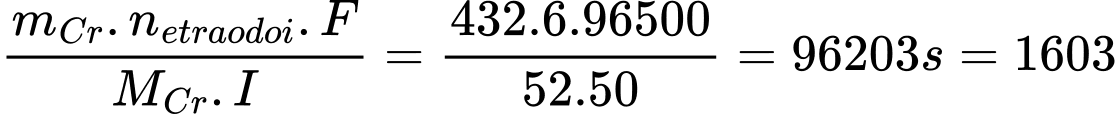 phút
phút
⟹ Điền đáp án: 1603
Ta có thể tích lớp chromium cần mạ là 4000.0,015 = 60 cm3
=> Khối lượng Cr: m=D.V = 7,2.60 = 432 gam
Từ định luật Faraday:
t=
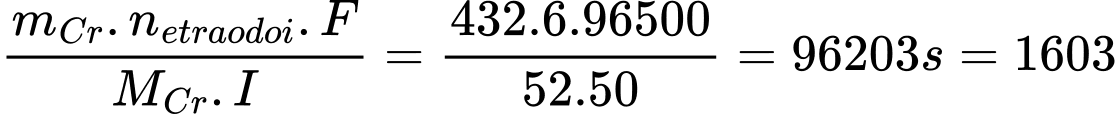 phút
phút
⟹ Điền đáp án: 1603
Câu 37 [560783]: Thanh kim loại Mg có khối lượng 10 gam được gắn vào để bảo vệ một ống thép chôn dưới đất. Trong quá trình này, chất oxi hóa chính là khí oxygen được hòa tan trong đất hoặc nước.
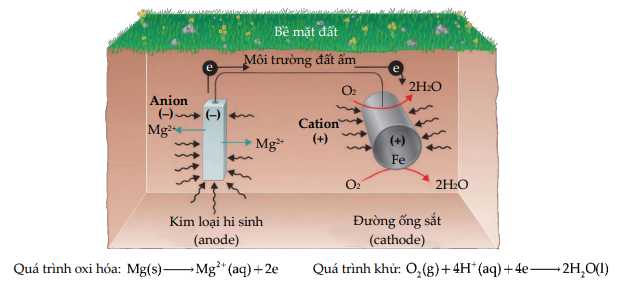
Giả sử chỉ có thanh Mg bị ăn mòn và nếu 3,2 gam O2 đã bị chuyển hóa thành H2O thì khối lượng thanh Mg còn lại là bao nhiêu?
Điền đáp án: ..........

Giả sử chỉ có thanh Mg bị ăn mòn và nếu 3,2 gam O2 đã bị chuyển hóa thành H2O thì khối lượng thanh Mg còn lại là bao nhiêu?
Điền đáp án: ..........
nO2 = 3,2/32 = 0,1 mol => n e trao đổi = 4.0,1= 0,4 mol
nMg = n e trao đổi /2 = 0,4/2 = 0,2 mol
=> Khối lượng Mg bị ăn mòn là 0,2.24 = 4,8 mol
=> Khối lượng thanh Mg còn lại là 10 - 4,8 = 5,2 gam
=> Điền đáp án: 5,2
nMg = n e trao đổi /2 = 0,4/2 = 0,2 mol
=> Khối lượng Mg bị ăn mòn là 0,2.24 = 4,8 mol
=> Khối lượng thanh Mg còn lại là 10 - 4,8 = 5,2 gam
=> Điền đáp án: 5,2
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó
PHƯƠNG PHÁP BẢO VỆ KIM LOẠI
Không giống như sự ăn mòn của sắt (Fe), sự ăn mòn của nhôm (Al) tạo ra một lớp phủ bảo vệ không hòa tan (Al2O3) ngăn chặn sự ăn mòn thêm của lớp kim loại phía bên dưới. Các kim loại được sử dụng để đúc tiền như đồng (Cu) và bạc (Ag) cũng bị ăn mòn, nhưng chậm hơn nhiều so với sắt hoặc nhôm:Cu(s) → Cu2+(aq) + 2e
Ag(s) → Ag+(aq) + e
Khi tiếp xúc với khí quyển thông thường, đồng tạo thành một lớp đồng carbonate (CuCO3), một chất màu xanh lá cây được gọi là lớp gỉ, giúp bảo vệ lớp kim loại phía bên dưới khỏi bị ăn mòn thêm. Tương tự như vậy, đồ dùng bằng bạc tiếp xúc với thực phẩm sẽ tạo ra một lớp bạc sulfide (Ag2S).

Một số phương pháp đã được nghĩ ra để bảo vệ kim loại khỏi bị ăn mòn. Hầu hết các phương pháp này đều nhằm mục đích ngăn ngừa sự hình thành rỉ sét. Cách tiếp cận rõ ràng nhất là phủ lên bề mặt kim loại một lớp sơn để tránh tiếp xúc với không khí. Tuy nhiên, nếu lớp sơn bị trầy xước hoặc bị hư hỏng, làm lộ ra phần kim loại rất nhỏ, rỉ sét vẫn sẽ hình thành dưới lớp sơn. Bề mặt của một số kim loại như sắt, nhôm, chromium có thể được làm cho không hoạt động bằng một quá trình gọi là thụ động hóa. Một lớp oxide mỏng được hình thành khi cho kim loại vào trong dung dịch nitric acid HNO3 đặm đặc ở nhiệt độ thường.
Một cách khác để bảo vệ kim loại đó chính là sử dụng công nghệ mạ, phủ một lớp kim loại bền, chống ăn mòn tốt lên trên bề mặt kim loại muốn bảo vệ. Để mạ chromium lên một bề mặt, tiến hành điện phân dung dịch H2CrO4, anode làm bằng Pt, cathode là vật cần mạ. Ví dụ có thể phủ một lớp kim loại chromium lên bề mặt của sắt để có thể bảo vệ sắt khỏi bị ăn mòn.
Câu 38 [560784]: Để giảm thiểu sự ăn mòn của lớp kim loại bên dưới, nhôm đã hình thành một lớp phủ bảo vệ có công thức là
A, AlCl3.
B, CuCO3.
C, Ag2S.
D, Al2O3.
Khi nhôm tiếp xúc với không khí, bề mặt của nó phản ứng với oxygen để tạo ra lớp oxide nhôm:
4Al + 3O2 ⟶ 2Al2O3
Lớp Al2O3 này rất mỏng nhưng cứng, bền và không thấm nước, giúp bảo vệ kim loại nhôm bên dưới khỏi các tác nhân ăn mòn như nước, không khí hoặc hóa chất.
⇒ Chọn đáp án D Đáp án: D
4Al + 3O2 ⟶ 2Al2O3
Lớp Al2O3 này rất mỏng nhưng cứng, bền và không thấm nước, giúp bảo vệ kim loại nhôm bên dưới khỏi các tác nhân ăn mòn như nước, không khí hoặc hóa chất.
⇒ Chọn đáp án D Đáp án: D
Câu 39 [382647]: Kim loại nào sau đây không bị thụ động hóa trong dung dịch HNO3 đậm đặc ở nhiệt độ thường?
A, Cu.
B, Fe.
C, Al.
D, Cr.
Kim loại bị thụ động hóa trong dung dịch HNO3 đậm đặc ở nhiệt độ thường là Fe, Al, Cr.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 40 [382648]: Để mạ chromium lên một vật hình trụ tròn có bề dày là 3 mm, bán kính 4 cm. Tiến hành điện phân dung dịch với cường độ dòng điện là 2A. Cho biết khối lượng riêng và nguyên tử khối của Cr lần lượt là 7,19 g/cm3 và 52 g/mol, lớp mạ bám đều lên các mặt của vật hình trụ. Thời gian cần điện phân để có lớp mạ dày 0,01 mm là

A, 5120 s.
B, 3695 s.
C, 4325 s.
D, 6860 s.
Diện tích bề mặt của hình trụ (bao gồm cả hai đáy và mặt ngoài) là:
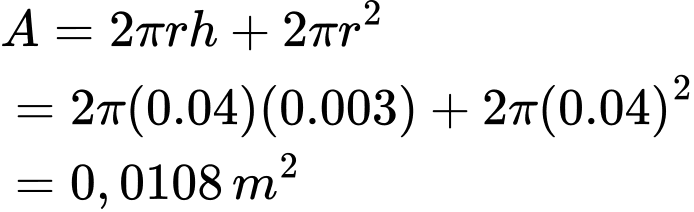
Tính khối lượng mạ cần bám lên:
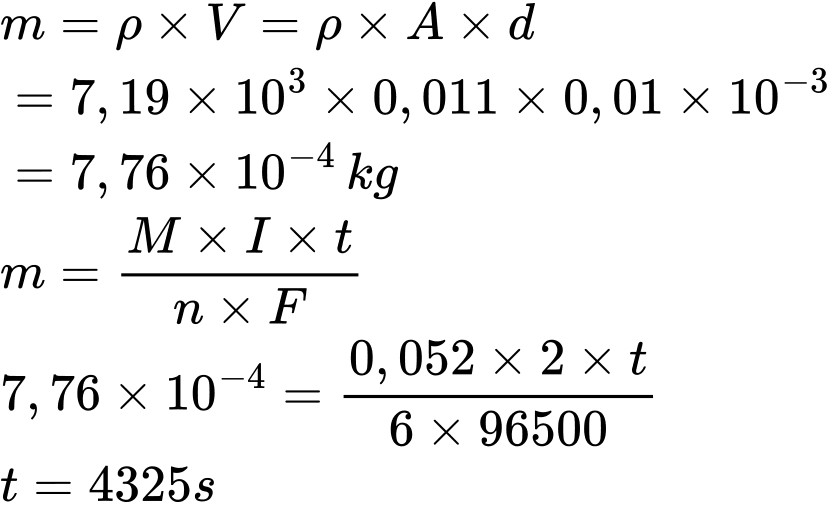
⇒ Chọn đáp án C Đáp án: C
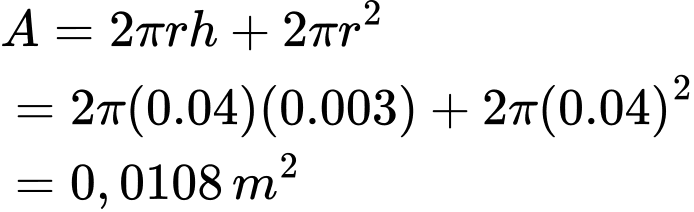
Tính khối lượng mạ cần bám lên:
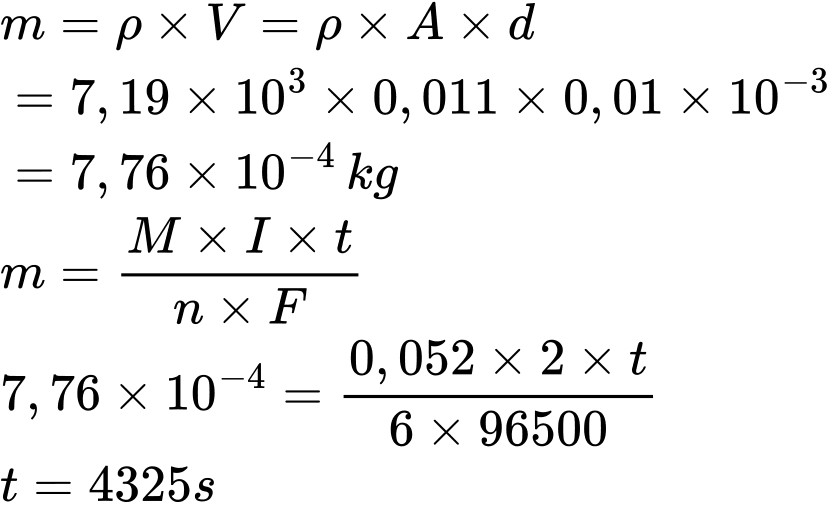
⇒ Chọn đáp án C Đáp án: C