Dạng 1: TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.
Câu 1 [560645]: Ở điều kiện thường, chromium tác dụng với phi kim nào sau đây?
A, Fluorine.
B, Lưu huỳnh.
C, Phosphorus.
D, Nitrogen.
Ở điều kiện thường, chromium tác dụng với fluorine:Cr + 2F2 → CrF4.
⟹ Chọn đáp án A Đáp án: A
⟹ Chọn đáp án A Đáp án: A
Câu 2 [57709]: Khi đốt nóng, kim loại nào sau đây không tác dụng với khí O2?
A, Mg.
B, Cu.
C, Au.
D, Fe.
"Lửa thử vàng - gian nan thử sức".
Vàng (Au) có tính khử rất yếu, không bị oxi hóa trong không khí dù ở nhiệt độ nào.
⇒ Chọn đáp án C Đáp án: C
Vàng (Au) có tính khử rất yếu, không bị oxi hóa trong không khí dù ở nhiệt độ nào.
⇒ Chọn đáp án C Đáp án: C
Câu 3 [57706]: Phản ứng hóa học nào sau đây sai?
A, 3Fe + 2O2 –––to–→ Fe3O4.
B, Ca + 2C –––to–→ CaC2.
C, Fe + Cl2 –––to–→ FeCl2.
D, Zn + S –––to–→ ZnS.
HD:
2Fe + 3Cl2 to→ 2FeCl3.
Đáp án: C
2Fe + 3Cl2 to→ 2FeCl3.
Đáp án: C
Câu 4 [57710]: Khi đốt nóng, khí clo không tác dụng trực tiếp với
A, khí O2.
B, kim loại Na.
C, kim loại Fe.
D, kim loại Al.
HD: Khí clo (Cl2) không tác dụng trực tiếp với khí O2.
► Cl2 tác dụng được với các kim loại thu được muối clorua tương ứng:
✔️2Na + Cl2 → 2NaCl.
✔️2Fe + 3Cl2 → 2FeCl3.
✔️2Al + 3Cl2 → 2AlCl3 .
⟹ Chọn đáp án A Đáp án: A
► Cl2 tác dụng được với các kim loại thu được muối clorua tương ứng:
✔️2Na + Cl2 → 2NaCl.
✔️2Fe + 3Cl2 → 2FeCl3.
✔️2Al + 3Cl2 → 2AlCl3 .
⟹ Chọn đáp án A Đáp án: A
Câu 5 [57711]: Cho từ từ đến dư một lượng bột sắt vào trong bình đựng một lượng nhỏ khí clo đã được đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, chất rắn thu được trong bình là
A, FeCl2 .
B, FeCl2 và FeCl3.
C, Fe và FeCl2.
D, Fe và FeCl3.
2Fe + 3Cl2 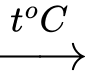 2FeCl3
2FeCl3
Chú ý: Chỉ trong dung dịch thì Fe dư mới có thể phản ứng với FeCl3 để tạo thành FeCl2:
Fe + 2FeCl3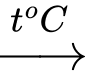 3FeCl2
3FeCl2
Vậy sau phản ứng chất rắn gồm Fe, FeCl3.
⇒ Chọn đáp án D Đáp án: D
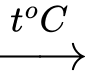 2FeCl3
2FeCl3Chú ý: Chỉ trong dung dịch thì Fe dư mới có thể phản ứng với FeCl3 để tạo thành FeCl2:
Fe + 2FeCl3
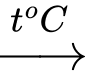 3FeCl2
3FeCl2Vậy sau phản ứng chất rắn gồm Fe, FeCl3.
⇒ Chọn đáp án D Đáp án: D
Câu 6 [560646]: Các ống nhiệt kế thường có chứa thủy ngân. Khi bị vỡ, thuỷ ngân dễ bay hơi và rất độc. Để xử lí thì có thể dùng bột lưu huỳnh để xử lí thuỷ ngân vì lưu huỳnh có thể phản ứng với thủy ngân ngay ở nhiệt độ thường. Phương trình hóa học nào sau đây biểu diễn đúng phản ứng xảy ra giữa lưu huỳnh và thủy ngân?
A, Hg(l) + 2S(s)  HgS2(s).
HgS2(s).
 HgS2(s).
HgS2(s).B, Hg(l) + H2S(g)  HgS(s) + H2(g).
HgS(s) + H2(g).
 HgS(s) + H2(g).
HgS(s) + H2(g).C, Hg(l) + S(s)  HgS(s).
HgS(s).
 HgS(s).
HgS(s).D, 2HgO(s) + 2S(s)  2HgS(s) + O2(g).
2HgS(s) + O2(g).
 2HgS(s) + O2(g).
2HgS(s) + O2(g).
Tại nhiệt độ thường, thủy ngân phản ứng với lưu huỳnh theo phương trình:
Hg(l) + S(s)  HgS(s).
HgS(s).
Đáp án: C  HgS(s).
HgS(s).
Câu 7 [560647]: Đồ trang sức bằng bạc có thể bị chuyển sang màu đen do có phản ứng giữa bạc với O2 và H2S trong không khí để tạo thành Ag2S và hơi nước.
4Ag(s) + 2H2S(g) + O2(g) (không khí) ⟶ 2Ag2S(s) + 2H2O(l)
Nhận định nào sau đây là đúng?
4Ag(s) + 2H2S(g) + O2(g) (không khí) ⟶ 2Ag2S(s) + 2H2O(l)
Nhận định nào sau đây là đúng?
A, Ag đóng vai trò là chất khử.
B, H2S đóng vai trò là chất oxi hóa.
C, Ag2S đóng vai trò là chất khử.
D, Hơi nước đóng vai trò là chất oxi hóa.
4Ag(s) + 2H2S(g) + O2(g) (không khí) ⟶ 2Ag2S(s) + 2H2O(l)
Quá trình oxi hóa: Ag ⟶ Ag+ + 1e
Quá trình khử: O2 + 4e ⟶ 2O2-
⟶ Trong phản ứng trên: Ag đóng vai trò là chất khử; O2 đóng vai trò là chất oxi hóa.
⇒ Chọn đáp án A Đáp án: A
Quá trình oxi hóa: Ag ⟶ Ag+ + 1e
Quá trình khử: O2 + 4e ⟶ 2O2-
⟶ Trong phản ứng trên: Ag đóng vai trò là chất khử; O2 đóng vai trò là chất oxi hóa.
⇒ Chọn đáp án A Đáp án: A
Câu 8 [237518]: Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước?
A, Ba.
B, Na.
C, K.
D, Be.
HD: các kim loại kiềm (như Na, K,...) và Ca, Ba, Sr phản ứng mãnh liệt với nước. Chỉ có Be không phản ứng với nước dù có đun nóng
⟹ Chọn đáp án D Đáp án: D
⟹ Chọn đáp án D Đáp án: D
Câu 9 [679784]: Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường?
A, Ag.
B, Na.
C, Mg.
D, Al.
HD: Bài học kim loại tác dụng với nước:

⇝ đáp án thoả mãn là B. 2Na + 2H2O → 2NaOH + H2↑. Đáp án: B

⇝ đáp án thoả mãn là B. 2Na + 2H2O → 2NaOH + H2↑. Đáp án: B
Câu 10 [679844]: Ở nhiệt độ thường, kim loại nào sau đây tan hết trong nước dư?
A, Ba.
B, Al.
C, Fe.
D, Cu.
HD: Bài học về kim loại tác dụng với nước:

⟹ Chọn đáp án A Ba: Ba + 2H2O → Ba(OH)2 + H2↑. Đáp án: A

⟹ Chọn đáp án A Ba: Ba + 2H2O → Ba(OH)2 + H2↑. Đáp án: A
Câu 11 [982278]: Kim loại nào sau đây tác dụng với H2O ở nhiệt độ thường?
A, Cu.
B, Au.
C, Ag.
D, Ba.
HD: Bài học về kim loại tác dụng với nước:

⟹ Chọn đáp án D. Ba. Phản ứng: Ba + 2H2O → Ba(OH)2 + H2↑. Đáp án: D

⟹ Chọn đáp án D. Ba. Phản ứng: Ba + 2H2O → Ba(OH)2 + H2↑. Đáp án: D
Câu 12 [560648]: Cho bảng thông tin sau:
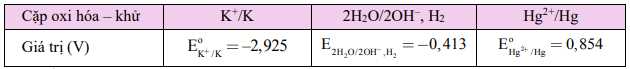
Phát biểu nào sau đây đúng?

Phát biểu nào sau đây đúng?
A, Kim loại Hg phản ứng được với nước tạo thành hydroxide và khí hydrogen.
B, Kim loại K phản ứng được với nước tạo thành hydroxide và khí hydrogen.
C, Ion K+ có tính khử lớn hơn ion Hg2+.
D, Kim loại Hg có tính khử lớn hơn kim loại K.
Vì giá trị thế điện chuẩn của K+/K âm hơn nước nên K có thể phản ứng với nước tạo thành hydroxide và khí hydrogen. Đáp án: B
Câu 13 [233233]: Kim loại nào sau đây không phản ứng được với dung dịch CuSO4?
A, Mg.
B, Fe.
C, Zn.
D, Ag.
HD: Theo dãy điện hóa: 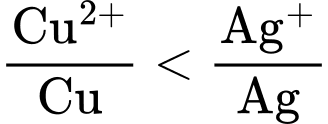 ⇒ Ag không phản ứng được với CuSO4
⇒ Ag không phản ứng được với CuSO4
⟹ Chọn đáp án D Đáp án: D
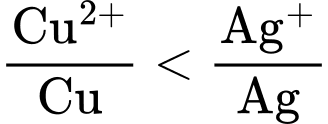 ⇒ Ag không phản ứng được với CuSO4
⇒ Ag không phản ứng được với CuSO4 ⟹ Chọn đáp án D Đáp án: D
Câu 14 [58051]: Cặp chất không xảy ra phản ứng hóa học là
A, Fe và dung dịch FeCl3.
B, Fe và dung dịch HCl.
C, Cu và dung dịch FeCl3.
D, Cu và dung dịch FeCl2.
Giải: Ta có dãy điện hóa:
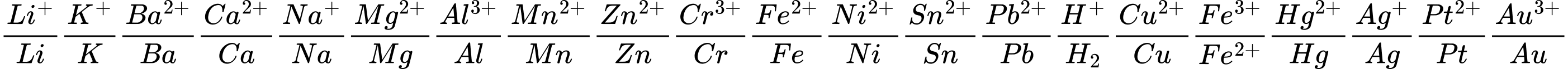
⇒ Cu không tác dụng với dung dịch muối Fe2+
⟹ Chọn đáp án D Đáp án: D
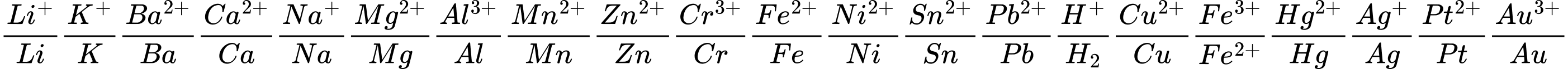
⇒ Cu không tác dụng với dung dịch muối Fe2+
⟹ Chọn đáp án D Đáp án: D
Câu 15 [58059]: Ở nhiệt độ thường, kim loại Al tác dụng được với dung dịch
A, Mg(NO3)2.
B, Ca(NO3)2.
C, KNO3.
D, Cu(NO3)2.
Ở nhiệt độ thường, Al đẩy được Cu ra khỏi dung dịch Cu(NO3)2
Al + Cu(NO3)2 ⟶ Al(NO3)3 + Cu.
⟹ Chọn đáp án D
Đáp án: D
Al + Cu(NO3)2 ⟶ Al(NO3)3 + Cu.
⟹ Chọn đáp án D
Đáp án: D
Câu 16 [39735]: Ở điều kiện thường, Fe không tác dụng với dung dịch (loãng) nào sau đây?
A, Fe2(SO4)3.
B, CuSO4.
C, K2SO4.
D, H2SO4.
Phân tích các đáp án:
✔️A. Fe + Fe2(SO4)3 → 3FeSO4.
✔️B. Fe + CuSO4 → FeSO4 + Cu.
❌C. Fe + K2SO4 → không phản ứng.
✔️D. Fe + H2SO4 → FeSO4 + H2.
⟹ Chọn đáp án C Đáp án: C
✔️A. Fe + Fe2(SO4)3 → 3FeSO4.
✔️B. Fe + CuSO4 → FeSO4 + Cu.
❌C. Fe + K2SO4 → không phản ứng.
✔️D. Fe + H2SO4 → FeSO4 + H2.
⟹ Chọn đáp án C Đáp án: C
Câu 17 [58052]: Ở nhiệt độ thường, dung dịch FeCl2 phản ứng được với kim loại
A, Zn.
B, Ag.
C, Cu.
D, Au.
HD: Thứ tự dãy điện hoá: 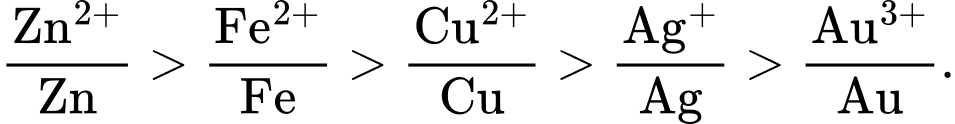
⇒ Theo quy tắc α thì chỉ có Zn tác dụng được với dung dịch FeCl2
Đáp án: A
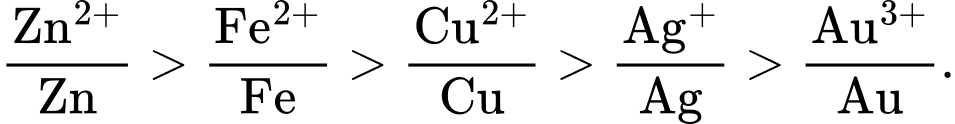
⇒ Theo quy tắc α thì chỉ có Zn tác dụng được với dung dịch FeCl2
⟹ Chọn đáp án A
Câu 18 [58063]: Kim loại nào sau đây không khử được ion Cu2+ trong dung dịch CuSO4 thành Cu?
A, Al.
B, Mg.
C, Fe.
D, K.
Tất cả các kim loại trong 4 đáp án đều có tính khử mạnh hơn Cu. Tuy nhiên, khi cho K vào dd CuSO4 thì:
2K + 2H2O → 2KOH + H2.
Sau đó: Cu2+ + 2OH– → Cu(OH)2.
⟹ Chọn đáp án D Đáp án: D
2K + 2H2O → 2KOH + H2.
Sau đó: Cu2+ + 2OH– → Cu(OH)2.
⟹ Chọn đáp án D Đáp án: D
Câu 19 [58071]: Dung dịch FeSO4 và dung dịch CuSO4 đều tác dụng được với
A, Ag.
B, Fe.
C, Cu.
D, Zn.
Phương trình phản ứng: Dung dịch CuSO4 và FeSO4 đều phản ứng được với Zn:
Zn + FeSO4 → ZnSO4 + Fe
Zn + CuSO4 → ZnSO4 + Cu.
⟹ Chọn đáp án D
Đáp án: D
Zn + FeSO4 → ZnSO4 + Fe
Zn + CuSO4 → ZnSO4 + Cu.
⟹ Chọn đáp án D
Đáp án: D
Câu 20 [62453]: Dung dịch FeSO4 có lẫn tạp chất là CuSO4. Để thu được FeSO4 tinh khiết ta dùng
A, bột Al dư.
B, bột Cu dư.
C, bột Fe dư.
D, bột Zn dư.
Nếu dùng Al hay Zn thì tạp chất CuSO4 mất đi nhưng thay vào đó là tạp chất Al2(SO4)3 hoặc ZnSO4.
+ Không dùng Cu vì Cu không tác dụng được với CuSO4 lẫn FeSO4.
⇒ Dùng Fe vì: Fe + CuSO4 → FeSO4 + Cu
⟹ Chọn đáp án C Đáp án: C
+ Không dùng Cu vì Cu không tác dụng được với CuSO4 lẫn FeSO4.
⇒ Dùng Fe vì: Fe + CuSO4 → FeSO4 + Cu
⟹ Chọn đáp án C Đáp án: C
Câu 21 [29888]: Để làm sạch dung dịch ZnSO4 có lẫn CuSO4, người ta dùng kim loại nào sau đây?
A, Al.
B, Cu.
C, Fe.
D, Zn.
Nhúng thanh kẽm vào hỗn hợp dung dịch chứa ZnSO4 có lẫn CuSO4
Zn+ CuSO4 → ZnSO4 + Cu
Lọc bỏ chất rắn Cu thu được dung dịch chứa ZnSO4
⟹ Chọn đáp án D
Đáp án: D
Zn+ CuSO4 → ZnSO4 + Cu
Lọc bỏ chất rắn Cu thu được dung dịch chứa ZnSO4
⟹ Chọn đáp án D
Đáp án: D
Câu 22 [62462]: Một kim loại dùng để loại bỏ tạp chất Fe2(SO4)3 trong dung dịch FeSO4 là
A, Fe.
B, Ag.
C, Cu.
D, Ba.
Phương trình phản ứng:
Fe + Fe2 (SO4)3 → 3FeSO4
Ag vào dung dịch chứa Fe2(SO4)3 và FeSO4 thì không xảy ra phản ứng → loại B
Cu vào dung dịch chứa Fe2(SO4)3 và FeSO4 thì 2Fe3+ + Cu → 2Fe2+ + Cu2+ vừa thu được FeSO4 và CuSO4 → loại C
Cho Ba vào dung dịch Fe2(SO4)3 và FeSO4 thu được Fe(OH)3 và Fe(OH)2. Loại D
⟹ Chọn đáp án A
Đáp án: A
Fe + Fe2 (SO4)3 → 3FeSO4
Ag vào dung dịch chứa Fe2(SO4)3 và FeSO4 thì không xảy ra phản ứng → loại B
Cu vào dung dịch chứa Fe2(SO4)3 và FeSO4 thì 2Fe3+ + Cu → 2Fe2+ + Cu2+ vừa thu được FeSO4 và CuSO4 → loại C
Cho Ba vào dung dịch Fe2(SO4)3 và FeSO4 thu được Fe(OH)3 và Fe(OH)2. Loại D
⟹ Chọn đáp án A
Đáp án: A
Câu 23 [560649]: Để làm tinh khiết bột đồng có lẫn các kim loại thiếc, kẽm, người ta có thể ngâm hỗn hợp trên vào lượng dư dung dịch nào sau đây?
A, Cu(NO3)2.
B, Zn(NO3)2.
C, Sn(NO3)2.
D, AgNO3.
Zn và Sn bị oxi hóa bởi cation của kim loại đứng sau nó trong dãy điện hóa
⇒ Chọn dung dịch Cu(NO3)2.
Mặc dù dung dịch AgNO3 cũng có thể hòa tan kim loại Zn và Sn lẫn trong bột đồng. Nhưng phản ứng này lại tạo ra kim loại Ag ⇒ không thu được đồng tinh khiết.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn dung dịch Cu(NO3)2.
Mặc dù dung dịch AgNO3 cũng có thể hòa tan kim loại Zn và Sn lẫn trong bột đồng. Nhưng phản ứng này lại tạo ra kim loại Ag ⇒ không thu được đồng tinh khiết.
⇒ Chọn đáp án A Đáp án: A
Câu 24 [30004]: Để làm sạch dung dịch copper(II) nitrate có lẫn tạp chất silver nitrate, người ta dùng lượng dư kim loại
A, Mg.
B, Cu.
C, Fe.
D, Au.
Đồng nitrat Cu(NO3)2, bạc nitrat AgNO3.
Mg, Fe phản ứng được với Cu(NO3)2 và AgNO3 ⇒ tuy loại được tạp chất AgNO3 nhưng Cu(NO3)2 cũng không còn.
Au không phản ứng với với Cu(NO3)2 và AgNO3.
Cu phản ứng với AgNO3: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
Như vậy, dung dịch AgNO3 không còn. Hơn nữa, sản phẩm tạo thành là Cu(NO3)2, không xuất hiện tạp chất mới.
⟹ Chọn đáp án B Đáp án: B
Mg, Fe phản ứng được với Cu(NO3)2 và AgNO3 ⇒ tuy loại được tạp chất AgNO3 nhưng Cu(NO3)2 cũng không còn.
Au không phản ứng với với Cu(NO3)2 và AgNO3.
Cu phản ứng với AgNO3: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
Như vậy, dung dịch AgNO3 không còn. Hơn nữa, sản phẩm tạo thành là Cu(NO3)2, không xuất hiện tạp chất mới.
⟹ Chọn đáp án B Đáp án: B
Câu 25 [679543]: Kim loại nào sau đây không tan được trong dung dịch HCl?
A, Al.
B, Ag.
C, Zn.
D, Mg.
HD: Dãy hoạt động kim loại: Mg > Al > Zn > (H)axit > Ag.
⇒ Ag không tan được trong dung dịch HCl. Đáp án: B
⇒ Ag không tan được trong dung dịch HCl. Đáp án: B
Câu 26 [233242]: Kim loại nào sau đây không phản ứng được với HCl trong dung dịch?
A, Ni.
B, Zn.
C, Fe.
D, Cu.
HD: Kim loại Cu đứng sau (H)axit trong dãy điện hóa nên không phản ứng được với HCl trong dung dịch
⟹ Chọn đáp án D Đáp án: D
⟹ Chọn đáp án D Đáp án: D
Câu 27 [233236]: Kim loại Fe tác dụng với dung dịch H2SO4 loãng sinh ra khí H2 và muối nào sau đây?
A, FeSO4.
B, FeS.
C, FeS2.
D, Fe2(SO4)3.
Kim loại Fe tác dụng với dung dịch H2SO4 loãng sinh ra khí H2 và muối FeSO4.
Phương trình phản ứng:
Fe + H2SO4 → FeSO4 + H2↑.
⟹ Chọn đáp án A Đáp án: A
Phương trình phản ứng:
Fe + H2SO4 → FeSO4 + H2↑.
⟹ Chọn đáp án A Đáp án: A
Câu 28 [57797]: Kim loại nào sau đây khi tác dụng với dung dịch H2SO4 loãng (không có mặt của oxi), khi kim loại tan hết trở thành một dung dịch trong suốt?
A, Mg.
B, Cu.
C, Ba.
D, Ag.
Khi không có mặt O2:
Mg + H2SO4 → MgSO4 + H2.
Ba + H2SO4 → BaSO4↓ + H2 (có kết tủa trắng).
Cu, Ag không tan trong H2SO4 loãng.
⟹ Chọn đáp án A Đáp án: A
Mg + H2SO4 → MgSO4 + H2.
Ba + H2SO4 → BaSO4↓ + H2 (có kết tủa trắng).
Cu, Ag không tan trong H2SO4 loãng.
⟹ Chọn đáp án A Đáp án: A
Câu 29 [57791]: Ở điều kiện thường, kim loại nào sau đây không khử được ion H+ trong dung dịch H2SO4 loãng?
A, Cu.
B, Mg.
C, Fe.
D, Al.
HD: Thứ tự các cặp oxi hoá - khử theo dãy điện hoá: 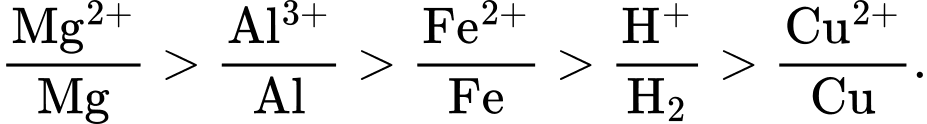
⇒ kim loại Cu không khử được ion H+ trong dung dịch H2SO4 loãng.
⟹ Chọn đáp án A Đáp án: A
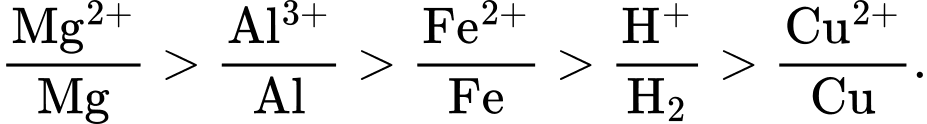
⇒ kim loại Cu không khử được ion H+ trong dung dịch H2SO4 loãng.
⟹ Chọn đáp án A Đáp án: A
Câu 30 [679247]: Cho Fe tác dụng với dung dịch HNO3 đặc, nóng, thu được khí X có màu nâu đỏ. Khí X là
A, N2.
B, N2O.
C, NO.
D, NO2.
Cho Fe tác dụng với dung dịch HNO3 đặc, nóng, thu được khí X có màu nâu đỏ.
Phương trình phản ứng:
Fe + 5HNO3 (đặc, nóng) Fe(NO3)3 + 3NO2↑ (khí màu nâu đỏ) + 3H2O.
Fe(NO3)3 + 3NO2↑ (khí màu nâu đỏ) + 3H2O.
Phương trình phản ứng:
Fe + 5HNO3 (đặc, nóng)
 Fe(NO3)3 + 3NO2↑ (khí màu nâu đỏ) + 3H2O.
Fe(NO3)3 + 3NO2↑ (khí màu nâu đỏ) + 3H2O.⟹ Khí X là NO2.
⟹ Chọn đáp án D
Đáp án: D ⟹ Chọn đáp án D
Câu 31 [983253]: Kim loại nào sau đây bị thụ động trong axit sunfuric đặc, nguội?
A, Cu.
B, Al.
C, Ag.
D, Mg.
HD: Các kim loại Al, Cr và Fe bị thụ động hoá trong dung dịch H2SO4 đặc nguội, HNO3 đặc nguội.
⟹ Chọn đáp án B
Đáp án: B
Câu 32 [560650]: Cho bảng thông tin sau:
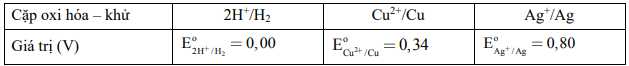
Phát biểu nào sau đây đúng?

Phát biểu nào sau đây đúng?
A, Cu phản ứng được với dung dịch acid HCl 1M.
B, Ag phản ứng được với dung dịch acid H2SO4 loãng 1M.
C, Cu và Ag đều không phản ứng với HCl.
D, Theo quy tắc alpha, Cu2+ phản ứng được với H2.
Dựa vào bảng, ta thấy EoCu2+/Cu và EoAg+/Ag đều dương hơn Eo2H+/H2
=> Cu và Ag đều không khử được H+ trong dung dịch HCl
=> C đúng Đáp án: C
=> Cu và Ag đều không khử được H+ trong dung dịch HCl
=> C đúng Đáp án: C
Câu 33 [560651]: Cho bảng thông tin sau:
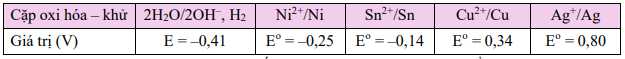
Dựa vào thông tin trong bảng hãy cho biết phương trình nào sau đây có thể xảy ra.
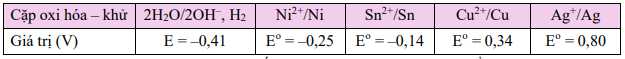
Dựa vào thông tin trong bảng hãy cho biết phương trình nào sau đây có thể xảy ra.
A, 2Ag(s) + Cu2+(aq)  Cu(s) + 2Ag+(aq).
Cu(s) + 2Ag+(aq).
 Cu(s) + 2Ag+(aq).
Cu(s) + 2Ag+(aq).B, Sn(s) + Cu2+(aq)  Cu(s) + Sn2+(aq).
Cu(s) + Sn2+(aq).
 Cu(s) + Sn2+(aq).
Cu(s) + Sn2+(aq).C, Ni(s) + H2O(l)  Ni(OH)2(s) + H2(g).
Ni(OH)2(s) + H2(g).
 Ni(OH)2(s) + H2(g).
Ni(OH)2(s) + H2(g).D, Cu(s) + Ni2+(aq)  Ni(s) + Cu2+(aq).
Ni(s) + Cu2+(aq).
 Ni(s) + Cu2+(aq).
Ni(s) + Cu2+(aq).
Vì giá trị thế điện chuẩn EoSn2+/Sn < EoCu2+/Cu nên Sn có thể khử được cation Cu2+ trong dung dịch.
Sn(s) + Cu2+(aq)  Cu(s) + Sn2+(aq).
Cu(s) + Sn2+(aq).
Đáp án: B  Cu(s) + Sn2+(aq).
Cu(s) + Sn2+(aq).
Câu 34 [560652]: Chọn phát biểu không đúng?
A, Kim loại càng hoạt động hoá học thì tính khử càng mạnh.
B, Những kim loại kém hoạt động hoá học (trơ) như vàng, platinum không thể hiện tính khử.
C, Kim loại mạnh có thể khử các kim loại yếu hơn trong dung dịch muối.
D, Kim loại bạc có tính khử yếu trong khi cation Ag+ có tính oxi hoá mạnh.
B. Sai vì tính chất hoá học cơ bản của kim loại là tính khử. Đáp án: B
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.
Câu 35 [560653]: Trong các phản ứng hóa học, các nguyên tử kim loại M dễ nhường electron theo sơ đồ: M(s) 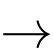 Mn+(aq) + ne.
Mn+(aq) + ne.
a. Tính chất hoá học đặc trưng của kim loại là tính khử.
b. Kim loại M càng dễ nhường electron thì tính khử càng mạnh.
c. Kim loại M có tính khử yếu thì ion Mn+ có tính oxi hóa yếu.
d. Kim loại M hoạt động càng mạnh thì giá trị thế điện cực chuẩn của cặp oxi hoá - khử Mn+ /M càng dương.
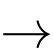 Mn+(aq) + ne.
Mn+(aq) + ne.a. Tính chất hoá học đặc trưng của kim loại là tính khử.
b. Kim loại M càng dễ nhường electron thì tính khử càng mạnh.
c. Kim loại M có tính khử yếu thì ion Mn+ có tính oxi hóa yếu.
d. Kim loại M hoạt động càng mạnh thì giá trị thế điện cực chuẩn của cặp oxi hoá - khử Mn+ /M càng dương.
Phân tích các phát biểu sau:
✔️ a. Đúng. Vì các nguyên tử kim loại dễ nhường electron trong các phản ứng hóa học nên tính chất đặc trưng của nó là tính khử.
✔️ b. Đúng. Kim loại M càng dễ nhường electron thì tính khử càng mạnh.
❌ c. Sai. Kim loại M có tính khử càng yếu thì dạng oxi hóa của nó là Mn+ có tính oxi hóa càng mạnh.
❌ d. Sai. Kim loại M hoạt động càng mạnh thì giá trị thế điện cực chuẩn của cặp oxi hoá - khử Mn+/M càng âm.
✔️ a. Đúng. Vì các nguyên tử kim loại dễ nhường electron trong các phản ứng hóa học nên tính chất đặc trưng của nó là tính khử.
✔️ b. Đúng. Kim loại M càng dễ nhường electron thì tính khử càng mạnh.
❌ c. Sai. Kim loại M có tính khử càng yếu thì dạng oxi hóa của nó là Mn+ có tính oxi hóa càng mạnh.
❌ d. Sai. Kim loại M hoạt động càng mạnh thì giá trị thế điện cực chuẩn của cặp oxi hoá - khử Mn+/M càng âm.
Câu 36 [560654]: Cho các cặp oxi hóa khử và các thế điện cực chuẩn như sau:

a. Ion X2+có tính oxi hóa mạnh nhất.
b. Chiều tăng dần tính khử của các kim loại là X > Z > Y.
c. Kim loại Y, Z có khả năng tham gia phản ứng với dung dịch HCl tạothành khí H2.
d. Trong dung dịch, ion X2+có thể oxi hóa kim loại Y thành ion Y2+.

a. Ion X2+có tính oxi hóa mạnh nhất.
b. Chiều tăng dần tính khử của các kim loại là X > Z > Y.
c. Kim loại Y, Z có khả năng tham gia phản ứng với dung dịch HCl tạothành khí H2.
d. Trong dung dịch, ion X2+có thể oxi hóa kim loại Y thành ion Y2+.
Phân tích các phát biểu sau:
✔️a. Đúng. Giá trị thế điện cực chuẩn của X2+/X lớn nhất nên tính khử của kim loại X yếu nhất và tính oxi hóa của X2+ mạnh nhất.
❌ b. Sai. Chiều tăng dần tính khử của kim loại là X < Z < Y.
✔️ c. Đúng. Ở điều kiện chuẩn, những kim loại có EoMn+/M có thể tác dụng với các dung dịch acid (như HCI, H2SO4) tạo thành H2.
✔️ d. Đúng. Vì giá trị thế điện cực chuẩn của X2+/X dương hơn nên ion X2+ có tính oxi hóa mạnh hơn ion Y2+ => có thể oxi hóa được kim loại Y thành ion Y2+.
✔️a. Đúng. Giá trị thế điện cực chuẩn của X2+/X lớn nhất nên tính khử của kim loại X yếu nhất và tính oxi hóa của X2+ mạnh nhất.
❌ b. Sai. Chiều tăng dần tính khử của kim loại là X < Z < Y.
✔️ c. Đúng. Ở điều kiện chuẩn, những kim loại có EoMn+/M có thể tác dụng với các dung dịch acid (như HCI, H2SO4) tạo thành H2.
✔️ d. Đúng. Vì giá trị thế điện cực chuẩn của X2+/X dương hơn nên ion X2+ có tính oxi hóa mạnh hơn ion Y2+ => có thể oxi hóa được kim loại Y thành ion Y2+.
Câu 37 [560655]: Tiến hành thí nghiệm theo trình tự sau:
Bước 1: Cho một mẩu magnesium đã đánh sạch bề mặt vào ống nghiệm (1).
Bước 2: Rót vào ống nghiệm (1) khoảng 3 – 4 mL dung dịch HCl.
Bước 3: Sau 2 phút, thêm 2 – 3 mL dung dịch NaOH vào ống nghiệm ở bước 2.
a. Sau bước 2 thấy có hiện tượng sủi bọt khí, không màu.
b. Sau bước 3 thấy xuất kiện kết tủa màu trắng, hơi xanh.
c. Nếu thay mẩu magnesium bằng mẩu copper thì hiện tượng quan sát
được ở bước 2 vẫn tương tự.
d. Nếu thay dung dịch NaOH bằng dung dịch KOH thì hiện tượng ở bước
3 không thay đổi.
Bước 1: Cho một mẩu magnesium đã đánh sạch bề mặt vào ống nghiệm (1).
Bước 2: Rót vào ống nghiệm (1) khoảng 3 – 4 mL dung dịch HCl.
Bước 3: Sau 2 phút, thêm 2 – 3 mL dung dịch NaOH vào ống nghiệm ở bước 2.
a. Sau bước 2 thấy có hiện tượng sủi bọt khí, không màu.
b. Sau bước 3 thấy xuất kiện kết tủa màu trắng, hơi xanh.
c. Nếu thay mẩu magnesium bằng mẩu copper thì hiện tượng quan sát
được ở bước 2 vẫn tương tự.
d. Nếu thay dung dịch NaOH bằng dung dịch KOH thì hiện tượng ở bước
3 không thay đổi.
Phân tích các phát biểu:
✔️ a. Đúng. Sau bước 2, thấy có hiện tượng sủi bọt khí, không màu vì xảy ra phản ứng:
✔️ a. Đúng. Sau bước 2, thấy có hiện tượng sủi bọt khí, không màu vì xảy ra phản ứng:
Mg + 2HCl ➝ MgCl2 + H2↑
✔️ b. Đúng. Sau bước 3 xuất hiện kết tủa trắng hơi xanh là Mg(OH)2.
❌ c. Sai. Copper không phản ứng với dung dịch HCl nên không có hiện tượng sủi bọt khí.
✔️ d. Đúng. Nếu thay dung dịch NaOH bằng dung dịch KOH thì vẫn thu được kết tủa trắng.
✔️ b. Đúng. Sau bước 3 xuất hiện kết tủa trắng hơi xanh là Mg(OH)2.
❌ c. Sai. Copper không phản ứng với dung dịch HCl nên không có hiện tượng sủi bọt khí.
✔️ d. Đúng. Nếu thay dung dịch NaOH bằng dung dịch KOH thì vẫn thu được kết tủa trắng.
Câu 38 [560656]: Lấy 3 ống nghiệm, cho vào mỗi ống 3 mL dung dịch HCl 1 M. Cho tiếp 3 mẫu kim loại Al, Fe, Cu có kích thước tương đương lần lượt vào 3 ống nghiệm được đánh số theo tứ tự (1), (2), (3) (mẩu Al đã được đánh sạch).
a. Cả 3 ống nghiệm đều có bọt khí xuất hiện.
b. Ống nghiệm số (2) khí thoát ra chậm hơn ống nghiệm số (1).
c. Nếu thay dung dịch HCl bằng dung dịch H2SO4 đặc, nóng thì hiện tượng xảy ra cả 3 ống nghiệm vẫn không đổi.
d. Ở điều kiện thường, thay dung dịch HCl bằng dung dịch HNO3 đặc thì ở ống nghiệm số (3) thoát ra khí Z có tỉ khối hơi so với H2 bằng 15.
a. Cả 3 ống nghiệm đều có bọt khí xuất hiện.
b. Ống nghiệm số (2) khí thoát ra chậm hơn ống nghiệm số (1).
c. Nếu thay dung dịch HCl bằng dung dịch H2SO4 đặc, nóng thì hiện tượng xảy ra cả 3 ống nghiệm vẫn không đổi.
d. Ở điều kiện thường, thay dung dịch HCl bằng dung dịch HNO3 đặc thì ở ống nghiệm số (3) thoát ra khí Z có tỉ khối hơi so với H2 bằng 15.
Phân tích các phát biểu sau:
❌ a. Sai. Ống nghiệm (3) không xuất hiện bọt khí vì Cu không phản ứng với dung dịch HCl.
✔️ b. Đúng. Do kim loại Al có tính khử mạnh hơn kim loại Fe.
❌ c. Sai. Cả 3 kim loại sẽ xảy ra phản ứng oxi hóa khử với dung dịch H2SO4 đặc, nóng tạo thành khí, Cu tan cho dung dịch màu xanh nên hiện tượng quan sát được sẽ thay đổi.
❌ d. Sai. Dung dịch HNO3 đặc nguội nên sản phẩm thu được là NO2, có tỉ khối hơi so với H2= 23.
❌ a. Sai. Ống nghiệm (3) không xuất hiện bọt khí vì Cu không phản ứng với dung dịch HCl.
✔️ b. Đúng. Do kim loại Al có tính khử mạnh hơn kim loại Fe.
❌ c. Sai. Cả 3 kim loại sẽ xảy ra phản ứng oxi hóa khử với dung dịch H2SO4 đặc, nóng tạo thành khí, Cu tan cho dung dịch màu xanh nên hiện tượng quan sát được sẽ thay đổi.
❌ d. Sai. Dung dịch HNO3 đặc nguội nên sản phẩm thu được là NO2, có tỉ khối hơi so với H2= 23.
Câu 39 [560657]: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy vào ống nghiệm thứ nhất 0,5 mL dung dịch HNO3 đặc (68%) và ống nghiệm thứ hai 0,5 mL dung dịch HNO3 15%.
Bước 2: Cho vào mỗi ống nghiệm một mảnh nhỏ đồng kim loại. Nút các ống nghiệm bằng bông tẩm dung dịch NaOH. Đun nhẹ ống nghiệm thứ hai.
Cho các phát biểu sau:
a. Ở hai ống nghiệm, mảnh đồng tan dần, dung dịch chuyển sang màu xanh.
b. Ở ống nghiệm thứ nhất, có khí màu nâu đỏ thoát ra khỏi dung dịch.
c. Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu ngoài không khí thoát ra khỏi dung dịch.
d. Có thể thay bông tẩm dung dịch NaOH bằng bông tẩm dung dịch NaCl
Bước 1: Lấy vào ống nghiệm thứ nhất 0,5 mL dung dịch HNO3 đặc (68%) và ống nghiệm thứ hai 0,5 mL dung dịch HNO3 15%.
Bước 2: Cho vào mỗi ống nghiệm một mảnh nhỏ đồng kim loại. Nút các ống nghiệm bằng bông tẩm dung dịch NaOH. Đun nhẹ ống nghiệm thứ hai.
Cho các phát biểu sau:
a. Ở hai ống nghiệm, mảnh đồng tan dần, dung dịch chuyển sang màu xanh.
b. Ở ống nghiệm thứ nhất, có khí màu nâu đỏ thoát ra khỏi dung dịch.
c. Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu ngoài không khí thoát ra khỏi dung dịch.
d. Có thể thay bông tẩm dung dịch NaOH bằng bông tẩm dung dịch NaCl
Phân tích các phát biểu sau:
✔️ a. Đúng. Ở 2 ống nghiệm, kim loại Cu tan ra tạo dung dịch màu xanh Cu(NO3)2.
✔️ b. Đúng. Ống nghiệm thứ nhất có chứa dung dịch HNO3 đặc, xảy ra phản ứng oxi hóa- khử tạo khí NO2 màu nâu đỏ.
❌ c. Sai. Ở ống nghiệm 2, xảy ra phương trình phản ứng tạo khí NO sinh ra hóa nâu trong không khí.
✔️ a. Đúng. Ở 2 ống nghiệm, kim loại Cu tan ra tạo dung dịch màu xanh Cu(NO3)2.
✔️ b. Đúng. Ống nghiệm thứ nhất có chứa dung dịch HNO3 đặc, xảy ra phản ứng oxi hóa- khử tạo khí NO2 màu nâu đỏ.
❌ c. Sai. Ở ống nghiệm 2, xảy ra phương trình phản ứng tạo khí NO sinh ra hóa nâu trong không khí.
Cu + 4HNO3 ➝ Cu(NO3)2 + NO⬆ + 2H2O
❌ d. Sai. Bông tẩm NaOH có vai trò hạn chế khí độc NO2 thoát ra do phản ứng:
NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
=> NO2 không tham gia phản ứng với dung dịch NaCl nên không thể thay bông tẩm dung dịch NaOH bằng bông tẩm dung dịch NaCl.
Câu 40 [560658]: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy 2 ống nghiệm, cho vào ống nghiệm số 1 dung dịch sulfuric acid loãng và ống nghiệm số 2 thêm vào dung dịch sulfuric acid đặc.
Bước 2: Thêm vào mỗi ống nghiệm một lá đồng. Đậy mỗi ống nghiệm bằng bông tẩm nước.
Bước 3: Đun hai ống nghiệm trên ngọn lửa đèn cồn.
Bước 4: Sau một thời gian, dùng mẩu giấy quỳ kiểm tra pH của bông tẩm nước đã dùng để nút hai ống nghiệm trên.
Chú ý: Cẩn thận khi sử dụng dung dịch sulfuric acid đặc
a. Sau bước 3, ống nghiệm số 2 xuất hiện dung dịch có màu xanh.
b. Sau bước 3, thấy lá đồng ở cả hai ống nghiệm tan dần, xuất hiện bọt khí.
c. Sau bước 4, màu giấy quỳ chuyển sang màu hồng ở ống nghiệm số 2.
d. Ở ống nghiệm 2, kim loại đồng đã bị khử bởi dung dịch H2SO4 đặc, nóng.
Bước 1: Lấy 2 ống nghiệm, cho vào ống nghiệm số 1 dung dịch sulfuric acid loãng và ống nghiệm số 2 thêm vào dung dịch sulfuric acid đặc.
Bước 2: Thêm vào mỗi ống nghiệm một lá đồng. Đậy mỗi ống nghiệm bằng bông tẩm nước.
Bước 3: Đun hai ống nghiệm trên ngọn lửa đèn cồn.
Bước 4: Sau một thời gian, dùng mẩu giấy quỳ kiểm tra pH của bông tẩm nước đã dùng để nút hai ống nghiệm trên.
Chú ý: Cẩn thận khi sử dụng dung dịch sulfuric acid đặc
a. Sau bước 3, ống nghiệm số 2 xuất hiện dung dịch có màu xanh.
b. Sau bước 3, thấy lá đồng ở cả hai ống nghiệm tan dần, xuất hiện bọt khí.
c. Sau bước 4, màu giấy quỳ chuyển sang màu hồng ở ống nghiệm số 2.
d. Ở ống nghiệm 2, kim loại đồng đã bị khử bởi dung dịch H2SO4 đặc, nóng.
Phân tích các phát biểu sau:
✔️ a. Đúng. Ống nghiệm thứ 2 chứa Cu tác dụng với sulfuric acid đặc nên xuất hiện dung dịch có màu xanh lam CuSO4.
❌ b. Sai. Cu không tan được trong dung dịch sulfuric acid loãng nên ống nghiệm thứ nhất đồng không tan, không xuất hiện bọt khí.
✔️ c. Đúng. Do ống nghiệm 2 sinh ra khí SO2 nên bông tẩm nước sẽ tạo dung dịch acid yếu (H2SO3) làm quỳ tím chuyển hồng.
❌ d. Sai. Kim loại đồng bị oxi hóa bởi dung dịch H2SO4 đặc, nóng.
✔️ a. Đúng. Ống nghiệm thứ 2 chứa Cu tác dụng với sulfuric acid đặc nên xuất hiện dung dịch có màu xanh lam CuSO4.
❌ b. Sai. Cu không tan được trong dung dịch sulfuric acid loãng nên ống nghiệm thứ nhất đồng không tan, không xuất hiện bọt khí.
✔️ c. Đúng. Do ống nghiệm 2 sinh ra khí SO2 nên bông tẩm nước sẽ tạo dung dịch acid yếu (H2SO3) làm quỳ tím chuyển hồng.
❌ d. Sai. Kim loại đồng bị oxi hóa bởi dung dịch H2SO4 đặc, nóng.
Câu 41 [560659]: Thả một đinh sắt nặng m1 gam đã được đánh sạch bề mặt vào cốc chứa dung dịch copper(II) sulfate màu xanh. Sau một thời gian thấy toàn bộ lượng đồng sinh ra đã bám vào đinh sắt. Lấy đinh sắt ra khỏi cốc, sấy khô, đem cân được m2 gam.
a. Phản ứng diễn ra là: 2Fe(s) + 3Cu2+ (aq) → 2Fe3+ (aq) + 3Cu(s).
b. Màu xanh của dung dịch copper(II) sulfate nhạt dần.
c. So sánh, thu được kết quả là m2 < m1.
d. Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch không thay đổi.
a. Phản ứng diễn ra là: 2Fe(s) + 3Cu2+ (aq) → 2Fe3+ (aq) + 3Cu(s).
b. Màu xanh của dung dịch copper(II) sulfate nhạt dần.
c. So sánh, thu được kết quả là m2 < m1.
d. Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch không thay đổi.
Phân tích các phát biểu sau:
❌ a. Sai. Fe bị oxi hóa thành ion Fe2+, không phải tạo thành Fe3+.
✔️ b. Đúng. Màu xanh nhạt dần vì copper(II) sulfate phản ứng hết với đinh sắt.
❌ c. Sai. Kết quả thu được m2 > m1 vì khối lượng mol của Cu lớn hơn Fe nên lượng Cu bám vào sẽ làm đinh sắt tăng khối lượng.
❌ d. Sai. Copper(II) sulfate cũng bị khử bởi kim loại Zn nên màu xanh dung dịch nhạt dần.
❌ a. Sai. Fe bị oxi hóa thành ion Fe2+, không phải tạo thành Fe3+.
✔️ b. Đúng. Màu xanh nhạt dần vì copper(II) sulfate phản ứng hết với đinh sắt.
❌ c. Sai. Kết quả thu được m2 > m1 vì khối lượng mol của Cu lớn hơn Fe nên lượng Cu bám vào sẽ làm đinh sắt tăng khối lượng.
❌ d. Sai. Copper(II) sulfate cũng bị khử bởi kim loại Zn nên màu xanh dung dịch nhạt dần.
Câu 42 [560660]: Cho một ít bột nhôm vào muỗng đốt hoá chất rồi đốt trên ngọn lửa đèn cồn. Khi một phần bột nhôm trong muỗng cháy đỏ thì đưa nhanh muỗng vào bình chứa oxygen dư. Bột nhôm cháy nhanh và phát ra ánh sáng màu trắng rất mạnh, tạo thành hợp chất A.
a. Nhôm bị khử tạo thành hợp chất A.
b. Số oxi hoá của nhôm trong hợp chất A là +3.
c. Biến thiên enthalpy chuẩn của phản ứng giữa nhôm và oxygen có giá trịâm ( ∆rH0298 < 0).
d. Phản ứng trên liên quan đến 2 cặp oxi hoá - khử là Al3+/Al và O2/2O2–
a. Nhôm bị khử tạo thành hợp chất A.
b. Số oxi hoá của nhôm trong hợp chất A là +3.
c. Biến thiên enthalpy chuẩn của phản ứng giữa nhôm và oxygen có giá trịâm ( ∆rH0298 < 0).
d. Phản ứng trên liên quan đến 2 cặp oxi hoá - khử là Al3+/Al và O2/2O2–
Phân tích các phát biểu sau:
❌ a. Sai. Nhôm bị oxi hóa tạo thành hợp chất A.
✔️ b. Đúng. Số oxi hóa của nhôm trong hợp chất A là +3.
✔️ c. Đúng. Do phản ứng cháy của Al trong bình chứa khí oxygen là phản ứng tỏa nhiệt nên biến thiên enthalpy chuẩn có giá trị âm.
✔️ d. Đúng. Phản ứng trên liên quan đến 2 cặp oxi hóa- khử là Al3+/Al và O2/2O2-.
❌ a. Sai. Nhôm bị oxi hóa tạo thành hợp chất A.
✔️ b. Đúng. Số oxi hóa của nhôm trong hợp chất A là +3.
✔️ c. Đúng. Do phản ứng cháy của Al trong bình chứa khí oxygen là phản ứng tỏa nhiệt nên biến thiên enthalpy chuẩn có giá trị âm.
✔️ d. Đúng. Phản ứng trên liên quan đến 2 cặp oxi hóa- khử là Al3+/Al và O2/2O2-.
Câu 43 [560661]: Cho 3 thí nghiệm sau:
• Thí nghiệm 1: Cho một mẩu sodium vào nước đã thêm vài giọt dung dịch phenolphthalein.
• Thí nghiệm 2: Cho một mẩu kẽm vào dung dịch hydrochloric acid loãng.
• Thí nghiệm 3: Cho một mẩu đồng vào dung dịch sulfuric acid đặc.
a. Các kim loại bị oxi hoá trong cả ba thí nghiệm trên.
b. Cả ba dung dịch đều đổi màu trong quá trình phản ứng.
c. Thí nghiệm 3 có sinh ra khí Z. Tỉ khối hơi của khí Z so với khí X thoát ra ở thí nghiệm 1 là 32.
d. Tổng hệ số tối giản của các chất trong phương trình hoá học ở thí nghiệm 3 là 6.
• Thí nghiệm 1: Cho một mẩu sodium vào nước đã thêm vài giọt dung dịch phenolphthalein.
• Thí nghiệm 2: Cho một mẩu kẽm vào dung dịch hydrochloric acid loãng.
• Thí nghiệm 3: Cho một mẩu đồng vào dung dịch sulfuric acid đặc.
a. Các kim loại bị oxi hoá trong cả ba thí nghiệm trên.
b. Cả ba dung dịch đều đổi màu trong quá trình phản ứng.
c. Thí nghiệm 3 có sinh ra khí Z. Tỉ khối hơi của khí Z so với khí X thoát ra ở thí nghiệm 1 là 32.
d. Tổng hệ số tối giản của các chất trong phương trình hoá học ở thí nghiệm 3 là 6.
Phân tích các phát biểu sau:
✔️ a. Đúng. Cả 3 kim loại đều bị oxi hóa trong cả 3 thí nghiệm trên.
❌ b. Sai. Dung dịch ở thí nghiệm 2 không bị đổi màu, chỉ có hiện tượng là mẩu kẽm tan ra, sủi bọt khí không màu.
✔️ c. Đúng. Thí nghiệm 3 sinh ra khí SO2 (Z), thí nghiệm 1 sinh ra khí H2 (X) => Tỉ khối hơi của khí Z so với khí X là 64/2 = 32.
❌ d. Sai. Phương trình hóa học ở thí nghiệm 3:
✔️ a. Đúng. Cả 3 kim loại đều bị oxi hóa trong cả 3 thí nghiệm trên.
❌ b. Sai. Dung dịch ở thí nghiệm 2 không bị đổi màu, chỉ có hiện tượng là mẩu kẽm tan ra, sủi bọt khí không màu.
✔️ c. Đúng. Thí nghiệm 3 sinh ra khí SO2 (Z), thí nghiệm 1 sinh ra khí H2 (X) => Tỉ khối hơi của khí Z so với khí X là 64/2 = 32.
❌ d. Sai. Phương trình hóa học ở thí nghiệm 3:
Cu + 2H2SO4 ➝ CuSO4 + SO2 + 2H2O => Tổng hệ số tối giản là 7.
Câu 44 [560662]: Ở môi trường trung tính, quá trình 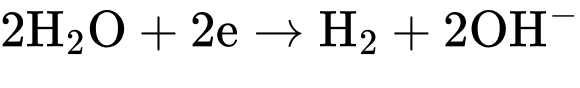 có giá trị
có giá trị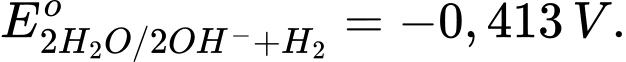
a. Những kim loại M có thế điện cực chuẩn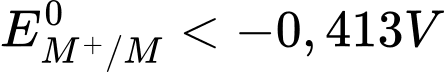 đều khử
đều khử
được nước.
b. Sodium khử được nước theo phương trình hoá học: 2Na + 2H2O → 2NaOH + H2 nên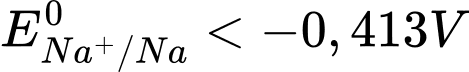
.
c. Nước đóng vai trò là chất khử khi phản ứng với kim loại M (như Na,
K) có thế điện cực chuẩn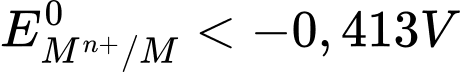 .
.
d. Khí hydrogen là sản phẩm khử của nước khi nước phản ứng với kim
loại mạnh như Na, K.
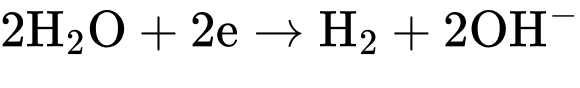 có giá trị
có giá trị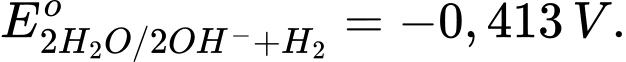
a. Những kim loại M có thế điện cực chuẩn
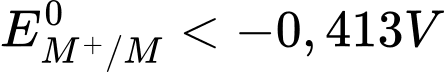 đều khử
đều khửđược nước.
b. Sodium khử được nước theo phương trình hoá học: 2Na + 2H2O → 2NaOH + H2 nên
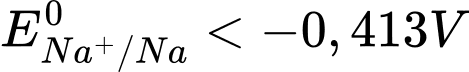
.
c. Nước đóng vai trò là chất khử khi phản ứng với kim loại M (như Na,
K) có thế điện cực chuẩn
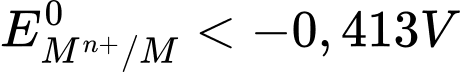 .
.d. Khí hydrogen là sản phẩm khử của nước khi nước phản ứng với kim
loại mạnh như Na, K.
Phân tích các phát biểu sau:
✔️ a. Đúng. Nhiều kim loại có thế điện cực chuẩn EoMn+/M < H2O nên kim loại M sẽ dễ dàng khử nước để tạo hydro vì thế khử của kim loại M mạnh hơn phản ứng khử của nước.
✔️ b. Đúng. Sodium (Na) khử được nước nên EoNan+/Na < -0,413V.
❌ c. Sai. Vì trong phản ứng với H2O, H2O đóng vai trò là chất oxi hóa, kim loại đóng vai trò là chất khử.
✔️ d. Đúng. Khí hydrogen là sản phẩm khử của nước khi nước phản ứng với kim loại mạnh như Na, K.
✔️ a. Đúng. Nhiều kim loại có thế điện cực chuẩn EoMn+/M < H2O nên kim loại M sẽ dễ dàng khử nước để tạo hydro vì thế khử của kim loại M mạnh hơn phản ứng khử của nước.
✔️ b. Đúng. Sodium (Na) khử được nước nên EoNan+/Na < -0,413V.
❌ c. Sai. Vì trong phản ứng với H2O, H2O đóng vai trò là chất oxi hóa, kim loại đóng vai trò là chất khử.
✔️ d. Đúng. Khí hydrogen là sản phẩm khử của nước khi nước phản ứng với kim loại mạnh như Na, K.
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
Câu 45 [560663]: Cho các kim loại: Zn, Ag, Fe, Mg lần lượt vào dung dịch CuSO4. Có bao nhiêu kim loại xảy ra phản ứng?
Điền đáp án: ..........
Điền đáp án: ..........
Các kim loại khử được ion Cu2+ trong dung dịch CuSO4 là Zn, Fe, Mg.
=> Điền đáp án: 3
=> Điền đáp án: 3
Câu 46 [560664]: Cho các kim loại Na, Fe, Mg, Zn, Cu lần lượt phản ứng với dung dịch AgNO3. Số trường hợp phản ứng tạo ra kim loại là
Điền đáp án: ..........
Điền đáp án: ..........
Các trường hợp phản ứng với dung dịch AgNO3 thành kim loại trong dung dịch là Fe, Mg, Zn, Cu.
=> Điền đáp án: 4
=> Điền đáp án: 4
Câu 47 [560665]: Cho đinh sắt đã được đánh sạch bề mặt vào dung dịch của một trong các muối sau (có nồng độ 1 M): aluminium chloride, zinc nitrate, copper(II) sulfate, lead(II) nitrate.Số trường hợp có phản ứng tạo thành kim loại là
Điền đáp án: ..........
Điền đáp án: ..........
Các trường hợp có phản ứng tạo thành kim loại là:
Fe + CuSO4 ➝ FeSO4 + Cu
Fe + Pb(NO3)2 ➝ Fe(NO3)2 + Pb
=> Điền đáp án: 2
Câu 48 [560666]: Cho thế điện cực chuẩn của một số cặp oxi hóa khử dưới đây:
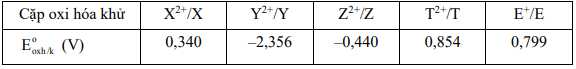
Có bao nhiêu kim loại tham gia phản ứng với dung dịch H2SO4 loãng giải phóng khí H2?
Điền đáp án: ..........

Có bao nhiêu kim loại tham gia phản ứng với dung dịch H2SO4 loãng giải phóng khí H2?
Điền đáp án: ..........
Do Eo2H+/H2 = 0 V nên kim loại M có giá trị thế điện cực chuẩn EoMn+/M2 < 0 có thể khử được ion H+ trong dung dịch H2SO4 loãng tạo thành khí H2
=> Có 2 kim loại Y và Z thỏa mãn
=> Điền đáp án: 2
=> Có 2 kim loại Y và Z thỏa mãn
=> Điền đáp án: 2
Câu 49 [560667]: Cho kim loại Fe lần lượt phản ứng với các dung dịch: HCl, H2SO4 (đặc, nguội), FeCl3, Cu(NO3)2, AgNO3, MgCl2. Số trường hợp xảy ra phản ứng hóa học là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
Các chất xảy ra phản ứng với Fe là HCl, FeCl3, Cu(NO3)2, AgNO3.
=> Điền đáp án: 4
=> Điền đáp án: 4
Câu 50 [560668]: Cho dãy các kim loại: Zn, Ag, Fe, Mg, Pt. Có bao nhiêu kim loại vừa tham gia phản ứng với dung dịch HCl, vừa tham gia phản ứng với dung dịch Cu(NO3)2?
Điền đáp án: ..........
Điền đáp án: ..........
- Các kim loại phản ứng với dung dịch HCl: Zn, Fe, Mg (đứng trước H+ trong dãy hoạt động hóa học.
- Các kim loại phản ứng với dung dịch Cu(NO3)2: Zn, Fe, Mg.
=> Zn, Fe, Mg vừa phản ứng với dung dịch HCl, vừa tham gia phản ứng với dung dịch Cu(NO3)2.
=> Điền đáp án: 3
- Các kim loại phản ứng với dung dịch Cu(NO3)2: Zn, Fe, Mg.
=> Zn, Fe, Mg vừa phản ứng với dung dịch HCl, vừa tham gia phản ứng với dung dịch Cu(NO3)2.
=> Điền đáp án: 3
Câu 51 [560669]: Tiến hành các thí nghiệm sau:
(a) Cho sợi Mg vào lượng dư dung dịch Fe2(SO4)3 loãng.
(b) Nhúng thanh Zn vào dung dịch CuSO4.
(c) Cho mẩu Cu vào dung dịch HCl.
(d) Cho magnesium trong ngọn lửa đèn cồn.
(đ) Cho mẩu Cu vào dung dịch iron (II) sulfate.
Có bao nhiêu trường hợp xảy ra phản ứng hóa học?
Điền đáp án: ..........
(a) Cho sợi Mg vào lượng dư dung dịch Fe2(SO4)3 loãng.
(b) Nhúng thanh Zn vào dung dịch CuSO4.
(c) Cho mẩu Cu vào dung dịch HCl.
(d) Cho magnesium trong ngọn lửa đèn cồn.
(đ) Cho mẩu Cu vào dung dịch iron (II) sulfate.
Có bao nhiêu trường hợp xảy ra phản ứng hóa học?
Điền đáp án: ..........
Các trường hợp xảy ra phản ứng hóa học là (a), (b), (d).
(a) Cho sợi Mg vào lượng dư dung dịch Fe2(SO4)3 loãng.
Mg + Fe2(SO4)3 ⟶ MgSO4 + Fe
(b) Nhúng thanh Zn vào dung dịch CuSO4.
Zn + CuSO4 ⟶ ZnSO4 + Cu
(c) Cho mẩu Cu vào dung dịch HCl.
⟶ Không phản ứng vì Cu đứng sau H trong dãy hoạt động hoá học.
(d) Cho magnesium trong ngọn lửa đèn cồn.
Mg + O2 ⟶ MgO
(đ) Cho mẩu Cu vào dung dịch iron (II) sulfate.
⟶ Không phản ứng vì Cu đứng sau Fe trong dãy hoạt động hoá học, yếu hơn Fe
=> Điền đáp án: 3
(a) Cho sợi Mg vào lượng dư dung dịch Fe2(SO4)3 loãng.
Mg + Fe2(SO4)3 ⟶ MgSO4 + Fe
(b) Nhúng thanh Zn vào dung dịch CuSO4.
Zn + CuSO4 ⟶ ZnSO4 + Cu
(c) Cho mẩu Cu vào dung dịch HCl.
⟶ Không phản ứng vì Cu đứng sau H trong dãy hoạt động hoá học.
(d) Cho magnesium trong ngọn lửa đèn cồn.
Mg + O2 ⟶ MgO
(đ) Cho mẩu Cu vào dung dịch iron (II) sulfate.
⟶ Không phản ứng vì Cu đứng sau Fe trong dãy hoạt động hoá học, yếu hơn Fe
=> Điền đáp án: 3
Câu 52 [560670]: Ngâm một lá kẽm trong 200 mL dung dịch AgNO3 0,1 M. Giả sử toàn bộ lượng kim loại Ag sinh ra đều bám hết vào lá kẽm. Khi phản ứng kết thúc, nhấc lá kẽm ra, làm khô, khối lượng lá kẽm tăng thêm bao nhiêu gam? (Làm tròn đến hai chữ số thập phân).
Điền đáp án: ..........
Điền đáp án: ..........
Phương trình hóa học của phản ứng:
Khối lượng lá kẽm tăng lên: mtăng= mAg sinh ra - mZn tan = 2,16 - 0,65= 1,51 gam
=> Điền đáp án: 1,51
Zn + 2AgNO3 ➝ Zn(NO3)2 + 2Ag
=> nZn tan= 0,02/2 = 0,01 ➝ mZn= 0,01 . 65 = 0,65 gam.Ta có: nAgNO3= 0,2.0,1 = 0,02 (mol) ➝ nAg= 0,02 (mol) ➝ mAg= 0,02.108 = 2,16 (g)
Khối lượng lá kẽm tăng lên: mtăng= mAg sinh ra - mZn tan = 2,16 - 0,65= 1,51 gam
=> Điền đáp án: 1,51
Câu 53 [560671]: Đốt cháy 5,4 gam kim loại M (có hóa trị không đổi) trong 0,1 mol khí O2 đến phản ứng hoàn toàn được chất rắn X. Hòa tan hết X trong dung dịch HCl dư thu được 0,1 mol khí H2. Nguyên tử khối của kim loại M là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
- Gọi hóa trị của M là n.
- Vì chất rắn X tan trong dung dịch HCl dư thu được 0,1 mol khí H2 nên trong X có kim loại M còn dư.
4M + nO2 ➝ 2M2On
2M + 2nHCl ➝ 2MCln + nH2
M2On + 2nHCl ➝ 2MCln + nH2O
➝ Từ nO2= 0,1 => nM =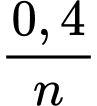
nH2 = 0,1 => nM =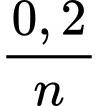
=> Số mol kim loại đã phản ứng: n =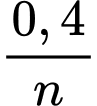 +
+ 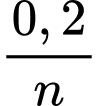 =
= 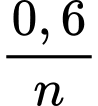 =
= 
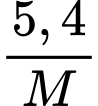
=>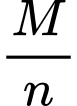 =
= 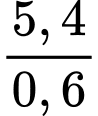 = 9
= 9
- Xét các giá trị n=1; n=2; n=3 ➝ M=27 (n=3) là aluminium.
=> Điền đáp án: 27
- Vì chất rắn X tan trong dung dịch HCl dư thu được 0,1 mol khí H2 nên trong X có kim loại M còn dư.
4M + nO2 ➝ 2M2On
2M + 2nHCl ➝ 2MCln + nH2
M2On + 2nHCl ➝ 2MCln + nH2O
➝ Từ nO2= 0,1 => nM =
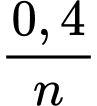
nH2 = 0,1 => nM =
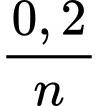
=> Số mol kim loại đã phản ứng: n =
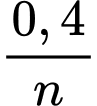 +
+ 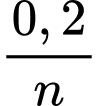 =
= 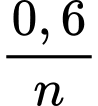 =
= 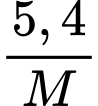
=>
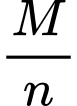 =
= 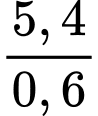 = 9
= 9 - Xét các giá trị n=1; n=2; n=3 ➝ M=27 (n=3) là aluminium.
=> Điền đáp án: 27
Câu 54 [560672]: A là kim loại khá hoạt động. Chất B là hoá chất thông dụng, chỉ chứa ba nguyên tố K, O và A (trong đó % theo khối lượng của K, O lần lượt là 40,27% và 32,96%). Nhỏ dung dịch HCl đến dư vào dung dịch chất B thì dung dịch đổi màu. Khối lượng phân tử B là
Điền đáp án: ..........
Điền đáp án: ..........
%A = 26,77%, gọi x là hóa trị của A, bảo toàn điện tích trong chất B ta có:
=>
=> A = 8,67.x
=> x= 6 thì A= 52 (Chromium)
Tỉ lệ các nguyên tử trong B là: K : O : Cr =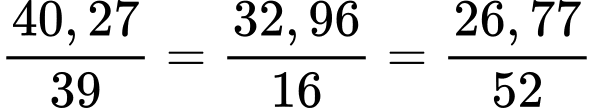
=> K : O : Cr = 1 : 2 : 0,5 = 2 : 4 : 1
=> B có công thức là K2CrO4
=> Khối lượng phân tử là 194
=> Điền đáp án: 194
=>
=> A = 8,67.x
=> x= 6 thì A= 52 (Chromium)
Tỉ lệ các nguyên tử trong B là: K : O : Cr =
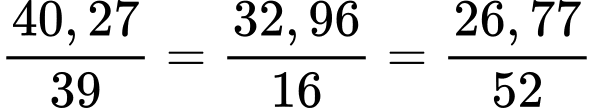
=> K : O : Cr = 1 : 2 : 0,5 = 2 : 4 : 1
=> B có công thức là K2CrO4
=> Khối lượng phân tử là 194
=> Điền đáp án: 194
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó
PHẢN ỨNG GIỮA KIM LOẠI VÀ NITRIC ACID
Một sinh viên muốn tìm hiểu bản chất của phản ứng hóa học giữa kim loại và nitric acid (HNO3). Bạn sinh viên đã tiến hành hai thí nghiệm với các điều kiện khác nhau giữa mỗi thí nghiệm.♦ Thí nghiệm 1
Trong thí nghiệm đầu tiên, bạn sinh viên đã tiến hành phản ứng hóa học giữa một mẫu nitric acid và một đồng xu. Bạn chọn nitric acid vì nó được biết đến là một acid mạnh, có khả năng phản ứng oxy hóa với nhiều chất. Đồng xu có thành phần chính là kim loại đồng (Cu), một kim loại ổn định có khả năng chống lại quá trình oxy hóa, còn lại là phần tạp chất trơ. Một phản ứng xảy ra sau đó.
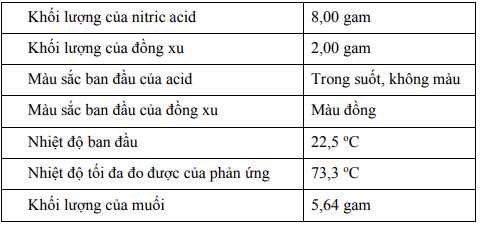
Những hiện tượng quan sát được về các sản phẩm bao gồm: Một dung dịch màu xanh đậm, một chất khí màu nâu đỏ (có mùi ngột ngạt) được hình thành và đồng xu đã biến mất.
♦ Thí nghiệm 2
Thí nghiệm này sử dụng cùng một lượng nitric acid, nhưng đồng xu này lại có thành phần chính là kim loại bạc (Ag), còn lại là phần tạp chất trơ.
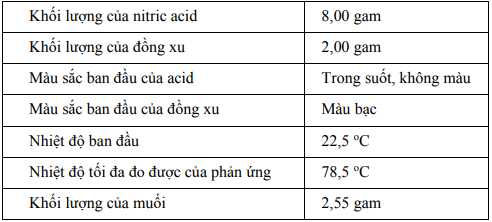
Những hiện tượng quan sát được về các sản phẩm bao gồm: Một dung dịch không màu, một chất khí màu nâu đỏ (có mùi ngột ngạt) được hình thành và đồng xu đã biến mất.
Câu 55 [560673]: Quan sát thí nghiệm 1 và 2, phát biểu nào sau đây là đúng?
A, Thay đổi kim loại thì phản ứng sẽ tạo ra khí khác nhau.
B, Chọn một đồng xu có màu khác thì khí tạo thành sẽ khác nhau.
C, Hai phản ứng đều tạo thành cùng một khí.
D, Tăng khối lượng acid thì khối lượng muối thu được sẽ nhiều hơn.
❌A. Thay đổi kim loại thì phản ứng sẽ tạo ra cùng 1 khí là sản phẩm khử của HNO3.
❌B. Chọn một đồng xu có màu khác thì khí tạo thành vẫn là sản phẩm khử của HNO3 ( NO2,..) không đổi màu khí.
✔️C. Hai phản ứng đều tạo thành cùng một khí là NO2.
❌D. Tăng khối lượng acid thì acid dư sẽ nhiều hơn, yếu tố thay đổi khối lượng muối là lượng kim loại cho vào ban đầu.
=>Chọn đáp án C
Đáp án: C
❌B. Chọn một đồng xu có màu khác thì khí tạo thành vẫn là sản phẩm khử của HNO3 ( NO2,..) không đổi màu khí.
✔️C. Hai phản ứng đều tạo thành cùng một khí là NO2.
❌D. Tăng khối lượng acid thì acid dư sẽ nhiều hơn, yếu tố thay đổi khối lượng muối là lượng kim loại cho vào ban đầu.
=>Chọn đáp án C
Đáp án: C
Câu 56 [560674]: Dựa trên dữ liệu được trình bày trong thí nghiệm 1 và 2, khí sinh ra rất có thể
A, CuO.
B, H2O.
C, NO2.
D, SO2.
Khí sinh ra là sản phẩm khử của HNO3, có thể là NO2, NO, N2,....
Hiện tượng quan sát được về các sản phẩm có một chất khí màu nâu đỏ (có mùi
ngột ngạt) được hình thành => khí NO2
Câu 57 [560675]: Trong thí nghiệm 2, kim loại bạc chiếm bao nhiêu phần trăm khối lượng trong đồng xu?
A, 96,00 %.
B, 94,26 %.
C, 89,25 %.
D, 81,00 %.
mmuối= 2,55 gam => nAgNO3 = 2,55/ 170 = 0,015 (mol)
Bảo toàn nguyên tố: nAg = nAgNO3 = 0,015
=> mAg = 0,015 . 108 = 1,62 gam
=> %Ag = 1,62/2 .100% = 81%
=> Chọn D Đáp án: D
Bảo toàn nguyên tố: nAg = nAgNO3 = 0,015
=> mAg = 0,015 . 108 = 1,62 gam
=> %Ag = 1,62/2 .100% = 81%
=> Chọn D Đáp án: D
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 58 đến 60
NHÔM
Nhôm là nguyên tố phổ biến thứ ba (sau oxygen và silicon), và là kim loại phổ biến nhất trong vỏ Trái Đất. Nhôm nằm ở ô 13 trong hệ thống bảng tuần hoàn các nguyên tố.
Câu 58 [560676]: Ở trạng thái cơ bản, cấu hình electron nguyên tử của nguyên tố nhôm là
A, 1s22s22p63s1.
B, 1s22s22p63s23p4.
C, 1s22s22p63s23p1.
D, 1s22s22p23p24p25p1.
Nhôm có số hiệu nguyên tử là 13, nên có 13 electron.
Cấu hình electron của Nhôm trong trạng thái cơ bản là:
1s2 2s2 2p6 3s2 3p1
=> Chọn đáp án C Đáp án: C
Cấu hình electron của Nhôm trong trạng thái cơ bản là:
1s2 2s2 2p6 3s2 3p1
=> Chọn đáp án C Đáp án: C
Câu 59 [560677]: Phát biểu nào sau đây đúng?
A, Ở trạng thái cơ bản, lớp electron ngoài cùng của nhôm có 3e.
B, Ở trạng thái cơ bản, cấu hình electron nguyên tử của nhôm là [Ar]3s23p1.
C, Ở trạng thái cơ bản, nguyên tử nhôm có 27e.
D, Bán kính của ion Al3+ lớn hơn bán kính của nguyên tử Al.
✔️A. Nhôm (Al) có số hiệu nguyên tử là 13, nghĩa là nó có 13 electron. Phân bố electron theo các lớp vỏ của nhôm là:2, 8, 3.
Như vậy, lớp electron ngoài cùng của nhôm có 3 electron.
❌B. Ở trạng thái cơ bản, cấu hình electron nguyên tử của nhôm là [Ne]3s23p1.
❌C. Ở trạng thái cơ bản, nguyên tử nhôm có 13e.
❌D. Khi nhôm mất 3 electron để trở thành ion Al3+, lớp electron ngoài cùng (3s² 3p¹) bị loại bỏ, làm giảm số lớp electron và giảm kích thước của ion => kích thước của Al3+ < Al.
=> Chọn đáp án A Đáp án: A
Như vậy, lớp electron ngoài cùng của nhôm có 3 electron.
❌B. Ở trạng thái cơ bản, cấu hình electron nguyên tử của nhôm là [Ne]3s23p1.
❌C. Ở trạng thái cơ bản, nguyên tử nhôm có 13e.
❌D. Khi nhôm mất 3 electron để trở thành ion Al3+, lớp electron ngoài cùng (3s² 3p¹) bị loại bỏ, làm giảm số lớp electron và giảm kích thước của ion => kích thước của Al3+ < Al.
=> Chọn đáp án A Đáp án: A
Câu 60 [560678]: Một học sinh tiến hành cho nhôm rắn tác dụng với dung dịch nước chứa các ion bạc. Phương trình phản ứng được biểu diễn:
Al(s) + 3Ag+(aq) → Al3+(aq) + 3Ag(s).
Sơ đồ hình bên biểu diễn một số loại hạt trong phản ứng.
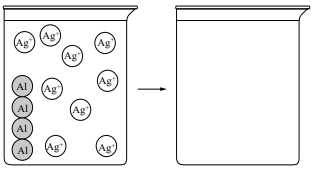
Cốc bên trái đại diện cho hệ trước khi phản ứng, cốc bên phải đại diện cho hệ sau khi phản ứng. Số lượng các hạt có trong cốc bên phải là
Al(s) + 3Ag+(aq) → Al3+(aq) + 3Ag(s).
Sơ đồ hình bên biểu diễn một số loại hạt trong phản ứng.

Cốc bên trái đại diện cho hệ trước khi phản ứng, cốc bên phải đại diện cho hệ sau khi phản ứng. Số lượng các hạt có trong cốc bên phải là
A, 3 nguyên tử Al, 2 nguyên tử Ag, 1 ion Al3+ và 7 ion Ag+.
B, 2 nguyên tử Al, 5 nguyên tử Ag, 2 ion Al3+ và 4 ion Ag+.
C, 1 nguyên tử Al, 4 nguyên tử Ag, 1 ion Al3+ và 5 ion Ag+.
D, 1 nguyên tử Al, 9 nguyên tử Ag, 3 ion Al3+ và 0 ion Ag+.
- Dựa trên phương trình phản ứng ta thấy: 1 nguyên tử Al kết hợp với 3 ion Ag+ tạo thành 1 ion Al3+ và 3 nguyên tử Ag.
- Cốc bên trái có 9 ion Ag+ sẽ cần 3 nguyên tử Al phản ứng => Ở cốc bên phải tạo thành 3 ion Al3+ và 9 nguyên tử Ag và 1 nguyên tử Al còn dư. Đáp án: D
- Cốc bên trái có 9 ion Ag+ sẽ cần 3 nguyên tử Al phản ứng => Ở cốc bên phải tạo thành 3 ion Al3+ và 9 nguyên tử Ag và 1 nguyên tử Al còn dư. Đáp án: D