Dạng 1: TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.
Câu 1 [273490]: Một khoáng chất chứa 31,3% silicon; 53,6% oxygen còn lại là nhôm và berillium. Phần trăm khối lượng của nhôm trong khoáng chất là
A, 2,5%.
B, 5,0%.
C, 10,1%.
D, 15,1%.
Ta có: % Al và Be còn lại: 15,1%
Gọi % Be = a ⟶ %Al = 15,1 - a
Do hóa trị của Al = 3, Be = 2, Si = 4 và O = 2
Gọi % Be = a ⟶ %Al = 15,1 - a
Do hóa trị của Al = 3, Be = 2, Si = 4 và O = 2
nên ta có: [(15 ×1 - a) / 27] × 3 + [(a / 9) × 2] + [(31 × 3 / 28) × 4] - [(53 × 6 / 16) × 2] = 0
=> Giải phương trình cho a = % Be = 4,96
Phần trăm khối lượng của nhôm trong khoáng chất là: %Al = 15.1 - a = 10,14%.
Chọn đáp án C
Câu 2 [273491]: Một khoáng chất có thành phần về khối lượng là: 14,81% Mg; 47,41% O; 0,25% H còn lại là Ca và Si. Phần trăm khối lượng của Ca trong khoáng chất là
A, 9,90%.
B, 17,78%.
C, 27,63%.
D, 37,53%.
Giả sử ta có 100 gam quặng loại này.
Tính lần lượt số mol các chất đã biết: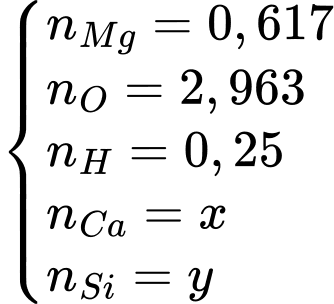
Trong quặng, thì các nguyên tố sẽ có các số oxi hóa tương ứng Ca2+, Mg2+, O2-, H+, Si4+. Ngoài ra, các số oxi hóa này phải đảm bảo cân bằng giữa tổng số oxi hóa âm và dương.
Tóm lại, ta có hệ: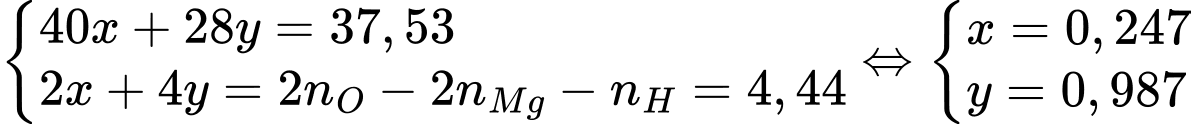
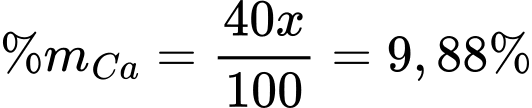
 Đáp án A
Đáp án A
Đáp án: A
Tính lần lượt số mol các chất đã biết:
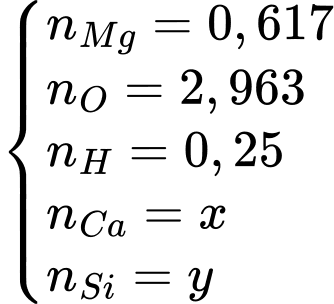
Trong quặng, thì các nguyên tố sẽ có các số oxi hóa tương ứng Ca2+, Mg2+, O2-, H+, Si4+. Ngoài ra, các số oxi hóa này phải đảm bảo cân bằng giữa tổng số oxi hóa âm và dương.
Tóm lại, ta có hệ:
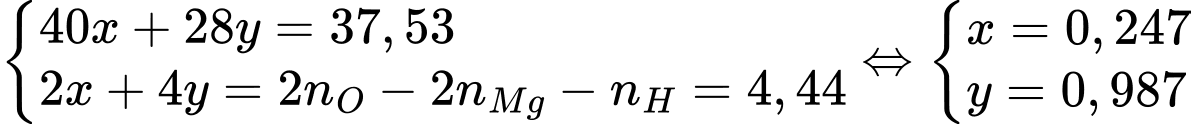
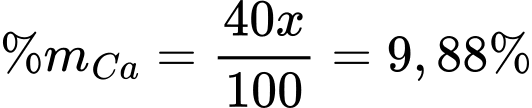
 Đáp án A
Đáp án AĐáp án: A
Câu 3 [273492]: Một khoáng chất có chứa a% nhôm, 21,7% silicon, 1,55% hydrogen (theo khối lượng), còn lại là oxygen. Giá trị của a là
A, 12,86%.
B, 52,94%.
C, 20,94%.
D, 39,13%.
Gọi công thức của khoáng chất : AlxSiyOzHt .
%mAl = a; %mO =b .
Ta có : a+ b= 100% - ( 21,7% + 1,55 % ) = 76,75% (1).
Áp dụng định luật bảo toàn điện tích ta có : 3x + 4y + t = 2z
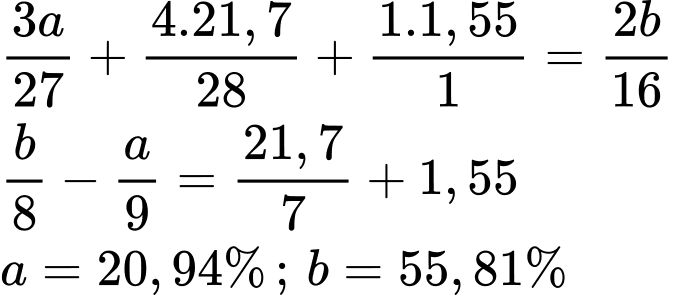
Vậy Al chiếm 20,94%
=> Chọn đáp án C
Đáp án: C
%mAl = a; %mO =b .
Ta có : a+ b= 100% - ( 21,7% + 1,55 % ) = 76,75% (1).
Áp dụng định luật bảo toàn điện tích ta có : 3x + 4y + t = 2z
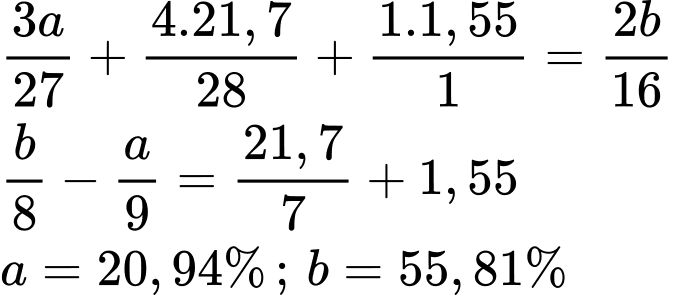
Vậy Al chiếm 20,94%
=> Chọn đáp án C
Đáp án: C
Câu 4 [273493]: Một khoáng chất có thành phần về khối lượng là: 39,68% Ca; 18,45% P; 38,10% O và còn lại là một nguyên tố X. Nguyên tố X là
A, N.
B, F.
C, S.
D, C.
Giả sử khối lượng X là 100 gam: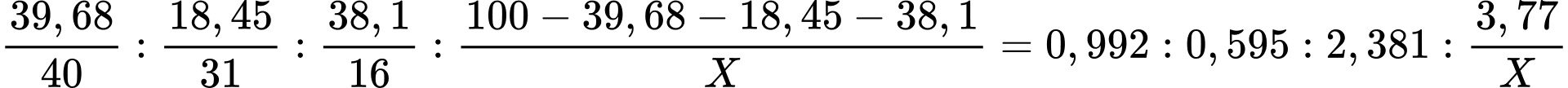
nx = 3,77: Mx
=> BT điện tích: 0,992. 2 + 0,5952. 5 + x. 3,77 : M(X) = 2. 2,381
=> M = 19nx
( Cân bằng điện tích có hóa trị của Ca là +2; P là +5; O là -2. Giả sử X có hóa trị là âm => thỏa mãn )
Biện luận nx=1, 2, 3, 4
Thấy có giá trị nx=1; M=19 thỏa mãn.
=> X là flourine.
=> Chọn B Đáp án: B
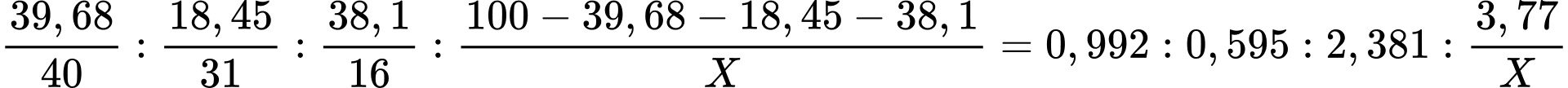
nx = 3,77: Mx
=> BT điện tích: 0,992. 2 + 0,5952. 5 + x. 3,77 : M(X) = 2. 2,381
=> M = 19nx
( Cân bằng điện tích có hóa trị của Ca là +2; P là +5; O là -2. Giả sử X có hóa trị là âm => thỏa mãn )
Biện luận nx=1, 2, 3, 4
Thấy có giá trị nx=1; M=19 thỏa mãn.
=> X là flourine.
=> Chọn B Đáp án: B
Câu 5 [273494]: Một loại khoáng có chứa 13,77% Na; 7,18% Mg; 57,48% O; 2,39% H và X về khối lượng. X là nguyên tố nào?
A, Lưu huỳnh.
B, Cacbon.
C, Nitơ.
D, Flo.
%X = 100% - 13.77% - 7.18% - 57.48% - 2.39% = 19.18%
Tỉ lệ nguyên tố:
Na : Mg : O : H : X =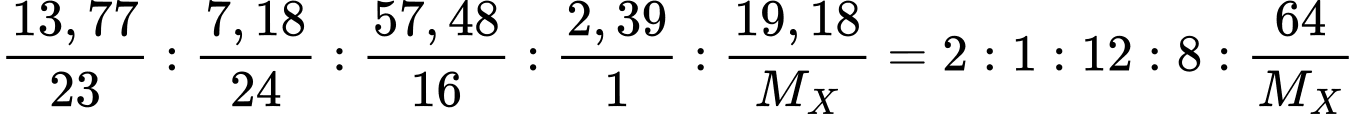
=> Biện luận tỉ lệ 64/MX là các giá trị nguyên như 1, 2, 3, 4, 5
=> MX lần lượt là 64 (Cu); 32 (Sulfur); 21,3 (Loại); 16 (Oxygen, trùng nên loại); 12,8 (Loại)
=> Chọn đáp án A Đáp án: A
Tỉ lệ nguyên tố:
Na : Mg : O : H : X =
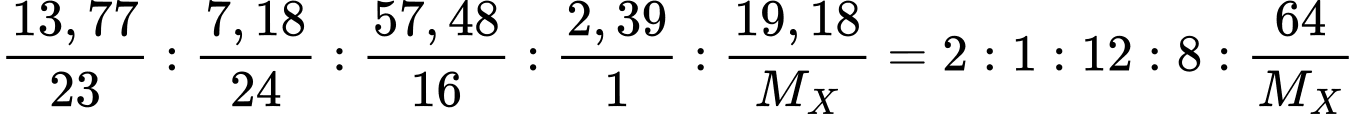
=> Biện luận tỉ lệ 64/MX là các giá trị nguyên như 1, 2, 3, 4, 5
=> MX lần lượt là 64 (Cu); 32 (Sulfur); 21,3 (Loại); 16 (Oxygen, trùng nên loại); 12,8 (Loại)
=> Chọn đáp án A Đáp án: A
Câu 6 [273495]: Một khoáng chất có thành phần về khối lượng là: 14,05% K; 8,65% Mg; 34,6% O; 4,32% H và còn lại là một nguyên tố X. Nguyên tố X là
A, S.
B, Cl.
C, P.
D, Si.
Giả sử m(khoáng chất) = 100 (g)
→ m(K) = 14,05; m(Mg) = 8,65; m(O) = 34,6; m(H) = 4,32 và m(X) = 38,388
→ n(K) = 0,36; n(Mg) = 0,36; n(O) = 2,1625; n(H) = 4,32
Gọi x là hóa trị của X
→ BT điện tích: x. n(X) = n(K) + 2n(Mg) + n(H) – 2n(O) = 1,08
→ M(X) = 35,5. x → X: Cl
=> Chọn đáp án B Đáp án: B
→ m(K) = 14,05; m(Mg) = 8,65; m(O) = 34,6; m(H) = 4,32 và m(X) = 38,388
→ n(K) = 0,36; n(Mg) = 0,36; n(O) = 2,1625; n(H) = 4,32
Gọi x là hóa trị của X
→ BT điện tích: x. n(X) = n(K) + 2n(Mg) + n(H) – 2n(O) = 1,08
→ M(X) = 35,5. x → X: Cl
=> Chọn đáp án B Đáp án: B
Câu 7 [560679]: Dựa vào giá trị thế điện cực chuẩn của cặp oxi hóa khử Au3+/Au, lí do nào sau đây giải thích vàng có thể tồn tại ở dạng đơn chất trong tự nhiên?
A, Do có thể khử chuẩn lớn nên Au cực kì kém hoạt động hóa học.
B, Do có thể khử chuẩn nhỏ nên Au3+ cực kì kém hoạt động hóa học.
C, Do có thể khử chuẩn lớn nên nên Au hoạt động hóa học mạnh.
D, Do có thể khử chuẩn nhỏ nên Au3+ hoạt động hóa học mạnh.
Thế điện cực chuẩn càng nhỏ thì dạng khử có tính khử càng mạnh và ngược lại. Do đó vì giá trị thế điện cực chuẩn lớn nên Au kém hoạt động hóa học.
Đáp án: A
Câu 8 [560680]: Nước tự nhiên ở khu vực có khoáng vật calcite (CaCO3) thường chứa cation kim loại nào?
A, Cu2+.
B, Ca2+.
C, NH4+.
D, CO32–.
Calcite là dạng khoáng vật chính của calcium carbonate, do đó nước trong khu vực này thường chứa ion calciumtừ quá trình hòa tan calcite.
 => Chứa cation Ca2+
=> Chứa cation Ca2+
⇒ Chọn đáp án B Đáp án: B
 => Chứa cation Ca2+
=> Chứa cation Ca2+⇒ Chọn đáp án B Đáp án: B
Câu 9 [560681]: Trong vỏ Trái Đất, những kim loại nào sau tồn tại chủ yếu dưới dạng đơn chất?
A, Ag, Au.
B, Zn, Fe.
C, Mg, Al.
D, Na, Ba.
Vì Ag và Au cực kì kém hoạt động hóa học nên tồn tại chủ yếu ở dạng đơn chất.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 10 [560682]: Một số kim loại, chẳng hạn như aluminium có thể được tách ra khỏi quặng bằng phương pháp điện phân nóng chảy. Giải thích tại sao lại chọn sử dụng phương pháp này?
A, Do các kim loại này có tính khử mạnh.
B, Do nhiệt độ nóng chảy của các kim loại thấp.
C, Do các kim loại có khả năng dẫn điện.
D, Do chi phí điện phân thấp hơn các phương pháp tách khác, dễ thực hiện.
Do các kim loại (kiềm, kiềm thổ, alunimium) có tính khử mạnh nên các phương pháp nhiệt luyện, thủy luyện không thể sử dụng được. Đáp án: A
Câu 11 [560683]: Trong tự nhiên, nguyên tố kim loại có thể được tìm thấy chủ yếu ở đâu trong các nguồn dưới đây?
(a) Nước ngầm.
(b) Nước biển.
(c) Đất đá.
(d) Cây xanh có hoa.
(a) Nước ngầm.
(b) Nước biển.
(c) Đất đá.
(d) Cây xanh có hoa.
A, (a), (b) và (c).
B, (b) và (c).
C, (a) và (c).
D, (a), (b), (c) và (d).
Kim loại có thể tìm thấy ở 3 nguồn nước ngầm, nước biển và đất đá. Đáp án: A
Câu 12 [560684]: Nguyên tắc tách kim loại ra khỏi hợp chất của chúng là
A, Khử ion kim loại trong hợp chất thành nguyên tử.
B, Oxi hoá ion kim loại trong hợp chất thành nguyên tử.
C, Hoà tan các khoáng vật có trong quặng để thu được kim loại.
D, Dựa trên tính chất của kim loại như từ tính, khối lượng riêng lớn để tách chúng ra khỏi quặng.
Trong hợp chất, nguyên tố kim loại tồn tại dạng cation kim loại (Mn+) nên nguyên tắc chung để tách được nguyên tố kim loại ra khỏi hợp chất cần thực hiện phản ứng khử cation kim loại thành nguyên tử.
Đáp án: A
Mn+ + ne ⟶ M
⇒ Chọn đáp án A
Câu 13 [982771]: Kim loại nào sau đây điều chế được bằng phương pháp nhiệt luyện với chất khử H2?
A, Mg.
B, Na.
C, Al.
D, Fe.
HD: H2 khử được các oxit sắt để thu được kim loại tương ứng:
Fe3O4 + 4H2 –––to–→ 3Fe + 4H2O.
⇒ Chọn đáp án D Đáp án: D
Fe3O4 + 4H2 –––to–→ 3Fe + 4H2O.
⇒ Chọn đáp án D Đáp án: D
Câu 14 [981796]: Kim loại nào sau đây điều chế được bằng phương pháp nhiệt luyện với chất khử CO?
A, Ba.
B, Fe.
C, Mg.
D, K.
HD: CO không khử được các oxit kim loại từ Zn trở lên.
⇒ Các đáp án Ba, Mg, K không thoả mãn. Còn lại:
3CO + Fe2O3 –––to–→ 3CO2 + 2Fe.
⇒ Chọn đáp án B Đáp án: B
⇒ Các đáp án Ba, Mg, K không thoả mãn. Còn lại:
3CO + Fe2O3 –––to–→ 3CO2 + 2Fe.
⇒ Chọn đáp án B Đáp án: B
Câu 15 [233843]: Ở nhiệt độ cao, chất nào sau đây không khử được Fe2O3?
A, H2.
B, CO.
C, Al.
D, CO2.
HD: Bài học phương pháp nhiệt luyện điều chế kim loại:
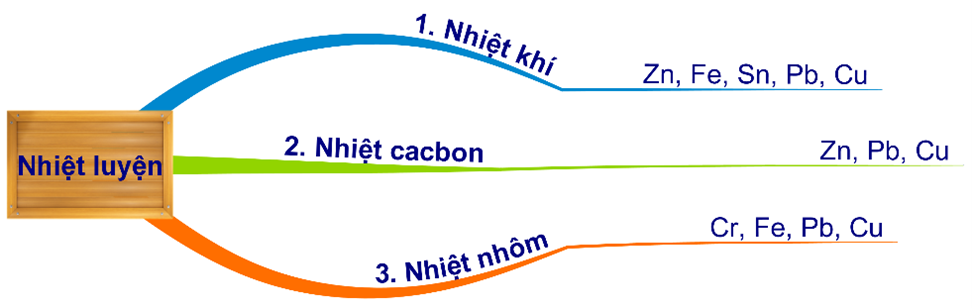
⇝ CO, H2 (nhiệt khí) và Al (nhiệt nhôm) khử được Fe.
► CO2 không thể nhận thêm e, làm sao mà "khử được" Fe2O3 nên cũng có thể chọn nhanh D.
☆ các phản ứng xảy ra:
✔️ 3CO + Fe2O3 ––to→ 2Fe + 3CO2.
✔️ 3H2 + Fe2O3 ––to→ 2Fe + 3H2O.
✔️ 2Al + Fe2O3 ––to→ 2Fe + Al2O3. Đáp án: D

⇝ CO, H2 (nhiệt khí) và Al (nhiệt nhôm) khử được Fe.
► CO2 không thể nhận thêm e, làm sao mà "khử được" Fe2O3 nên cũng có thể chọn nhanh D.
☆ các phản ứng xảy ra:
✔️ 3CO + Fe2O3 ––to→ 2Fe + 3CO2.
✔️ 3H2 + Fe2O3 ––to→ 2Fe + 3H2O.
✔️ 2Al + Fe2O3 ––to→ 2Fe + Al2O3. Đáp án: D
Câu 16 [59338]: Trong công nghiệp, crom được điều chế bằng phương pháp nhiệt luyện. Kim loại nào sau đây được dùng để khử Cr2O3 thành Cr?
A, Ag.
B, Cu.
C, Al.
D, Fe.
HD:
Trong công nghiệp, crom được điều chế bằng cách cho Al khử Cr2O3 thành Cr:
2Al + Cr2O3 to→ 2Cr + Al2O3.
⇒ Chọn đáp án C
Đáp án: C
Trong công nghiệp, crom được điều chế bằng cách cho Al khử Cr2O3 thành Cr:
2Al + Cr2O3 to→ 2Cr + Al2O3.
⇒ Chọn đáp án C
Đáp án: C
Câu 17 [12650]: Dẫn khí CO dư đi qua hỗn hợp bột gồm MgO, CuO, Al2O3 và FeO, nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp chất rắn Y. Số oxit kim loại có trong Y là
A, 3.
B, 1.
C, 4.
D, 2.
HD: CO khử các oxit kim loại trung bình yếu: CuO, Feo thành kim loại:
![596549[LG].png](https://asset.moon.vn/img/ai/Teachers/rongden_167/ProS2018/TAPIII/596549[LG].png)
CO không khử được MgO và Al2O3. Có 2 oxit thỏa mãn yêu cầu
→ Chọn đáp án D. ♠.
Đáp án: D
![596549[LG].png](https://asset.moon.vn/img/ai/Teachers/rongden_167/ProS2018/TAPIII/596549[LG].png)
CO không khử được MgO và Al2O3. Có 2 oxit thỏa mãn yêu cầu
→ Chọn đáp án D. ♠.
Đáp án: D
Câu 18 [560685]: Tách Fe bằng cách khử Fe2O3 bởi CO theo phương trình hoá học:
Fe2O3(s) + 3CO(g) 2Fe(l) + 3CO2(g).
2Fe(l) + 3CO2(g).
Chất khử được sử dụng trong phản ứng là
Fe2O3(s) + 3CO(g)
 2Fe(l) + 3CO2(g).
2Fe(l) + 3CO2(g).Chất khử được sử dụng trong phản ứng là
A, Fe2O3.
B, CO.
C, Fe.
D, CO2.
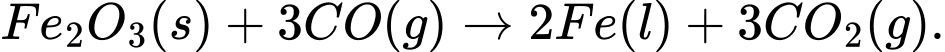
Khử tăng – oxi hóa giảm.
Chất khử được sử dụng trong phản ứng là CO (do số oxi hóa tăng từ +2 lên +4).
=> Chọn đáp án B Đáp án: B
Câu 19 [560686]: Tách Zn bằng cách khử ZnO bởi C theo phương trình hoá học:
ZnO(s) + C(s) Zn(g) + CO(g).
Zn(g) + CO(g).
Sau phản ứng, làm nguội, hơi kẽm ngưng tụ thành kẽm ở thể lỏng hoặc rắn. Chất khử được sử dụng trong phản ứng là
ZnO(s) + C(s)
 Zn(g) + CO(g).
Zn(g) + CO(g).Sau phản ứng, làm nguội, hơi kẽm ngưng tụ thành kẽm ở thể lỏng hoặc rắn. Chất khử được sử dụng trong phản ứng là
A, ZnO.
B, C.
C, Zn.
D, CO.
Quá trình oxi hóa (nhường e): C0 ⟶ C+2 + 2e nên chất khử được sử dụng trong phản ứng là C. Đáp án: B
Câu 20 [560687]: Tách iron từ quặng hematite theo phương trình:
Fe2O3(s) + 3CO(g) 2Fe(l) + 3CO2(g).
2Fe(l) + 3CO2(g).
Trong phương trình này, Fe2O3 đóng vai trò là
Fe2O3(s) + 3CO(g)
 2Fe(l) + 3CO2(g).
2Fe(l) + 3CO2(g).Trong phương trình này, Fe2O3 đóng vai trò là
A, Chất bị khử.
B, Chất bị oxi hóa.
C, Chất trung tính.
D, Chất nhường electron.
Fe3+ + 3e ⟶ Fe là quá trình nhận electron nên Fe2O3 là chất oxi hóa (bị khử). Đáp án: A
Câu 21 [560688]: Nhiều kim loại có thể được điều chế từ quặng của chúng bằng cách nung oxide kim loại với carbon (phương pháp nhiệt carbon). Kim loại nào sau đây không thể được điều chế bằng phương pháp nhiệt carbon?
A, Zinc.
B, Copper.
C, Aluminium.
D, Iron.
- Nhôm là một
kim loại có tính khử rất mạnh (nằm cao trong dãy điện hóa). Nó có khả năng khử
các oxide kim loại khác nhưng bản thân oxide của nó
rất bền
=> Chọn đáp án C Đáp án: C
Câu 22 [212583]: Kim loại nào sau đây điều chế được bằng phương pháp thủy luyện?
A, Au.
B, Ca.
C, Na.
D, Mg.
HD: ☆ Bài học về điều chế kim loại:
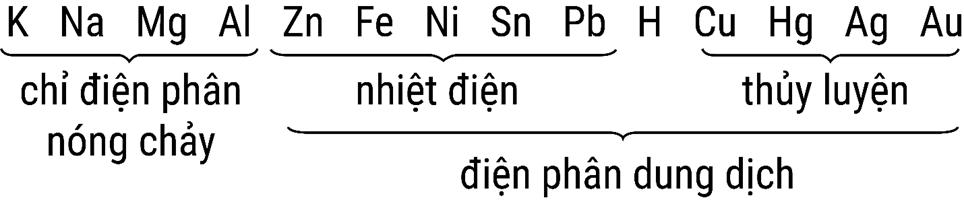
⇒ Au được điều chế bằng phương pháp thủy luyện (Na, Ca, Mg phản ứng được với nước nên không điều chế được) ⇝ Chọn đáp án A. ♥ Đáp án: A

⇒ Au được điều chế bằng phương pháp thủy luyện (Na, Ca, Mg phản ứng được với nước nên không điều chế được) ⇝ Chọn đáp án A. ♥ Đáp án: A
Câu 23 [59356]: Để thu được kim loại Cu từ dung dịch CuSO4 bằng phương pháp thủy luyện, ta không thể dùng kim loại nào sau đây?
A, Mg.
B, Ca.
C, Fe.
D, Zn.
HD: Thứ tự dãy điện hóa các kim loại: Ca > Mg > Zn > Fe > Cu.
⇝ các kim loại đều đứng trước Cu trong dãy điện hóa.
Tuy nhiên, trường hợp các kim loại kiềm, kiềm thổ như Na, K, Ca, Ba
phản ứng mãnh liệt với H2O tạo dung dịch bazơ trước:
Ca + 2H2O → Ca(OH)2 + H2↑.
Sau đó: Ca(OH)2 + CuSO4 → Cu(OH)2↓ + CaSO4.
⇒ không dùng được Ca để đẩy Cu2+ ra khỏi dung dịch bằng phương pháp thủy luyện. ❒
⇒ Chọn đáp án B Đáp án: B
⇝ các kim loại đều đứng trước Cu trong dãy điện hóa.
Tuy nhiên, trường hợp các kim loại kiềm, kiềm thổ như Na, K, Ca, Ba
phản ứng mãnh liệt với H2O tạo dung dịch bazơ trước:
Ca + 2H2O → Ca(OH)2 + H2↑.
Sau đó: Ca(OH)2 + CuSO4 → Cu(OH)2↓ + CaSO4.
⇒ không dùng được Ca để đẩy Cu2+ ra khỏi dung dịch bằng phương pháp thủy luyện. ❒
⇒ Chọn đáp án B Đáp án: B
Câu 24 [59367]: Trong các kim loại Cu; Ag; Na; K và Ba, số kim loại điều chế được bằng phương pháp thủy luyện là
- Phương pháp thủy luyện áp dụng điều chế các kim loại có mức độ hoạt động thấp như Cu, Hg, Au, Ag...
- Điều chế kim loại bằng phương pháp thủy luyện thường được sử dụng trong phòng thí nghiệm với mục đích điều chế những kim loại yếu đứng sau Mg.
Kim loại được điều chế bằng phương pháp thủy luyện gồm Cu và Ag
⇒ Có 2 kim loại.
Điền đáp án : 2
- Điều chế kim loại bằng phương pháp thủy luyện thường được sử dụng trong phòng thí nghiệm với mục đích điều chế những kim loại yếu đứng sau Mg.
Kim loại được điều chế bằng phương pháp thủy luyện gồm Cu và Ag
⇒ Có 2 kim loại.
Điền đáp án : 2
Câu 25 [560689]: Aluminium có thể được sản xuất bằng phương pháp điện phân.

Phát biểu nào sau đây không đúng về quá trình điện phân aluminium oxide?

Phát biểu nào sau đây không đúng về quá trình điện phân aluminium oxide?
A, Cực âm phải được thay thế thường xuyên vì nó bị cháy đi.
B, Aluminium nhận electron trong quá trình điện phân và bị khử.
C, Cực dương và cực âm được làm bằng than chì.
D, Cryolite được thêm vào đề làm giảm điêm nóng chảy của aluminium oxide.
Cực dương (anode) cần được thay thế sau một thời gian sử dụng vì khí O2 sinh ra phản ứng với điện cực ở nhiệt độ cao tạo khí CO và CO2
=> Chọn A Đáp án: A
=> Chọn A Đáp án: A
Câu 26 [560690]: Với quá trình tách sodium bằng phương pháp điện phân sodium chloride nóng chảy, phát biểu nào sau đây là đúng?
A, Tại anode xảy ra quá trình khử ion Na+.
B, Tại cathode xảy ra quá trình khử ion Cl–.
C, Tại cathode xảy ra quá trình khử ion Na+.
D, Tại anode xảy ra quá trình khử ion Cl–.
Khi điện phân nóng chảy NaCl:
Anode (+) xảy ra quá trình oxi hóa: 2Cl- ⟶ Cl2 + 2e
Cathode (-) xảy ra quá trình khử: Na+ + 1e ⟶ Na
⇒ Chọn đáp án C Đáp án: C
Anode (+) xảy ra quá trình oxi hóa: 2Cl- ⟶ Cl2 + 2e
Cathode (-) xảy ra quá trình khử: Na+ + 1e ⟶ Na
⇒ Chọn đáp án C Đáp án: C
Câu 27 [560691]: Hình vẽ bên liên quan đến công đoạn nào trong quá trình tái chế kim loại?


A, Thu gom, phân loại.
B, Nghiền, băm nhỏ.
C, Luyện kim.
D, Tạo vật liệu.

Quá trình tinh luyện để cho các kim loại đạt được độ sạch cao nhất, sau đó pha trộn giữa các kim loại đó lại để có các hợp kim đáp ứng được những yêu cầu mong như mong muốn. Và sau đó tạo hình dáng cho chúng để phù hợp với các nhu cầu sử dụng của các chủ đầu tư. Đây là quá trình được gọi là công nghệ luyện kim.
=> Chọn đáp án C Đáp án: C
Câu 28 [560692]: Lý do nào không đúng khi nói về sự cần thiết của tái chế kim loại?
A, Trữ lượng các mỏ quặng kim loại ngày càng cạn kiệt.
B, Do lượng phế thải kim loại tạo ra ngày càng nhiều.
C, Đảm bảo nguồn cung, tăng giá trị kinh tế.
D, Kim loại thu được từ tái chế tinh khiết hơn kim loại sản xuất từ quặng.
✔️A. Việc khai thác quặng kim loại làm cạn kiệt tài nguyên tự nhiên.
✔️B. Tái chế giúp giảm lượng phế thải, bảo vệ môi trường.
✔️C. Tái chế kim loại giúp duy trì nguồn cung và giảm chi phí khai thác.
❌D. Sai vì kim loại tái chế thường chứa tạp chất, không thể tinh khiết hơn so với kim loại nguyên khai sản xuất từ quặng.
=> Chọn đáp án D Đáp án: D
✔️B. Tái chế giúp giảm lượng phế thải, bảo vệ môi trường.
✔️C. Tái chế kim loại giúp duy trì nguồn cung và giảm chi phí khai thác.
❌D. Sai vì kim loại tái chế thường chứa tạp chất, không thể tinh khiết hơn so với kim loại nguyên khai sản xuất từ quặng.
=> Chọn đáp án D Đáp án: D
Câu 29 [560693]: Ba phát biểu về aluminium dưới đây đều chính xác.
(i) Aluminium phản ứng dễ dàng tạo thành aluminium oxide.
(ii) Aluminium được tách ra khỏi quặng bằng phương pháp điện phân nóng chảy do không thể điều chế bằng phương pháp nhiệt luyện.
(iii) Aluminium được dùng làm lõi dây điện vì khả năng dẫn điện tốt.
Khi thay aluminium bằng copper thì những phát biểu vẫn đúng là
(i) Aluminium phản ứng dễ dàng tạo thành aluminium oxide.
(ii) Aluminium được tách ra khỏi quặng bằng phương pháp điện phân nóng chảy do không thể điều chế bằng phương pháp nhiệt luyện.
(iii) Aluminium được dùng làm lõi dây điện vì khả năng dẫn điện tốt.
Khi thay aluminium bằng copper thì những phát biểu vẫn đúng là
A, Cả (i), (ii), (iii).
B, Chỉ (ii).
C, (i) và (iii).
D, Chỉ (iii).
✔️ (i) – Đúng. Aluminium phản ứng dễ dàng tạo thành aluminium oxide.
❌ (ii) – Sai.
Làm giàu quặng: Do hàm lượng đồng trong quặng thấp (dưới 1%) vì vậy làm giàu bằng phương pháp tuyển nổi.
- Chuyển hóa quặng đồng thành đồng
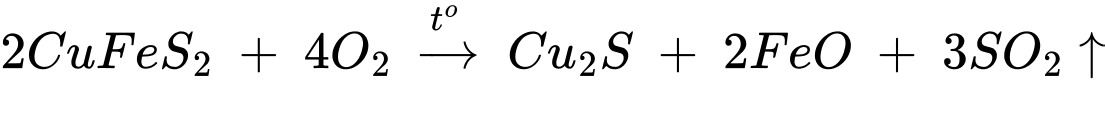
- Nung Cu2S trong không khí sao cho một phần Cu2S chuyển thành Cu2O
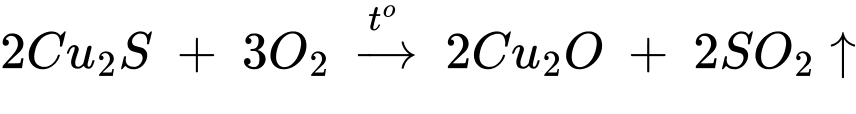
- Sau đó ngừng cung cấp oxi để xảy ra phản ứng:
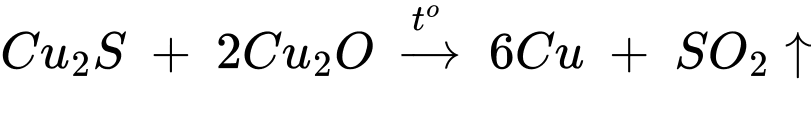
✔️ (iii) – Đúng. Copper được dùng làm lõi dây điện vì khả năng dẫn điện tốt.
⇒ Chọn đáp án C Đáp án: C
❌ (ii) – Sai.
Làm giàu quặng: Do hàm lượng đồng trong quặng thấp (dưới 1%) vì vậy làm giàu bằng phương pháp tuyển nổi.
- Chuyển hóa quặng đồng thành đồng
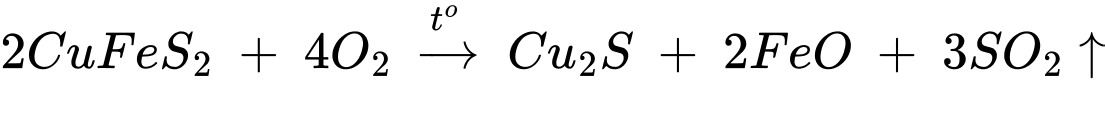
- Nung Cu2S trong không khí sao cho một phần Cu2S chuyển thành Cu2O
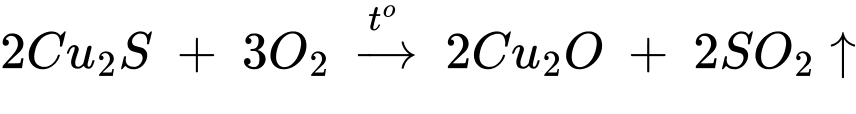
- Sau đó ngừng cung cấp oxi để xảy ra phản ứng:
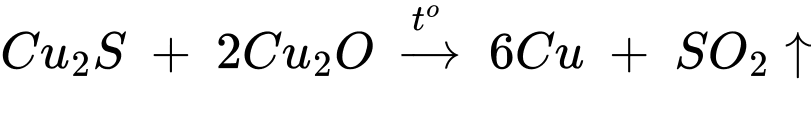
✔️ (iii) – Đúng. Copper được dùng làm lõi dây điện vì khả năng dẫn điện tốt.
⇒ Chọn đáp án C Đáp án: C
Câu 30 [560694]: Một số tính chất của các phân tử X, L, M và N được đưa ra như sau:
(i) X đóng vai trò là chất xúc tác và oxide của nó phản ứng với hydrochloric acid.
(ii) L là chất rắn màu xám đen xỉn, dẫn điện và có nhiệt độ nóng chảy 3600°C.
(ii) M dễ dàng được rèn thành hình và có khối lượng riêng lớn.
(iv) N có nhiệt độ nóng chảy là 113° C và tạo thành acidic oxide khi tác dụng với oxygen.
Nguyên tố nào có thể là kim loại?
(i) X đóng vai trò là chất xúc tác và oxide của nó phản ứng với hydrochloric acid.
(ii) L là chất rắn màu xám đen xỉn, dẫn điện và có nhiệt độ nóng chảy 3600°C.
(ii) M dễ dàng được rèn thành hình và có khối lượng riêng lớn.
(iv) N có nhiệt độ nóng chảy là 113° C và tạo thành acidic oxide khi tác dụng với oxygen.
Nguyên tố nào có thể là kim loại?
A, X và M.
B, L, M và N.
C, L, M.
D, L và N.
+ X, M là kim loại
+ L là carbon
+ N là phi kim Đáp án: A
+ L là carbon
+ N là phi kim Đáp án: A
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.
Câu 31 [560695]: Kim loại kẽm được tách từ hợp chất zinc sulfide trong khoáng vật sphalerite.
Bước 1: Đốt zinc sulfide trong khí oxygen dư để tạo zinc oxide và sulfur dioxide.
Bước 2: Để thu được zinc, có thể khử zinc oxide bằng carbon.
a. Zinc sulfide có công thức hóa học là ZnSO3.
b. Zn trong zinc sulfide có số oxi hóa +2.
c. Trong bước 1, nguyên tử Zn trong zinc sulfide bị oxi hóa.
d. Trong bước 2, nguyên tử Zn có số oxi hóa +2 bị khử thành số oxi hóa 0.
Bước 1: Đốt zinc sulfide trong khí oxygen dư để tạo zinc oxide và sulfur dioxide.
Bước 2: Để thu được zinc, có thể khử zinc oxide bằng carbon.
a. Zinc sulfide có công thức hóa học là ZnSO3.
b. Zn trong zinc sulfide có số oxi hóa +2.
c. Trong bước 1, nguyên tử Zn trong zinc sulfide bị oxi hóa.
d. Trong bước 2, nguyên tử Zn có số oxi hóa +2 bị khử thành số oxi hóa 0.
Phân tích các phát biểu:
❌a. Sai. Zinc sulfide có công thức hóa học là ZnS, không phải ZnSO3
✔️b. Đúng. Trong hợp chất ZnS, (S) có số oxi hóa -2. Vì hợp chất trung hòa điện tích, nên (Zn) phải có số oxi hóa +2.
❌c. Sai. Phản ứng trong bước 1 là: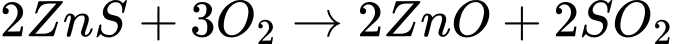
Số oxi hóa của Zn vẫn là +2 trong cả ZnS và ZnO.Tuy nhiên, (S) trong ZnS bị oxi hóa từ -2 (trong ZnS) thành +4 (trong SO2).
✔️d. Đúng. Zinc (Zn) trong ZnO có số oxi hóa +2 và bị khử thành số oxi hóa 0 trong Zn.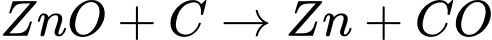
❌a. Sai. Zinc sulfide có công thức hóa học là ZnS, không phải ZnSO3
✔️b. Đúng. Trong hợp chất ZnS, (S) có số oxi hóa -2. Vì hợp chất trung hòa điện tích, nên (Zn) phải có số oxi hóa +2.
❌c. Sai. Phản ứng trong bước 1 là:
Số oxi hóa của Zn vẫn là +2 trong cả ZnS và ZnO.Tuy nhiên, (S) trong ZnS bị oxi hóa từ -2 (trong ZnS) thành +4 (trong SO2).
✔️d. Đúng. Zinc (Zn) trong ZnO có số oxi hóa +2 và bị khử thành số oxi hóa 0 trong Zn.
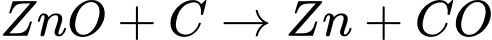
Câu 32 [560696]: Để tái chế nhôm, người ta có thể sử dụng phế liệu kim loại như vỏ của các lon, hộp chứa nước giải khát hay thực phẩm. Phế liệu này còn lẫn các tạp chất là các hợp chất hữu cơ và vô cơ (có trong nhãn, mác in hoặc sơn trên vỏ lon, hộp). Phế liệu được cắt, băm nhỏ rồi cho vào lò nung đến khi chảy lỏng. Phần lớn các tạp chất biến thành xỉ lỏng, nổi lên trên, được vớt ra khỏi lò. Phần tạp chất còn lại vẫn bị lẫn trong trong nhôm ở trạng thái nóng chảy.
a. Việc cắt, băm nhỏ phế liệu nhôm trước khi nung chảy để tăng diện tích
tiếp xúc với nhiệt.
b. Không dùng loại nhôm tái chế theo quy trình trên để chế tạo xoong, chảo.
c. Vỏ của các lon, hộp chứa nước giải khát chứa lượng lớn nhôm.
d. Lớp xỉ lỏng nổi bên trên ngăn không cho nhôm tiếp xúc với không khí.
a. Việc cắt, băm nhỏ phế liệu nhôm trước khi nung chảy để tăng diện tích
tiếp xúc với nhiệt.
b. Không dùng loại nhôm tái chế theo quy trình trên để chế tạo xoong, chảo.
c. Vỏ của các lon, hộp chứa nước giải khát chứa lượng lớn nhôm.
d. Lớp xỉ lỏng nổi bên trên ngăn không cho nhôm tiếp xúc với không khí.
Phân tích các phát biểu:
✔️ a. Đúng. Việc cắt, băm nhỏ phế liệu nhôm trước khi nung chảy để tăng diện tích tiếp xúc với nhiệt.
✔️b. Đúng. Nhôm tái chế có thể chứa các tạp chất như kim loại nặng (chì, cadmium…) hoặc hợp chất không mong muốn, ảnh hưởng đến an toàn thực phẩm. Không nên dùng nhôm tái chế để chế tạo xoong, chảo.
✔️ c. Đúng. Vỏ của các lon, hộp chứa nước giải khát chứa lượng nhôm lớn.
✔️ d. Đúng. Lớp xỉ lỏng bên trên đóng vai trò tạo lớp bảo vệ, ngăn không cho Al tiếp xúc với không khí.
✔️ a. Đúng. Việc cắt, băm nhỏ phế liệu nhôm trước khi nung chảy để tăng diện tích tiếp xúc với nhiệt.
✔️b. Đúng. Nhôm tái chế có thể chứa các tạp chất như kim loại nặng (chì, cadmium…) hoặc hợp chất không mong muốn, ảnh hưởng đến an toàn thực phẩm. Không nên dùng nhôm tái chế để chế tạo xoong, chảo.
✔️ c. Đúng. Vỏ của các lon, hộp chứa nước giải khát chứa lượng nhôm lớn.
✔️ d. Đúng. Lớp xỉ lỏng bên trên đóng vai trò tạo lớp bảo vệ, ngăn không cho Al tiếp xúc với không khí.
Câu 33 [560697]: Hầu hết các kim loại đều được điều chế từ quặng tìm thấy trong lớp vỏ Trái đất. Phương pháp được sử dụng để tách kim loại ra khỏi quặng có liên quan đến khả năng phản ứng của kim loại. Mức độ phản ứng của một số kim loại được hiển thị dưới đây:
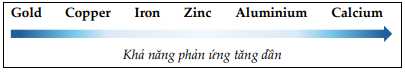
a. Trong tự nhiên có thể tìm thấy gold ở dạng đơn chất.
b. Aluminium dễ nhường electron hơn so với iron, copper.
c. Có thể tách Al, Zn, Fe ra khỏi quặng bằng phương pháp nhiệt luyện.
d. Trong các phương pháp tách kim loại: thủy luyện, nhiệt luyện, điện phân nóng chảy, điện phân dung dịch có 2 phương pháp có thể áp dụng để điều chế copper

a. Trong tự nhiên có thể tìm thấy gold ở dạng đơn chất.
b. Aluminium dễ nhường electron hơn so với iron, copper.
c. Có thể tách Al, Zn, Fe ra khỏi quặng bằng phương pháp nhiệt luyện.
d. Trong các phương pháp tách kim loại: thủy luyện, nhiệt luyện, điện phân nóng chảy, điện phân dung dịch có 2 phương pháp có thể áp dụng để điều chế copper
Phân tích các phát biểu:
✔️ a. Đúng. Trong tự nhiên có thể tìm thấy gold ở dạng đơn chất.
✔️ b. Đúng. Aluminium khả năng hoạt động hóa học mạnh hơn iron, copper nên dễ nhường electron hơn.
❌ c. Sai. Tách Al bằng phương pháp điện phân nóng chảy.
❌ d. Sai. Có 3 phương pháp có thể áp dụng để điều chế copper là: thủy luyện, nhiệt luyệt, điện phân dung dịch.
✔️ a. Đúng. Trong tự nhiên có thể tìm thấy gold ở dạng đơn chất.
✔️ b. Đúng. Aluminium khả năng hoạt động hóa học mạnh hơn iron, copper nên dễ nhường electron hơn.
❌ c. Sai. Tách Al bằng phương pháp điện phân nóng chảy.
❌ d. Sai. Có 3 phương pháp có thể áp dụng để điều chế copper là: thủy luyện, nhiệt luyệt, điện phân dung dịch.
Câu 34 [560698]: Mức độ phản ứng của một số kim loại được hiển thị dưới đây:

a. Kim loại luôn tìm thấy ở dạng quặng trong vỏ Trái đất là platinum.
b. Điều chế aluminium từ quặng bauxite có thể dùng phương pháp điện phân nóng chảy.
c. Iron được tách ra khỏi oxide bằng cách nung nóng oxide với carbon theo phương pháp: iron oxide + carbon → iron + carbon dioxide, trong phản ứng này iron oxide đóng vai trò là chất nhường electron.
d. Xuất phát từ 240 tấn iron(III) oxide nung nóng với carbon có thể điều chế tối đa được 84 gam iron (giả sử hiệu suất phản ứng là 100%).

a. Kim loại luôn tìm thấy ở dạng quặng trong vỏ Trái đất là platinum.
b. Điều chế aluminium từ quặng bauxite có thể dùng phương pháp điện phân nóng chảy.
c. Iron được tách ra khỏi oxide bằng cách nung nóng oxide với carbon theo phương pháp: iron oxide + carbon → iron + carbon dioxide, trong phản ứng này iron oxide đóng vai trò là chất nhường electron.
d. Xuất phát từ 240 tấn iron(III) oxide nung nóng với carbon có thể điều chế tối đa được 84 gam iron (giả sử hiệu suất phản ứng là 100%).
Phân tích các phát biểu:
❌ a. Sai. Kim loại luôn tìm thấy ở dạng quặng trong vỏ Trái đất là nhôm và sắt.
✔️ b. Đúng. Điều chế aluminium từ quặng bauxite có thể dùng phương pháp điện phân nóng chảy.
❌ c. Sai. Trong phản ứng thì iron oxide đóng vai trò là chất nhận electron để tạo thành kim loại iron.
❌ d. Sai. Từ 240 tấn Fe2O3 => nFe2O3 = 240/160 = 1,5 => nFe = 1,5 .2 = 3 mol. Vậy khối lượng Fe thu được là 168 tấn.
❌ a. Sai. Kim loại luôn tìm thấy ở dạng quặng trong vỏ Trái đất là nhôm và sắt.
✔️ b. Đúng. Điều chế aluminium từ quặng bauxite có thể dùng phương pháp điện phân nóng chảy.
❌ c. Sai. Trong phản ứng thì iron oxide đóng vai trò là chất nhận electron để tạo thành kim loại iron.
❌ d. Sai. Từ 240 tấn Fe2O3 => nFe2O3 = 240/160 = 1,5 => nFe = 1,5 .2 = 3 mol. Vậy khối lượng Fe thu được là 168 tấn.
Câu 35 [560699]: Trong công nghiệp, aluminium (nhôm) được sản xuất từ quặng bauxite theo hai giai đoạn chính:
Giai đoạn 1: Tinh chế quặng bauxite.
Giai đoạn 2: Điện phân Al2O3 nóng chảy.
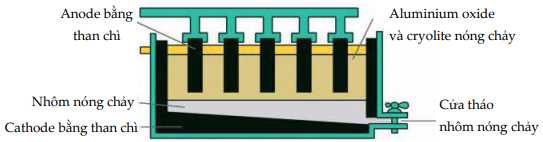
a. Alumium oxide được hòa tan trong cryolite nóng chảy và được thu lấy ở cực dương.
b. Ở anode thấy có khí duy nhất thoát ra là oxygen.
c. Cực dương bị mòn dần theo thời gian và cần được thay thế thường xuyên.
d. Trung bình để sản xuất được 1 tấn Al thì lượng điện cực than chì bị tiêu hao do phản ứng oxi hoá là 0,34 tấn. (Giả thiết thành phần khí bay ra ở cực dương gồm 50% CO và 50% CO2 về thể tích).
Giai đoạn 1: Tinh chế quặng bauxite.
Giai đoạn 2: Điện phân Al2O3 nóng chảy.

a. Alumium oxide được hòa tan trong cryolite nóng chảy và được thu lấy ở cực dương.
b. Ở anode thấy có khí duy nhất thoát ra là oxygen.
c. Cực dương bị mòn dần theo thời gian và cần được thay thế thường xuyên.
d. Trung bình để sản xuất được 1 tấn Al thì lượng điện cực than chì bị tiêu hao do phản ứng oxi hoá là 0,34 tấn. (Giả thiết thành phần khí bay ra ở cực dương gồm 50% CO và 50% CO2 về thể tích).
Phân tích các phát biểu:
❌ a. Sai. Aluminium được tạo ra ở cathode (cực âm).
❌ b. Sai. Khí O2 sinh ra ở nhiệt độ cao phản ứng với điện cực than chì (C) tạo hỗn hợp khí CO và khí CO2.
✔️ c. Đúng. Cực dương (anode) làm bằng than chì bị mòn dầy theo thời gian vì phản ứng với oxygen và cần được thay thế thường xuyên.
❌ d. Sai. PTHH: 2Al2O3 ⟶ 4Al + 3O2 => nO2= 3/4. nAl = 1/36 (mol).
Vì lượng CO và CO2 sinh ra là như nhau => nCO= nCO2= a (mol) => nO2 phản ứng= a/2 + a= 1/36
=> a=1/54 => Khối lượng carbon phản ứng là 2. a . 12 = 0,44 tấn.
❌ a. Sai. Aluminium được tạo ra ở cathode (cực âm).
❌ b. Sai. Khí O2 sinh ra ở nhiệt độ cao phản ứng với điện cực than chì (C) tạo hỗn hợp khí CO và khí CO2.
✔️ c. Đúng. Cực dương (anode) làm bằng than chì bị mòn dầy theo thời gian vì phản ứng với oxygen và cần được thay thế thường xuyên.
❌ d. Sai. PTHH: 2Al2O3 ⟶ 4Al + 3O2 => nO2= 3/4. nAl = 1/36 (mol).
Vì lượng CO và CO2 sinh ra là như nhau => nCO= nCO2= a (mol) => nO2 phản ứng= a/2 + a= 1/36
=> a=1/54 => Khối lượng carbon phản ứng là 2. a . 12 = 0,44 tấn.
Câu 36 [560700]: Iron được chiết xuất từ quặng hematite (thành phần chính là Fe2O3, ngoài ra còn có sillic dioxide). Nguyên liệu ban đầu gồm có quặng hematite, than cốc và chất phụ gia như đá vôi sẽ sản xuất được hợp kim quan trọng của iron là gang. Quá trình luyện gang trong lò cao với 3 phản ứng chính:
- Phản ứng tạo chất khử CO (1).
- Phản ứng CO khử iron oxide thành iron (2).
- Phản ứng tạo thành xỉ giữa calcium oxide và sillic dioxide (3).
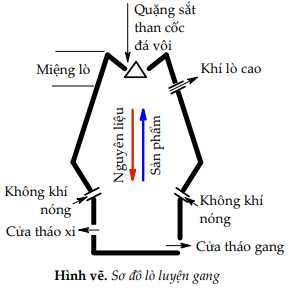
a. Phản ứng xảy ra ở (2) là Fe2O3 + 3CO 2Fe + 3CO2.
2Fe + 3CO2.
b. Trong các phản ứng ở (1), carbon là chất nhận electron.
c. Phản ứng tạo thành xỉ là CaO + SiO2 → CaSiO3.
d. Vai trò của đá vôi trong là loại bỏ tạp chất sillic dioxide có trong quặng
- Phản ứng tạo chất khử CO (1).
- Phản ứng CO khử iron oxide thành iron (2).
- Phản ứng tạo thành xỉ giữa calcium oxide và sillic dioxide (3).

a. Phản ứng xảy ra ở (2) là Fe2O3 + 3CO
 2Fe + 3CO2.
2Fe + 3CO2.b. Trong các phản ứng ở (1), carbon là chất nhận electron.
c. Phản ứng tạo thành xỉ là CaO + SiO2 → CaSiO3.
d. Vai trò của đá vôi trong là loại bỏ tạp chất sillic dioxide có trong quặng
Giai đoạn 1:
C + O2 ⟶ CO2
C + O2 ⟶ CO
Giai đoạn 2 :
3CO + Fe2O3 ⟶ 2Fe + 3CO2
C tăng số oxi hóa trong các giai đoạn ⟶ nhường e
Phân tích các đáp án:
✔️A – Đúng. Phản ứng xảy ra ở (2) là
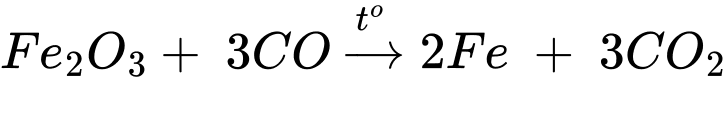
❌B – Sai. Carbon đóng vai trò là chất nhường electron do là chất khử.
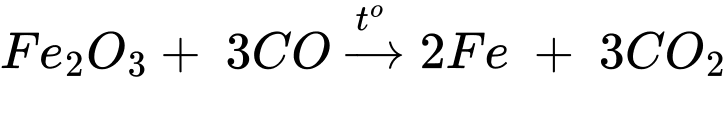
Quá trình oxi hóa: C2+ → C4+ + 2e
Quá trình khử: Fe3+ + 3e → Fe
✔️C – Đúng. Phản ứng tạo thành xỉ là CaO + SiO2 → CaSiO3
✔️D – Đúng. Vai trò của đá vôi là loại bỏ tạp chất sillic dioxide (SiO2) có trong quặng theo quá trình:
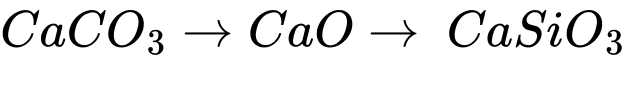
C + O2 ⟶ CO2
C + O2 ⟶ CO
Giai đoạn 2 :
3CO + Fe2O3 ⟶ 2Fe + 3CO2
C tăng số oxi hóa trong các giai đoạn ⟶ nhường e
Phân tích các đáp án:
✔️A – Đúng. Phản ứng xảy ra ở (2) là
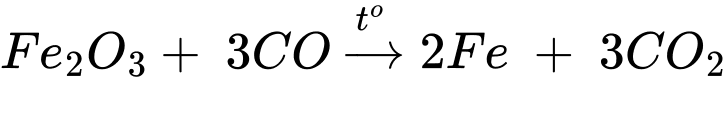
❌B – Sai. Carbon đóng vai trò là chất nhường electron do là chất khử.
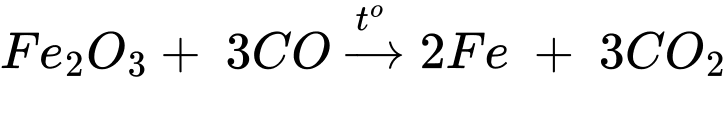
Quá trình oxi hóa: C2+ → C4+ + 2e
Quá trình khử: Fe3+ + 3e → Fe
✔️C – Đúng. Phản ứng tạo thành xỉ là CaO + SiO2 → CaSiO3
✔️D – Đúng. Vai trò của đá vôi là loại bỏ tạp chất sillic dioxide (SiO2) có trong quặng theo quá trình:
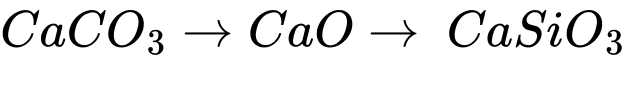
Câu 37 [560701]: Trong công nghiệp, nhôm được sản xuất bằng cách điện phân nóng chảy hỗn hợp aluminium oxide (Al2O3) và cryolite (Na3AlF6) còn gọi là quy trình Hall Héroult:
2Al2O3(s) 4Al(l) + 3O2(g)
4Al(l) + 3O2(g)
Nhiệt độ nóng chảy của hỗn hợp aluminium oxide và cryolite khoảng 950oC, thấp hơn nhiều so với nhiệt độ nóng chảy của aluminium oxide (> 2000oC); ngoài ra, cryolite còn làm tăng độ dẫn điện của hỗn hợp nóng chảy. Trong quá trình điện phân, cực dương làm bằng graphite bị ăn mòn và liên tục được nhúng xuống bể điện phân. Sau một thời gian, các thanh graphite này sẽ được thay mới.
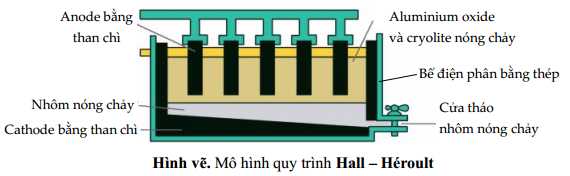
a. Aluminium kim loại được tách ra tại cathode.
b. Cryolite được thêm vào bể điện phân giúp tiết kiệm năng lượng, giảm chi phí sản xuất.
c. Bên cạnh aluminium, oxygen tinh khiết cũng có thể thu được trực tiếp từ quy trình này.
d. Vì anode và cathode đều làm bằng graphite, nên nếu đổi chiều dòng điện (anode trở thành cathode và ngược lại) thì quy trình điện phân vẫn ra bình thường.
2Al2O3(s)
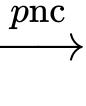 4Al(l) + 3O2(g)
4Al(l) + 3O2(g)Nhiệt độ nóng chảy của hỗn hợp aluminium oxide và cryolite khoảng 950oC, thấp hơn nhiều so với nhiệt độ nóng chảy của aluminium oxide (> 2000oC); ngoài ra, cryolite còn làm tăng độ dẫn điện của hỗn hợp nóng chảy. Trong quá trình điện phân, cực dương làm bằng graphite bị ăn mòn và liên tục được nhúng xuống bể điện phân. Sau một thời gian, các thanh graphite này sẽ được thay mới.

a. Aluminium kim loại được tách ra tại cathode.
b. Cryolite được thêm vào bể điện phân giúp tiết kiệm năng lượng, giảm chi phí sản xuất.
c. Bên cạnh aluminium, oxygen tinh khiết cũng có thể thu được trực tiếp từ quy trình này.
d. Vì anode và cathode đều làm bằng graphite, nên nếu đổi chiều dòng điện (anode trở thành cathode và ngược lại) thì quy trình điện phân vẫn ra bình thường.
Phân tích các phát biểu:
✔️ a. Đúng. Aluminium kim loại được tách ra tại cathode.
✔️ b. Đúng. Cryloite được thêm vào bể điện phân giúp tiết kiệm năng lượng, giảm chi phí sản xuất.
❌ c. Sai. Khí oxygen có lẫn cả CO và CO2 vì O2 phản ứng với điện cực than chì.
❌ d. Sai. Trong quá trình điện phân nhôm oxit, nhôm kim loại được tạo thành ở cathode và chìm xuống đáy bể do mật độ cao hơn cryolite. Nếu đổi cực, nhôm sẽ di chuyển lên trên, điều này không khả thi vì nó không thể nổi qua lớp cryolite.
✔️ a. Đúng. Aluminium kim loại được tách ra tại cathode.
✔️ b. Đúng. Cryloite được thêm vào bể điện phân giúp tiết kiệm năng lượng, giảm chi phí sản xuất.
❌ c. Sai. Khí oxygen có lẫn cả CO và CO2 vì O2 phản ứng với điện cực than chì.
❌ d. Sai. Trong quá trình điện phân nhôm oxit, nhôm kim loại được tạo thành ở cathode và chìm xuống đáy bể do mật độ cao hơn cryolite. Nếu đổi cực, nhôm sẽ di chuyển lên trên, điều này không khả thi vì nó không thể nổi qua lớp cryolite.
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
Câu 38 [560702]: Một khoáng chất có chứa 20,93% nhôm; 21,7% silicon và còn lại là oxygen và hydrogen (về khối lượng). Tổng số nguyên tử trong một phân tử khoáng vật (dạng đơn giản nhất) này là
Điền đáp án: ..........
Điền đáp án: ..........
Giả sử ta có 100 gam quặng loại này.
Tính lần lượt số mol các chất đã biết: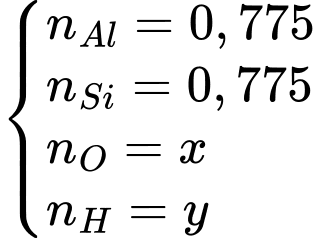
Trong quặng, các nguyên tố sẽ có các số oxi hóa tương ứng Al3+, Si4+, O2-, H+. Ngoài ra, các số oxi hóa này phải đảm bảo cân bằng giữa tổng số oxi hóa âm và dương.
Tóm lại, ta có hệ: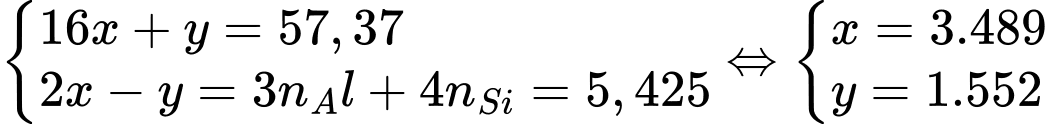
Tỉ lệ nguyên tử Al : Si : O : H = 0,775 : 0,775 : 3,489 : 1,552 = 2 : 2 : 9 : 4
=> Tổng số nguyên tử là 17 nguyên tử.
=> Điền đáp án: 17
Tính lần lượt số mol các chất đã biết:
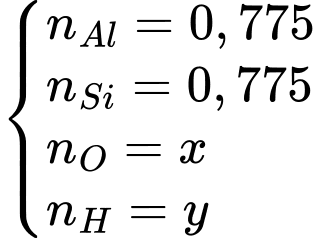
Trong quặng, các nguyên tố sẽ có các số oxi hóa tương ứng Al3+, Si4+, O2-, H+. Ngoài ra, các số oxi hóa này phải đảm bảo cân bằng giữa tổng số oxi hóa âm và dương.
Tóm lại, ta có hệ:
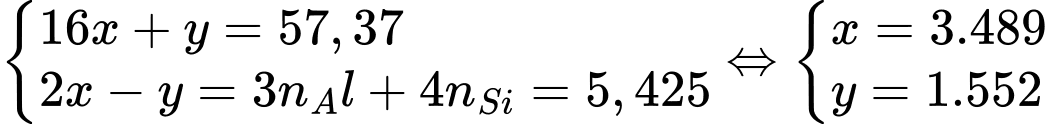
Tỉ lệ nguyên tử Al : Si : O : H = 0,775 : 0,775 : 3,489 : 1,552 = 2 : 2 : 9 : 4
=> Tổng số nguyên tử là 17 nguyên tử.
=> Điền đáp án: 17
Câu 39 [560703]: Một loại khoáng chất X có chứa 13,77% Na; 7,18% Mg; 57,48% O; 2,39% H và còn lại là nguyên tố Y về khối lượng. Số nguyên tử có trong một phân tử khoáng chất X (dạng đơn giản nhất) là
Điền đáp án: ..........
Điền đáp án: ..........
Đặt công thức phân tử là Nax.Mgy.Oz.Ht.Yu
Ta có x : y : z : t : u = (13,77/23) : (7,18/24) : (57,48/16) : (2,39/1) : (19,18/MX)
= 2 : 1 : 12 : 8 : (64/MY)
Vì x, y, z, t, u là những số nguyên nên 64/MY phải là số nguyên.
Biện luận MY có thể là:
+) 2 với u = 32 (loại)
+) 4 với u = 16 (loại)
+) 8 với u = 8 (loại)
+) 16 với u = 4 ⟶ X là O (trùng với oxygen đã có => loại)
+) 32 với u = 2 ⟶ X là S.
+) 64 với u = 1 ⟶ X là Cu (không cân bằng số oxi hóa trong hợp chất => loại)
Vậy, khoáng vật có thể là Na2MgO12H8S2 (Na2SO4.MgSO4.4H2O)
=> Điền đáp án: 25
Ta có x : y : z : t : u = (13,77/23) : (7,18/24) : (57,48/16) : (2,39/1) : (19,18/MX)
= 2 : 1 : 12 : 8 : (64/MY)
Vì x, y, z, t, u là những số nguyên nên 64/MY phải là số nguyên.
Biện luận MY có thể là:
+) 2 với u = 32 (loại)
+) 4 với u = 16 (loại)
+) 8 với u = 8 (loại)
+) 16 với u = 4 ⟶ X là O (trùng với oxygen đã có => loại)
+) 32 với u = 2 ⟶ X là S.
+) 64 với u = 1 ⟶ X là Cu (không cân bằng số oxi hóa trong hợp chất => loại)
Vậy, khoáng vật có thể là Na2MgO12H8S2 (Na2SO4.MgSO4.4H2O)
=> Điền đáp án: 25
Câu 40 [560704]: Scheelite là khoáng vật chứa calcium với volfram với công thức hóa học CaxWyOz và tạp chất. Kết quả phân tích cho thấy trong CaxWyOz có chứa 13,9% là calcium, 63,9% là volfram còn lại là oxygen về khối lượng. Giá trị (x + y + z) là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
%O= 100 - 13,9 - 63,9 = 22,2
=> Tỉ lệ: x : y : z =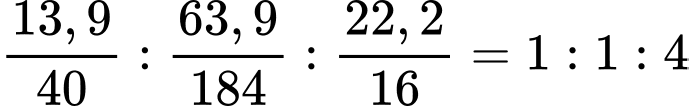
=> Công thức: CaWO4
=> Điền đáp án: 6
=> Tỉ lệ: x : y : z =
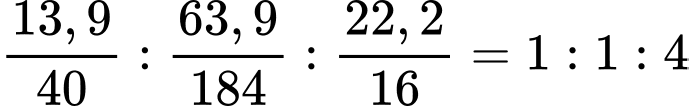
=> Công thức: CaWO4
=> Điền đáp án: 6
Câu 41 [560705]: Phần trăm copper trong quặng thường khá nhỏ nên việc tái chế copper là cần thiết và mang lại nhiều hiệu quả về kinh tế. Từ 5.000 kg một quặng loại copper có thể điều chế được 42,5 kg copper. Phần trăm theo khối lượng của copper trong loại quặng trên là bao nhiêu? (làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
Điền đáp án: ..........
Phần trăm copper trong loại quặng trên là: 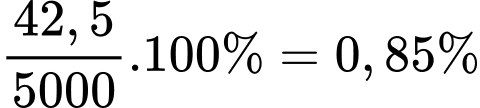
=> Điền đáp án: 0,85
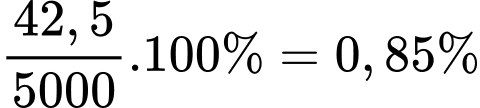
=> Điền đáp án: 0,85
Câu 42 [560706]: Phân tích một loại quặng của titanium thấy rằng cứ 12,0 gam nguyên tử titanium sẽ cần kết hợp với 8,0 gam nguyên tử oxygen. Tổng số nguyên tử trong công thức oxide của titanium ở dạng tối giản nhất là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
Tỉ lệ Ti : O= 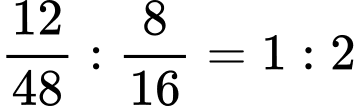
=> Công thức TiO2
=> Điền đáp án: 3
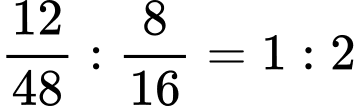
=> Công thức TiO2
=> Điền đáp án: 3
Câu 43 [560707]: Lead được tìm thấy trong vỏ Trái đất dưới dạng quặng. Trong 5.000 kg quặng phát hiện có 48,2 kg kim loại lead. Phần trăm theo khối lượng của lead trong quặng là bao nhiêu? (làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
Điền đáp án: ..........
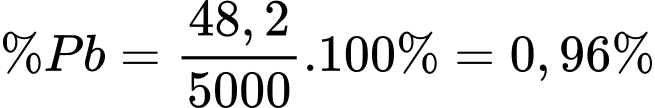
=> Điền đáp án: 0,96
Câu 44 [560708]: Phân tích các mẫu đá Mặt Trăng cho biết thành phần hóa học của bề mặt Mặt Trăng như sau:
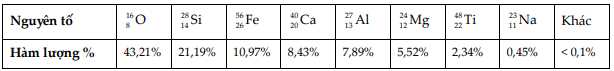
Biết rằng các nguyên tố đều ở dạng oxide, trong đó Ti chỉ ở dạng TiO2. Để xem nguyên tố iron trên bề Mặt Trăng tồn tại chủ yếu ở dạng oxide nào, hãy tính toán giá trị tỉ lệ số mol oxygen và iron (làm tròn đến hàng phần trăm).
Điền đáp án: ..........

Biết rằng các nguyên tố đều ở dạng oxide, trong đó Ti chỉ ở dạng TiO2. Để xem nguyên tố iron trên bề Mặt Trăng tồn tại chủ yếu ở dạng oxide nào, hãy tính toán giá trị tỉ lệ số mol oxygen và iron (làm tròn đến hàng phần trăm).
Điền đáp án: ..........
Giả sử có 100 gam mẫu đá ban đầu.
% oxygen có trong mẫu = tổng % oxygen có trong các oxide.
Số mol oxygen trong các hợp chất = ( khối lượng kim loại / M kim loại ) × số nguyên tử O
=> Điền đáp án: 13,8
% oxygen có trong mẫu = tổng % oxygen có trong các oxide.
Số mol oxygen trong các hợp chất = ( khối lượng kim loại / M kim loại ) × số nguyên tử O
=> Điền đáp án: 13,8
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó
TÁI CHẾ KIM LOẠI NHÔM
Lon nước giải khát bằng nhôm hầu như không được biết đến trước những năm 1960; tuy nhiên vào đầu những năm 1970, hơn 1,3 tỷ pound (0,59 triệu tấn) nhôm đã được sử dụng để sản xuất lon nước. Lý do khiến nhôm được ưa chuộng trong ngành đồ uống là vì nó không độc hại, không mùi, không vị và nhẹ. Hơn nữa, nó dẫn nhiệt nên chất lỏng bên trong lon có thể được làm lạnh nhanh chóng.
Hình ảnh. Tái chế vỏ lon nhôm
Tuy nhiên, nhu cầu về nhôm tăng mạnh cũng có một nhược điểm nhất định. Hơn 3 tỷ pound lon nhôm và tấm kim loại nhôm bị vứt bỏ ở Hoa Kỳ hàng năm. Họ xả rác ở vùng nông thôn và làm tắc nghẽn các bãi chôn lấp. Giải pháp tốt nhất cho vấn đề ô nhiễm môi trường, cũng như tìm cách ngăn chặn sự cạn kiệt nhanh chóng của nguồn tài nguyên hữu hạn nhôm là tái chế.
Lợi ích kinh tế của việc tái chế nhôm là gì? Chúng ta hãy so sánh năng lượng tiêu thụ trong quá trình sản xuất nhôm từ quặng bauxite được khai thác từ tự nhiên với năng lượng tiêu thụ khi nhôm được tái chế.
• Năng lượng cần thiết để sản xuất 1 mol Al từ quặng bauxite là 297 kJ.
• Năng lượng cần thiết để tái chế 1 mol Al là 26,1 kJ.
Để so sánh mức tiêu thụ năng lượng của hai phương pháp này, ta thực hiện phép tính:
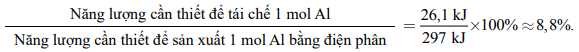
Do đó, bằng cách tái chế lon nhôm, chúng ta có thể tiết kiệm khoảng 91% năng lượng cần thiết để sản xuất kim loại từ quặng bauxite.
Câu 45 [560709]: Theo bài đọc, nhôm thường được dùng để sản xuất vỏ lon nhôm không phải vì lí do nào sau đây?
A, Nhôm không độc hại.
B, Nhôm thường nhẹ hơn các kim loại khác.
C, Nhôm dẫn nhiệt tốt.
D, Nhôm có giá thành rẻ hơn nhựa.
" Lý do nhôm được ưa chuộng trong nghề đồ uống là vì nó không độc hại, không mùi, không vị và nhẹ. Hơn nữa nó dẫn nhiệt tốt nên chất lỏng bên trong có thể làm lạnh nhanh chóng."
=> Không phải do Nhôm có giá rẻ hơn nhựa.
=> Chọn đáp án D Đáp án: D
=> Không phải do Nhôm có giá rẻ hơn nhựa.
=> Chọn đáp án D Đáp án: D
Câu 46 [560710]: Phản ứng tổng thể của quá trình điều chế nhôm từ quặng bauxite như sau:
2Al2O3 (trong cryolit nóng chảy) + 3C(s) 4Al(l) + 3X(g)
4Al(l) + 3X(g)
Khí X được sinh ra trong quá trình trên gây ra hiệu ứng nhà kính. Cho biết X là chất khí nào sau đây?
2Al2O3 (trong cryolit nóng chảy) + 3C(s)
 4Al(l) + 3X(g)
4Al(l) + 3X(g)Khí X được sinh ra trong quá trình trên gây ra hiệu ứng nhà kính. Cho biết X là chất khí nào sau đây?
A, CO.
B, CO2.
C, H2.
D, N2.
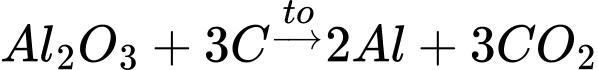
Khí X là CO2
=> Chọn đáp án B Đáp án: B
Câu 47 [560711]: Để tái chế 1 tấn nhôm cần tiêu tốn bao nhiêu năng lượng?
A, 9,67×105 kJ.
B, 5,79×105 kJ.
C, 2,90×105 kJ.
D, 8,45×105 kJ.
nAl= 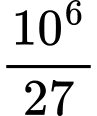 = 37037,04 mol
= 37037,04 mol
=> Năng lượng cần để tái chế 1 tấn Al là 37037,04 . 26,1 = 9,67 . 105
=> Đáp án A Đáp án: A
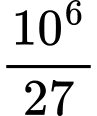 = 37037,04 mol
= 37037,04 mol=> Năng lượng cần để tái chế 1 tấn Al là 37037,04 . 26,1 = 9,67 . 105
=> Đáp án A Đáp án: A
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 48 đến 50
TÁCH VÀ TINH CHẾ KIM LOẠI BẠC
Người ta có thể tách kim loại Ag bằng phương pháp cyanide:👣 Bước 1: Nghiền nhỏ quặng silver sulfide (Ag2S).
👣 Bước 2: Hòa tan quặng bằng dung dịch sodium cyanide (NaCN), rồi lọc để thu được dung dịch chứa phức chất tan của bạc Na[Ag(CN)2]:
Ag2S(s) + 4NaCN(aq) → 2Na[Ag(CN)2](aq) + Na2S(aq) (I)
Do thế điện cực của cặp oxi hóa – khử Ag+/Ag tương đối lớn nên Ag có thể tồn tại ở dạng đơn chất trong quặng. Tuy nhiên nó sẽ chứa nhiều tạp chất, để tinh chế thì có thể sục khí oxygen vào trong hỗn hợp của quặng chứa bạc với dung dịch NaCN:
4Ag(s) + O2(g) + 8NaCN(aq) + 2H2O(l) → 4Na[Ag(CN)2](aq) + 4NaOH(aq) (II)
👣 Bước 3: Sau đó, ion Ag+ trong phức được khử bằng kim loại kẽm:
2Na[Ag(CN)2](aq) + Zn(s) → Na2[Zn(CN)4](aq) + 2Ag(s) (III)
👣 Bước 4: Cuối cùng người ta dùng dung dịch acid không có tính oxi hoá (HCl, H2SO4 loãng) để loại bỏ kẽm dư, bạc không phản ứng với acid trên nên chất rắn thu được sẽ là kim loại bạc tinh khiết.
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Câu 48 [560712]: Theo phương trình (I), nguyên tử Ag trong silver sulfide sau phản ứng có số oxi hóa
A, tăng.
B, giảm.
C, không đổi.
D, không xác định.
Trong hợp chất Na[Ag(CN)2], số oxi hóa của bạc (Ag) là +1.
Trong hợp chất Ag2S, số oxi hóa của bạc (Ag) là +1.
=> Số oxi hóa của Ag không đổi.
=> Chọn đáp án C Đáp án: C
Trong hợp chất Ag2S, số oxi hóa của bạc (Ag) là +1.
=> Số oxi hóa của Ag không đổi.
=> Chọn đáp án C Đáp án: C
Câu 49 [560713]: Theo phương trình (II), khí oxygen được sục vào dung dịch có tác dụng
A, oxi hóa kim loại bạc.
B, loại bỏ tạp chất không tan.
C, khử NaCN.
D, tạo môi trường base.
Do thế điện cực của cặp oxi hóa - khử Ag+/Ag tương đối lớn nên Ag có thể tồn tại ở dạng đơn chất trong quặng. Tuy nhiên nó sẽ chứa nhiều tạp chất, để tinh chế thì có thể sục khí oxygen vào trong hỗn hợp của quặng chứa bạc với dung dịch NaCN:
4Ag(s) + O2(g) + 8NaCN(aq) + 2H2O(I)
⟶4Na[Ag(CN)2](aq) + 4NaOH(aq) (II).
=> Chọn đáp án B Đáp án: B
4Ag(s) + O2(g) + 8NaCN(aq) + 2H2O(I)
⟶4Na[Ag(CN)2](aq) + 4NaOH(aq) (II).
=> Chọn đáp án B Đáp án: B
Câu 50 [560714]: Theo phương trình (III), giả sử phản ứng xảy ra hoàn toàn thì từ 13 gam kẽm sẽ tạo ra tối đa bao nhiêu gam bạc?
A, 21,6 gam.
B, 86,4 gam.
C, 43,2 gam.
D, 94,8 gam.
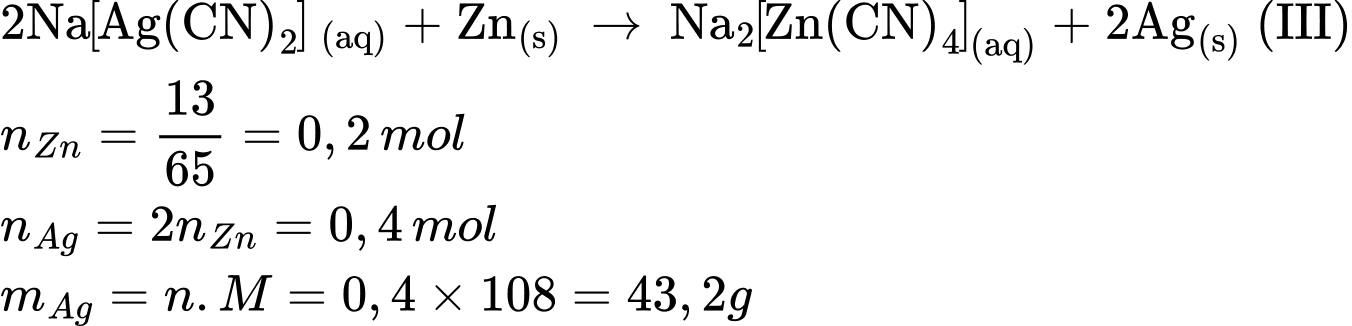
=> Chọn đáp án C Đáp án: C