Quay lại
Đáp án
1C
2D
3C
4A
5B
6C
7B
8C
9B
10D
11A
12B
13A
14C
15C
16A
17A
18A
19C
20C
21B
22A
23C
24A
25D
26B
27A
28B
29C
30D
31D
32A
33D
34A
35A
36A
37B
38D
39B
40A
41B
42D
43D
44C
45A
46A
47A
48A
49B
50A
51D
52D
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85C
86B
87C
88A
89C
90C
Dạng 1: TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.
Câu 1 [628912]: Kim loại nào sau đây là kim loại kiềm?
A, Al.
B, Mg.
C, K.
D, Ca.
Phân nhóm chính IA (kim loại kiềm) bao gồm các nguyên tố:
Li → Li
Na → Na
K → Kéo
Rb → Rèm
Cs → Xe
Fr → Pháp
⟹ Chọn đáp án C Đáp án: C
Li → Li
Na → Na
K → Kéo
Rb → Rèm
Cs → Xe
Fr → Pháp
⟹ Chọn đáp án C Đáp án: C
Câu 2 [233844]: Kim loại nào sau đây là kim loại kiềm?
A, Mg.
B, Ag.
C, Cu.
D, Na.
Kim loại kiềm là các kim loại thuộc nhóm IA trong BTH: Li, K, Na, Rb, Cs.
⟹ Chọn đáp án D Đáp án: D
⟹ Chọn đáp án D Đáp án: D
Câu 3 [59858]: Công thức chung của oxide kim loại thuộc nhóm IA là
A, R2O3.
B, RO2.
C, R2O.
D, RO.
HD Kim loại thuộc nhóm IA có 1 electron ở lớp ngoài cùng → Oxide kim loại thuộc nhóm IA là R2O
→ Chọn đáp án C
Đáp án: C
→ Chọn đáp án C
Đáp án: C
Câu 4 [560785]: Dựa vào cấu hình electron và bán kính nguyên tử, tại sao trong các hợp chất, kim loại nhóm IA đều thể hiện số oxi hoá +1?
A, Bán kính lớn và có 1e hóa trị.
B, Bán kính nhỏ và có 2e hóa trị.
C, Bán kính lớn và có 2e hóa trị.
D, Bán kính nhỏ và cấu hình electron chỉ có 1e.
Các kim loại nhóm IA đều có 1 electron ở lớp ngoài cùng, với cấu hình electron chung là ns1, ví dụ:
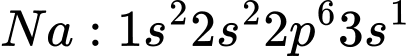
Do dễ mất 1 electron duy nhất ở lớp ngoài cùng do cấu hình electron, bán kính nguyên tử lớn và năng lượng ion hóa thấp là lý do khiến các kim loại nhóm IA luôn thể hiện số oxi hóa +1 trong các hợp chất.
=> Chọn đáp án A Đáp án: A
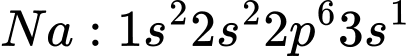
Do dễ mất 1 electron duy nhất ở lớp ngoài cùng do cấu hình electron, bán kính nguyên tử lớn và năng lượng ion hóa thấp là lý do khiến các kim loại nhóm IA luôn thể hiện số oxi hóa +1 trong các hợp chất.
=> Chọn đáp án A Đáp án: A
Câu 5 [560786]: Phát biểu nào sau đây không đúng với kim loại nhóm IA?
A, Có nhiệt độ nóng chảy thấp.
B, Có khối lượng riêng lớn.
C, Đều là các kim loại mềm.
D, Có bán kính nguyên tử lớn nhất so với các nguyên tố cùng chu kì.
Các kim loại nhóm IA đều có độ cứng thấp, dễ nóng chảy, khối lượng riêng nhỏ, dẫn điện tốt. Đáp án: B
Câu 6 [560787]: Vì sao trong tự nhiên không tìm thấy đơn chất kim loại kiềm?
A, Vì kim loại kiềm có 1 electron hóa trị.
B, Vì kim loại kiềm có khối lượng riêng nhỏ.
C, Vì kim loại kiềm có tính khử rất mạnh.
D, Vì kim loại kiềm chỉ có 1 số oxi hóa là +1.
Trong tự nhiên không tìm thấy đơn chất kim loại kiềm vì các kim loại kiềm có tính khử rất mạnh, có khả năng tác dụng với nhiều đơn chất, hợp chất trong môi trường ngay ở điều kiện thường để trở thành hợp chất Đáp án: C
Câu 7 [560788]: Xu hướng biến đổi nhiệt độ nóng chảy của các kim loại nhóm IA từ Li đến Cs là
A, tăng dần.
B, giảm dần.
C, không đổi.
D, không xác định.
Trong nhóm IA, đi từ Li đến Cs: Nhiệt độ nóng chảy và nhiệt độ sôi giảm dần. Đáp án: B
Câu 8 [560789]: Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại khác. Nguyên nhân là do:
(1) Tinh thể có kiểu mạng lập phương tâm khối.
(2) Khối lượng nguyên tử nhỏ hơn các kim loại khác.
(3) Có lực liên kết kim loại yếu.
(1) Tinh thể có kiểu mạng lập phương tâm khối.
(2) Khối lượng nguyên tử nhỏ hơn các kim loại khác.
(3) Có lực liên kết kim loại yếu.
A, (1), (2) và (3).
B, (2) và (3).
C, (1) và (3).
D, (1) và (2).
Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại khác. Nguyên nhân là do:
(1) Tinh thể có kiểu mạng lập phương tâm khối.
(3) Có lực liên kết kim loại yếu. Đáp án: C
(1) Tinh thể có kiểu mạng lập phương tâm khối.
(3) Có lực liên kết kim loại yếu. Đáp án: C
Câu 9 [560790]: Cho khối lượng riêng của một số kim loại: K (0,86 g/cm3), Na (0,97 g/cm3), Mg (1,74 g/cm3), Fe (7,09 g/cm3). Khi cho từng mẩu kim loại trên vào nước, số kim loại nổi trên nước là
A, 1.
B, 2.
C, 3.
D, 4.
Khối lượng riêng của nước d = 1 g/mL (1 mL 1 cm3).
Kim loại nhẹ hơn nước (khối lượng riêng nhỏ hơn 1,0 g/mL) sẽ nổi lên trên nước.
→ Có 2 kim loain nổi trên nước trong dãy trên là: K (0,86 g/cm3), Na (0,97 g/cm3). Đáp án: B
Kim loại nhẹ hơn nước (khối lượng riêng nhỏ hơn 1,0 g/mL) sẽ nổi lên trên nước.
→ Có 2 kim loain nổi trên nước trong dãy trên là: K (0,86 g/cm3), Na (0,97 g/cm3). Đáp án: B
Câu 10 [560791]: Tính chất hóa học chung của kim loại kiềm là
A, tính acid.
B, tính base.
C, tính oxi hóa mạnh.
D, tính khử mạnh.
Tính chất hóa học chung của kim loại kiềm là tính khử mạnh.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 11 [560792]: Khi cắt mẩu sodium ở trong không khí, bề mặt vừa cắt có ánh kim lập tức mờ đi. Điều này được giải thích là vì kim loại sodium phản ứng với oxygen trong không khí tạo thành chất X đồng thời mất đi tính ánh kim của kim loại. Chất X là
A, Sodium oxide.
B, Sodium hydroxide.
C, Sodium hydride.
D, Sodium nitride.
Kim loại sodium phản ứng với oxygen trong không khí tạo thành sodium oxide. Phản ứng xảy ra như sau:
Na + O2 → Na2O (sodium oxide)
Đáp án: A
Câu 12 [560793]: Cho các sơ đồ chuyển hóa sau:
• A + H2O NaOH;
NaOH;
• A B
B  NaOH + O2Chất B được sử dụng để tạo oxygen trong tàu ngầm. Chất A và B lần lượt là
NaOH + O2Chất B được sử dụng để tạo oxygen trong tàu ngầm. Chất A và B lần lượt là
• A + H2O
 NaOH;
NaOH; • A
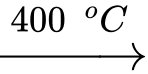 B
B 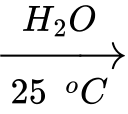 NaOH + O2Chất B được sử dụng để tạo oxygen trong tàu ngầm. Chất A và B lần lượt là
NaOH + O2Chất B được sử dụng để tạo oxygen trong tàu ngầm. Chất A và B lần lượt là A, Na2O2 và Na2O.
B, Na2O và Na2O2.
C, Na2O2 và O2.
D, Na2O và O2.
Phản ứng 1. 
Phản ứng 2: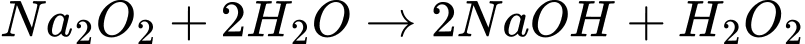
⟹ Chất A là Na2O, chất B là Na2O2.
⟹ Chọn đáp án B Đáp án: B

Phản ứng 2:
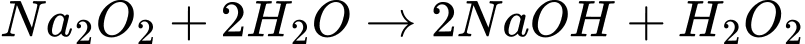
⟹ Chất A là Na2O, chất B là Na2O2.
⟹ Chọn đáp án B Đáp án: B
Câu 13 [560794]: Phương trình hoá học của phản ứng giữa Na với khí Cl2 là
A, 2Na(s) + Cl2(g) → 2NaCl(s).
B, 2Na(s) + Cl2(g) → 2NaCl(g).
C, Na(s) + Cl2(g) → NaCl2(s).
D, 4Na(s) + Cl2(g) → 2Na2Cl(s).
Phản ứng hóa học giữa kim loại Na (s) và khí Cl2 (g) , tạo ra NaCl kết tinh (s)
⟹ chọn đáp án A Đáp án: A
⟹ chọn đáp án A Đáp án: A
Câu 14 [560795]: Lithium rắn phản ứng với nước lạnh tạo thành dung dịch. Phương trình hóa học cân bằng nào đúng cho phản ứng của lithium với nước?
A, Li(s) + H2O(g) → LiOH(aq) + H2(g).
B, Li (s) + H2O(l) → LiOH(aq) + H2(g).
C, 2Li(s) + 2H2O(l) → 2LiOH(aq) + H2(g).
D, 2Li (s) + 2H2O(g) → 2LiOH(aq) + H2(g).
Phản ứng hóa học giữa lithium rắn và nước lạnh tạo thành dung dịch hydroxide và khí hydrogen
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C Đáp án: C
Câu 15 [560796]: Khi cho mẩu nhỏ sodium phản ứng với nước, hiện tượng quan sát được là
A, Mẩu sodium chìm xuống đáy và có khí thoát ra.
B, Mẩu sodium bốc cháy, cho ngọn lửa màu tím.
C, Mẩu sodium chạy trên bề mặt nước, có khí không màu thoát ra.
D, Mẩu sodium bốc cháy kèm tiếng nổ nhỏ.
Khi sodium (Na) phản ứng với nước, nó tạo ra natri hydroxide (NaOH) và khí (H2) . Khí hydrogen không màu và mẩu sodium có thể chạy trên bề mặt nước vì phản ứng sinh nhiệt, khiến sodium nổi lên và di chuyển.
⟹ chọn đáp án C Đáp án: C
⟹ chọn đáp án C Đáp án: C
Câu 16 [560797]: Khi thêm lithium vào nước sẽ tạo ra khí. Thí nghiệm và kết quả nào sẽ xác định chính xác loại khí này?
A, Đốt cháy khí sinh ra ở đầu ống dẫn khí thấy có tiếng nổ nhỏ.
B, Dẫn vào dung dịch nước vôi trong thấy xuất hiện vẩn đục.
C, Cho vào quỳ tím ẩm thấy quỳ tím bị mất màu.
D, Đốt cháy khí sinh ra ở đầu ống dẫn khí thấy ngọn lửa có màu tím nhạt.
Khi hydrogen (H₂) bị đốt cháy, nó sẽ phản ứng với oxygen trong không khí và tạo ra nước, đồng thời phát ra tiếng nổ nhỏ đặc trưng. Đáp án: A
Câu 17 [560798]: Trong phòng thí nghiệm, tại sao khi cho kim loại nhóm IA (Li, Na, K) tác dụng với nước thì cần lấy mẫu kim loại nhỏ?
A, Kim loại nhóm IA phản ứng mãnh liệt với nước.
B, Kim loại nhóm IA rất cứng, khó cắt.
C, Kim loại nhóm IA rất mềm, dễ cắt.
D, Kim loại nhóm IA có khối lượng riêng nhỏ.
Các kim loại nhóm IA phản ứng mạnh với nước để tạo ra kiềm (NaOH, KOH,...) và khí hydrogen (H2), đồng thời tỏa ra một lượng nhiệt lớn. Nếu sử dụng mẫu kim loại lớn, phản ứng sẽ sinh nhiệt mạnh hơn, có thể gây nổ hoặc cháy do khí hidro dễ cháy.
⟹ chọn đáp án A Đáp án: A
⟹ chọn đáp án A Đáp án: A
Câu 18 [560799]: Cho một mẩu nhỏ postassium vào nước thu được dung dịch. Giá trị pH của dung dịch sau phản ứng có thể nhận giá trị nào dưới đây?
A, pH = 11.
B, pH = 2.
C, pH = 7.
D, pH = 6.
2K + 2H2O  2KOH + H2
2KOH + H2
Phản ứng của K với nước sinh ra KOH tạo môi trường base (kiềm) mạnh nên dung dịch sau phản ứng có thể có giá trị pH = 11.
⇒ Chọn đáp án A Đáp án: A
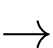 2KOH + H2
2KOH + H2Phản ứng của K với nước sinh ra KOH tạo môi trường base (kiềm) mạnh nên dung dịch sau phản ứng có thể có giá trị pH = 11.
⇒ Chọn đáp án A Đáp án: A
Câu 19 [560800]: Giả sử thế điện hóa quyết định khả năng phản ứng của kim loại kiềm với nước. Cho bảng giá trị sau:
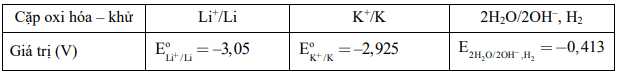
Khi cho potassium và lithium vào trong nước. Nhận định nào sau đây đúng?

Khi cho potassium và lithium vào trong nước. Nhận định nào sau đây đúng?
A, Potassium không phản ứng với nước.
B, Lithium không phản ứng với nước.
C, Potassium phản ứng với nước mạnh hơn lithium.
D, Lithium phản ứng với nước mạnh hơn potassium.
Phân tích các phát biểu:
❌Sai. a. Potassium phản ứng với nước.
❌Sai. b. Lithium phản ứng với nước.
✔️Đúng. c. Potassium phản ứng với nước mạnh hơn lithium.
❌Sai. d. Lithium phản ứng với nước mạnh hơn potassium.
Chọn đáp án C Đáp án: C
❌Sai. a. Potassium phản ứng với nước.
❌Sai. b. Lithium phản ứng với nước.
✔️Đúng. c. Potassium phản ứng với nước mạnh hơn lithium.
❌Sai. d. Lithium phản ứng với nước mạnh hơn potassium.
Chọn đáp án C Đáp án: C
Câu 20 [560801]: Để ngăn ngừa sự hình thành các oxide, peroxide và superoxide, kim loại kiềm đôi khi được bảo quản trong môi trường trơ. Khí nào sau đây không nên dùng để bảo quản lithium
A, Ne.
B, Ar.
C, N2.
D, Kr.
Để bảo quản kim loại kiềm như lithium, ta cần chọn một môi trường khí trơ, không phản ứng với kim loại này
- Ne, Ar, và Kr đều là các khí hiếm thuộc nhóm khí trơ, không phản ứng với lithium, nên chúng phù hợp để bảo quản lithium.
- N2 (nitơ) phản ứng với Lithium ở điều kiện thường tạo Li3N
Phương trình phản ứng: 6Li + N2 → 2Li3N
Không dùng khí N2 để bảo quản lithium
⟹ Chọn đáp án C Đáp án: C
- Ne, Ar, và Kr đều là các khí hiếm thuộc nhóm khí trơ, không phản ứng với lithium, nên chúng phù hợp để bảo quản lithium.
- N2 (nitơ) phản ứng với Lithium ở điều kiện thường tạo Li3N
Phương trình phản ứng: 6Li + N2 → 2Li3N
Không dùng khí N2 để bảo quản lithium
⟹ Chọn đáp án C Đáp án: C
Câu 21 [679749]: Trong phòng thí nghiệm, kim loại Na được bảo quản bằng cách ngâm trong chất lỏng nào sau đây?
A, Nước.
B, Dầu hỏa.
C, Giấm ăn.
D, Ethanol.
HD: Dầu hoả là các hydrocarbon, không có phản ứng với Na, giúp cách li Na với không khí nên dùng bảo quản Na, còn lại:
❌ A. Nước: 2H2O + 2Na → 2NaOH + H2↑.
❌ C. Giấm ăn: 2CH3COOH + 2Na → 2CH3COONa + H2↑.
❌ D. Ethanol: 2C2H5OH + 2Na → 2C2H5ONa + H2↑.
⟹ Chọn đáp án B Đáp án: B
❌ A. Nước: 2H2O + 2Na → 2NaOH + H2↑.
❌ C. Giấm ăn: 2CH3COOH + 2Na → 2CH3COONa + H2↑.
❌ D. Ethanol: 2C2H5OH + 2Na → 2C2H5ONa + H2↑.
⟹ Chọn đáp án B Đáp án: B
Câu 22 [560802]: Để bảo quản kim loại Na, K người ta ngâm chúng trong dầu hoả. Ngoài yếu tố Na, K không phản ứng với dầu hỏa thì còn một yếu tố quyết định nữa là Na, K có khối lượng riêng
A, Lớn hơn dầu hỏa nên sẽ chìm xuống dưới bề mặt của dầu hỏa.
B, Nhỏ hơn dầu hỏa nên sẽ nổi lên trên bề mặt của dầu hỏa.
C, Nhỏ hơn dầu hỏa nên sẽ chìm xuống dưới bề mặt của dầu hỏa.
D, Lớn hơn dầu hỏa nên sẽ nổi lên trên bề mặt của dầu hỏa.
- Na và K rất dễ phản ứng mạnh với nước và không khí (cụ thể là hơi nước và oxy). Để ngăn cản chúng tiếp xúc với môi trường, người ta ngâm chúng trong dầu hỏa.
- Vì khối lượng riêng của Na, K nặng hơn khối lượng riêng của dầu hỏa, chúng sẽ chìm xuống dưới bề mặt dầu hỏa.
⟹ Chọn đáp án A
Đáp án: A
- Vì khối lượng riêng của Na, K nặng hơn khối lượng riêng của dầu hỏa, chúng sẽ chìm xuống dưới bề mặt dầu hỏa.
⟹ Chọn đáp án A
Đáp án: A
Câu 23 [560803]: Khối lượng riêng của dầu hoả khan khoảng 0,80 g/cm3 và lithium là 0,53 g/cm3. Có thể quan sát được hiện tượng gì khi cho một mẩu lithium vào dầu hoả khan?
A, Mẩu lithium phản ứng tạo thành khí không màu.
B, Mẩu lithium phản ứng tạo thành kết tủa màu trắng.
C, Mẩu lithium không phản ứng và nổi trên mặt lớp dầu hỏa khan.
D, Mẩu lithium không phản ứng và chìm xuống dưới lớp dầu hỏa khan.
- Vì khối lượng riêng của lithium nhỏ hơn khối lượng riêng của dầu hỏa khan, mẩu lithium sẽ nổi trên mặt dầu hỏa khan.
- Trong môi trường dầu hỏa khan, không có nước nên lithium không phản ứng với nước.
⟹ Mẩu lithium không phản ứng và nổi trên mặt lớp dầu hỏa khan.
⟹ Chọn đáp án C Đáp án: C
- Trong môi trường dầu hỏa khan, không có nước nên lithium không phản ứng với nước.
⟹ Mẩu lithium không phản ứng và nổi trên mặt lớp dầu hỏa khan.
⟹ Chọn đáp án C Đáp án: C
Câu 24 [560804]: Tại sao Li không phản ứng với dầu hỏa nhưng không nên bảo quản Li trong dầu hỏa?
A, Li có khối lượng riêng nhỏ hơn dầu hỏa.
B, Li có độ cứng thấp.
C, Li có tính ánh kim.
D, Li có nhiệt độ nóng chảy, nhiệt độ sôi thấp.
Li có khối lượng riêng thấp hơn dầu hỏa, nên nó nổi lên trên dầu hỏa và không phản ứng với nó nhưng có thể gây nguy hiểm trong những điều kiện nhất định (như nhiệt độ cao, phản ứng với không khí hoặc chất khác) và không đảm bảo sự ổn định lâu dài.
⟹ Chọn đáp án A Đáp án: A
⟹ Chọn đáp án A Đáp án: A
Câu 25 [560805]: Trong các kim loại sau, kim loại nào thường được dùng làm tế bào quang điện?
A, Na.
B, K.
C, Rb.
D, Cs.
- Cs có khả năng dễ dàng nhả electron khi bị chiếu sáng, có tính năng quang điện tốt.
- Na (Natri), K (Kali) và Rb (Rubidi) không được sử dụng trong các tế bào quang điện chủ yếu vì khó cho electron hơn khi bị chiếu sáng, có tính ổn định kém và hiệu suất kém.
⟹ Chọn đáp án D Đáp án: D
- Na (Natri), K (Kali) và Rb (Rubidi) không được sử dụng trong các tế bào quang điện chủ yếu vì khó cho electron hơn khi bị chiếu sáng, có tính ổn định kém và hiệu suất kém.
⟹ Chọn đáp án D Đáp án: D
Câu 26 [560806]: Sodium chloride được dùng để làm gia vị thức ăn, điều chế sodium, xút, nước Javel. Công thức của sodium chloride là
A, Na2CO3.
B, NaCl.
C, NaHCO3.
D, KCl.
Công thức của Sodium chloride là:
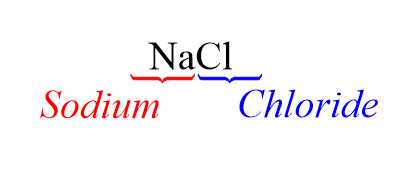
các chất còn lại có tên gọi như sau:
Na2CO3: sodium carbonate
NaHCO3: sodium bicarbonate
KCl: potassium chloride
⇒ Chọn đáp án B Đáp án: B

các chất còn lại có tên gọi như sau:
Na2CO3: sodium carbonate
NaHCO3: sodium bicarbonate
KCl: potassium chloride
⇒ Chọn đáp án B Đáp án: B
Câu 27 [560807]: Nước muối sinh lí là dung dịch nồng độ 0,9% của muối X, có tác dụng diệt khuẩn và sát trùng. Muối X là
A, NaCl.
B, NaClO.
C, Na2SO4.
D, NaNO3.
- NaClO có tính oxy hóa mạnh có thể gây hại cho các tế bào và mô sống nếu tiếp xúc lâu dài.
- Na2SO4 có thể gây mất cân bằng điện giải hoặc kích ứng trong cơ thể khi sử dụng. Nó không có tính chất diệt khuẩn và không phù hợp để duy trì sự ổn định của môi trường sinh lý.
- NaNO3 là một muối nitrat, và muối nitrat có thể tham gia vào các phản ứng tạo ra các hợp chất có thể gây độc hại nếu có mặt trong cơ thể với nồng độ cao.
⟹ NaCl là muối duy nhất trong các lựa chọn này có tính chất tương thích với cơ thể người, giúp duy trì sự cân bằng điện giải (nồng độ ion Na⁺ và Cl⁻ trong cơ thể) và không gây tác dụng phụ.
⟹ Chọn đáp án A Đáp án: A
- Na2SO4 có thể gây mất cân bằng điện giải hoặc kích ứng trong cơ thể khi sử dụng. Nó không có tính chất diệt khuẩn và không phù hợp để duy trì sự ổn định của môi trường sinh lý.
- NaNO3 là một muối nitrat, và muối nitrat có thể tham gia vào các phản ứng tạo ra các hợp chất có thể gây độc hại nếu có mặt trong cơ thể với nồng độ cao.
⟹ NaCl là muối duy nhất trong các lựa chọn này có tính chất tương thích với cơ thể người, giúp duy trì sự cân bằng điện giải (nồng độ ion Na⁺ và Cl⁻ trong cơ thể) và không gây tác dụng phụ.
⟹ Chọn đáp án A Đáp án: A
Câu 28 [560808]: Sodium hydroxide (hay xút ăn da) là chất rắn, không màu, dễ nóng chảy, hút ẩm mạnh, tan nhiều trong nước và tỏa ra một lượng nhiệt lớn. Công thức của sodium hydroxide là
A, Ca(OH)2.
B, NaOH.
C, NaHCO3.
D, Na2CO3.
Hydroxide là một nhóm chức hóa học, công thức hóa học là OH−, gồm một nguyên tử oxygen liên kết với một nguyên tử hydrogen
⤑ Sodium là Na; hydroxide là OH nên sodium hydroxide có công thức là NaOH.
⇒ Chọn đáp án B Đáp án: B
⤑ Sodium là Na; hydroxide là OH nên sodium hydroxide có công thức là NaOH.
⇒ Chọn đáp án B Đáp án: B
Câu 29 [560809]: Phương pháp điều chế NaOH trong công nghiệp là
A, Cho kim loại Na tác dụng với nước.
B, Cho Na2O tác dụng với nước.
C, Điện phân dung dịch NaCl bão hoà có màng ngăn.
D, Điện phân dung dịch NaCl bão hoà, không có màng ngăn.
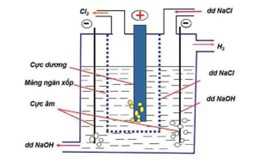
Phương pháp điều chế NaOH trong công nghiệp là Điện phân dung dịch NaCl bão hoà có màng ngăn
⟹ Chọn đáp án C Đáp án: C
Câu 30 [560810]: Sodium hydrogencarbonate được dùng làm thuốc giảm đau dạ dày do thừa acid. Công thức của Sodium hydrogencarbonate là
A, KHCO3.
B, Na2CO3.
C, K2CO3.
D, NaHCO3.
Sodium hydrogencarbonate (NaHCO3), còn gọi là baking soda, có tính chất lưỡng tính, có thể phản ứng với cả acid và base.
Tên của các hợp chất còn lại:
A. KHCO3: Patossium hydrogencarbonate
B. Na2CO3: Sodium carbonate
C. K2CO3: Patossium carbonate
D. NaHCO3: Sodium hydrogencarbonate
⇒ Chọn đáp án D Đáp án: D
Tên của các hợp chất còn lại:
A. KHCO3: Patossium hydrogencarbonate
B. Na2CO3: Sodium carbonate
C. K2CO3: Patossium carbonate
D. NaHCO3: Sodium hydrogencarbonate
⇒ Chọn đáp án D Đáp án: D
Câu 31 [560811]: Soda khan (không ngậm nước) là hóa chất quan trọng trong sản xuất thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức hóa học của soda khan là
A, NaCl.
B, Na2SO4.
C, NaNO3.
D, Na2CO3.
Công thức hóa học của soda khan là Na2CO3 (Sodium carbonat).
Tên các chất còn lại:
A. NaCl: Sodium chloride (hay còn gọi là muối ăn).
B. Na2SO4: Sodium sulfate
C. NaNO3: Sodium nitrate
⟹ Chọn đáp án D Đáp án: D
Tên các chất còn lại:
A. NaCl: Sodium chloride (hay còn gọi là muối ăn).
B. Na2SO4: Sodium sulfate
C. NaNO3: Sodium nitrate
⟹ Chọn đáp án D Đáp án: D
Câu 32 [560812]: Diêm tiêu potassium được dùng chế tạo thuốc nổ đen (làm mìn phá đá), đồng thời được dùng làm phân bón, cung cấp nguyên tố nitrogen và potassium cho cây trồng. Công thức hóa học của diêm tiêu potassium là
A, KNO3.
B, K2CO3.
C, KCl.
D, K2SO4.
Diêm tiêu potassium cung cấp nguyên tố nitrogen và potassium cho cây trồng nên trong phân tử phải có cả nguyên tố N và K.
Loại các đáp án B, C, D vì không có N.
Công thức hóa học của diêm tiêu potassium là KNO3.
⇒ Chọn đáp án A Đáp án: A
Loại các đáp án B, C, D vì không có N.
Công thức hóa học của diêm tiêu potassium là KNO3.
⇒ Chọn đáp án A Đáp án: A
Câu 33 [560813]: Dựa vào phản ứng của công nghiệp chlorine – kiềm:
2NaCl(aq) + 2H2O(1)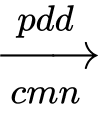 2NaOH(aq) + Cl2(g) + H2(g)
2NaOH(aq) + Cl2(g) + H2(g)
Chất nào sau đây không phải là sản phẩm cơ bản của công nghiệp chlorine – kiềm?
2NaCl(aq) + 2H2O(1)
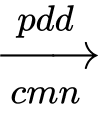 2NaOH(aq) + Cl2(g) + H2(g)
2NaOH(aq) + Cl2(g) + H2(g)Chất nào sau đây không phải là sản phẩm cơ bản của công nghiệp chlorine – kiềm?
A, Sodium hydroxide.
B, Khí hydrogen.
C, Khí chlorine.
D, Khí oxygen.
A. Sodium hydroxide ( NaOH )
B.Khí hydrogen ( H2 )
C.Khí chlorine ( Cl2 )
D.Khí oxygen ( O2 )
⟹ Chọn D vì không có oxygen trong phương trình phản ứng. Đáp án: D
B.Khí hydrogen ( H2 )
C.Khí chlorine ( Cl2 )
D.Khí oxygen ( O2 )
⟹ Chọn D vì không có oxygen trong phương trình phản ứng. Đáp án: D
Câu 34 [560814]: Ống dẫn nước của bồn rửa bát thường có lớp dầu, mỡ bám vào. Giải thích vì sao nên dùng soda, không nên dùng baking soda để tẩy rửa lớp bám này?
A, Soda tan trong nước tạo môi trường base giúp thủy phân dầu, mỡ.
B, Baking soda tan trong nước tạo môi trường acid giúp thủy phân dầu, mỡ.
C, Dung dịch soda là môi trường phân cực hòa tan tốt các chất dầu, mỡ.
D, Dung dịch baking soda là môi trường kém phân cực hòa tan tốt các chất dầu, mỡ.
Soda (Na2CO3):
- Khi tan trong nước, Na2CO3 thủy phân tạo ra ion OH⁻, làm cho dung dịch có tính base mạnh.
- Lớp dầu, mỡ là các ester, có thể bị thủy phân trong môi trường base, phá vỡ cấu trúc của chúng và làm sạch bề mặt.
Baking soda (NaHCO3):
- Khi tan trongnước, NaHCO3 chỉ tạo môi trường hơi kiềm, yếu hơn so với Na2CO3. Do đó, khả năng thủy phân dầu, mỡ của NaHCO3 là rất thấp.
⇒ Chọn đáp án A Đáp án: A
- Khi tan trong nước, Na2CO3 thủy phân tạo ra ion OH⁻, làm cho dung dịch có tính base mạnh.
- Lớp dầu, mỡ là các ester, có thể bị thủy phân trong môi trường base, phá vỡ cấu trúc của chúng và làm sạch bề mặt.
Baking soda (NaHCO3):
- Khi tan trongnước, NaHCO3 chỉ tạo môi trường hơi kiềm, yếu hơn so với Na2CO3. Do đó, khả năng thủy phân dầu, mỡ của NaHCO3 là rất thấp.
⇒ Chọn đáp án A Đáp án: A
Câu 35 [560815]: Phương trình nào sau đây giải thích việc NaHCO3 được dùng làm bột nở?
A, 2NaHCO3(s)  Na2CO3(s) + CO2(g) + H2O(g).
Na2CO3(s) + CO2(g) + H2O(g).
 Na2CO3(s) + CO2(g) + H2O(g).
Na2CO3(s) + CO2(g) + H2O(g).B, 2NaHCO3(s)  Na2O(s) + 2CO2(g) + H2O(g).
Na2O(s) + 2CO2(g) + H2O(g).
 Na2O(s) + 2CO2(g) + H2O(g).
Na2O(s) + 2CO2(g) + H2O(g).C, Na2CO3(s) + CO2(g) + H2O(g)  2NaHCO3(s).
2NaHCO3(s).
 2NaHCO3(s).
2NaHCO3(s).D, NaHCO3(s)  Na(s) + CO2(g) + H2O(g).
Na(s) + CO2(g) + H2O(g).
 Na(s) + CO2(g) + H2O(g).
Na(s) + CO2(g) + H2O(g).
- Khi NaHCO3 bị phân hủy (nở) dưới tác động của nhiệt, nó sẽ tạo ra sodium carbonate (Na2CO3), khí CO2 và hơi nước (H2O). Khí CO2 này giúp làm nở các loại bánh, tạo ra các bọt khí nhỏ trong quá trình nướng.
⟹ Chọn đáp án A Đáp án: A
⟹ Chọn đáp án A Đáp án: A
Câu 36 [560816]: Trong phòng thí nghiệm, tại sao khi cần dùng dung môi hữu cơ khan thì lại dùng sodium để loại nước khỏi dung môi hữu cơ?
A, Sodium nhạy và phản ứng tốt với nước.
B, Sodium không phản ứng với tất cả dung môi hữu cơ.
C, Sodium không phản ứng với nước.
D, Sodium phản ứng được với các dung môi hữu cơ.
- Khi cần loại nước khỏi dung môi hữu cơ khan, sodium được sử dụng vì phản ứng mạnh với nước, tạo ra hydrocarbon (đặc biệt là các hydrua) và giải phóng khí hydro. Quá trình này giúp loại bỏ nước, giữ cho dung môi hữu cơ khan (không chứa nước).
- B sai vì sodium có thể phản ứng với một số dung môi hữu cơ, đặc biệt là các dung môi có nhóm chức có thể tương tác với sodium (chẳng hạn như các alcohol hoặc ester).
- C sai vì sodium phản ứng rất mạnh với nước. Khi sodium tiếp xúc với nước.
- D sai vì mục đích sử dụng sodium ở đây là để loại bỏ nước, chứ không phải để phản ứng với chính dung môi hữu cơ.
⟹ Chọn đáp án A. Đáp án: A
- B sai vì sodium có thể phản ứng với một số dung môi hữu cơ, đặc biệt là các dung môi có nhóm chức có thể tương tác với sodium (chẳng hạn như các alcohol hoặc ester).
- C sai vì sodium phản ứng rất mạnh với nước. Khi sodium tiếp xúc với nước.
- D sai vì mục đích sử dụng sodium ở đây là để loại bỏ nước, chứ không phải để phản ứng với chính dung môi hữu cơ.
⟹ Chọn đáp án A. Đáp án: A
Câu 37 [982756]: Dung dịch nào sau đây làm quỳ tím chuyển sang màu xanh?
A, NaCl.
B, NaOH.
C, KHSO4.
D, KNO3.
Dung dịch NaCl, KNO3 có môi trường trung tính, pH = 7, không làm quỳ tím đổi màu.
Dung dịch NaOH có môi trường bazơ, pH > 7, làm quỳ tím hóa xanh.
Dung dịch KHSO4 có môi trường axit, pH < 7, làm quỳ tím hóa đỏ.
⟹ Chọn đáp án B Đáp án: B
Dung dịch NaOH có môi trường bazơ, pH > 7, làm quỳ tím hóa xanh.
Dung dịch KHSO4 có môi trường axit, pH < 7, làm quỳ tím hóa đỏ.
⟹ Chọn đáp án B Đáp án: B
Câu 38 [911583]: Chất nào sau đây không tác dụng với dung dịch NaOH?
A, FeCl2.
B, CuSO4.
C, MgCl2.
D, KNO3.
Phân tích các đáp án:
✔️ A. FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl.
✔️ B. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
✔️ C. MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl.
❌ D. KNO3 + NaOH ⇝ không xảy ra phản ứng.
⟹ Chọn đáp án D Đáp án: D
✔️ A. FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl.
✔️ B. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
✔️ C. MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl.
❌ D. KNO3 + NaOH ⇝ không xảy ra phản ứng.
⟹ Chọn đáp án D Đáp án: D
Câu 39 [679454]: Cho các chất sau: CrO3, Fe, Cr(OH)3, Cr. Số chất tan được trong dung dịch NaOH là
A, 1.
B, 2.
C, 3.
D, 4.
HD: Phân tích các chất:
✔️ CrO3: acidic oxide, phản ứng với NaOH tạo muối tương ứng và nước:
CrO3 + 2NaOH → Na2CrO4 + H2O.
❌❌ Fe và Cr là hai kim loại, không phản ứng với NaOH dù có đun nóng.
✔️ Cr(OH)3: hydroxide lưỡng tính, phản ứng được với cả HCl và NaOH:
Cr(OH)3 + NaOH → NaCrO2 + 2H2O.
⇝ có 2/4 chất thỏa mãn yêu cầu
⇝ Chọn đáp án B Đáp án: B
✔️ CrO3: acidic oxide, phản ứng với NaOH tạo muối tương ứng và nước:
CrO3 + 2NaOH → Na2CrO4 + H2O.
❌❌ Fe và Cr là hai kim loại, không phản ứng với NaOH dù có đun nóng.
✔️ Cr(OH)3: hydroxide lưỡng tính, phản ứng được với cả HCl và NaOH:
Cr(OH)3 + NaOH → NaCrO2 + 2H2O.
⇝ có 2/4 chất thỏa mãn yêu cầu
⇝ Chọn đáp án B Đáp án: B
Câu 40 [792342]: Chất nào sau đây tác dụng với dung dịch KHCO3 sinh ra khí CO2?
A, HCl.
B, K2SO4.
C, NaCl.
D, Na2SO4.
HD: K2SO4; NaCl và Na2SO4 là các muối trung tính, không phản ứng với KHCO3, chỉ có HCl phản ứng được với KHCO3 và "thật may mắn" khi nó cũng sinh ra khí CO2 thỏa mãn yêu cầu:
• HCl + KHCO3 → KCl + CO2↑ + H2O.
⟹ Chọn đáp án A Đáp án: A
• HCl + KHCO3 → KCl + CO2↑ + H2O.
⟹ Chọn đáp án A Đáp án: A
Câu 41 [39846]: Hợp chất nào sau đây được dùng để làm bột nở cho bánh kẹo, chất tạo khí trong thuốc sủi bọt và thuốc trị chứng thừa axit trong dạ dày?
A, Na2CO3.
B, NaHCO3.
C, NaCl.
D, NaOH.
HD: Ứng dụng làm bột nở do NaHCO3 dễ bị nhiệt phân hủy sinh ra khí CO2 và H2O.
Ứng dụng làm thuốc do NaHCO3 có khả năng phản ứng với acid dư trong dạ dày.
⟹ Chọn đáp án B Đáp án: B
Ứng dụng làm thuốc do NaHCO3 có khả năng phản ứng với acid dư trong dạ dày.
⟹ Chọn đáp án B Đáp án: B
Câu 42 [62466]: Hóa chất NaOH rắn có thể làm khô các khí nào trong số các khí sau
A, H2S.
B, SO2.
C, CO2.
D, NH3.
HD: NaOH rắn hút ẩm, nhưng phản ứng được với H2S, SO2, CO2. Vì vậy NaOH rắn chỉ làm khô được khí NH3 trong các khí trên.
⟹ Chọn đáp án D Đáp án: D
⟹ Chọn đáp án D Đáp án: D
Câu 43 [59951]: Cho dãy chuyển hóa sau: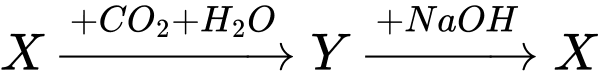
Công thức của X là
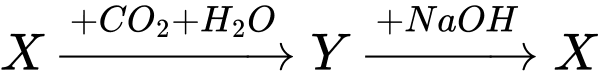
Công thức của X là
A, NaHCO3.
B, NaOH.
C, Na2O.
D, Na2CO3.
HD:
Na2CO3 + CO2 + H2O → 2NaHCO3.
NaHCO3 + NaOH → Na2CO3 + H2O.
Đáp án: D
Na2CO3 + CO2 + H2O → 2NaHCO3.
NaHCO3 + NaOH → Na2CO3 + H2O.
Đáp án: D
Câu 44 [241139]: Nhỏ từ từ đến dư dung dịch NaOH loãng vào mỗi dung dịch sau: FeCl3, CuCl2, AlCl3, FeSO4. Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp thu được kết tủa là
A, 4.
B, 2.
C, 3.
D, 1.
HD• - 3NaOH + FeCl3 → Fe(OH)3↓ + 3NaCl
- 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
- 3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl; NaOH + Al(OH)3 → NaAlO2 + 2H2O
- 2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓
→ Có 3 trường hợp thu được kết tủa
→ Chọn đáp án C
Đáp án: C
- 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
- 3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl; NaOH + Al(OH)3 → NaAlO2 + 2H2O
- 2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓
→ Có 3 trường hợp thu được kết tủa
→ Chọn đáp án C
Đáp án: C
Câu 45 [560817]: Trong quá trình Solvay, X là một trong những sản phẩm được tạo thành khi calcium hydroxide phản ứng với ammonium chloride. X ở trạng thái rắn là một chất màu trắng, nó là sản phẩm cuối của quá trình Solvay và được thải ra đại dương. Chất X là
A, Calcium chloride.
B, Calcium carbonate.
C, Calcium oxide.
D, Calcium hydrogencarbonate.
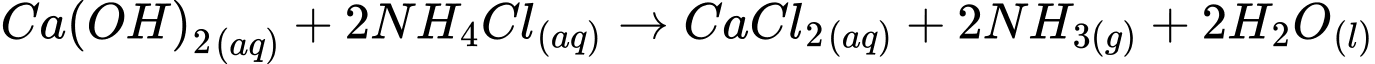
- Calcium chloride (CaCl₂) là sản phẩm chính trong phản ứng này và nó có thể được thải ra trong quá trình Solvay.
Công thức các câu còn lại
- B. Calcium carbonate : CaCO3.
- C. Calcium oxide: CaO.
- D. Calcium hydrogencarbonate: Ca(HCO3)2.
⟹ Chọn đáp án A. Đáp án: A
Câu 46 [560818]: Nguyên liệu thô là bất kỳ nguyên liệu chưa qua chế biến và được sử dụng trong quá trình sản xuất.
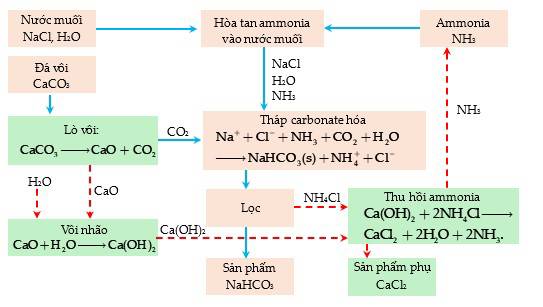

Hình ảnh. Quy trình Solvay.
Xác định ba chất chính đóng vai trò là nguyên liệu thô trong quy trình Solvay. A, Nước muối, ammonia và đá vôi.
B, Nước, ammonia và carbon dioxide.
C, Nước muối, ammonia và carbon dioxide.
D, Nước, sodium hydrogencarbonate và calcium oxide.
- Nước muối (NaCl): Cung cấp ion sodium (Na⁺) cho quá trình tạo ra sodium carbonate (Na2CO3).
- Ammonia (NH3): Tham gia vào phản ứng với nước muối để tạo ra ammonia và ammonium bicarbonate, một bước quan trọng trong quá trình Solvay.
- Đá vôi (CaCO3): Được sử dụng để tạo ra calcium carbonate (CaCO3) và calcium oxide (CaO) trong quá trình.
- B,C sai vì carbon dioxide ( CO2) là sản phẩm tạo ra trong quá trình.
- D sai vì sodium hydrogencarbonate ( NaHCO3) và calcium oxide ( CaO )
⟹ Chọn đáp án A. Đáp án: A
- Ammonia (NH3): Tham gia vào phản ứng với nước muối để tạo ra ammonia và ammonium bicarbonate, một bước quan trọng trong quá trình Solvay.
- Đá vôi (CaCO3): Được sử dụng để tạo ra calcium carbonate (CaCO3) và calcium oxide (CaO) trong quá trình.
- B,C sai vì carbon dioxide ( CO2) là sản phẩm tạo ra trong quá trình.
- D sai vì sodium hydrogencarbonate ( NaHCO3) và calcium oxide ( CaO )
⟹ Chọn đáp án A. Đáp án: A
Câu 47 [560819]: Trong quá trình Solvay, ở giai đoạn tạo thành NaHCO3 tồn tại cân bằng sau:
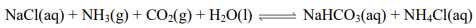
Khi làm lạnh dung dịch trên, muối bị tách ra khỏi dung dịch là
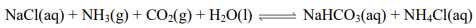
Khi làm lạnh dung dịch trên, muối bị tách ra khỏi dung dịch là
A, NaHCO3.
B, NH4Cl.
C, NaCl.
D, NH4HCO3.
- Trong quá trình Solvay, khi làm lạnh dung dịch chứa NaHCO3, muối NaHCO3 sẽ tách ra khỏi dung dịch. Điều này là do NaHCO3 ít tan trong nước lạnh hơn so với trong nước nóng.
⟹ Chọn đáp án A. Đáp án: A
⟹ Chọn đáp án A. Đáp án: A
Câu 48 [560820]: Nhúng đầu dây platinum vào dung dịch sodium chlorine. Sau đó, đưa đầu dây platinum vào ngọn lửa đèn khí thì xuất hiện ngọn lửa màu
A, vàng.
B, tím.
C, xanh.
D, đỏ.
Khi sodium chloride bị đốt nóng, các ion sodium (Na+) phát ra ánh sáng vàng đặc trưng.
⟹ Chọn đáp án A Đáp án: A
⟹ Chọn đáp án A Đáp án: A
Câu 49 [560821]: Nhúng đầu dây platinum vào dung dịch potassium nitrate. Sau đó, đưa đầu dây platinum vào ngọn lửa đèn khí thì xuất hiện ngọn lửa màu
A, vàng.
B, tím.
C, xanh.
D, đỏ.
Khi potassium (K+) bị đốt nóng, các ion potassium phát ra ánh sáng màu tím đặc trưng.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 50 [560822]: Nhúng đầu dây platinum vào dung dịch hydroxide của một kim loại kiềm; sau đó, đưa đầu dây platinum vào ngọn lửa đèn khí thì có xuất hiện ngọn lửa màu đỏ tía. Hợp chất hydroxide của kim loại kiềm có công thức là
A, LiOH.
B, NaOH.
C, KOH.
D, Sr(OH)2.
Khi đầu dây bạch kim (Pt) được nhúng vào dung dịch hydroxide của loại kim Kiềm vào ngọn lửa, sẽ tạo ra màu đặc biệt của nguyên tố trong nhóm kim loại kiềm hoặc kiềm thổ:
- Li : đỏ
- Na: vàng
- K: tím
- Sr: đỏ son
⟹ Chọn đáp án A Đáp án: A
- Li : đỏ
- Na: vàng
- K: tím
- Sr: đỏ son
⟹ Chọn đáp án A Đáp án: A
Câu 51 [560823]: Dung dịch của mỗi chất sau đều không màu: Na2SO4, KCl, LiNO3. Có thể phân biệt các dung dịch trên bằng
A, quỳ tím ẩm.
B, dung dịch Ba(OH)2.
C, dung dịch AgNO3.
D, Đốt cháy trên ngọn lửa.
Đốt các mẫu thử có kết tủa trắng trên ngọn lửa:
- Ngọn lửa màu tím nhạt: KCl
- Ngọn lửa màu vàng: Na2SO4
- Ngọn lửa màu đỏ tía: LiNO3
⟹ Chọn đáp án: D Đáp án: D
- Ngọn lửa màu tím nhạt: KCl
- Ngọn lửa màu vàng: Na2SO4
- Ngọn lửa màu đỏ tía: LiNO3
⟹ Chọn đáp án: D Đáp án: D
Câu 52 [560824]: Có ba ống nghiệm chứa riêng biệt: dung dịch soda, dung dịch lithium chloride, dung dịch potassium carbonate. Với mỗi dung dịch, nhúng đầu dây platinum vào rồi đem đốt trên ngọn lửa đèn khí. Dự đoán hiện tượng xảy ra khi đốt mỗi dung dịch.
A, Dung dịch trong ống nghiệm chứa soda sẽ cháy với ngọn lửa màu vàng.
B, Dung dịch trong ống nghiệm chứa lithium chloride sẽ cháy với ngọn lửa màu đỏ tía.
C, Dung dịch trong ống nghiệm chứa potassium carbonate sẽ cháy với ngọn lửa màu tím.
D, Có thể dựa vào màu ngọn lửa để nhận biết ba dung dịch: soda, lithium chloride, potassium carbonate.
- Dung dịch soda (Na2CO3):Thành phần chính chứa ion Na+. Khi đốt, ngọn lửa phát ra ánh sáng màu vàng sáng đặc trưng của ion Na+.
- Dung dịch lithium chloride (LiCl): Thành phần chính chứa ion Li+. Khi đốt, ngọn lửa phát ra ánh sáng màu đỏ thẫm đặc trưng của ion Li+.
- Dung dịch potassium carbonate (K2CO3): Thành phần chính chứa ion K+.
Khi đốt, ngọn lửa phát ra ánh sáng màu đỏ tím đặc trưng của ion K+.
⟹ Có thể dựa vào màu ngọn lửa để nhận biết ba dung dịch: soda, lithium chloride, potassium carbonate.
⟹ Chọn đáp án D Đáp án: D
- Dung dịch lithium chloride (LiCl): Thành phần chính chứa ion Li+. Khi đốt, ngọn lửa phát ra ánh sáng màu đỏ thẫm đặc trưng của ion Li+.
- Dung dịch potassium carbonate (K2CO3): Thành phần chính chứa ion K+.
Khi đốt, ngọn lửa phát ra ánh sáng màu đỏ tím đặc trưng của ion K+.
⟹ Có thể dựa vào màu ngọn lửa để nhận biết ba dung dịch: soda, lithium chloride, potassium carbonate.
⟹ Chọn đáp án D Đáp án: D
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.
Câu 53 [560825]: Các kim loại nhóm IA và hợp chất của chúng có nhiều ứng dụng trong đời sống.

a. Các kim loại nhóm IA có cấu hình electron lớp ngoài cùng là ns1(với n > 1).
b. Các kim loại nhóm IA có bán kính nguyên tử nhỏ nhất so với cácnguyên tố cùng chu kì.
c. Tính khử giảm dần từ lithium đến ceasium.
d. Các kim loại kiềm có thế điện cực chuẩn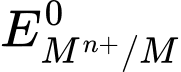 rất nhỏ.
rất nhỏ.

a. Các kim loại nhóm IA có cấu hình electron lớp ngoài cùng là ns1(với n > 1).
b. Các kim loại nhóm IA có bán kính nguyên tử nhỏ nhất so với cácnguyên tố cùng chu kì.
c. Tính khử giảm dần từ lithium đến ceasium.
d. Các kim loại kiềm có thế điện cực chuẩn
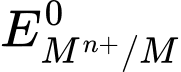 rất nhỏ.
rất nhỏ.
✔️a. Đúng. Các kim loại nhóm IA có cấu hình electron lớp ngoài cùng là ns, với n là số hiệu chu kỳ của nguyên tố.
❌b. Sai. Các kim loại nhóm IA có bán kính nguyên tử lớn hơn các nguyên tố cùng chu kỳ, ngoại trừ lithium. Lithium có bán kính nguyên tử nhỏ nhất trong nhóm IA, nhưng khi di chuyển xuống dưới nhóm, bán kính tăng lên.
❌c. Sai. Tính khử tăng dần từ lithium đến cesium vì bán kính nguyên tử tăng lên, làm giảm lực hút giữa hạt nhân và electron ngoài cùng, khiến electron dễ bị mất hơn.
✔️d. Đúng. Các kim loại kiềm có thế điện cực chuẩn (E°) rất nhỏ (thường là âm), phản ánh khả năng dễ bị oxi hóa của chúng.
❌b. Sai. Các kim loại nhóm IA có bán kính nguyên tử lớn hơn các nguyên tố cùng chu kỳ, ngoại trừ lithium. Lithium có bán kính nguyên tử nhỏ nhất trong nhóm IA, nhưng khi di chuyển xuống dưới nhóm, bán kính tăng lên.
❌c. Sai. Tính khử tăng dần từ lithium đến cesium vì bán kính nguyên tử tăng lên, làm giảm lực hút giữa hạt nhân và electron ngoài cùng, khiến electron dễ bị mất hơn.
✔️d. Đúng. Các kim loại kiềm có thế điện cực chuẩn (E°) rất nhỏ (thường là âm), phản ánh khả năng dễ bị oxi hóa của chúng.
Câu 54 [560826]: Một số thông số vật lí của kim loại nhóm IA được cho ở bảng dưới đây
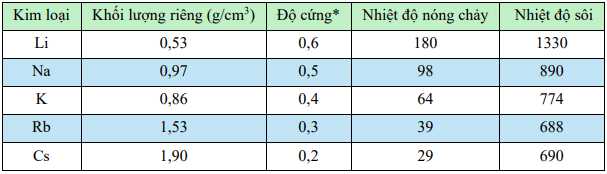
a. Đi từ lithium đến caesium, nhiệt độ nóng chảy giảm dần.
b. Các kim loại nhóm IA đều là kim loại nặng.
c. Các kim loại Li, Na, K, Rb khi phản ứng với nước đều nổi trên bề mặt dầu hỏa (d = 0,8 g/cm3).
d. Các kim loại nhóm IA đều có độ cứng thấp, dễ dàng dùng dao cắt đượcdo có lực liên kết kim loại yếu.

a. Đi từ lithium đến caesium, nhiệt độ nóng chảy giảm dần.
b. Các kim loại nhóm IA đều là kim loại nặng.
c. Các kim loại Li, Na, K, Rb khi phản ứng với nước đều nổi trên bề mặt dầu hỏa (d = 0,8 g/cm3).
d. Các kim loại nhóm IA đều có độ cứng thấp, dễ dàng dùng dao cắt đượcdo có lực liên kết kim loại yếu.
✔️a. Đúng. Nhiệt độ nóng chảy của các kim loại nhóm IA giảm dần khi đi từ lithium (Li) đến caesium (Cs).
❌b. Sai. Các kim loại nhóm IA (Li, Na, K, Rb, Cs) là kim loại nhẹ, không phải kim loại nặng.
❌c.Sai. Li có khối lượng riêng < dầu hỏa => nổi trên dầu hỏa.
✔️d. Đúng. Các kim loại nhóm IA có độ cứng thấp và dễ cắt vì lực liên kết kim loại giữa các nguyên tử yếu.
❌b. Sai. Các kim loại nhóm IA (Li, Na, K, Rb, Cs) là kim loại nhẹ, không phải kim loại nặng.
❌c.Sai. Li có khối lượng riêng < dầu hỏa => nổi trên dầu hỏa.
✔️d. Đúng. Các kim loại nhóm IA có độ cứng thấp và dễ cắt vì lực liên kết kim loại giữa các nguyên tử yếu.
Câu 55 [560827]: Postassium (Z=19) là kim loại tạo nên nhiều hợp chất quan trọng trong đời sống.
a. Postassium thuộc vào chu kì 3, nhóm IA trong bảng tuần hoàn.
b. Nguyên tử postassium có chứa 1 electron độc thân.
c. Bán kính nguyên tử của postassium lớn nhất trong nhóm IA.
d. Postassium phản ứng với nước mãnh liệt hơn caesium.
a. Postassium thuộc vào chu kì 3, nhóm IA trong bảng tuần hoàn.
b. Nguyên tử postassium có chứa 1 electron độc thân.
c. Bán kính nguyên tử của postassium lớn nhất trong nhóm IA.
d. Postassium phản ứng với nước mãnh liệt hơn caesium.
❌ a. Sai. Potassium (K) thuộc vào chu kỳ 4, nhóm IA trong bảng tuần hoàn (không phải chu kỳ 3).
✔️ b. Đúng. Nguyên tử potassium có chứa 1 electron độc thân trong lớp vỏ ngoài cùng (cấu hình electron là [Ar] 4s1).
❌ c. Sai . Bán kính nguyên tử của potassium bé nhất trong nhóm IA, vì khi đi xuống nhóm, bán kính nguyên tử tăng dần.
❌ d. Sai. Potassium phản ứng với nước mạnh, nhưng cesium (Cs) phản ứng mạnh mẽ hơn với nước và gây ra phản ứng nổ mạnh hơn.
✔️ b. Đúng. Nguyên tử potassium có chứa 1 electron độc thân trong lớp vỏ ngoài cùng (cấu hình electron là [Ar] 4s1).
❌ c. Sai . Bán kính nguyên tử của potassium bé nhất trong nhóm IA, vì khi đi xuống nhóm, bán kính nguyên tử tăng dần.
❌ d. Sai. Potassium phản ứng với nước mạnh, nhưng cesium (Cs) phản ứng mạnh mẽ hơn với nước và gây ra phản ứng nổ mạnh hơn.
Câu 56 [560828]: Muối NaHCO3 dùng để tạo bọt và tăng pH trong các loại thuốc sủi bọt khi người bệnh bị dư acid.
a. Dịch dạ dày của người bị dư acid có pH thấp.
b. NaHCO3 có tính lưỡng tính nên phản ứng được với ion H+.
c. Khi sử dụng NaHCO3 thì nồng độ H+giảm, từ đó giá trị pH giảm.
d. Các bọt khí sinh ra trong quá trình phản ứng là khí CO2.
a. Dịch dạ dày của người bị dư acid có pH thấp.
b. NaHCO3 có tính lưỡng tính nên phản ứng được với ion H+.
c. Khi sử dụng NaHCO3 thì nồng độ H+giảm, từ đó giá trị pH giảm.
d. Các bọt khí sinh ra trong quá trình phản ứng là khí CO2.
✔️a. Đúng. Dịch dạ dày có pH thấp (thường khoảng 1.5-3.5) do có acid clohidric (HCl), đặc biệt khi người bệnh bị dư acid.
✔️b. Đúng. NaHCO3 có thể phản ứng với ion H⁺ (acid) để tạo ra CO2, nước và muối. Đây là lý do tại sao NaHCO3 được dùng để trung hòa acid dạ dày.
❌c. Sai. Khi NaHCO3 phản ứng với acid (H+), nó làm tăng pH, vì NaHCO3 trung hòa acid, làm giảm nồng độ ion H+, do đó pH tăng lên chứ không giảm.
✔️d. Đúng. Khi NaHCO3 phản ứng với acid, khí CO2 sinh ra, và ion H⁺ trong dịch dạ dày bị giảm, dẫn đến tăng pH.
✔️b. Đúng. NaHCO3 có thể phản ứng với ion H⁺ (acid) để tạo ra CO2, nước và muối. Đây là lý do tại sao NaHCO3 được dùng để trung hòa acid dạ dày.
❌c. Sai. Khi NaHCO3 phản ứng với acid (H+), nó làm tăng pH, vì NaHCO3 trung hòa acid, làm giảm nồng độ ion H+, do đó pH tăng lên chứ không giảm.
✔️d. Đúng. Khi NaHCO3 phản ứng với acid, khí CO2 sinh ra, và ion H⁺ trong dịch dạ dày bị giảm, dẫn đến tăng pH.
Câu 57 [560829]: Kim loại nhóm IA phản ứng với nước rất mãnh liệt ngay ở nhiệt độ thường, tiến hành thí nghiệm thêm một mầu nhỏ lithium vào nước.
a. Khi cho lithium vào nước sẽ tạo thành lithium hydroxide và khíhydrogen.
b. Dung dịch thu được sau phản ứng có pH < 7.
c. Trong phản ứng với nước, lithium đóng vai trò là chất khử, đã nhậnthêm 1 electron.
d. Thay lithium bằng postassium thấy phản ứng xảy ra mãnh liệt hơn.Điều này cho thấy thế điện cực chuẩn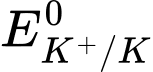 <
< 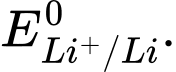
a. Khi cho lithium vào nước sẽ tạo thành lithium hydroxide và khíhydrogen.
b. Dung dịch thu được sau phản ứng có pH < 7.
c. Trong phản ứng với nước, lithium đóng vai trò là chất khử, đã nhậnthêm 1 electron.
d. Thay lithium bằng postassium thấy phản ứng xảy ra mãnh liệt hơn.Điều này cho thấy thế điện cực chuẩn
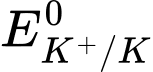 <
< 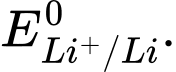
Phân tích các phát biểu:
✔️ a. Đúng: Khi lithium (Li) phản ứng với nước (H2O), phản ứng tạo ra lithium hydroxide (LiOH) và khí hydrogen (H2) theo phương trình:
❌ c. Sai: Trong phản ứng này, lithium (Li) đóng vai trò là chất khử, nó mất electron, không nhận electron.
❌ d. Sai: Khi thay lithium bằng potassium (K), phản ứng xảy ra mạnh mẽ hơn. Chứng tỏ thế điện cực của K+/K < Li+/Li. Tuy nhiên, thực tế thế điện cực của Li+/Li = -3,040V < K+/K = -2,924V.
✔️ a. Đúng: Khi lithium (Li) phản ứng với nước (H2O), phản ứng tạo ra lithium hydroxide (LiOH) và khí hydrogen (H2) theo phương trình:
2Li + 2H2O → 2LiOH + H2
❌ b. Sai: Dung dịch thu được sẽ có pH > 7, vì lithium hydroxide (LiOH) là một base❌ c. Sai: Trong phản ứng này, lithium (Li) đóng vai trò là chất khử, nó mất electron, không nhận electron.
❌ d. Sai: Khi thay lithium bằng potassium (K), phản ứng xảy ra mạnh mẽ hơn. Chứng tỏ thế điện cực của K+/K < Li+/Li. Tuy nhiên, thực tế thế điện cực của Li+/Li = -3,040V < K+/K = -2,924V.
Câu 58 [560830]: Các kim loại kiềm có thế điện cực chuẩn rất âm, do đó chúng đều phản ứng với nước ở điều kiện thường. Tiến hành thí nghiệm kiểm chứng với sodium bằng cách cho một mẩu sodium nhỏ vào cốc nước có chứa vài giọt phenolphthalein.
a. Sodium bị hoà tan nhanh chóng là do hiện tượng ăn mòn điện hoá.
b. Cốc nước chuyển từ không màu sang màu hồng.
c. Khí thoát ra trong thí nghiệm là một khí dễ cháy.
d. Nếu thay mẩu sodium bằng mẩu lithium cùng kích thước thì phản ứngdiễn ra chậm hơn.
a. Sodium bị hoà tan nhanh chóng là do hiện tượng ăn mòn điện hoá.
b. Cốc nước chuyển từ không màu sang màu hồng.
c. Khí thoát ra trong thí nghiệm là một khí dễ cháy.
d. Nếu thay mẩu sodium bằng mẩu lithium cùng kích thước thì phản ứngdiễn ra chậm hơn.
❌ a. Sai: Sodium phản ứng nhanh chóng với nước. Quá trình này xảy ra theo cơ chế ăn mòn hóa học.
✔️c. Đúng: Khí thoát ra là khí hydrogen (H2), và khí này dễ cháy.
✔️d. Đúng: Lithium có độ phản ứng thấp hơn sodium, nên khi thay mẩu sodium bằng lithium, phản ứng sẽ diễn ra chậm hơn.
2Na + 2H2O → 2NaOH + H2
✔️b. Đúng. Phenolphthalein chỉ chuyển sang màu hồng trong môi trường kiềm . Trong phản ứng tạo NaOH là 1 base nên làm phenolphtalein chuyển màu.✔️c. Đúng: Khí thoát ra là khí hydrogen (H2), và khí này dễ cháy.
✔️d. Đúng: Lithium có độ phản ứng thấp hơn sodium, nên khi thay mẩu sodium bằng lithium, phản ứng sẽ diễn ra chậm hơn.
Câu 59 [560831]: Tiến hành thí nghiệm như sau: Cho mỗi mẫu kim loại vào một chậu thuỷ tinh chứa nước, hiện tượng xảy ra được ghi lại trong bảng sau:

a. Từ thí nghiệm trên có thể dự đoán các kim loại kiềm đều tham gia phảnứng mãnh liệt với nước ở nhiệt độ thường.
b. Phương trình tổng quát của phản ứng diễn ra trong thí nghiệm như sau:2M + 2H2O → 2MOH + H2.
c. Thí nghiệm trên cho thấy tính khử giảm dần từ Li đến K.
d. Cho quỳ tím vào ba dung dịch sau phản ứng thì quỳ tím đều chuyển hồng.

a. Từ thí nghiệm trên có thể dự đoán các kim loại kiềm đều tham gia phảnứng mãnh liệt với nước ở nhiệt độ thường.
b. Phương trình tổng quát của phản ứng diễn ra trong thí nghiệm như sau:2M + 2H2O → 2MOH + H2.
c. Thí nghiệm trên cho thấy tính khử giảm dần từ Li đến K.
d. Cho quỳ tím vào ba dung dịch sau phản ứng thì quỳ tím đều chuyển hồng.
❌ a. Sai. Các kim loại kiềm (như Li, Na, K,…) đều có tính phản ứng với nước ở nhiệt độ thường, tạo thành dung dịch kiềm và khí hydrogen. Tuy nhiên, Li phản ứng chậm với nước hơn so với Na và K.
Điều này chứng tỏ kim loại kiềm tham gia phản ứng mạnh với nước.
❌ c. Sai. Tính khử của các kim loại kiềm tăng dần từ Li đến K. Do tốc độ phản ứng tăng dần từ Li đến K.
❌ d. Sai. Khi cho quỳ tím vào các dung dịch hydroxide của kim loại kiềm (NaOH, KOH,...), quỳ tím sẽ chuyển màu xanh, chứng tỏ các dung dịch này có tính base.
Điều này chứng tỏ kim loại kiềm tham gia phản ứng mạnh với nước.
✔️ b. Đúng.
Trong đó M là kim loại kiềm, tạo thành hydroxide kim loại kiềm.❌ c. Sai. Tính khử của các kim loại kiềm tăng dần từ Li đến K. Do tốc độ phản ứng tăng dần từ Li đến K.
❌ d. Sai. Khi cho quỳ tím vào các dung dịch hydroxide của kim loại kiềm (NaOH, KOH,...), quỳ tím sẽ chuyển màu xanh, chứng tỏ các dung dịch này có tính base.
Câu 60 [560832]: Dùng kẹp lấy các mẩu kim loại (Li, Na, K) có kích cỡ xấp xỉ nhau đã thấm khô dầu và cho vào chậu thuỷ tinh đã chứa khoảng 1/3 thể tích nước. Thêm 2 - 3 giọt dung dịch phenolphthalein vào chậu.
a. Sau khi kim loại tan hết các dung dịch thu được sau phản ứng đều cómàu hồng.
b. Trong nước, potassium tan nhanh hơn so với sodium, sodium tan nhanhhơn so với lithium.
c. Các cặp oxi hoá – khử M+/M (M: Li, Na, K) đều có giá trị thế điện cựcchuẩn lớn hơn giá trị thế điện cực của cặp oxi hoá – khử 2H2O/ H2, 2OH–.
d. Kết quả thí nghiệm cho kết luận tính khử của các kim loại tăng dần theo dãy K, Na, Li.
a. Sau khi kim loại tan hết các dung dịch thu được sau phản ứng đều cómàu hồng.
b. Trong nước, potassium tan nhanh hơn so với sodium, sodium tan nhanhhơn so với lithium.
c. Các cặp oxi hoá – khử M+/M (M: Li, Na, K) đều có giá trị thế điện cựcchuẩn lớn hơn giá trị thế điện cực của cặp oxi hoá – khử 2H2O/ H2, 2OH–.
d. Kết quả thí nghiệm cho kết luận tính khử của các kim loại tăng dần theo dãy K, Na, Li.
✔️ a. Đúng. Khi kim loại nhóm 1 (Li, Na, K) phản ứng với nước, sẽ tạo ra các dung dịch kiềm (NaOH, KOH, LiOH) làm phenolphthalein chuyển sang màu hồng.
✔️ b. Đúng. Potassium (K) tan nhanh hơn sodium (Na), và sodium tan nhanh hơn lithium (Li) khi tiếp xúc với nước, vì tính phản ứng của chúng tăng dần từ Li → Na → K.
❌ c. Sai. Các cặp oxi hoá-khử của Li, Na, K (M+/M) có thế điện cực chuẩn lần lượt là: Li+/Li: -3.04 V; Na+/Na: -2.71 V; K+/K: -2.93 V .
Thế điện cực chuẩn của cặp 2H+/H2 là 0 V, và các giá trị này đều < 0, do đó, các cặp oxi hoá-khử của M+/M có thế điện cực < 2H+/H2.
❌ d. Sai. Tính khử của các kim loại trong nhóm này tăng dần từ Li, Na đến K.
✔️ b. Đúng. Potassium (K) tan nhanh hơn sodium (Na), và sodium tan nhanh hơn lithium (Li) khi tiếp xúc với nước, vì tính phản ứng của chúng tăng dần từ Li → Na → K.
❌ c. Sai. Các cặp oxi hoá-khử của Li, Na, K (M+/M) có thế điện cực chuẩn lần lượt là: Li+/Li: -3.04 V; Na+/Na: -2.71 V; K+/K: -2.93 V .
Thế điện cực chuẩn của cặp 2H+/H2 là 0 V, và các giá trị này đều < 0, do đó, các cặp oxi hoá-khử của M+/M có thế điện cực < 2H+/H2.
❌ d. Sai. Tính khử của các kim loại trong nhóm này tăng dần từ Li, Na đến K.
Câu 61 [560833]: Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch sodium chloride bão hoà trong bình điện phân có màng ngăn xốp. Phương trình hoá học của quá trình điện phân là: 2NaCl(aq) + 2H2O(1) 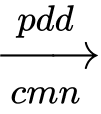 2NaOH(aq) + Cl2(g) + H2(g).
2NaOH(aq) + Cl2(g) + H2(g).
a. Anion Cl–bị khử thành khí chlorine tại anode.
b. Tại cathode, thu được sodium hydroxide.
c. Nếu không có màng ngăn xốp, nước Javel được hình thành trong bìnhđiện phân.
d. Hydrogen cũng là một sản phẩm có giá trị của công nghiệp chlorine –kiềm.
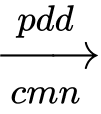 2NaOH(aq) + Cl2(g) + H2(g).
2NaOH(aq) + Cl2(g) + H2(g).a. Anion Cl–bị khử thành khí chlorine tại anode.
b. Tại cathode, thu được sodium hydroxide.
c. Nếu không có màng ngăn xốp, nước Javel được hình thành trong bìnhđiện phân.
d. Hydrogen cũng là một sản phẩm có giá trị của công nghiệp chlorine –kiềm.
❌a. Sai. Tại anode, anion Cl- bị oxy hóa thành khí chlorine (Cl2), theo phương trình: 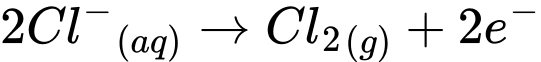
✔️b. Đúng. Tại cathode, nước (H2O) bị khử thành khí hydro (H2) theo phương trình:
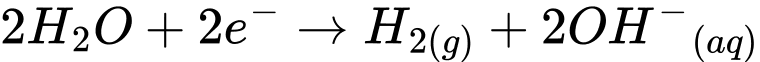
Sodium hydroxide (NaOH) là sản phẩm được tạo thành trong dung dịch do OH- kết hợp với Na+.
✔️c. Đúng. Nếu không có màng ngăn xốp, các sản phẩm chlorine (Cl2) và sodium hydroxide (NaOH) có thể phản ứng với nhau để tạo ra nước Javel, chứa hypochlorite (NaClO), theo phương trình:
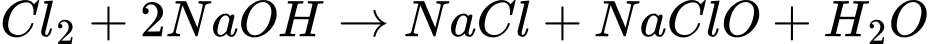
✔️d. Đúng. Hydrogen (H2) là một sản phẩm phụ có giá trị trong quá trình điện phân, thường được thu ở cathode và có nhiều ứng dụng công nghiệp.
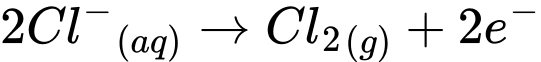
✔️b. Đúng. Tại cathode, nước (H2O) bị khử thành khí hydro (H2) theo phương trình:
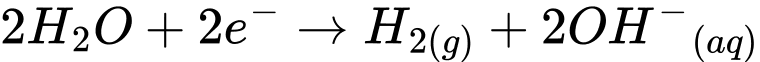
Sodium hydroxide (NaOH) là sản phẩm được tạo thành trong dung dịch do OH- kết hợp với Na+.
✔️c. Đúng. Nếu không có màng ngăn xốp, các sản phẩm chlorine (Cl2) và sodium hydroxide (NaOH) có thể phản ứng với nhau để tạo ra nước Javel, chứa hypochlorite (NaClO), theo phương trình:
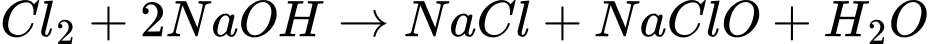
✔️d. Đúng. Hydrogen (H2) là một sản phẩm phụ có giá trị trong quá trình điện phân, thường được thu ở cathode và có nhiều ứng dụng công nghiệp.
Câu 62 [560834]: Trong công nghiệp, sodium hydrogencarbonate (baking soda) và sodium carbonate (soda) được sản xuất bằng phương pháp Solvay từ nguyên liệu chính là đá vôi, muối ăn, ammonia và nước theo sơ đồ sau:
Độ tan của NaHCO3 ở t1 = 20 °C và ở t2 = 40 °C lần lượt là 9,6 g/100 g nước và 12,7 g/100 g nước.
a. Đá vôi đóng vai trò cung cấp CO2 cho quá trình Solvay.
b. Phương trình hóa học chuyển hóa NaHCO3 thành Na2CO3 là: 2NaHCO3 (s) Na2CO3(s) + CO2(g) + H2O(g)
Na2CO3(s) + CO2(g) + H2O(g)
c. Quy trình điều chế theo sơ đồ trên có thể tái chế NH3 và CO2.
d. Khi giảm nhiệt độ của 225,4 gam dung dịch NaHCO3 bão hoà từ t2 về t1 thì khối lượng muối NaHCO3 kết tinh là 2,83 gam.

Độ tan của NaHCO3 ở t1 = 20 °C và ở t2 = 40 °C lần lượt là 9,6 g/100 g nước và 12,7 g/100 g nước.
a. Đá vôi đóng vai trò cung cấp CO2 cho quá trình Solvay.
b. Phương trình hóa học chuyển hóa NaHCO3 thành Na2CO3 là: 2NaHCO3 (s)
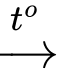 Na2CO3(s) + CO2(g) + H2O(g)
Na2CO3(s) + CO2(g) + H2O(g)c. Quy trình điều chế theo sơ đồ trên có thể tái chế NH3 và CO2.
d. Khi giảm nhiệt độ của 225,4 gam dung dịch NaHCO3 bão hoà từ t2 về t1 thì khối lượng muối NaHCO3 kết tinh là 2,83 gam.
✔️ a. Đúng: Đá vôi (CaCO3) khi bị nung nóng sẽ phân hủy thành calcium oxide (CaO) và CO2. CO2 sau đó được sử dụng trong quá trình Solvay để phản ứng với amoniac (NH3) và muối ăn (NaCl), từ đó tạo ra sodium hydrogencarbonate (NaHCO3) và sodium carbonate (Na2CO3).
✔️ b. Đúng: Phương trình phản ứng đúng là: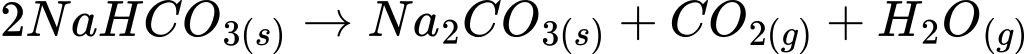
Đây là phản ứng phân hủy nhiệt của NaHCO₃.
✔️ c. Đúng: Quy trình Solvay có thể tái chế ammonia (NH3) để giảm thiểu chi phí và tài nguyên. Trong quá trình này, NH3 được sử dụng để tạo ra amoniac trong dung dịch, sau đó có thể được thu hồi và tái sử dụng.
❌ d. Sai. Khi giảm nhiệt độ của 225,4 gam dung dịch NaHCO3 bão hoà từ t2 về t1 thì khối lượng muối NaHCO3 kết tinh là 5,66 gam.
Lượng NaHCO3 bão hoà trong 225,4 g dung dịch ở 40 oC là:
(225,4. 12,7): (100 + 12,7) = 25,40 (g).
Lượng NaHCO3 bão hoà trong 225,4 g dung dịch ở 20 oC là:
(225,4.9,6): (100 + 9,6) = 19,74 (g).
Lượng NaHCO3 kết tinh khi làm giảm nhiệt độ dung dịch là:
25,40 – 19,74 = 5,66 (g).
✔️ b. Đúng: Phương trình phản ứng đúng là:
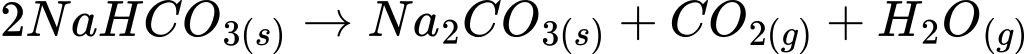
Đây là phản ứng phân hủy nhiệt của NaHCO₃.
✔️ c. Đúng: Quy trình Solvay có thể tái chế ammonia (NH3) để giảm thiểu chi phí và tài nguyên. Trong quá trình này, NH3 được sử dụng để tạo ra amoniac trong dung dịch, sau đó có thể được thu hồi và tái sử dụng.
❌ d. Sai. Khi giảm nhiệt độ của 225,4 gam dung dịch NaHCO3 bão hoà từ t2 về t1 thì khối lượng muối NaHCO3 kết tinh là 5,66 gam.
Lượng NaHCO3 bão hoà trong 225,4 g dung dịch ở 40 oC là:
(225,4. 12,7): (100 + 12,7) = 25,40 (g).
Lượng NaHCO3 bão hoà trong 225,4 g dung dịch ở 20 oC là:
(225,4.9,6): (100 + 9,6) = 19,74 (g).
Lượng NaHCO3 kết tinh khi làm giảm nhiệt độ dung dịch là:
25,40 – 19,74 = 5,66 (g).
Câu 63 [560835]: Soda (Na2CO3) là một trong những chất có nhiều ứng dụng quan trọng. Để “tối ưu hóa” quy trình sản xuất soda (quy trình Solvay), nhà hóa học Hou Debang đã sử dụng sodium chloride làm nguyên liệu thô và thực hiện theo sơ đồ được mô tả ngắn gọn dưới đây.
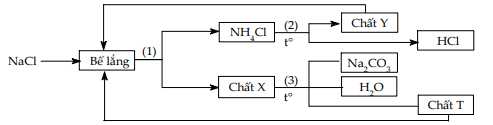
a. Chất X, Y, T lần lượt là NaHCO3, CO2, NH3.
b. Trong sơ đồ trên hai hóa chất được tái sử dụng là chất T và chất Y.
c. Phương trình phản ứng ở (1) là NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl.
d. Nguyên liệu ban đầu cần dùng duy nhất trong quy trình Solvay là NaCl.

a. Chất X, Y, T lần lượt là NaHCO3, CO2, NH3.
b. Trong sơ đồ trên hai hóa chất được tái sử dụng là chất T và chất Y.
c. Phương trình phản ứng ở (1) là NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl.
d. Nguyên liệu ban đầu cần dùng duy nhất trong quy trình Solvay là NaCl.
- NaHCO3 (chất X): Kết tủa từ phản ứng (1).
- CO2 (chất T): Được sử dụng trong các bước để tạo NaHCO3.
- NH3 (chất Y): Được tái sử dụng sau các phản ứng.
❌ a. Sai. Chất X,Y,T lần lượt là NaHCO3, NH3, CO2.
✔️b.Đúng. Hai hóa chất được tái sử dụng là chất T và chất Y
- NH3 (chất Y) được tái sử dụng và CO2 (chất T)
✔️c.Đúng. Phương trình phản ứng (1) là
NaCl + NH3 + CO2 + H2O ⟶ NaHCO3 + NH4Cl.
❌ d. Sai. Nguyên liệu ban đầu cần duy nhất trong quy trình Solvay là NaCl. Ngoài NaCl, quy trình còn cần CO2 và NH3 từ bên ngoài, không chỉ dựa duy nhất vào NaCl.
- CO2 (chất T): Được sử dụng trong các bước để tạo NaHCO3.
- NH3 (chất Y): Được tái sử dụng sau các phản ứng.
❌ a. Sai. Chất X,Y,T lần lượt là NaHCO3, NH3, CO2.
✔️b.Đúng. Hai hóa chất được tái sử dụng là chất T và chất Y
- NH3 (chất Y) được tái sử dụng và CO2 (chất T)
✔️c.Đúng. Phương trình phản ứng (1) là
NaCl + NH3 + CO2 + H2O ⟶ NaHCO3 + NH4Cl.
❌ d. Sai. Nguyên liệu ban đầu cần duy nhất trong quy trình Solvay là NaCl. Ngoài NaCl, quy trình còn cần CO2 và NH3 từ bên ngoài, không chỉ dựa duy nhất vào NaCl.
Câu 64 [560836]: Soda được sản xuất theo phương pháp Solvay theo các phương trình hoá học:
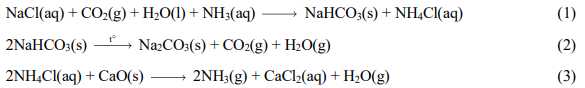
a. Phản ứng (1) cho thấy H2CO3 (CO2 + H2O) có tính acid mạnh hơndung dịch HCl.
b. Muối sodium hydrogencarbonate ít tan trong nước và kém bền khi bịnung nóng.
c. Phản ứng (3) nhằm thu hồi và tái sử dụng NH3.
d. Trong phản ứng (2) khối lượng chất rắn giảm 45% sau khi nung (giảsử hiệu suất nung là 100%).
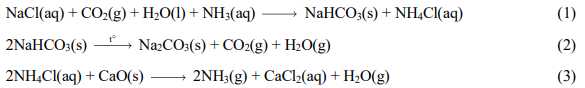
a. Phản ứng (1) cho thấy H2CO3 (CO2 + H2O) có tính acid mạnh hơndung dịch HCl.
b. Muối sodium hydrogencarbonate ít tan trong nước và kém bền khi bịnung nóng.
c. Phản ứng (3) nhằm thu hồi và tái sử dụng NH3.
d. Trong phản ứng (2) khối lượng chất rắn giảm 45% sau khi nung (giảsử hiệu suất nung là 100%).
❌a. Sai. H2CO3 là một acid yếu, HCl là một acid mạnh.
✔️b. Đúng. NaHCO3 ít tan trong nước và dễ bị phân hủy khi nung để tạo Na2CO3, CO2, H2O
✔️c. Đúng. Phản ứng này tái sinh NH3, giúp tiết kiệm và duy trì chu trình sản xuất.
❌d. Sai. Tính toán cho thấy khối lượng giảm khoảng 37%, không phải 45%.

Tỉ lệ khối lượng ban đầu và sau phản ứng: 2. 84g = 106g
Khối lượng giảm =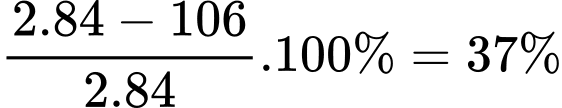
✔️b. Đúng. NaHCO3 ít tan trong nước và dễ bị phân hủy khi nung để tạo Na2CO3, CO2, H2O
✔️c. Đúng. Phản ứng này tái sinh NH3, giúp tiết kiệm và duy trì chu trình sản xuất.
❌d. Sai. Tính toán cho thấy khối lượng giảm khoảng 37%, không phải 45%.

Tỉ lệ khối lượng ban đầu và sau phản ứng: 2. 84g = 106g
Khối lượng giảm =
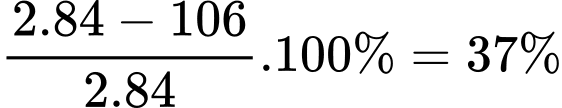
Câu 65 [560837]: Nhiệt tạo thành của một số chất được cho trong bảng sau:

a. Quá trình hình thành muối NaHCO3 từ các đơn chất thuận lợi về nănglượng hơn so với quá trình hình thành muối Na2CO3 từ các đơn chất.
b. Giá trị biến thiên enthalpy chuẩn của phản ứng2NaHCO3(s) → Na2CO3(s) + H2O(l) + CO2(g) là –91,28 kJ.
c. Phản ứng Na2CO3(s) → Na2O(s) + CO2(g) không thuận lợi về mặtnăng lượng.
d. Muối Na2CO3 có độ bền nhiệt cao hơn muối NaHCO3.

a. Quá trình hình thành muối NaHCO3 từ các đơn chất thuận lợi về nănglượng hơn so với quá trình hình thành muối Na2CO3 từ các đơn chất.
b. Giá trị biến thiên enthalpy chuẩn của phản ứng2NaHCO3(s) → Na2CO3(s) + H2O(l) + CO2(g) là –91,28 kJ.
c. Phản ứng Na2CO3(s) → Na2O(s) + CO2(g) không thuận lợi về mặtnăng lượng.
d. Muối Na2CO3 có độ bền nhiệt cao hơn muối NaHCO3.
❌a. Sai.So sánh Δf Ho của NaHCO3 và Na2CO3 thấy Δf Ho của NaHCO3 (-950,81 kJ/mol) lớn hơn Δf Ho của Na2CO3 (-1130,70 kJ/mol). => quá trình hình thành Na2CO3 tỏa ra nhiều nhiệt hơn, tức là thuận lợi về mặt năng lượng hơn.
❌b. Sai. Giá trị biến thiên enthalpy chuẩn của phản ứng là 91,58 kJ
✔️c. Đúng. Na2CO3 không thuận lợi về mặt năng lượng.
Δf Ho 298 = Δf Ho Na2O + Δf Ho CO2 - Δf Ho Na2CO3
= - 414,2 + (-393,51) - (-1130,7) = 322,99 kJ > 0
⟶ Không thuận lợi về mặt năng lượng
✔️d. Đúng. Dựa vào giá trị Δf Ho , ta thấy quá trình hình thành Na2CO3 tỏa ra nhiều nhiệt hơn, tức là Na2CO3 bền hơn NaHCO3. Khi đun nóng, chất kém bền hơn (NaHCO3) sẽ phân hủy trước.
❌b. Sai. Giá trị biến thiên enthalpy chuẩn của phản ứng là 91,58 kJ
✔️c. Đúng. Na2CO3 không thuận lợi về mặt năng lượng.
Δf Ho 298 = Δf Ho Na2O + Δf Ho CO2 - Δf Ho Na2CO3
= - 414,2 + (-393,51) - (-1130,7) = 322,99 kJ > 0
⟶ Không thuận lợi về mặt năng lượng
✔️d. Đúng. Dựa vào giá trị Δf Ho , ta thấy quá trình hình thành Na2CO3 tỏa ra nhiều nhiệt hơn, tức là Na2CO3 bền hơn NaHCO3. Khi đun nóng, chất kém bền hơn (NaHCO3) sẽ phân hủy trước.
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
Câu 66 [560838]: Khối lượng riêng của một số kim loại kiềm được cho trong bảng sau:
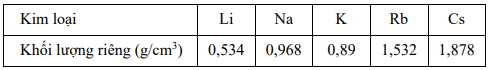
Có bao nhiêu kim loại nổi trên bề mặt của dầu hỏa (d = 0,8 g/cm3)?
Điền đáp án: ..........

Có bao nhiêu kim loại nổi trên bề mặt của dầu hỏa (d = 0,8 g/cm3)?
Điền đáp án: ..........
Nếu khối lượng riêng của kim loại nhỏ hơn khối lượng riêng của dầu hỏa, kim loại đó sẽ nổi trên bề mặt dầu hỏa.
⟹ Chỉ có kim loại Li nổi trên bề mặt dầu hỏa.
⟹ Điền đáp án: 1
⟹ Chỉ có kim loại Li nổi trên bề mặt dầu hỏa.
⟹ Điền đáp án: 1
Câu 67 [560839]: Cho những đặc điểm chung của các kim loại kiềm M như sau:
(a) Kim loại M trong cặp oxi hoá - khử M+/M có thế điện cực chuẩn rất âm.
(b) Mềm và dễ nóng chảy.
(c) Có nhiều electron hoá trị nên dễ dàng nhường electron.
(d) Lực hút của hạt nhân đối với electron hoá trị trong kim loại kiềm yếu hơn so với lực hút tương ứng ở các kim loại nhóm khác.
(đ) Có cấu trúc tinh thể rỗng.
Có bao nhiêu đặc điểm có thể giúp giải thích kim loại kiềm có tính khử mạnh?
Điền đáp án: ..........
(a) Kim loại M trong cặp oxi hoá - khử M+/M có thế điện cực chuẩn rất âm.
(b) Mềm và dễ nóng chảy.
(c) Có nhiều electron hoá trị nên dễ dàng nhường electron.
(d) Lực hút của hạt nhân đối với electron hoá trị trong kim loại kiềm yếu hơn so với lực hút tương ứng ở các kim loại nhóm khác.
(đ) Có cấu trúc tinh thể rỗng.
Có bao nhiêu đặc điểm có thể giúp giải thích kim loại kiềm có tính khử mạnh?
Điền đáp án: ..........
(a)Thế điện cực chuẩn rất âm cho thấy kim loại kiềm dễ bị oxi hóa (nhường electron), do đó đặc điểm này giải thích tính khử mạnh.
→ Phù hợp.
(b)Tính mềm và nhiệt độ nóng chảy thấp là do cấu trúc tinh thể và liên kết kim loại yếu, nhưng không trực tiếp giải thích tính khử mạnh.
→ Không phù hợp.
(c) Kim loại kiềm có một electron hoá trị (ở phân lớp ns), và chính điều này khiến chúng dễ nhường electron. Tuy nhiên, việc nói "nhiều electron hoá trị" không chính xác với kim loại kiềm.
→ Không phù hợp.
(d)Lực hút yếu làm electron hóa trị dễ bị tách ra, điều này giải thích vì sao kim loại kiềm dễ bị oxi hóa và có tính khử mạnh.
→ Phù hợp.
(đ)Cấu trúc tinh thể ảnh hưởng đến tính chất vật lý (như độ mềm), nhưng không trực tiếp giải thích tính khử mạnh.
→ Không phù hợp.
⟹ điền đáp án: 2
→ Phù hợp.
(b)Tính mềm và nhiệt độ nóng chảy thấp là do cấu trúc tinh thể và liên kết kim loại yếu, nhưng không trực tiếp giải thích tính khử mạnh.
→ Không phù hợp.
(c) Kim loại kiềm có một electron hoá trị (ở phân lớp ns), và chính điều này khiến chúng dễ nhường electron. Tuy nhiên, việc nói "nhiều electron hoá trị" không chính xác với kim loại kiềm.
→ Không phù hợp.
(d)Lực hút yếu làm electron hóa trị dễ bị tách ra, điều này giải thích vì sao kim loại kiềm dễ bị oxi hóa và có tính khử mạnh.
→ Phù hợp.
(đ)Cấu trúc tinh thể ảnh hưởng đến tính chất vật lý (như độ mềm), nhưng không trực tiếp giải thích tính khử mạnh.
→ Không phù hợp.
⟹ điền đáp án: 2
Câu 68 [560840]: Kim loại sodium bị xỉn màu trong không khí tạo thành một lớp oxide trên bề mặt của nó. Thấy rằng 0,92 gam sodium kết hợp với 0,32 gam oxygen trong oxide. Trong công thức của oxide này có tổng số nguyên tử là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
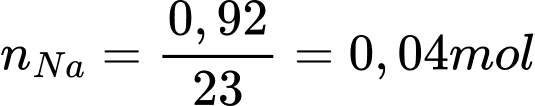
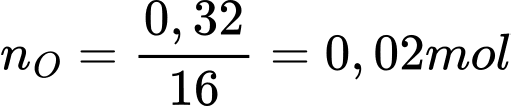
Tỉ lệ mol giữa Na và O là:
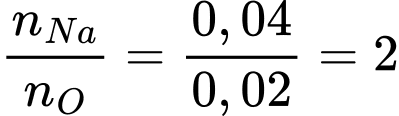
⟹ Công thức của oxide: Na2O
⟹ Tổng số nguyên tử : 2 + 1 = 3
⟹ Điền đáp án: 3
Câu 69 [560841]: Rubidium phản ứng với nước tạo thành rubidium hydroxide và hydrogen. Lấy 8,5 gam rubidium phản ứng hoàn toàn với nước thu được dung dịch có thể tích là 2,5 dm3. Nồng độ của dung dịch rubidium hydroxide (g.dm-3) là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
Phương trình phản ứng
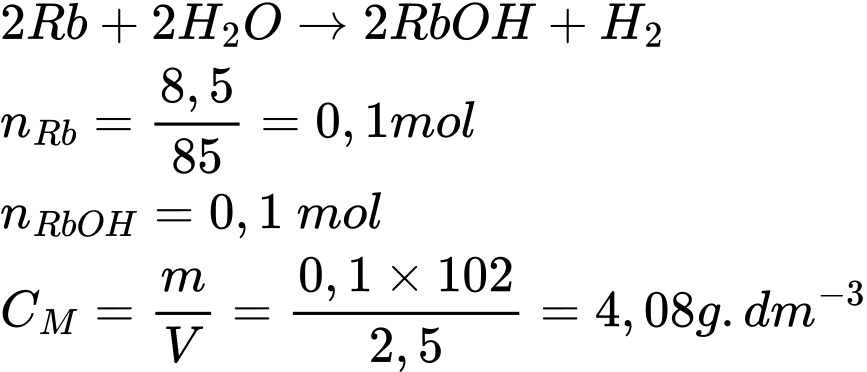
⟹ Điền đáp án: 4,08
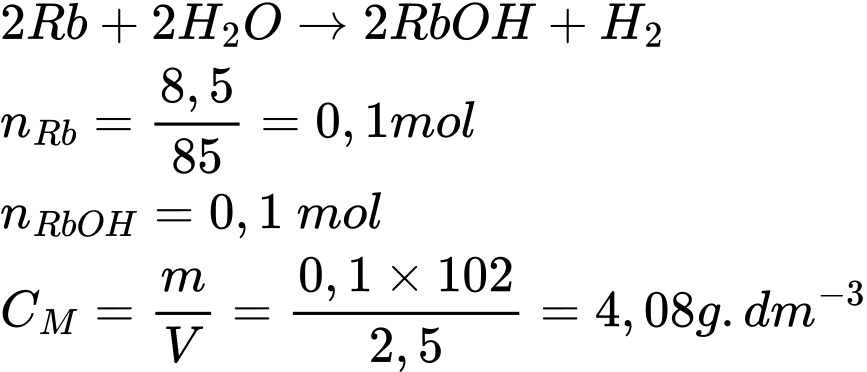
⟹ Điền đáp án: 4,08
Câu 70 [560842]: Nước muối bão hoà có nồng độ 300 g/L, trong khi đó “nước muối nghèo” có nồng độ 220 g/L. Với mỗi lít nước muối bão hoà ban đầu thì thu được bao nhiêu gam sodium hydroxide, nếu hiệu suất của quá trình là 80%?
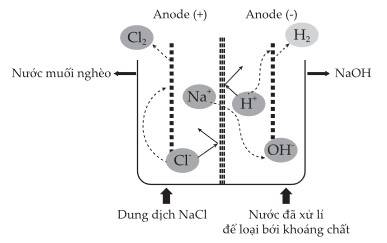

Hình vẽ. Mô hình điện phân dung dịch sodium chloride bão hòa.
Điền đáp án: ............
2NaCl + 2H2O ⟶ 2NaOH + Cl2 + H2
Khối lượng NaCl đã bị điện phân : 300 – 220 = 80g
nNaCl = m : M = 80 : 58,5 = nNaOH
⟹ m NaOH = n.M = 80/58,5 × 40 × 80% = 43,7606...≈ 43,8g
⟹ Điền đáp án: 43,8
Khối lượng NaCl đã bị điện phân : 300 – 220 = 80g
nNaCl = m : M = 80 : 58,5 = nNaOH
⟹ m NaOH = n.M = 80/58,5 × 40 × 80% = 43,7606...≈ 43,8g
⟹ Điền đáp án: 43,8
Câu 71 [560843]: Nhúng que platinum sạch vào dung dịch chất X, sau đó đưa lên ngọn lửa đèn khí, đèn khí cháy với ngọn lửa màu vàng. Mặt khác, thêm vài giọt dung dịch chất X vào dung dịch silver nitrate thấy xuất hiện kết tủa vàng.
Cho các chất sau:
(1) Potassium iodide.
(2) Sodium iodide.
(3) Sodium phosphate.
(4) Potassium phosphate.
(5) Sodium chloride.
(6) Potassium chloride.
Có bao nhiêu chất X thỏa mãn thí nghiệm trên?
Điền đáp án: ..........
Cho các chất sau:
(1) Potassium iodide.
(2) Sodium iodide.
(3) Sodium phosphate.
(4) Potassium phosphate.
(5) Sodium chloride.
(6) Potassium chloride.
Có bao nhiêu chất X thỏa mãn thí nghiệm trên?
Điền đáp án: ..........
- Lửa màu vàng thường xuất hiện khi có ion iod (I-) trong dung dịch, vì ion iod phát ra ánh sáng vàng khi bị đun nóng.
- Khi thêm dung dịch iod vào dung dịch bạc nitrat (AgNO3), sẽ có phản ứng tạo ra kết tủa vàng của bạc iodide (AgI), theo phương trình: ( R là kim loại )

Với các chất đã cho, có 2 chất phù hợp:
1. (kết tủa vàng )
(kết tủa vàng )
2. (kết tủa vàng )
(kết tủa vàng )
3. Na3PO4+3AgNO3 → Ag3PO4↓+3NaNO3. ( kết tủa vàng )
4. ( kết tủa trắng )
( kết tủa trắng )
5. ( kết tủa trắng )
( kết tủa trắng )
⟹ Điền đáp án: 2
- Khi thêm dung dịch iod vào dung dịch bạc nitrat (AgNO3), sẽ có phản ứng tạo ra kết tủa vàng của bạc iodide (AgI), theo phương trình: ( R là kim loại )

Với các chất đã cho, có 2 chất phù hợp:
1.
 (kết tủa vàng )
(kết tủa vàng )2.
 (kết tủa vàng )
(kết tủa vàng )3. Na3PO4+3AgNO3 → Ag3PO4↓+3NaNO3. ( kết tủa vàng )
4.
 ( kết tủa trắng )
( kết tủa trắng )5.
 ( kết tủa trắng )
( kết tủa trắng )⟹ Điền đáp án: 2
Câu 72 [560844]: Độ tan của NaHCO3 ở 20°C và ở 40°C lần lượt là 9,6 g/100 g nước và 12,7 g/100 g nước. Khi giảm nhiệt độ của 112,7 gam dung dịch NaHCO3 bão hoà từ 40°C về 20°C thì khối lượng muối NaHCO3 kết tinh là bao nhiêu gam?(Làm tròn đến giá trị nguyên)
Điền đáp án: ..........
Điền đáp án: ..........
Lượng NaHCO3 bão hoà trong 112,7 g dung dịch ở 40oC là:
(112,7. 12,7): (100+ 12,7) = 12,70 (g).
Lượng NaHCO3 kết tinh khi làm giảm nhiệt độ dung dịch là:
12,7 - 9,6 = 3,1 (g)
⟹ Điền đáp án 3
(112,7. 12,7): (100+ 12,7) = 12,70 (g).
Lượng NaHCO3 kết tinh khi làm giảm nhiệt độ dung dịch là:
12,7 - 9,6 = 3,1 (g)
⟹ Điền đáp án 3
Câu 73 [560845]: Trong phản ứng giữa lithium và nước tạo thành 150 cm³ dung dịch lithium hydroxide. Dung dịch lithium hydroxide sau đó được trung hòa hoàn toàn bằng 24,85 cm³ sulfuric acid 0,100 mol/dm³. Nồng độ (mol/dm³) của dung dịch lithium hydroxide thu được là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
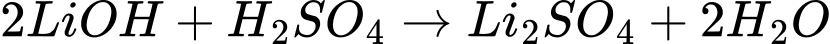

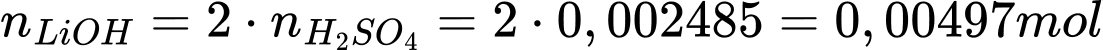
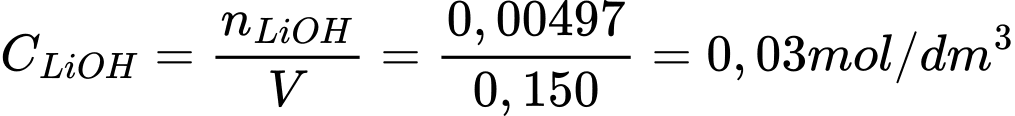
Điền đáp án: 0,03
Câu 74 [560846]: Na2O2 thường được dùng làm chất cung cấp oxygen trong quá trình lặn theo phương trình: 2Na2O2 + 2CO2 → 2Na2CO3 + O2.Tính khối lượng sodium peroxide (gam) cần dùng để tạo ra 2,5 mol oxygen cho quá trình lặn?

Điền đáp án: ..........

Điền đáp án: ..........
Khối lượng sodium peroxide (gam) cần dùng để tạo ra 2,5 mol oxygen cho quá trình lặn là:
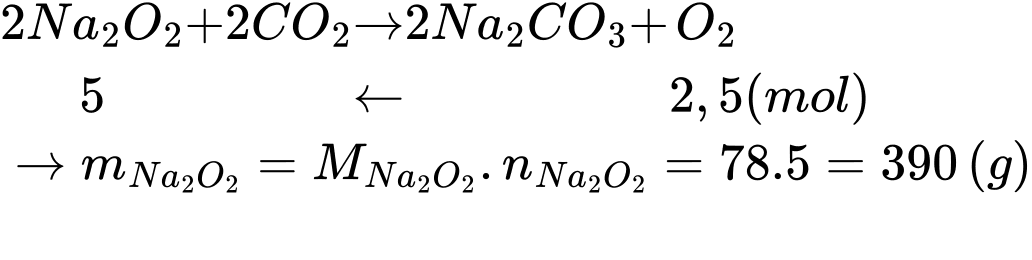
⇒ Điền đáp án: 390
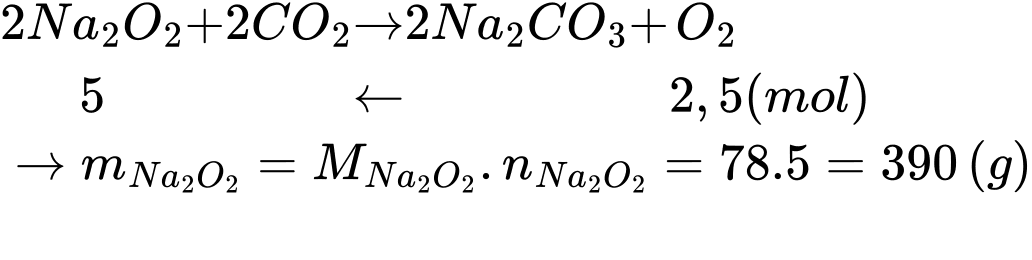
⇒ Điền đáp án: 390
Câu 75 [560847]: Một học sinh cho 0,750 gam sodium hydroxide rắn (NaOH) vào 20,00 mL nước ở 25,0°C trong một nhiệt lượng kế. Nhiệt độ cuối cùng của chất lỏng trong nhiệt lượng kế là 34,6°C. Biết rằng, khối lượng riêng của nước là 1,0 g.mL–1, để nâng nhiệt độ của 1 gam nước lên 1oC, cần 4,184 J và nhiệt lượng kế có hiệu suất 100%. Biến thiên enthalpy chuẩn của phản ứng ΔrHo của phản ứng: NaOH(s)  NaOH (aq) có giá trị là bao nhiêu kJ?
NaOH (aq) có giá trị là bao nhiêu kJ?
(Làm tròn đến giá trị nguyên).
Điền đáp án: ..........
 NaOH (aq) có giá trị là bao nhiêu kJ?
NaOH (aq) có giá trị là bao nhiêu kJ?(Làm tròn đến giá trị nguyên).
Điền đáp án: ..........
Khối lượng riêng của H2O là 1 g/mL nên 20 mL có khối lượng là 20 gam.
Nhiệt lượng mà quá trình hòa tan 0,75 gam NaOH tỏa ra để làm 20 gam H2O nóng lên là Q = mcAT = 20.4,184. (34,6-25) 803,328 J
0,75 gam NaOH có số mol là 0,75 / 40 = 0,01875 mol
Cứ 0,01875 mol NaOH rắn hòa tan vào nước thì tỏa ra 803,328 J
Nên 1 mol NaOH rắn hòa tan vào nước thì tỏa ra 1.803,328 / 0,01875 = 42844,16 J
Vậy biến thiên enthalpy của quá trình: NaOH (s) → NaOH (aq) là ∆rHo298 = -42844,16 J = -42,84416 ≈ -43 kJ.
Điền đáp án: -43
Nhiệt lượng mà quá trình hòa tan 0,75 gam NaOH tỏa ra để làm 20 gam H2O nóng lên là Q = mcAT = 20.4,184. (34,6-25) 803,328 J
0,75 gam NaOH có số mol là 0,75 / 40 = 0,01875 mol
Cứ 0,01875 mol NaOH rắn hòa tan vào nước thì tỏa ra 803,328 J
Nên 1 mol NaOH rắn hòa tan vào nước thì tỏa ra 1.803,328 / 0,01875 = 42844,16 J
Vậy biến thiên enthalpy của quá trình: NaOH (s) → NaOH (aq) là ∆rHo298 = -42844,16 J = -42,84416 ≈ -43 kJ.
Điền đáp án: -43
Câu 76 [560848]: Một cốc thủy tinh có chứa 25,0 mL hydrochloric acid 1 M và có nhiệt độ ban đầu được ghi là 22,7 °C. Thêm từ từ 25 mL dung dịch sodium hydroxide 1M vào cốc thủy tinh trên, thấy nhiệt độ cao nhất được ghi nhận là 29,3 °C. Giả sử nhiệt dung riêng của dung dịch là 4,18 J/(K.g) và khối lượng riêng của dung dịch là 1,00 g/cm3. Tính biến thiên enthalpy cho quá trình tạo thành 1 mol nước theo đơn vị kJ (làm tròn đến hàng đơn vị).
Điền đáp án: ..........
Điền đáp án: ..........
nHCl = nNaOH = C . V = 1,0 . 0,025 = 0,025 (mol)
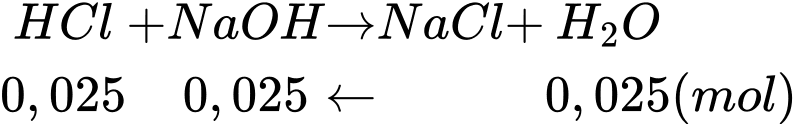
Tổng thể tích dung dịch là:
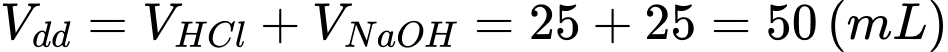
Tổng khối lượng dung dịch là(giả sử khối lượng riêng của dung dịch là D = 1,00g/mL):
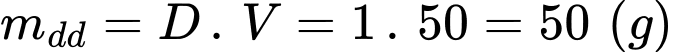
Nhiệt độ tăng lên là:
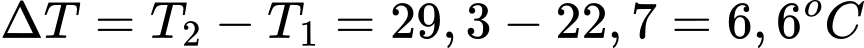
Nhiệt lượng tỏa ra là:
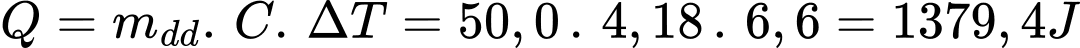
Biến thiên enthalpy chuẩn tính trên 1 mol nước là:
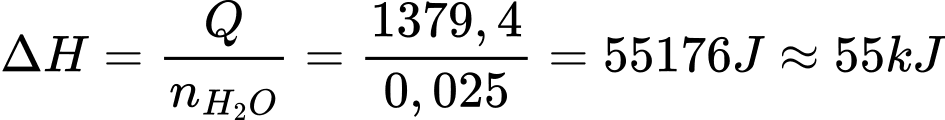
Vì đây là quá trình tỏa nhiệt nên biến thiên enthalpy được biểu diễn thêm dấu âm: -55 kJ
Điền đáp án: -55
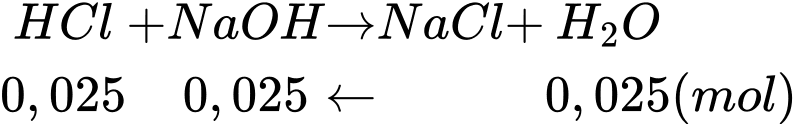
Tổng thể tích dung dịch là:
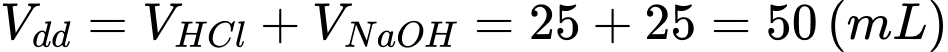
Tổng khối lượng dung dịch là(giả sử khối lượng riêng của dung dịch là D = 1,00g/mL):
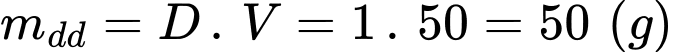
Nhiệt độ tăng lên là:
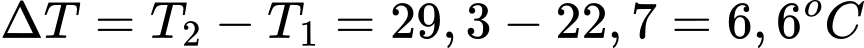
Nhiệt lượng tỏa ra là:
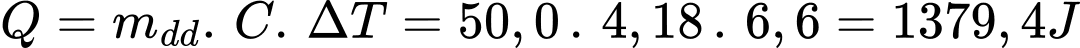
Biến thiên enthalpy chuẩn tính trên 1 mol nước là:
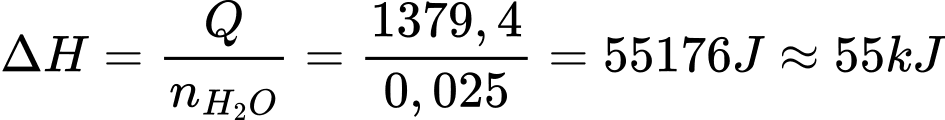
Vì đây là quá trình tỏa nhiệt nên biến thiên enthalpy được biểu diễn thêm dấu âm: -55 kJ
Điền đáp án: -55
Câu 77 [560849]: Hòa tan sodium oxide vào nước xảy ra phản ứng như sau:
 Kết quả được ghi lại như sau:
Kết quả được ghi lại như sau:
 Nhiệt năng (Q) tỏa ra trong thí nghiệm này tính bằng J có giá trị là bao nhiêu (kết quả làm tròn đến hàng phần chục) biết
Nhiệt năng (Q) tỏa ra trong thí nghiệm này tính bằng J có giá trị là bao nhiêu (kết quả làm tròn đến hàng phần chục) biết  khối lượng 1 cm3 của nước là 1 gam.
khối lượng 1 cm3 của nước là 1 gam.
Điền đáp án: ..........
Na2O(s) + H2O(l) → 2NaOH(aq)
Một số học sinh sử dụng các thiết bị sau để đo sự thay đổi nhiệt độ của phản ứng:

 khối lượng 1 cm3 của nước là 1 gam.
khối lượng 1 cm3 của nước là 1 gam.Điền đáp án: ..........
Biết rằng khối lượng 1 cm3 của nước là 1 gam
Đổi 50 cm3 = 50 gam
Nhiệt năng (Q) tỏa ra trong thí nghiệm này là:
Q = m . Delta T . C = 50. 4,2.(30,5 - 19,5 ) = 2310 J
⇒ Điền đáp án: 2310
Câu 78 [560850]: Vào giữa những năm 1700, một phương pháp đã được đưa ra để điều chế khí chlorine từ sodium chloride như sau:
NaCl(s) + H2SO4(l) + MnO2(s) → Na2SO4(s) + MnCl2(aq) + H2O(l) + Cl2(g)
Giá trị biến thiên enthalpy cho phản ứng trên là bao nhiêu kJ?. Biết enthalpy tạo thành chuẩn của các chất được cho trong bảng sau:
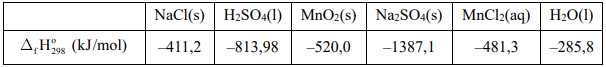
Điền đáp án: ..........
NaCl(s) + H2SO4(l) + MnO2(s) → Na2SO4(s) + MnCl2(aq) + H2O(l) + Cl2(g)
Giá trị biến thiên enthalpy cho phản ứng trên là bao nhiêu kJ?. Biết enthalpy tạo thành chuẩn của các chất được cho trong bảng sau:

Điền đáp án: ..........
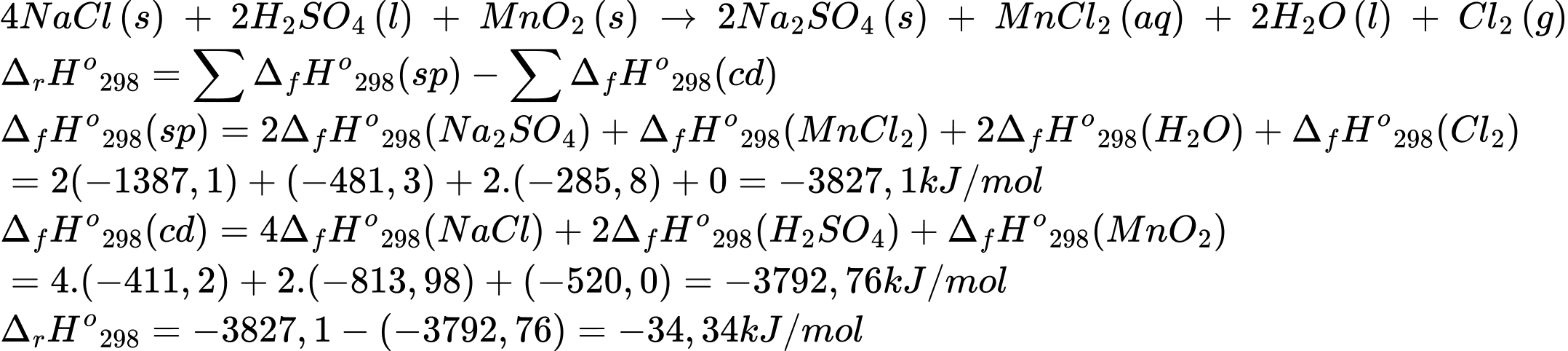
Điền đáp án: -34,3
Câu 79 [560851]: Dung dịch NaCl(aq) có thể tích 0,872 L được điện phân trong 2,50 phút với dòng điện 0,810 Α. Tính pH của dung dịch sau điện phân.
Điền đáp án: ..........
Điền đáp án: ..........
Phản ứng tại cực âm (cathode): 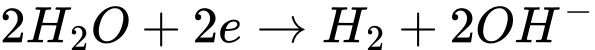
Phản ứng tại cực dương ( anode):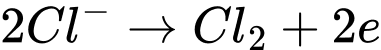
Q= I.t = 0,81.150 = 121,5 C
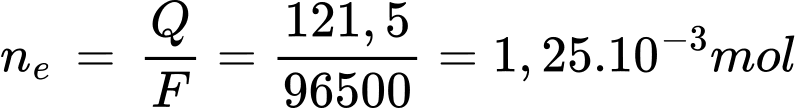
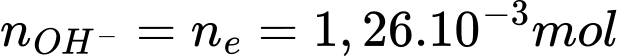
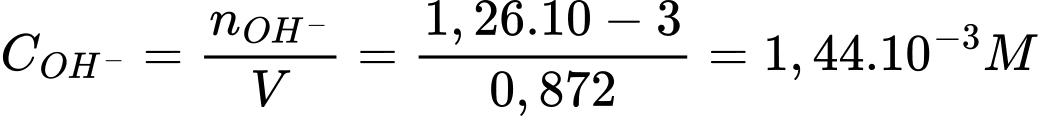
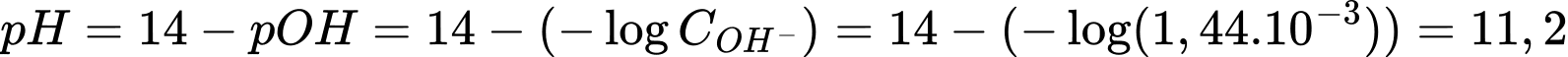
Điền đáp án: 11,2
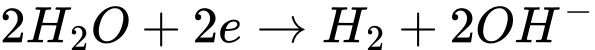
Phản ứng tại cực dương ( anode):
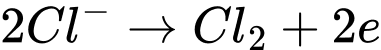
Q= I.t = 0,81.150 = 121,5 C
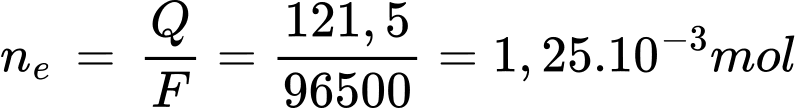
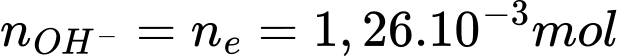
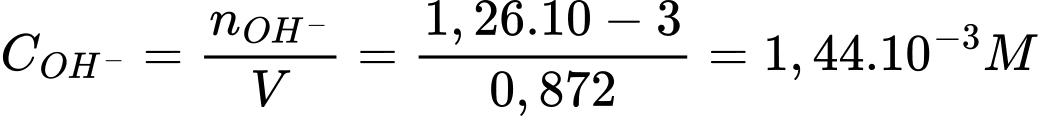
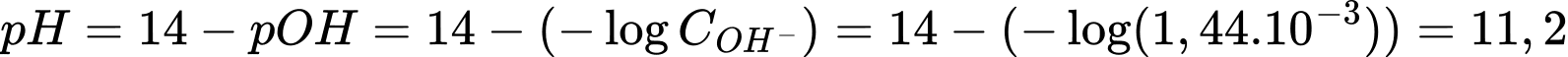
Điền đáp án: 11,2
Câu 80 [560852]: Một phân tích về một nhà máy chế biến Solvay cho thấy cứ 1,00 kg NaCl tiêu thụ thì thu được 1,03 kg NaHCO3. Hiệu suất phần trăm của quá trình chuyển đổi NaCl thành NaHCO3 là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
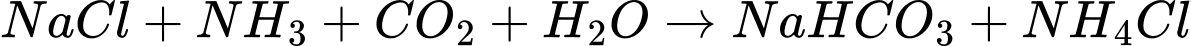
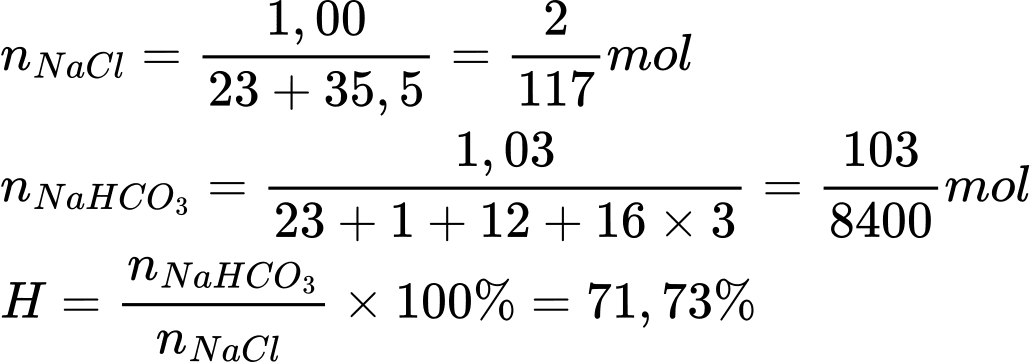
Điền đáp án: 71,7
Câu 81 [560853]: "Phèn chua" được sử dụng trong nấu ăn là potassium aluminum sulfate ngậm nước, KAl(SO4)2 . xH2O. Để tìm giá trị của x, có thể đun nóng một mẫu hợp chất để đuổi hết nước và chỉ còn lại KAl(SO4)2. Giả sử đun nóng 4,74 g hợp chất ngậm nước và mẫu mất đi 2,16 g nước. Giá trị của x là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
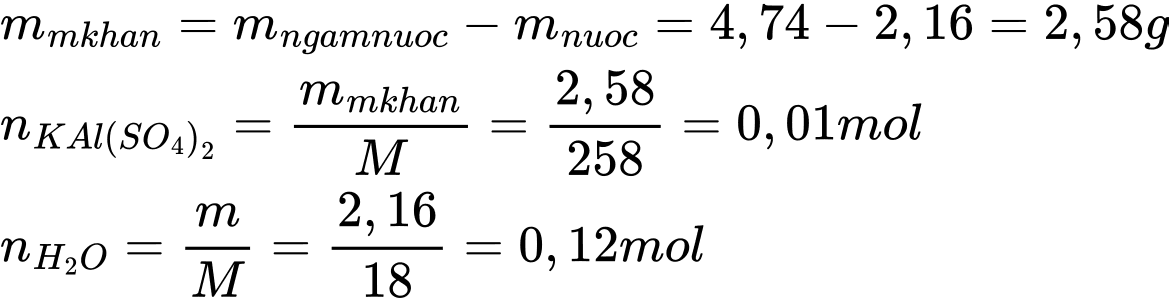
Trong công thức KAl(SO4)2⋅xH2O, số mol H2O tỉ lệ với số mol KAl(SO4)2
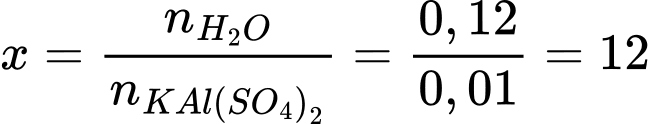
Công thức của hợp chất ngậm nước là KAl(SO4)2.12H2O
Điền đáp án: 12
Câu 82 [560854]: Ở nhiệt độ cao, NaHCO3 được chuyển hóa thành Na2CO3.
2NaHCO3(s) Na2CO3(s) + CO2(g) + H2O(g)
Na2CO3(s) + CO2(g) + H2O(g)
Đun nóng 1,7184 g mẫu NaHCO3 không tinh khiết thu được 0,196 g CO2. Phần trăm khối lượng của NaHCO3 trong mẫu ban đầu là bao nhiêu?
Điền đáp án: ..........
2NaHCO3(s)
 Na2CO3(s) + CO2(g) + H2O(g)
Na2CO3(s) + CO2(g) + H2O(g)Đun nóng 1,7184 g mẫu NaHCO3 không tinh khiết thu được 0,196 g CO2. Phần trăm khối lượng của NaHCO3 trong mẫu ban đầu là bao nhiêu?
Điền đáp án: ..........
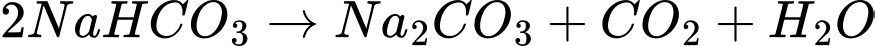
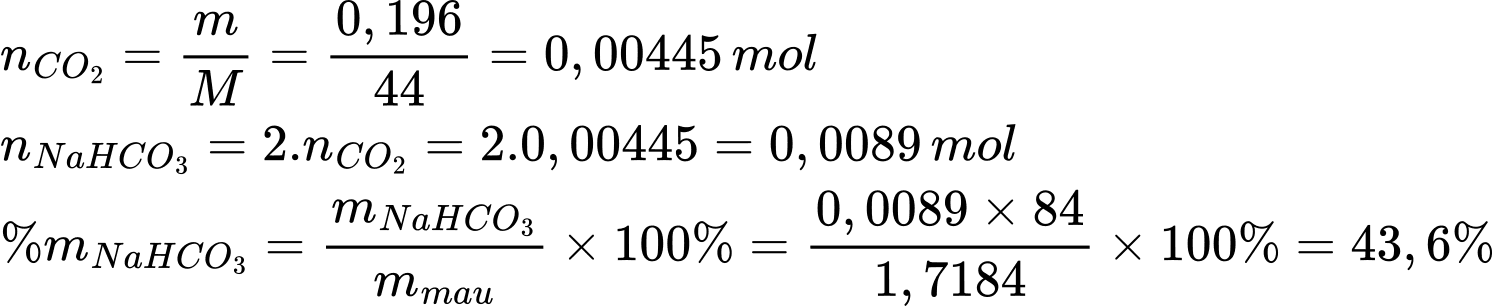
Điền đáp án: 43,6
Câu 83 [560855]: Sodium thiosulfate, Na2S2O3, được sử dụng làm chất "sửa chữa" trong chụp ảnh đen trắng. Giả sử bạn có một chai sodium thiosulfate và muốn xác định độ tinh khiết của nó. Ion thiosulfate có thể bị oxy hóa bằng I2 theo phương trình ion rút gọn:
I2(aq) + 2S2O32–(aq) 2I–(aq) + S4O62–(aq)
2I–(aq) + S4O62–(aq)
Hòa tan 3,232 g mẫu chất không tinh khiết chứa Na2S2O3 vào nước để tạo thành 100 mL dung dịch X. Nếu bạn sử dụng hết 40,21 mL dung dịch I2 0,246 M trong phép chuẩn độ 100 mL X thì phần trăm khối lượng của Na2S2O3 trong 3,232 g mẫu chất không tinh khiết là bao nhiêu?
I2(aq) + 2S2O32–(aq)
 2I–(aq) + S4O62–(aq)
2I–(aq) + S4O62–(aq)Hòa tan 3,232 g mẫu chất không tinh khiết chứa Na2S2O3 vào nước để tạo thành 100 mL dung dịch X. Nếu bạn sử dụng hết 40,21 mL dung dịch I2 0,246 M trong phép chuẩn độ 100 mL X thì phần trăm khối lượng của Na2S2O3 trong 3,232 g mẫu chất không tinh khiết là bao nhiêu?
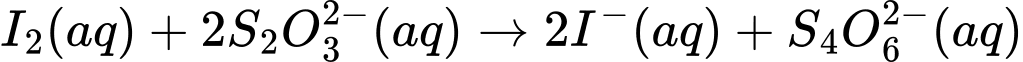
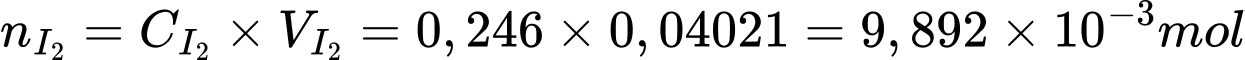
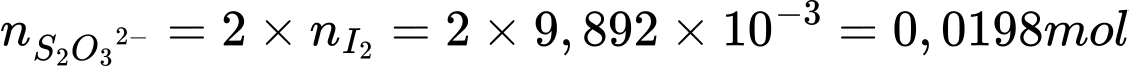
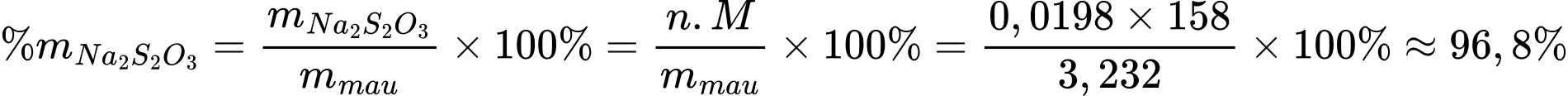
⟹ Điền đáp án: 96,8
Câu 84 [560856]: Giả sử trộn 100,0 mL CsOH 0,20 M với 50,0 mL HCl 0,40 M trong một cốc kín có nhiệt lượng kế. Phản ứng sau xảy ra:
CsOH(aq) + HCl(aq) CsCl(aq) + H2O(l)
CsCl(aq) + H2O(l)
Nhiệt độ của dung dịch trước khi trộn là 22,50 °C và sau khi trộn là 24,28 °C. Biến thiên enthalpy chuẩn của phản ứng là bao nhiêu trên mỗi mol CsOH? Giả sử khối lượng riêng của dung dịch là 1,00 g/mL và nhiệt dung riêng của các dung dịch là 4,2 J/g.K.
Điền đáp án: ..........
CsOH(aq) + HCl(aq)
 CsCl(aq) + H2O(l)
CsCl(aq) + H2O(l)Nhiệt độ của dung dịch trước khi trộn là 22,50 °C và sau khi trộn là 24,28 °C. Biến thiên enthalpy chuẩn của phản ứng là bao nhiêu trên mỗi mol CsOH? Giả sử khối lượng riêng của dung dịch là 1,00 g/mL và nhiệt dung riêng của các dung dịch là 4,2 J/g.K.
Điền đáp án: ..........
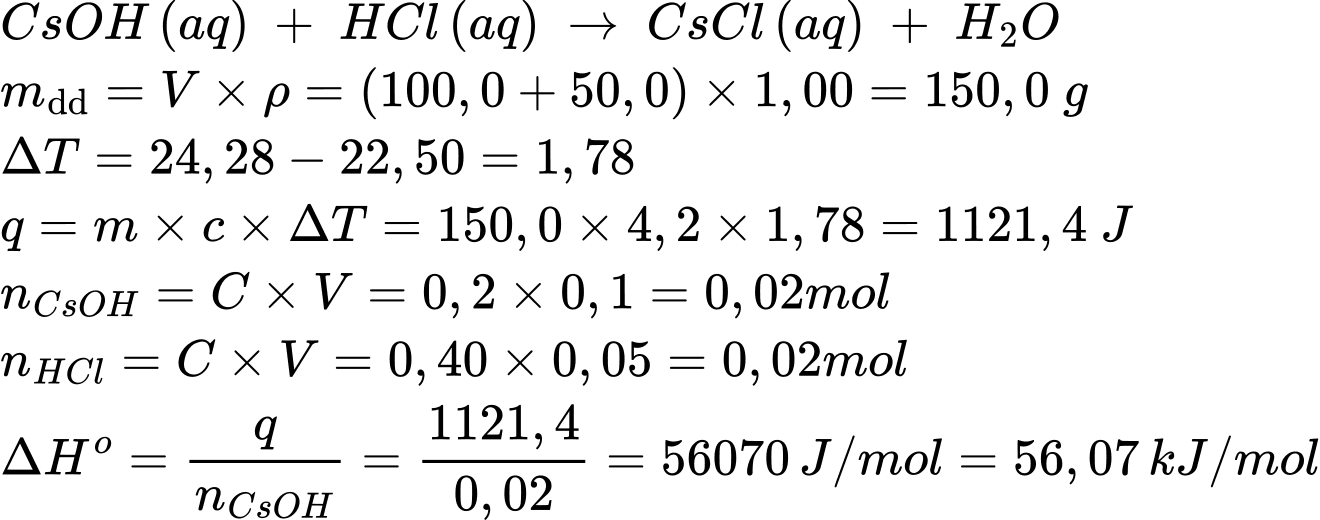
Vì phản ứng là tỏa nhiệt nên delta H>0
Điền đáp án: -56,0
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó
CHẤT THAY THẾ MUỐI
Sodium chloride (NaCl), một trong những loại gia vị phổ biến nhất trên thế giới, có chứa cation kim loại Nhóm 1A là Na+. Do những điểm tương đồng với sodium nên các kim loại nhóm 1A khác cũng tạo thành muối chloride.
Lithium chloride (LiCl) và potassium chloride (KCl) đặc biệt giống với sodium chloride về hình thức và mùi vị, và cả hai đều được sử dụng làm chất thay thế muối cho những người có chế độ ăn ít sodium. Khi bạn ăn một bữa ăn có lượng muối quá cao hoặc tiêu thụ quá nhiều muối trong một ngày, sẽ gây ra cảm giác đầy hơi do thận không thể lọc hết lượng sodium dư thừa ra khỏi máu. Dư thừa sodium sẽ dẫn tới tăng huyết áp, dẫn đến tai biến mạch máu não, nhồi máu cơ tim và nhiều bệnh tim mạch khác.

Lithium chloride được sử dụng trong thời gian ngắn như một chất thay thế muối vào những năm 1940, tuy nhiên nó tỏ ra nguy hiểm và việc sử dụng nó đã dẫn đến các trường hợp nhiễm độc lithium nghiêm trọng, trong đó có một số trường hợp gây tử vong. Ngày nay, các chất thay thế muối như Chất thay thế muối Morton và Nu-Salt sẽ có chứa potassium chloride.
Câu 85 [560857]: Nguyên tố nào sau đây không thuộc nhóm 1A?
A, Li.
B, Cs.
C, Sr.
D, Rb.
Các kim loại nhóm IA là Li, Na, K, Cs, Rb
Sr là kim loại nhóm IIA
=> Chọn đáp án C Đáp án: C
Sr là kim loại nhóm IIA
=> Chọn đáp án C Đáp án: C
Câu 86 [560858]: Lithium chloride và potassium chloride giống với sodium chloride ở đặc điểm nào sau đây?
A, Giá thành sản xuất.
B, Hình thức và mùi vị.
C, An toàn với con người.
D, bbbb.
Lithium chloride và potassium chloride giống với sodium chloride ở hình thức và mùi vị
=> Chọn đáp án B Đáp án: B
=> Chọn đáp án B Đáp án: B
Câu 87 [560859]: Một loại sản phẩm thay thế muối có nồng độ KCl là khoảng 25%, còn lại là NaCl. Từ 100 kg muối NaCl có thể điều chế được bao nhiêu kg sản phẩm thay thế muối bên trên?
A, 100 kg.
B, 75 kg.
C, 133 kg.
D, 158 kg.
Gọi x là khối lượng của sản phẩm thay thế muối. Trong sản phẩm này, lượng NaCl chiếm 75%, do đó
Khối lượng NaCl trong sản phẩm thay thế = 0,75x
Khối lượng NaCl ban đầu là 100 kg và toàn bộ được sử dụng để tạo ra sản phẩm thay thế.
0,75.x=100 => x =133 kg
=> Chọn đáp án C Đáp án: C
Khối lượng NaCl trong sản phẩm thay thế = 0,75x
Khối lượng NaCl ban đầu là 100 kg và toàn bộ được sử dụng để tạo ra sản phẩm thay thế.
0,75.x=100 => x =133 kg
=> Chọn đáp án C Đáp án: C
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 88 đến 90
SỰ PHÁT TRIỂN KHÔNG THỂ TIN ĐƯỢC CỦA THUỐC LITHIUM
Tất cả muối của các ion kim loại kiềm đều hòa tan trong nước và là các ion khán giả trong hầu hết các dung dịch. Những ion kiềm đóng vai trò quan trọng trong sinh lý con người. Ví dụ, các ion sodium và potassium lần lượt là thành phần chính của huyết tương và dịch nội bào với nồng độ trung bình là 0,1 M. Ngược lại, ion lithium không có chức năng nào được biết đến trong sinh lý bình thường của con người. Tuy nhiên, kể từ khi phát hiện ra lithium vào năm 1817, người ta đã tin rằng muối của nguyên tố này có khả năng chữa bệnh thần thánh. Thậm chí còn có tuyên bố rằng các ion lithium là một thành phần trong công thức suối nguồn tuổi trẻ cổ xưa “fountain of youth”. Năm 1927, các thương hiệu bắt đầu tiếp thị một loại nước giải khát có chứa lithium. Cái tên khó sử dụng ban đầu của loại đồ uống này là “Bib-Label Lithated Lemon-Lime Soda”, tên này nhanh chóng được đổi thành cái tên đơn giản và quen thuộc hơn 7UP.
Do lo ngại của Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ, lithium đã bị loại bỏ khỏi 7UP vào đầu những năm 1950. Gần như cùng lúc đó, các bác sĩ tâm thần phát hiện ra rằng các ion lithium có tác dụng chữa bệnh đáng chú ý đối với tình trạng tâm thần gọi là rối loạn lưỡng cực. Những người mắc chứng rối loạn tâm thần này sẽ trải qua những thay đổi tâm trạng nghiêm trọng từ hưng phấn đến trầm cảm sâu sắc. Ion lithium làm dịu những thay đổi tâm trạng này, cho phép bệnh nhân lưỡng cực hoạt động hiệu quả hơn trong cuộc sống hàng ngày.
Vì quá liều lithium có thể gây ra tác dụng phụ nghiêm trọng ở người, bao gồm suy thận và tử vong, nên muối lithium không được chấp thuận làm thuốc chống loạn thần cho người cho đến năm 1970. Ngày nay Li+ thường được dùng qua đường uống dưới dạng Li2CO3, đây là hoạt chất trong thuốc kê đơn. Thuốc lithium có hiệu quả đối với khoảng 70% bệnh nhân lưỡng cực dùng thuốc.
Trong thời đại công nghệ sinh học và thiết kế thuốc phức tạp này, ion lithium đơn giản vẫn là phương pháp điều trị hiệu quả nhất cho chứng rối loạn tâm thần tàn khốc. Điều đáng chú ý là dù đã nghiên cứu chuyên sâu nhưng các nhà khoa học vẫn chưa hiểu hết tác dụng sinh hóa dẫn đến tác dụng chữa bệnh của lithium. Do tương tự như Na+, Li+ được tích hợp vào huyết tương, nơi nó có thể ảnh hưởng đến hoạt động của các tế bào thần kinh và cơ. Nhưng Li+ có bán kính nhỏ hơn Na+, nên cách Li+ tương tác với các phân tử trong tế bào người khác với cách Na+ tương tác với các phân tử.
Câu 88 [560860]: Theo bài đọc, câu: “các ion kim loại kiềm là các ion khán giả trong hầu hết các dung dịch” có nghĩa là các ion kim loại kiềm
A, không phản ứng với các ion khác trong dung dịch.
B, di chuyển hỗn loạn trong dung dịch.
C, tan tốt trong nước.
D, có vai trò quan trọng trong sinh lí người.
Các ion kim loại kiềm (như Li+, Na+, K+,...) thường không tham gia trực tiếp vào phản ứng hóa học trong dung dịch.
=> Chọn đáp án A Đáp án: A
=> Chọn đáp án A Đáp án: A
Câu 89 [560861]: Theo bài đọc, ngày nay, ion Li+ thường được dùng qua đường uống dưới dạng muối nào?
A, Li2SO4.
B, LiCl.
C, Li2CO3.
D, LiNO3.
Ngày nay, ion Li+ thường được dùng qua đường uống dưới dạng muối Li2CO3
=> Chọn đáp án C Đáp án: C
=> Chọn đáp án C Đáp án: C
Câu 90 [560862]: Sắp xếp chiều bán kính ion của các nguyên tố sau theo chiều tăng dần?
A, Na+ < Li+ < K+.
B, Li+ < K+ < Na+.
C, Li+ < Na+ < K+.
D, K+ < Na+ < Li+.
Li, Na, K lần lượt thuộc các chu kỳ 2, 3, và 4 trong nhóm kim loại kiềm (nhóm IA).
Khi đi xuống trong cùng một nhóm, số lớp electron tăng, dẫn đến kích thước ion tăng.
=> Chọn đáp án C Đáp án: C
Khi đi xuống trong cùng một nhóm, số lớp electron tăng, dẫn đến kích thước ion tăng.
=> Chọn đáp án C Đáp án: C