Đáp án
Dạng 1: TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.
⇒ Kim loại kiềm thổ xuất hiện trong 4 phương án là Ca (canxi).
⟹ Chọn đáp án C Đáp án: C
❌A. Sr, K: Sr thuộc nhóm IIA, K thuộc nhóm IA.
❌B. Be, Al: Be thuộc nhóm IIA, Al thuộc nhóm IIIA.
✔️C. Ca, Ba đều thuộc nhóm IIA.
❌D. Na, Ba: Na thuộc nhóm IA, Ba thuộc nhóm IIA.
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C
Đáp án: C
✔️ A. Calcite: CaCO3.
✔️ B. Dolomite: CaCO3.MgCO3.
✔️ C. Đá hoa: CaCO3.
❌ D. Magnesite: MgCO3.
⇒ Chọn đáp án D Đáp án: D

Một mẫu khoáng vật calcite ở vùng Balkal, Nga
- Khoáng vật dolomite có thành phần chủ yếu là MgCO3.CaCO3.
- Mà CaCO3 và MgCO3 đều không tan trong nước.
⟶ Các khoáng vật calcite, dolomite,... hầu như không tan trong nước.
Chọn đáp án A Đáp án: A
(1) Các cation M2+ trong nước ao hồ, nước ngầm.
(2) Các khoáng vật ít tan như carbonate, sulfate, silicate.
(3) Các hợp chất ít tan trong răng, xương động vật.
(1) Các cation M2+ trong nước ao hồ, nước ngầm.
(2) Các khoáng vật ít tan như carbonate, sulfate, silicate.
(3) Các hợp chất ít tan trong răng, xương động vật.
Chọn đáp án C Đáp án: C
⟶ Tuy nhiên, nhiệt độ nóng chảy của kim loại trong cùng nhóm IIA biến đổi không theo xuhướng rõ rệt. Ví dụ từ Be đến Mg có nhiệt độ nóng chảy giảm nhưng Mg đến Ca nhiệt độ nóng chảy lại tăng. Sau đó từ Ca đến Sr, Ba thì nhiệt độ nóng chảy giảm.
⟹ Chọn đáp án D Đáp án: D

Ứng dụng trên không dựa vào tính chất vật lí nào của hợp kim magnesium?
Chọn đáp án D Đáp án: D
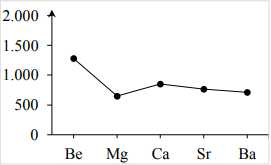
➢ Tuy nhiên, nhiệt độ nóng chảy của kim loại trong cùng nhóm IIA biến đổi không theo xu hướng rõ rệt nên được biểu diễn như biểu đồ trên.
Chọn đáp án B Đáp án: B
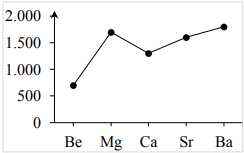
Nên nhiệt độ nóng chảy từ Be đến Ba do sự giảm dần của lực liên kết kim loại khi di chuyển xuống nhóm 2 trong bảng tuần hoàn.
Chọn đáp án A Đáp án: A
M ⟶ M2+ + 2e
⇒ Đóng vai trò chất khử trong phản ứng.
⇒ Chọn đáp án B Đáp án: B
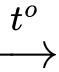 Ba2O(s) + H2(g).
Ba2O(s) + H2(g).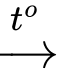 Ba(OH)2(s) + H2(g).
Ba(OH)2(s) + H2(g).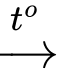 2BaO(s).
2BaO(s). 2Ba2O(s).
2Ba2O(s).PTHH:
2Ba(s) + O2(g)
 2BaO(s).
2BaO(s).Chọn đáp án C Đáp án: C
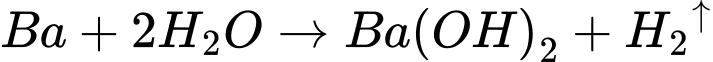
Xét các phản ứng:
✔️
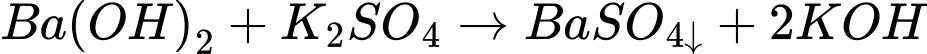
✔️
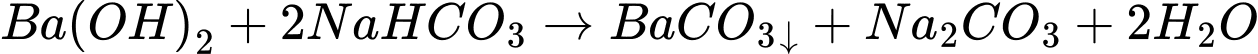
❌
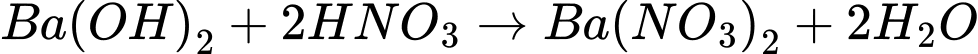
❌
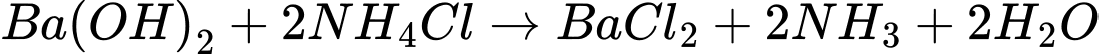
⟹ Có 2 phản ứng tạo kết tủa.
⟹ Chọn đáp án C Đáp án: C
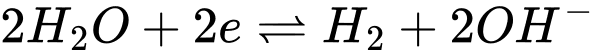 là
là 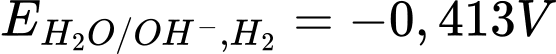 ở pH = 7
ở pH = 7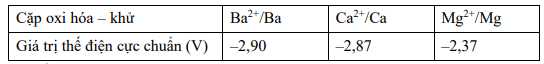
Hãy cho biết kim loại nào sau đây tác dụng được với nước?
Cả Ba, Ca, Mg đều có Eo < Eo (H2O), dó đó có khả năng khử nước tạo H2.
⟹ Chọn đáp án D Đáp án: D
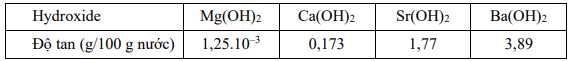
Xu hướng biến đổi độ tan của các hydroxide nhóm IIA là
Độ tan tăng dần từ Mg < Ca < Sr < Ba.
⟹ Chọn đáp án A Đáp án: A
• Barium hydroxyde tan trong nước tạo dung dịch điện li mạnh.
• Magnesium hydroxide không tan trong nước.
Khả năng phản ứng với barium với nước như nào so với magnesium với nước?
⇒ Ba(OH)2 phản ứng với nước mạnh hơn Mg(OH)2 do có độ hòa tan cao hơn và tính chất base mạnh hơn.
⇒ Chọn đáp án A Đáp án: A

Một số bọt khí hydrogen xuất hiện khi cho magnesium vào nước ở điều kiện thường
- Lớp màng này không tan trong nước, bền và có tác dụng ngăn cản sự tiếp xúc giữa kim loại Mg với nước, làm chậm phản ứng.
⟹ Chọn đáp án A. Đáp án: A
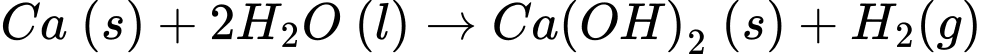
- Ca(OH)2 chỉ tan một phần, nên dung dịch sẽ có màu hồng nhạt do phenolphthalein đổi màu trong môi trường base.
- Do Ca(OH)2 không tan hết, trong cốc sẽ có hiện tượng vẩn đục do Ca(OH)2 rắn lắng xuống.
⟹ Chọn đáp án C Đáp án: C
(1) Barium có tính khử mạnh hơn magnesium.
(2) Độ tan của barium hydroxide trong nước cao hơn nhiều so với magnesium hydroxide.
(3) Bọt khí hydrogen sinh ra bám trên bề mặt magnesium nhiều hơn, cản trở phản ứng tiếp diễn.
✔️ 1. Ba có tính khử mạnh hơn Mg: Đây là đúng vì trong nhóm kim loại kiềm thổ, tính khử tăng dần từ trên xuống dưới bảng tuần hoàn. Ba nằm dưới Mg nên có tính khử mạnh hơn.
✔️ 2. Độ tan của barium hydroxide (Ba(OH2) cao hơn nhiều so với magnesium hydroxide (Mg(OH)2): Đúng vì Ba(OH)2 tan tốt trong nước, trong khi Mg(OH)2 rất ít tan, làm cho phản ứng của Ba diễn ra dễ hơn.
❌3. Ba hoạt động hoá học mạnh hơn nên tốc độ thoát khí của H2 mạnh hơn magnesium.
Chọn đáp án D Đáp án: D
✔️ A. Đúng. Beryllium sẽ không phản ứng với nước lạnh: Beryllium (Be) không phản ứng với nước lạnh, vì nó có lớp vỏ oxide bảo vệ bề mặt kim loại, ngăn cản phản ứng với nước.
✔️ B. Đúng. Strontium có bán kính nguyên tử lớn hơn calcium: Strontium (Sr) nằm dưới calcium (Ca) trong bảng tuần hoàn, vì vậy bán kính nguyên tử của strontium lớn hơn calcium.
❌ C. Sai. Barium chloride (BaCl2) tan tốt trong nước, ngay cả ở nhiệt độ lạnh.
✔️ D. Đúng. Radium phản ứng mạnh với nước: Radium (Ra) là một kim loại kiềm thổ nặng, và nó phản ứng mạnh với nước, tạo ra radium hydroxide và khí hydrogen.
Chọn đáp án C Đáp án: C
| Công thức | A. CaSO4. | B. CaO. | C. Ca(OH)2. | D. CaCO3. |
| Tên gọi | calcium sulfate | calcium oxide | calcium hydroxide | calcium carbonate |
⇒ Chọn đáp án A Đáp án: A
| Công thức | A. Ca(OH)2. | B. CaO. | C. CaSO4. | D. CaCO3. |
| Tên gọi | canxi hiđroxit | canxi oxit | canxi sunfat | canxi cacbonat |
| Tên gọi khác | vôi tôi | vôi sống | thạch cao | đá vôi |
⇝ Chọn đáp án A. Đáp án: A
❌A. Bauxite là Al2O3.2H2O.
❌B. Đá vôi là CaCO3.
❌C. Thạch cao nung là CaSO4.H2O.
✔️D. Thạch cao sống là CaSO4.2H2O.
⇒ Chọn đáp án D.
Đáp án: D

⇒ Đúc tượng, bó bột khi gãy xương dùng thạch cao nung: CaSO4.H2O.
⇒ Chọn đáp án A Đáp án: A
⇒ Biện pháp khắc phục là bón vôi tôi (CaO) bởi CaO + H2O → Ca(OH)2 có tính base ⇝ tăng tính kiềm cho đất cũng như giúp khử chua (loại bỏ các acid trong đất).
⇒ Chọn đáp án A Đáp án: A
Các hydroxide khác:
NaOH (sodium hydroxide) và KOH (potassium hydroxide): Mặc dù cũng là các base mạnh và có nhiều ứng dụng, nhưng thường có giá thành cao hơn Ca(OH)2 .
Ba(OH)2 (barium hydroxide): Có tính base mạnh nhưng độc hại và ít được sử dụng rộng rãi hơn Ca(OH)2 .
⟹ Chọn đáp án C Đáp án: C
► Các chất như CaO, CaOCl2 không được sử dụng do khi hút ẩm sẽ gây ảnh hưởng đến da tay.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án D Đáp án: D
Các ứng dụng khác cũng có nhưng không phải là chủ yếu.
⟹ Chọn đáp án A Đáp án: A
- BaSO4 là muối ít tan và không có tính kiềm mạnh, nên không có tác dụng với việc trung hòa acid trong dạ dày.
⟹ Chọn đáp án B Đáp án: B
❌ B. Barium chloride (BaCl2): Là một muối tan trong nước, không có đặc tính phù hợp với yêu cầu của thuốc diệt chuột.
❌ C. Barium hydroxide (Ba(OH)2): Là một base mạnh, tan trong nước và có tính kiềm cao, không phù hợp để làm thuốc diệt chuột.
❌ D. Barium sulfate (BaSO4): Là một muối không tan trong nước và cũng không có tính độc hại ở nồng độ bình thường, không phù hợp với mục đích diệt chuột.
⟹ Chọn đáp án A. Đáp án: A
❌ B. Sai. Mg(OH)2 mới được dùng trong các thuốc chữa chứng khó tiêu).
✔️ C. Đúng. SrCO3 (Strontium carbonate) được sử dụng trong ngành công nghiệp pháo hoa và pháo sáng, tạo ra màu đỏ đặc trưng khi đốt cháy.
❌ D. Sai. BaCl2 (Barium chloride) không được dùng làm "bột barium" trong y học mà (BaSO4) mới được sử dụng trong y học để chụp X-quang (chủ yếu để tạo hình ảnh trong chụp cắt lớp).
⟹ Chọn đáp án C Đáp án: C
Vì vậy, oxide tạo ra dung dịch bão hòa có pH cao nhất sẽ là BaO (aq), do nó tạo ra dung dịch kiềm mạnh với nồng độ OH⁻ cao nhất.
⟹ Chọn đáp án D. Đáp án: D
Giấm có tính acid của CH3COOH nên phản ứng với CaCO3 giải phóng khí carbon dioxide (CO2).
PTHH:
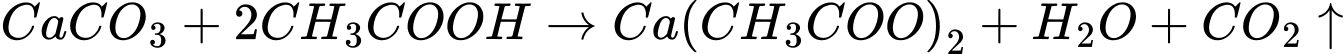
Chọn đáp án C Đáp án: C
❌ A. NaOH + Ba(HCO3)2 → NaOH + BaCO3↓ + H2O.
❌ B. 2HCl + Ba(HCO3)2 → BaCl2 + 2CO2↑ + 2H2O.
❌ C. Ca(OH)2 + Ba(HCO3)2 → BaCO3↓ + CaCO3↓ + 2H2O.
✔️ D. H2SO4 + Ba(HCO3)2 → BaSO4↓ + 2CO2↑ + 2H2O.
⟹ Chọn đáp án D Đáp án: D
 CaO + CO2↑.
CaO + CO2↑.⟶ Ngoài CO2, chất còn lại là CaO.
⟹ Chọn đáp án D Đáp án: D
Hoặc khi CaO hút ẩm: CaO + H2O → Ca(OH)2
|⇝ Sau đó: Ca(OH)2 + CO2 → CaCO3 + H2O.
⟹ Chọn đáp án C Đáp án: C
Hiện tượng sủi bọt khí không màu CO2↑ và có kết tủa trắng CaCO3↓ → Đáp án đúng là đáp án B
Đáp án: B
⇝ Hiện tượng: xuát hiện kết tủa trắng CaCO3↓. ❒ Đáp án: C
Chọn C.
Đáp án: C

Hình ảnh. Phần núi đá vôi trong nước biển dễ bị xói mòn
Phương trình nào sau đây biểu diễn cho quá trình nói trên?
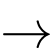 Ca(HCO3)2(aq).
Ca(HCO3)2(aq). Ca(HCO3)2(aq).
Ca(HCO3)2(aq). CaO(s) + CO2(g).
CaO(s) + CO2(g). Ca(HCO3)2(aq).
Ca(HCO3)2(aq).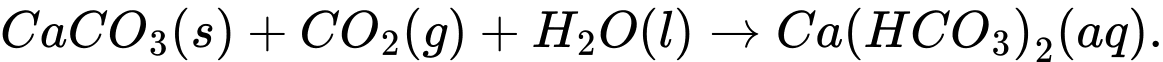
Chọn đáp án C Đáp án: D
PTHH:
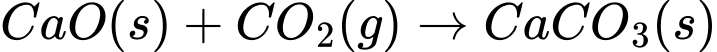
⟹ Chọn đáp án C
Đáp án: C
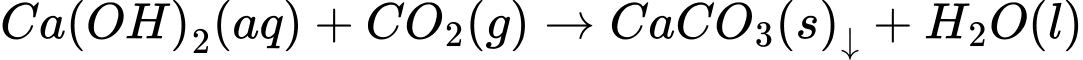
→ Chất X là CaCO3.
⟹ Chọn đáp án C Đáp án: C
- Z là CO2 (carbon dioxide), không phải là khí duy trì sự sống (oxygen, O2). CO2 là khí gây ra hiệu ứng nhà kính và không hỗ trợ sự sống của hầu hết các sinh vật trên trái đất.
Phương trình phản ứng giữa Y (CaCO3) và acid mạnh (ví dụ, hydrochloric acid HCl) để tạo ra Z (CO2) và các sản phẩm khác:
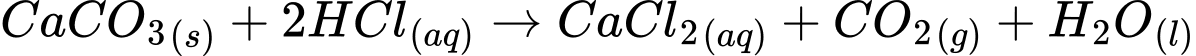
⟹ Chọn đáp án B Đáp án: B
✔️ Nước không có phản ứng đặc trưng với cả hai hợp chất. Nhưng khi hòa tan thì MgCO3 không tan trong nước, còn Mg(NO3)2 tan tạo thành dung dịch.
❌ Khí oxygen không phản ứng đặc biệt với MgCO3 hoặc Mg(NO3)2.
❌ NaOH rắn không dụng với MgCO3, với Mg(NO3)2.
⟹ Chọn đáp án B
Đáp án: B




B.
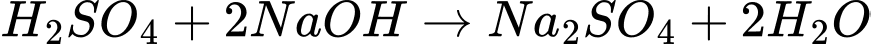
C.
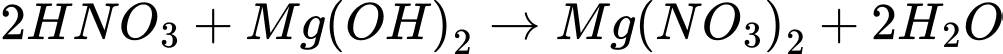
D.
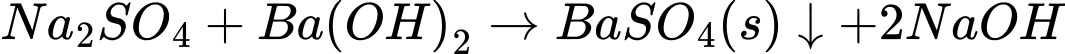
Phản ứng D sinh ra chất không tan là BaSO4.
⟹ Chọn đáp án D
Đáp án: D
MgCO3(s)
 X(s) + Y(g).
X(s) + Y(g).Hợp chất X và Y lần lượt là
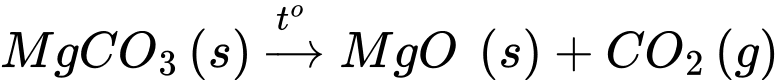
X là magnesium oxide (MgO) và hợp chất Y là khí carbon dioxide (CO2).
⟹ Chọn đáp án A Đáp án: A
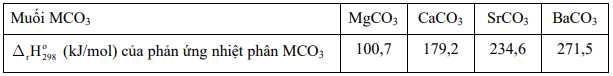
Hãy cho biết quá trình phân huỷ 1 mol muối carbonate của nguyên tố nhóm IIA nào sau đây cần hấp thu nhiều năng lượng nhất.
⟹ Chọn đáp án D Đáp án: D
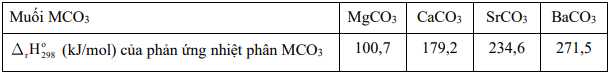
Muối nào sau đây có độ bền nhiệt cao nhất?
⟹ Chọn đáp án D Đáp án: D
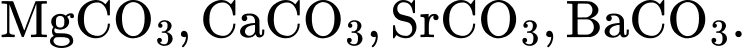

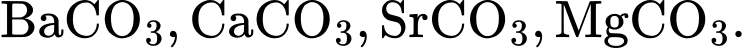
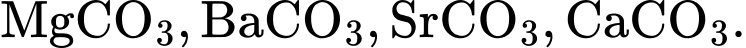
Nhiệt độ phân huỷ thành oxide của các muối carbonate của kim loại nhóm IIA giảm dần theo dãy
BeCO3 < MgCO3 < CaCO3 < SrCO3 < BaCO3
⟹ Chọn đáp án A

Hãy cho biết quá trình phân huỷ 1 mol muối nitrate của nguyên tố nhóm IIA nào sau đây cần hấp thu nhiều năng lượng nhất.
⟹ Chọn đáp án D Đáp án: D
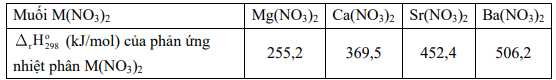
Muối nào sau đây có độ bền nhiệt cao nhất?
⟹ Chọn đáp án D Đáp án: D
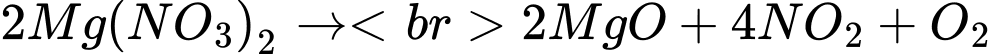
nNO2 = 2nMg(NO3)2 = 0,05.2 = 0,1 mol
nO2 = 0,05.1/2 = 0,025 mol
nhỗn hợp = 0,1 + 0,025 = 0,125 mol.
⟹ V = 0,125.24,79 ≈ 3,1 L
⟹ Chọn đáp án A
Đáp án: A
Phương trình phản ứng:
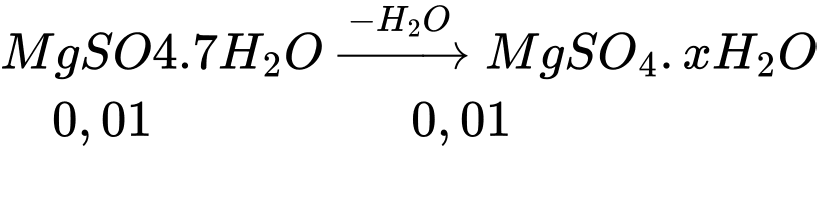
Khối lượng muối tạo thành
mMgSO4.xH2O =1,744 = 0,01.(24 + 96 + 18.x) ⟹ x = 3
Công thức của muối sau khi mất đi một vài phân tử nước là: MgSO4.3H2O
⟹ Chọn đáp án D.
Đáp án: D
⟹ Chọn đáp án B
Đáp án: B
❌ B. Dung dịch NH3: Dung dịch NH3 có thể phân biệt được dung dịch CaCl2 và BaCl2. Khi thêm dung dịch NH3 vào dung dịch CaCl2, sẽ không xảy ra hiện tượng gì rõ rệt.
✔️ C. Na2CrO4: Dung dịch Na2CrO4 sẽ tạo ra kết tủa màu vàng với dung dịch BaCl2 (do tạo ra BaCrO4), nhưng không phản ứng với CaCl2.
❌ D. Na2CO3: Khi thêm Na2CO3 vào dung dịch CaCl2, cả 2 sẽ tạo ra kết tủa CaCO3, BaCO3 trắng.
⟹ Chọn đáp án C Đáp án: C
1. CaCl2 (Calcium chloride): Khi đốt, tạo ra màu cam đặc trưng.
2. BaCl2 (Barium chloride): Khi đốt, tạo ra màu xanh lá cây.
3. KCl (Potassium chloride): Khi đốt, tạo ra màu tím.
4. NaCl (Sodium chloride): Khi đốt, tạo ra màu vàng đặc trưng.
5. Na2CO3 (Sodium carbonate): Đây là muối có chứa anion carbonate (CO32-) và khi đốt cháy không tạo ra màu sắc đặc trưng như các muối chloride khác.
⟹ Có thể phân biệt cả 5 chất.
⟹ Chọn đáp án D Đáp án: D
✔️ A. Đúng. Các muối nitrate của nhóm IIA (ví dụ: Mg(NO3)2, Ca(NO3)2, Ba(NO3)2) đều tan tốt trong nước. Đây là quy tắc chung cho tất cả các muối nitrate (NO3-), chúng đều hòa tan trong nước.
✔️ B. Đúng. Muối magnesium sulfate (MgSO4) là chất tan trong nước, trong khi đó muối barium sulfate (BaSO4) lại là chất không tan trong nước.
✔️ C. Đúng. Các muối carbonate của nhóm IIA (MgCO3, CaCO3, SrCO3, BaCO3) đều không tan trong nước.
❌ D. Sai. Các hydroxide của nhóm IA (NaOH, KOH, LiOH) đều tan rất tốt trong nước. Tuy nhiên, hydroxide của nhóm IIA có độ tan khác nhau. Ví dụ, Mg(OH)2 rất ít tan.
⟹ Chọn đáp án D Đáp án: D
❌ A. Sai. Ca(OH)2 hay vôi tôi thường được sử dụng trong nông nghiệp để trung hòa đất acid và cải thiện độ pH của đất.
✔️ B. Đúng. Mg(OH)2 là thành phần phổ biến trong các thuốc antacid (thuốc trung hòa acid dạ dày) dùng để chữa chứng khó tiêu, trào ngược acid hoặc đau dạ dày.
✔️ C. Đúng. Anion hydroxide trong Ba(OH)2 là OH-. Nguyên tử O: Có 8 electron + Nguyên tử H: Có 1 electron + Ion OH⁻ mang điện tích -1: (nghĩa là ion
OH⁻ đã nhận thêm 1 electron so với trạng thái trung hòa).
Tổng = 10
⟹ Chọn đáp án A
Đáp án: A
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.
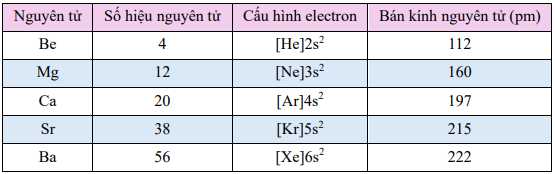
a. Cấu hình electron lớp ngoài cùng của các kim loại nhóm IIA có dạng ns2.
b. Số oxi hóa đặc trưng của các nguyên tố nhóm IIA là +2.
c. Bán kính nguyên tử tăng dần từ Be đến Ba do sự tăng số lớp electron.
d. Tính khử giảm dần từ Be đến Ba.
✔️ a. Đúng. Tất cả các nguyên tố nhóm IIA (Be, Mg, Ca, Sr, Ba) đều có 2 electron ở lớp ngoài cùng với cấu hình electron dạng ns2, như bảng đã nêu.
✔️ b. Đúng. Các nguyên tố nhóm IIA dễ dàng mất 2 electron ở lớp ngoài cùng để tạo ion M2+ nên số oxi hóa đặc trưng là +2.
✔️ c. Đúng. Khi đi từ Be (Z=4) đến Ba (Z=56), số lớp electron tăng từ 2 (Be) lên 6 (Ba), dẫn đến bán kính nguyên tử tăng.
❌ d. Sai. Từ Be đến Ba, năng lượng ion hóa giảm do bán kính nguyên tử tăng, lực hút hạt nhân lên electron ngoài cùng yếu hơn, nên tính khử tăng dần từ Be đến Ba chứ không giảm.
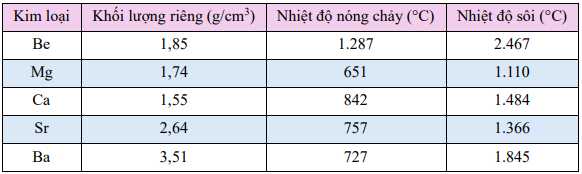
a. Các kim loại nhóm IIA đều là kim loại nhẹ.
b. Các kim loại nhóm IIA có nhiệt độ nóng chảy, nhiệt độ sôi giảm dần từBe đến Ba.
c. Các kim loại nhóm IIA có nhiệt độ nóng chảy cao hơn kim loại nhóm IA.
d. Các kim loại nhóm IIA dễ nhường electron hơn các kim loại nhóm IAthuộc cùng một chu kì.
✔️ a. Đúng. Khối lượng riêng của các kim loại nhóm IIA (Be, Mg, Ca, Sr, Ba) đều tương đối nhỏ, từ 1,55 g/cm3 (Ca) đến 3,51 g/cm3 (Ba). Đây là các kim loại nhẹ.
❌ b. Sai.
+) Nhiệt độ nóng chảy: Giảm từ Be (1.287 oC) đến Mg (651 oC), nhưng sau đó dao động không đều (Ca: 842 oC, Sr: 757 oC, Ba: 727 oC).
+) Nhiệt độ sôi: Không giảm dần từ Be đến Ba (Be: 2.467 oC, Mg: 1.110 oC, Ca: 1.484 oC, Sr: 1.366 oC, Ba: 1.845 oC).
→ Không có xu hướng giảm dần rõ ràng.
✔️ c. Đúng. Kim loại nhóm IIA có nhiệt độ nóng chảy cao hơn kim loại nhóm IA do liên kết kim loại mạnh hơn, nhờ vào mật độ electron cao hơn và ion dương có kích thước nhỏ hơn.
❌ d. Sai. Kim loại nhóm IA (như Li, Na, K) dễ nhường electron hơn nhóm IIA (như Be, Mg, Ca) cùng chu kì vì kim loại nhóm IA chỉ cần mất 1 electron để đạt cấu hình bền, trong khi nhóm IIA cần mất 2 electron.
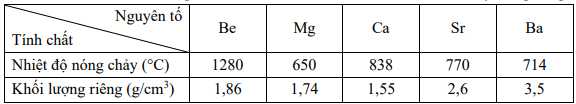
a. Beryllium là kim loại nhẹ nhất trong các kim loại nhóm IIA.
b. Magnesium là kim loại có nhiệt độ nóng chảy thấp nhất trong nhóm IIA.
c. Các kim loại nhóm IIA đều dẫn điện.
d. Các kim loại nhóm IIA có cùng kiểu mạng tinh thể.
❌ a. Sai. Beryllium có khối lượng riêng là 1,86 g/cm3, nhưng magnesium nhẹ hơn với khối lượng riêng là 1,74 g/cm3.
✔️ b. Đúng. Magnesium có nhiệt độ nóng chảy là 650 oC, thấp nhất trong các kim loại nhóm IIA.
✔️ c. Đúng. Các kim loại nhóm IIA đều có các electron tự do nên có khả năng dẫn điện tốt. Mặc dù mỗi kim loại trong nhóm IIA có các tính chất vật lí khác nhau, nhưng tất cả đều có khả năng dẫn điện.
❌ d. Sai. Các kim loại nhóm IIA có mạng tinh thể khác nhau. Ví dụ, Beryllium có mạng tinh thể lục phương chặt khít, trong khi các kim loại khác (như calcium) có cấu trúc lập phương tâm khối.
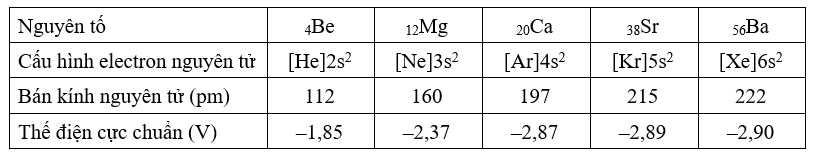
a. Các nguyên tố nhóm IIA thuộc vào nguyên tố s.
b. Các kim loại nhóm IIA đều có 2 electron độc thân.
c. Do bán kính nguyên tử có xu hướng tăng dần từ Be đến Ba nên khả năng nhường electron tăng dần từ Be đến Ba.
d. Khi tham gia phản ứng với H2O, magnessium phản ứng mãnh liệt hơn barium.
✔️ a. Đúng. Các nguyên tố nhóm IIA thuộc vào nguyên tố s do có electron cuối dùng điền vào phân lớp s, có cấu hình ns2.
❌ b. Sai. Các nguyên tố nhóm IIA có cấu hình electron kết thúc ở ns2, tức là có 2 electron ở lớp vỏ ngoài cùng điền đủ vào một ô orbital nên không có electron độc thân.
✔️ c. Đúng. Khi bán kính nguyên tử tăng, lực hút electron yếu hơn, các electron ở lớp ngoài cùng dễ bị tách ra hơn. Điều này làm cho khả năng nhường electron (tính kim loại) tăng dần từ Be đến Ba.
❌ d. Sai. Barium phản ứng mạnh mẽ hơn magnesium khi tiếp xúc với nước vì các electron ngoài cùng của Ba dễ dàng bị nhường hơn.
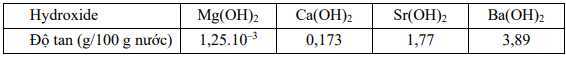
a. Phản ứng tổng quát với nước của kim loại nhóm IIA (trừ Be) là: M + H2O → M(OH)2 + H2.
b. Độ tan trong nước của các hydroxide nhóm IIA có xu hướng tăng dần.
c. Khi cho các kim loại Mg, Ca, Sr, Ba tác dụng với nước, bọt khí xuất hiện nhanh nhất trên bề mặt kim loại Mg.
d. Trong số các kim loại Mg, Ca, Sr, Ba, có 2 kim loại phản ứng nhanh khi tác dụng với nước ở nhiệt độ thường
❌ a. Sai. Phản ứng tổng quát với nước của kim loại nhóm IIA (trừ Be) là: M + 2H2O → M(OH)2 + H2.
Beryllium không phản ứng với nước, kể cả khi đun nóng.
✔️ b. Đúng. Dựa vào bảng độ tan trên, thấy độ tan của các hydroxide nhóm IIA tăng dần từ Mg(OH)2 đến Ba(OH)2.
❌ c. Sai. Mức độ của phản ứng với nước thường liên quan đến độ tan của hydroxide tạo thành: hydroxide
có độ tan lớn hơn thì phản ứng của kim loại đó với nước thuận lợi hơn nên bọt khí xuất hiện nhanh nhất trên bề mặt kim loại Ba.
❌ d. Sai. Có 3 kim loại (Ca, Sr, Ba) đều phản ứng nhanh với nước ở nhiệt độ thường.
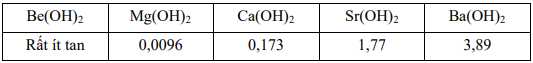
a. Phương trình phản ứng của strontium với nước là:2Sr + 2H2O → 2SrOH + H2.
b. Khả năng phản ứng của các nguyên tố với nước giảm dần khi đi từ Be đến Ba.
c. Độ pH của dung dịch tạo thành tăng dần khi đi từ Be đến Ba.
d. Tốc độ thoát khí tăng dần khi đi từ Ba đến Be.
❌ a. Sai. Sr là kim loại nhóm IIA nên có hóa trị II, khi phản ứng với nước tạo Sr(OH)2 chứ không phải SrOH.
Phương trình phản ứng đúng phải là:
Sr + 2H2 O → Sr(OH)2 + H2
❌ b.Sai. Beryllium (Be) không phản ứng với nước ở nhiệt độ thường do lớp oxide bảo vệ bền.
Magnesium (Mg) phản ứng chậm với nước lạnh nhưng rõ rệt hơn với nước nóng.
Calcium (Ca), Strontium (Sr), và Barium (Ba) phản ứng ngày càng mạnh hơn do độ tan của hydroxide và khả năng nhường electron tăng.
→ Khả năng phản ứng của các nguyên tố với nước tăng dần khi đi từ Be đến Ba.
✔️ c. Đúng. Khi tan, hydroxide giải phóng ion OH⁻, làm tăng pH. Độ tan của các hydroxide nhóm IIA trong nước tăng dần từ Be đến Ba nên độ pH của dung dịch tạo thành cũng tăng dần khi đi từ Be đến Ba.
❌ d. Sai.
+) Be không phản ứng với nước, nên không có khí thoát ra.
+) Mg phản ứng chậm, khí thoát ra ít.
+) Ca, Sr, và Ba phản ứng ngày càng mạnh hơn, dẫn đến khí H2 thoát ra nhanh hơn.
→ Tốc độ thoát khí tăng dần khi đi từ Be đến Ba.
(1) X
 Y + Z.
Y + Z.(2) Y + H2O
 T.
T.(3) T + F → G + X + H2O.
(4) T + 2F
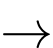 H + X + 2H2O.
H + X + 2H2O.Biết X là thành phần chính của đá vôi, F là hợp chất của Na; Y được dùng để khử chua đất trồng.
a. Chất Z là nguyên nhân gây ra hiện tượng hiệu ứng nhà kính.
b. Chất F được sử dụng trong quy trình solvay để điều chế soda.
c. Ở điều kiện thường, chất F là chất rắn, tan nhiều trong nước.
d. T được ứng dụng để khử chua, làm mềm nước cứng.

2.

3.
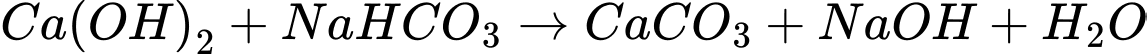
4.
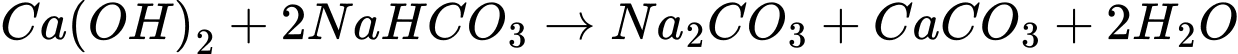
X là CaCO3
Y là CaO ; Z là CO2 ; T là Ca(OH)2 ; G là NaOH
F là NaHCO3 ; G là NaOH ; H là Na2CO3
Phân tích các phát biểu:
✔️ a. Đúng – Z là CO2, nguyên nhân chính gây ra hiệu ứng nhà kính.
✔️ b. Đúng – F (NaHCO3) được sử dụng trong quy trình Solvay để điều chế soda.
❌ c. Sai – F (NaHCO3) là chất rắn,ít tan trong nước.
✔️ d. Đúng – T (Ca(OH)2) được ứng dụng để khử chua và làm mềm nước cứng.
a. Dung dịch chuyển từ không màu sang màu hồng.
b. Phản ứng xảy ra nhanh hơn khi đun nóng nên đây là phản ứng thu nhiệt.
c. Sản phẩm thu được sau phản ứng có thể khử chua đất, làm mềm nước cứng.
d. Nếu cho bằng giấy quỳ tím vào dung dịch sau phản ứng thì có màu hồng.

Phân tích các phát biểu:
✔️a. Đúng. Dung dịch chuyển từ không màu sang màu hồng do tạo Ca(OH)2 là base mạnh.
❌b.Sai. Phản ứng xảy ra nhanh hơn khi đun nóng và là phản ứng tỏa nhiệt (delta H < 0).
✔️c. Đúng. Sản phẩm thu được sau phản ứng Ca(OH)2 có thể khử chua đất, làm mềm nước cứng.
❌d.Sai. Nếu cho giấy quỳ tím vào dung dịch sau phản ứng thì có màu xanh do Ca(OH)2 là base mạnh.
Thí nghiệm 2: Cho mẩu nhỏ kim loại barium (khoảng 2 g) vào chậu thuỷ tinh chứa khoảng 500 mL nước và vài giọt dung dịch phenolphthalein.
a. Ở cả thí nghiệm 1 và thí nghiệm 2, dung dịch sau phản ứng đều bị đục.
b. Mẩu calcium ở thí nghiệm 1 tan nhanh hơn mẩu barium ở thí nghiệm 2.
c. Hai thí nghiệm này chứng minh rằng calcium và barium là các kim loạicó thế khử chuẩn âm.
d. Ở cả thí nghiệm 1 và thí nghiệm 2, dung dịch sau phản ứng có màu hồng.
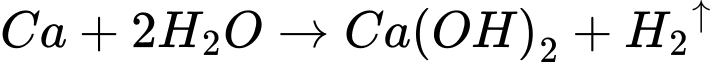
Thí nghiệm 2: Barium phản ứng với nước:
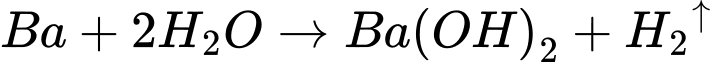
Phân tích các phát biểu
✔️a. Đúng: Dung dịch sau phản ứng bị đục vì có sự tạo thành kết tủa Ca(OH)2, Ba(OH)2 .
❌b. Sai: Mặc dù Ca nhẹ hơn Ba, nhưng Ba phản ứng với nước mạnh hơn Ca. Do đó, mẩu Ba sẽ tan nhanh hơn mẩu Ca.
✔️c. Đúng: Cả Ca và Ba phản ứng với nước, giải phóng khí H2. Điều này chứng minh rằng chúng là các kim loại có thế khử chuẩn âm.
✔️d. Đúng: Dung dịch sau phản ứng có màu hồng do Ca(OH)2 và Ba(OH)2 đều là các base mạnh.

a. Phương trình nhiệt phân muối carbonate của các chất trên là:MCO3
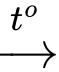 t MO + CO2.
t MO + CO2.b. Độ bền nhiệt của muối tăng từ MgCO3 đến BaCO3.
c. Giá trị biến thiên enthalpy chuẩn của phản ứng lớn hơn 0 nên phản ứngsẽ tỏa nhiệt.
d. Phản ứng nhiệt phân 21 gam MgCO3 tỏa ra nhiệt lượng là 200,14 kJ/mol.
✔️a.Đúng. Đây là phương trình đúng cho phản ứng nhiệt phân muối carbonate của kim loại kiềm thổ (Ca, Sr, Ba, Mg).
✔️b. Đúng.Từ MgCO3 đến BaCO3, bán kính ion kim loại tăng dần, khả năng phân cực giảm, nên độ bền nhiệt tăng.
❌c.Sai. Biến thiên enthalpy chuẩn (ΔH 0 ) của phản ứng dương (>0) có nghĩa là phản ứng thu nhiệt (không tỏa nhiệt).
❌d. Sai.
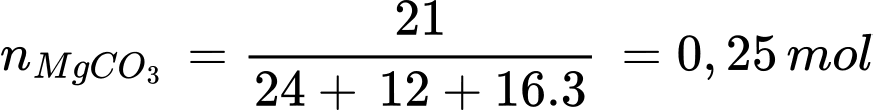
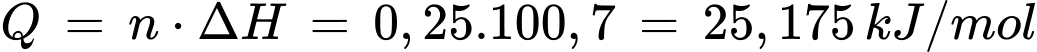
a. Vôi tôi và vôi sống đều có thể dùng để khử chua đất trong nông nghiệp.
b. Đá vôi và thạch cao đều được dùng trong sản xuất vật liệu xây dựng.
c. Khoáng vật apatite được khai thác để sản xuất phân đạm.
d. Vôi tôi có thể được dùng để làm mềm nước cứng
✔️a. Đúng. Cả vôi tôi (Ca(OH)2) và vôi sống (CaO) đều có tác dụng khử chua đất, làm tăng độ pH của đất, giúp cải thiện chất lượng đất trong nông nghiệp.
✔️b. Đúng. Đá vôi (CaCO3) là nguyên liệu chính trong sản xuất xi măng, trong khi thạch cao (CaSO4·2H2O) được dùng để sản xuất tấm thạch cao và làm vật liệu chống cháy trong xây dựng.
❌c. Sai. Apatite (Ca5(PO4)3F) là khoáng vật chứa photphat, được khai thác để sản xuất phân bón photphat, một nguyên liệu quan trọng trong sản xuất phân lân.
✔️d. Đúng. Vôi tôi (Ca(OH)2) có thể dùng để làm mềm nước cứng, do nó phản ứng với các ion canxi và magiê trong nước, làm giảm độ cứng của nước.
Bước 1: Đặt 2 ống nghiệm vào giá. Thêm khoảng 2 mL dung dịch CaCl2 vào ống nghiệm (1), 2 mL dung dịch BaCl2 vào ống nghiệm (2).
Bước 2: Nhỏ từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm cho đến khi xuất hiện kết tủa.
a. Thí nghiệm trên có thể tiến hành để so sánh độ tan giữa calcium sulfate
và barium sulfate.
b. Ống nghiệm (1) thấy xuất hiện kết tủa nhanh hơn so với ống nghiệm (2).
c. Nếu thay dung dịch CuSO4 bằng Na2CO3 thì hiện tượng quan sát được là
tương tự.
d. CaSO4 có độ tan lớn hơn độ tan của BaSO4.
✔️a. Đúng.
Vì CaSO4 và có độ tan khác nhau, hiện tượng kết tủa xảy ra sẽ khác biệt, từ đó có thể so sánh được độ tan.❌b. Sai. có độ tan nhỏ hơn rất nhiều, nên kết tủa ở ống (2) (chứa ) sẽ xuất hiện nhanh hơn.
❌c. Sai.Dung dịch CuSO4 có màu xanh, hiện tượng khi phản ứng với BaCl2 và CaCl2 hiện tượng xuất hiện kết tủa trắng mà xanh của dung dịch nhạt dần. Dung dịch không màu cũng tạo kết tủa với và , tương ứng là và BaCO3 màu trắng.
✔️d.Đúng. Theo bảng độ tan, B rất ít tan (gần như không tan), trong khi có độ tan lớn hơn một chút.
Bước 1: Cho khoảng 1 mL dung dịch Na2CO3 1M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl2 1 M, lắc đều.
Bước 2: Thêm tiếp 2 mL dung dịch HCl 2 M vào ống nghiệm, lắc đều.
a. Sau bước 1, thấy xuất hiện kết tủa có màu trắng hơi xanh.
b. Sau bước 2 thấy kết tủa tan dần, sủi bọt khí không màu.
c. Thí nghiệm trên tiến hành để nhận biết sự có mặt của ion Ca2+.
d. Nếu thay dung dịch CaCl2 bằng Ca(NO3)2 thì hiện tượng quan sát đượclà tương tự.
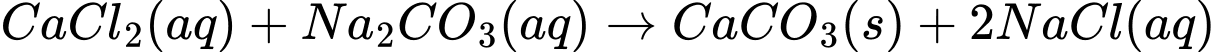
Bước 2. Phản ứng:
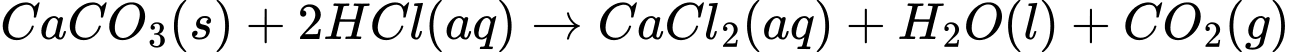
Phân tích các phát biểu:
❌a. Sau bước 1, kết tủa trắng là do sự tạo thành CaCO3 (canxi cacbonat) từ phản ứng giữa Na2CO3 và CaCl2.
✔️b. Sau khi thêm HCl, kết tủa tan và khí CO2 được giải phóng, gây hiện tượng sủi bọt khí không màu.
✔️c. Thí nghiệm này giúp nhận biết ion Ca2+, vì chỉ có ion Ca2+ mới tạo kết tủa trắng với Na2CO3 và tan khi có HCl.
✔️d. Nếu thay CaCl2 bằng Ca(NO3)2, phản ứng vẫn xảy ra tương tự vì ion Ca2+ từ cả hai muối đều có khả năng tạo kết tủa với Na2CO3 và phản ứng với HCl.
a. Việc thêm vôi vào đất ẩm làm giảm độ pH của đất.
b. Việc bón vôi thích hợp với các đất cần khử chua.
c. Sản phẩm thu được sau khi thêm ammonium sulfate gồm có ammonia,calcium hydroxide và nước.
d. Việc dùng vôi bón vào đất có thể gây tác hại làm chai đất do sinh rahóa chất ít tan.
❌a. Sai. Việc thêm vôi vào đất ẩm sẽ làm tăng độ pH của đất, tức là làm đất trở nên ít chua hơn.
✔️b. Đúng. Việc bón vôi vào đất là thích hợp đối với các loại đất có độ pH thấp (đất chua), vì vôi có tác dụng làm trung hòa axit, khử chua đất, giúp cây trồng phát triển tốt hơn.
❌c. Sai. Sản phẩm thu được khi bón ammonium sulfate vào đất là một phản ứng hóa học giữa NH3, nước và acid (có thể là từ đất). Phản ứng chính là:
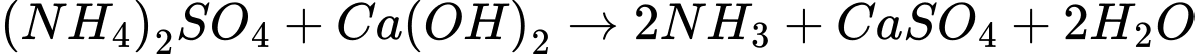
Sản phẩm không chứa calcium hydroxide (Ca(OH)2).
✔️d. Đúng. Việc sử dụng vôi trong một số trường hợp có thể dẫn đến việc đất bị chai cứng, do sự hình thành của các hợp chất ít tan, hoặc do sự thay đổi cấu trúc đất khi vôi quá mức, làm giảm khả năng thấm nước và khí trong đất.
- Hợp chất Q là muối carbonate trung hòa của kim loại nhẹ hơn Al, được kết hợp với Al tạo các bộ phận máy bay, vỏ ô tô.
- Hợp chất R được sử dụng làm vật liệu xây dựng. Nung R ở nhiệt độ cao tạo thành hợp chất S, hydrate hóa S tạo thành hợp chất T có thể dùng khử chua, làm mềm nước cứng.
a. Tổng số nguyên tử trong phân tử chất Q và chất R là bằng nhau.
b. Khối lượng phân tử của Q lớn hơn khối lượng phân tử của R.
c. Nguyên tố kim loại trong S phản ứng với nước mãnh liệt hơn nguyêntố kim loại trong Q.
d. Nếu lấy cùng 1 gam chất Q và R tham gia phản ứng với dung dịchHCl thì chất R cần lượng HCl lớn hơn
+ Hợp chất Q là muối carbonate trung hòa của kim loại nhẹ hơn Al và kết hợp với Al tạo các bộ phận máy bay, vỏ ô tô. Đây là đặc trưng của Mg
Q = MgCO3.
+ Hợp chất R được sử dụng làm vật liệu xây dựng, và khi nung R ở nhiệt độ cao tạo thành hợp chất S. Đây là một đặc trưng của vôi sống (CaO), là sản phẩm của quá trình nung CaCO3. Vôi sống được sử dụng rộng rãi trong xây dựng và xử lý nước.
R = CaCO3.
+ Hợp chất S được tạo thành khi nung R (CaCO3) ở nhiệt độ cao, tạo thành CaO. Khi hydrate hóa CaO, nó sẽ tạo ra hợp chất Ca(OH)2, một chất dùng để khử chua và làm mềm nước cứng.
S = CaO.
+ Hợp chất T là sản phẩm hydrate của S, có thể dùng khử chua và làm mềm nước cứng. Hợp chất này chính là Ca(OH)2, chất dùng trong các ứng dụng khử chua đất và làm mềm nước.
T = Ca(OH)2
Phân tích các phát biểu:
✔️a.Đúng. Với Q là MgCO3 có 5 nguyên tử; R là CaCO3 có 5 nguyên tử.
Vậy tổng số nguyên tử trong phân tử của Q và R bằng nhau.
❌b. Sai. Khối lượng phân tử của Q là 84 g/mol < của R là 100 g/mol.
✔️c. Đúng. S có Ca phản ứng với nước mãnh liệt hơn Q có Mg.
❌d. Sai. Vì cả Mg và Ca đều phản ứng với HCl theo tỷ lệ 1:2, nhưng khối lượng phân tử của Ca lớn hơn Mg, do đó, 1 gam Ca sẽ cần ít mol HCl hơn so với 1 gam Mg.
- Dung dịch chất X và chất Y đều làm dung dịch phenolphthalein chuyển sang màu hồng.
- Trộn X và Y thu được kết tủa màu trắng.
- Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
Biết mỗi chất X, Y đều chỉ chứa một loại cation và một loại anion.
a. Chất X có chứa cation Ba2+, chất Y chứa cation K+.
b. Chất X không thể là barium chloride.
c. Chất Y phải là potassium carbonate.
d. Kết tủa màu trắng phải là hợp chất của barium.
=> X và Y đều là các chất bazơ, cụ thể là các dung dịch chứa ion OH−
- Khi trộn dung dịch X và Y, thu được kết tủa màu trắng:
=> Kết tủa màu trắng có thể là một muối ít tan
- Ngọn lửa màu lục đặc trưng cho ion Ba2+ (barium).
- Ngọn lửa màu tím đặc trưng cho ion K+ (potassium).
Phân tích các phát biểu:
✔️(a) Đúng vì X cháy cho ngọn lửa màu lục, Y cháy cho ngọn lửa màu tím.
✔️(b) Đúng vì X chuyển phenolphtalein sang màu hồng.
❌(c) Sai, Y có thể là KHCO3, K2SO3, K3PO4…
✔️(d) Đúng vì các hợp chất của K (Y) tan trong nước.
Biến thiên enthalpy chuẩn
 của phản ứng thuận ở mỗi cân bằng (1) và (2) khi phân huỷ 1 mol mỗi chất lần lượt có giá trị là 108,7 kJ và 271,5 kJ.A
của phản ứng thuận ở mỗi cân bằng (1) và (2) khi phân huỷ 1 mol mỗi chất lần lượt có giá trị là 108,7 kJ và 271,5 kJ.Aa. Nhiệt lượng toả ra khi phân huỷ 1 mol BaCO3 lớn hơn nhiệt lượng toảra khi phân huỷ 1 mol CaCO3.
b. BaCO3 bị phân huỷ ở nhiệt độ cao hơn CaCO3.
c. Khi tăng nhiệt độ, cả hai phản ứng đều dịch chuyển theo chiều thuận.
d. CO2 cần được lấy ra khỏi lò nung để tăng hiệu suất của phản ứng.
❌a.Sai. Tiêu chuẩn enthalpy biến thiên của phản ứng phân hủy BaCO3 là 271,5 kJ/mol > CaCO3 là 108,7 kJ/mol. Do đó, nhiệt lượng toả khi phân hủy 1 mol BaCO3 > 1 mol CaCO3.Nhưng 2 phản ứng là phản ứng thu nhiệt, không phải tỏa nhiệt.
✔️b. Đúng. Phản ứng BaCO3 có enthalpy giá trị cao hơn, điều này cho thấy BaCO3 cần có nhiệt độ cao hơn để phân hủy so với CaCO3.
✔️c. Đúng. Cả 2 là phản ứng thu nhiệt ( enthalpy > 0 ). Khi nhiệt độ tăng, cả hai phản ứng đều dịch chuyển theo chiều thuận.
✔️d. Đúng.Việc loại bỏ CO2 sẽ làm giảm nồng độ CO2 trong hệ, cân bằng dịch chuyển theo chiều tăng nồng độ CO2, nghĩa là chiều thuận.
Cho dãy chuyển hóa sau: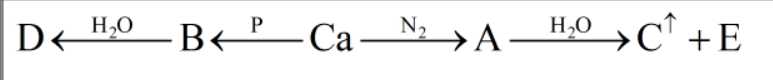
a. Sản phẩm E thu được trong dung dịch gọi là nước vôi trong.
b. Quan sát màu có thể phân biệt được hai khí C và D.
c. Các phản ứng xảy ra trong dãy chuyển hóa đều là phản ứng oxi hóa - khử.
d. Khí D có khả năng tự bốc cháy trong không khí khi có mặt P2H4
(1)
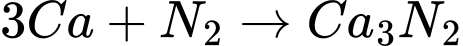 (A)
(A)(2)
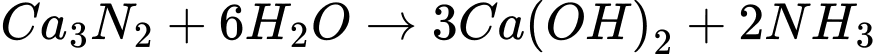 (C)
(C)(3)
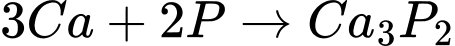 (B)
(B)(4)
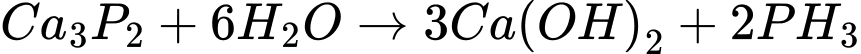
Phân tích các phát biểu:
✔️a. Đúng. Sản phẩm E ( Ca(OH)2) thu được trong dung dịch gọi là nước vôi trong.
❌b.Sai. Quan sát màu không thể phân biệt được hai khí C và D do cả 2 đều không màu.
❌c. Sai. Các phản ứng xảy ra trong dãy chuyển hóa có 2 phản ứng là phản ứng oxi hóa - khử là 1 và 3.
✔️d. Đúng. Khí D là PH3 có khả năng tự bốc cháy trong không khí khi có mặt P2H4
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
(a) Potassium carbonate và calcium hydroxide.
(b) Sodium phosphate và barium chloride.
(c) Magnesium hydrogencarbonate và sulfuric acid.
(d) Sodium hydrogencarbonate và barium hydroxide.
(e) Barium hydroxide và nitric acid.
Có bao nhiêu phản ứng sau khi kết thúc thu được kết tủa?
Điền đáp án: ..........

(b) Sodium phosphate (Na3PO4)+ barium chloride (BaCl2)
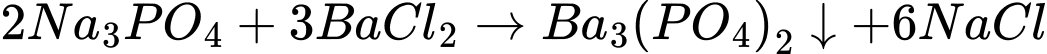
(c) Magnesium hydrogencarbonate (Mg(HCO3)2) + sulfuric acid (H2SO4)
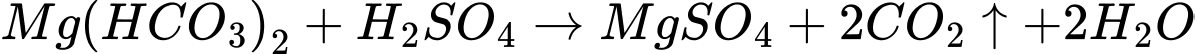
(d) Sodium hydrogencarbonate (NaHCO3) + barium hydroxide (Ba(OH)2)
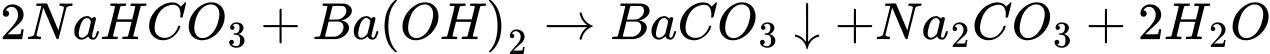
(e) Barium hydroxide (Ba(OH)2) + nitric acid (HNO3)
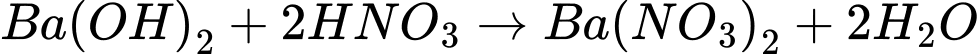
Có 3 phản ứng tạo kết tủa là a,b,d
Điền đáp án: 3
Điền đáp án: ..........
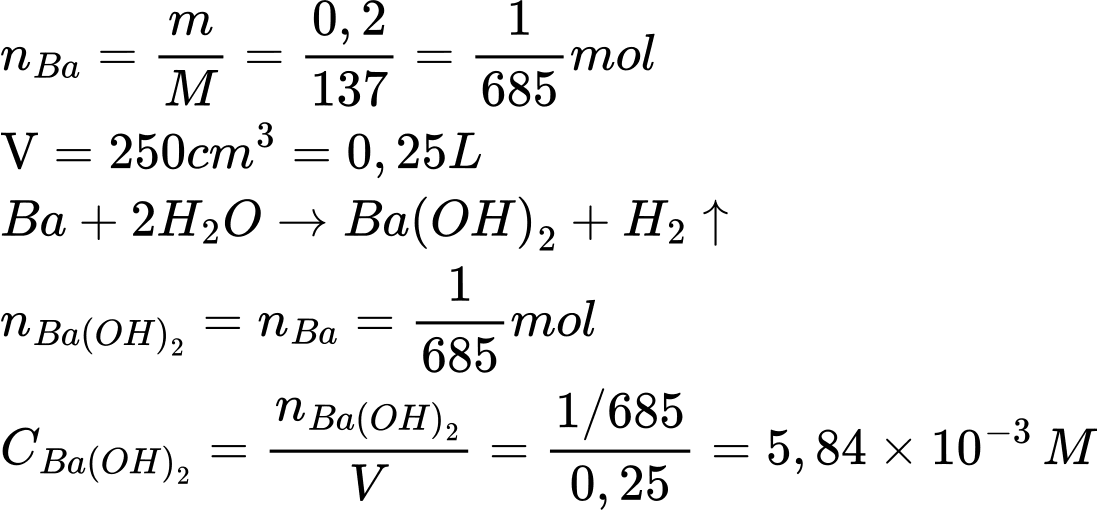
Điền đáp án: 5,84
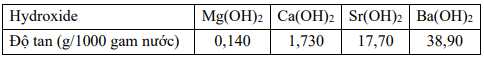
Học sinh Mun tiến hành thí nghiệm thấy rằng trong 50 mL một dung dịch có chứa 802 mg hydroxide của một kim loại nhóm IIA. Khối lượng phân tử của hydroxide trên là bao nhiêu? ( làm tròn đến hàng đơn vị )
Điền đáp án: ..........
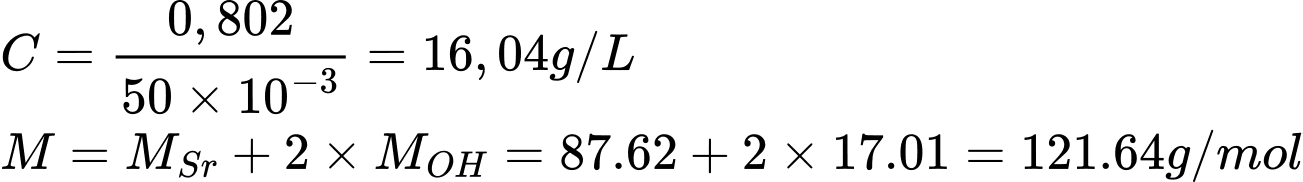
Với giá trị C=16.04 g/LC = 16.04 đối chiếu với bảng:
• Mg(OH)2: 0.140 (không khớp).
• Ca(OH)2: 1.730 (không khớp).
• Sr(OH)2: 17.70 (khớp gần nhất).
• Ba(OH)2: 38.90 (quá cao).
Do đó, chất tan là Sr(OH)2
Điền đáp án: 122
Điền đáp án: ..........
1. Dung dịch NaOH: tạo Ba(OH)2 tan tốt trong nước, do đó không tạo kết tủa với Ba2+.
2. Dung dịch Na2CO3:
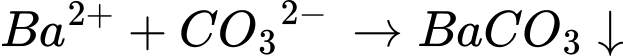
3. Dung dịch K3PO4:
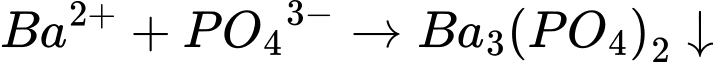 ;
;4. Dung dịch HCl: tạo BaCl2 tan tốt trong nước, không tạo kết tủa.
5. Dung dịch H2SO4:
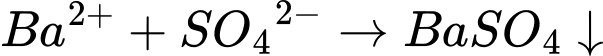
6. Dung dịch NaCl: tạo BaCl2 tan tốt trong nước, không tạo kết tủa.
Có 3 dung dịch có thể dùng để nhận biết Ba2+
Điền đáp án: 3
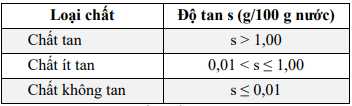
Cho bảng độ tan (g/100 g nước) của một số muối trong nước ở 20 °C như sau:

Có bao nhiêu chất ít tan trong số các chất trên?
Điền đáp án: ..........
=> Có 2 chất ít tan là CaSO4 ( 0,2) và SrSO4 (0,013)
⟹ Điền đáp án: 2
Điền đáp án: ..........
1. Phân bón ammonium sulfate (NH4)2SO4 là chất có tính acid khi tan trong nước, làm tăng tính acid của đất => pH giảm.
2. Muối ăn NaCl là muối trung tính, không ảnh hưởng đáng kể đến pH của đất => không ảnh hưởng tới pH.
3. Đá vôi CaCO3 là chất có tính kiềm yếu, có khả năng ổn định pH trong đất => tăng pH.
4. Vôi sống CaO là oxit bazơ mạnh, phản ứng với nước tạo thành Ca(OH)2, có tính kiềm mạnh, trung hòa acid hiệu quả => tăng pH.
5. Vôi tôi Ca(OH)2 là bazơ mạnh, có khả năng trung hòa acid => tăng pH.
6. Soda Na2CO3 là muối có tính kiềm, tan trong nước tạo môi trường base, có thể trung hòa acid => tăng pH.
7. Baking soda NaHCO3 là muối axit yếu, nhưng có tính kiềm nhẹ, có thể trung hòa acid yếu => tăng pH.
8. Phèn nhôm KAl(SO4)2⋅12H2O. Khi tan trong nước, giải phóng ion H+ làm tăng tính acid của đất => giảm pH
9. Phèn sắt FeSO4⋅7H2O.Khi tan trong nước, giải phóng ion H+ làm tăng tính acid của đất => giảm pH.
=> Các chất có thể làm tăng pH của đất là: 3,4,5,6,7
Điền đáp án: 5
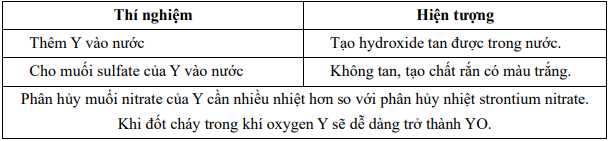
Nguyên tử khối của Y là bao nhiêu?
Điền đáp án: ..........
2. Cho muối sulfate của Y vào nước: tạo kết tủa trắng => Có thể là CaSO4, SrSO4, BaSO4.
3. Phân hủy nhiệt nitrate của Y cần nhiều nhiệt hơn so với Sr => Y nhẹ hơn Sr vì kim loại nhẹ hơn cần nhiệt độ cao hơn để phân hủy nitrate. => Ba
4. Đốt cháy dễ tạo thành YO => BaO
=> Nguyên tử khối của Ba là 137
Điền đáp án: 137
 MgO(s) + CO2(g)
MgO(s) + CO2(g)Nhiệt tạo thành chuẩn của MgCO3(s), MgO(s) và CO2(s) lần lượt là –1096 (kJ.mol-1); –601,8 (kJ.mol-1) và –393,5 (kJ.mol-1). (Làm tròn tới phần số nguyên)
Điền đáp án: ..........
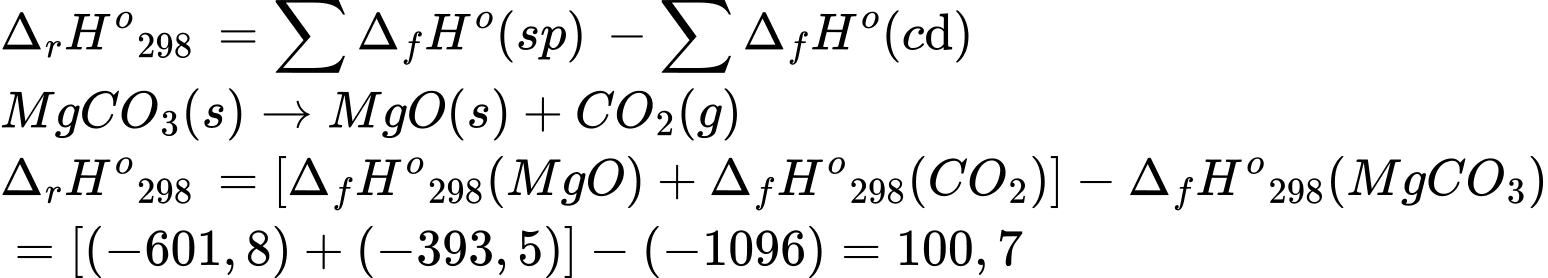
Điền đáp án: 101
 CaO(s) + CO2(g)
CaO(s) + CO2(g)Nhiệt tạo thành chuẩn của CaCO3(s), CaO(s) và CO2(s) lần lượt là –1207,6 (kJ.mol-1); –634,9 (kJ.mol-1) và –393,5 (kJ.mol-1). Năng lượng cần cung cấp (kJ) để quá trình phân hủy 200 g CaCO3 ở điều kiện chuẩn là bao nhiêu? ( làm tròn tới hàng đơn vị ).
Điền đáp án: ..........
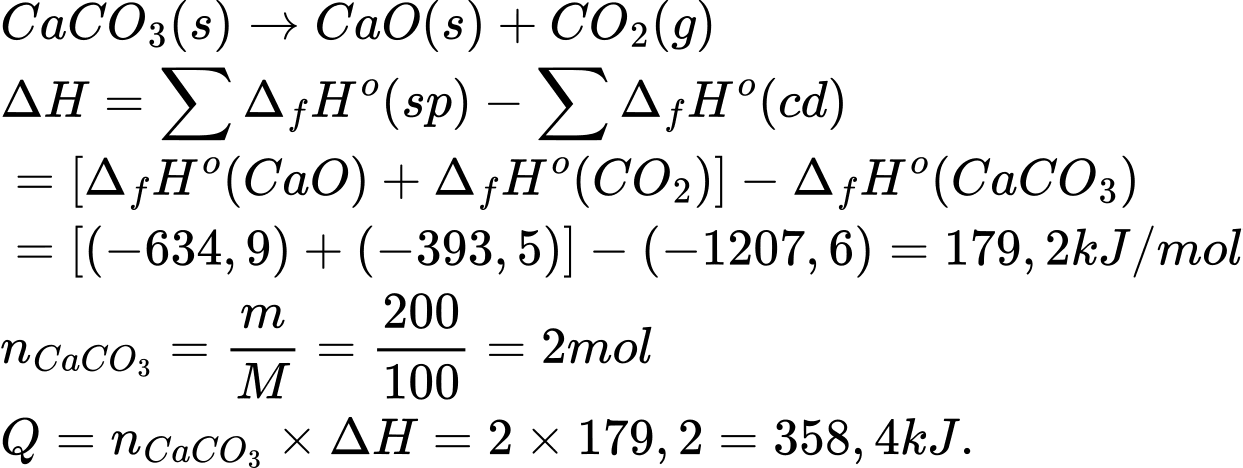
Điền đáp án: 358
Điền đáp án: ..........
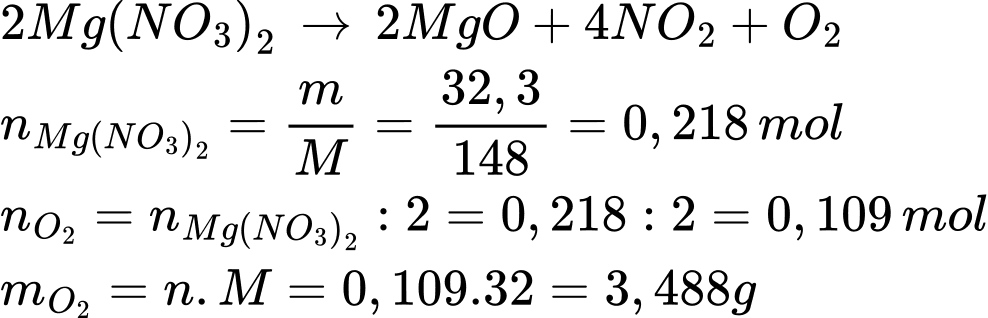
Điền đáp án: 3,5
Điền đáp án: ..........
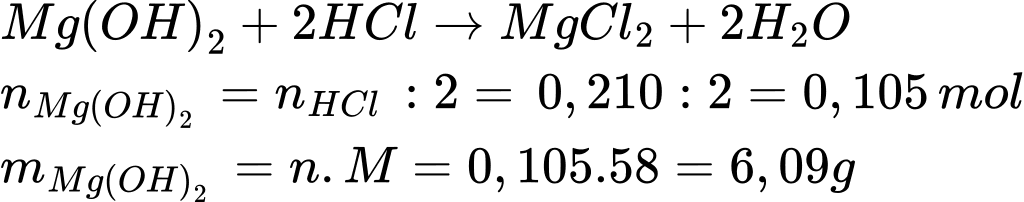
Điền đáp án: 6,1
Điền đáp án: ..........
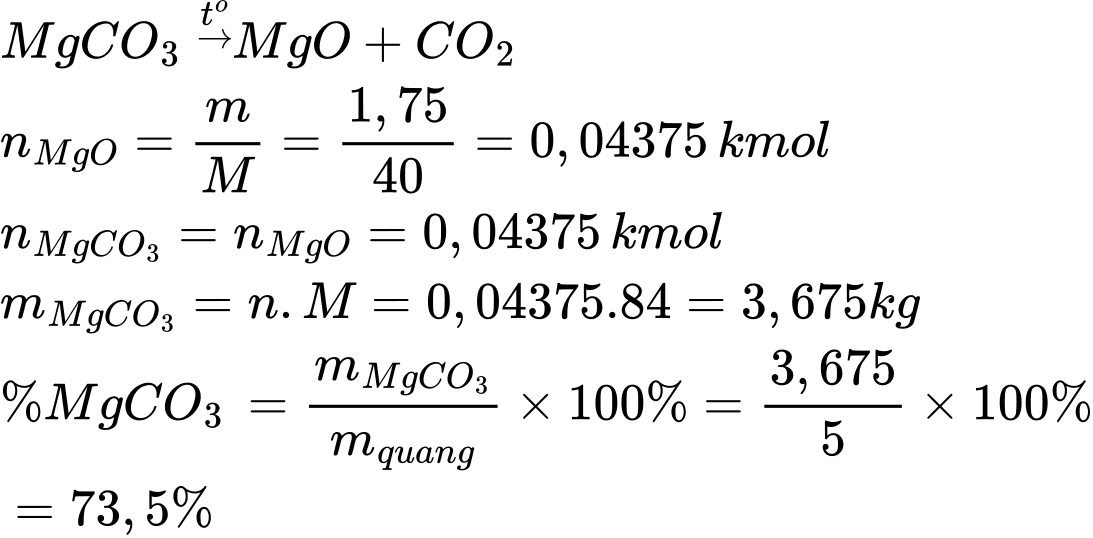
Điền đáp án: 73,5
 SrO(s) + N2(g) + 2CO2(g) + CO(g)
SrO(s) + N2(g) + 2CO2(g) + CO(g)Thể tích khí thoát ra (đkc) khi trộn 10,6 gam stronium nitrate với hỗn hợp pháo hoa.(làm tròn đến phần chục).
Điền đáp án: ..........
Số mol của Sr(NO3)2
n =10.6 : 211.6 = 0.05 mol.
Theo phương trình, số mol khí sinh ra:
nkhí = 4×nSr(NO3)2 = 4×0.05 = 0.2 mol.
V = nkhí×24,79 = 0,2.24,79 = 4,958L
Điền đáp án: 5,0
Điền đáp án: ..........
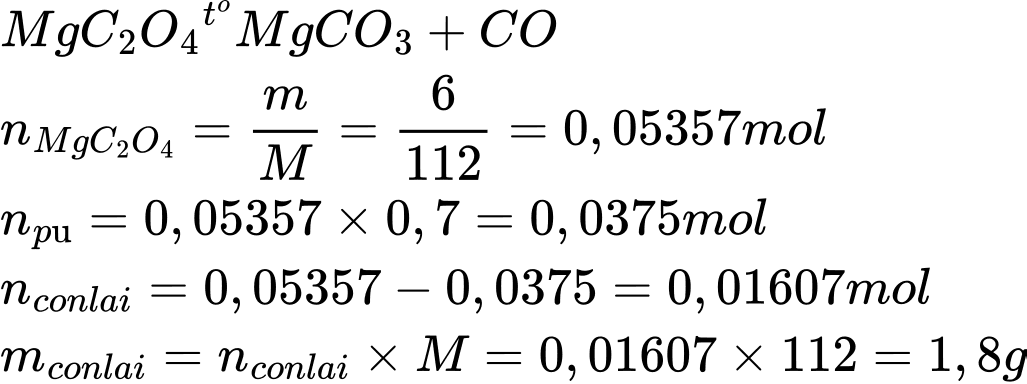
Điền đáp án: 1,8
Điền đáp án: ..........
m Ba(NO3)2 = x
⟹x : ( 109,02 – x ) × 100 = 9,02
⟹ m Ba(NO3)2 = x = 9,02 g
⟹m H2O = 100g
Gọi số mol Ba(NO3)2 .6H2O kết tinh là a
Ở 10oC, m Ba(NO3)2 = 9,02 - 261a
⟹ m H2O = 100 – 6ax18
⟹ ( 9,02 – 261a ) : ( 100 – 6× 18a ) × 100 = 6,67
⟹ A = 9,26 × 10 -3
Vậy khối lượng Ba(NO3)2 .6H2O kết tinh là : 369a = 3,42 g
Điền đáp án: 3,42
Điền đáp án: ..........
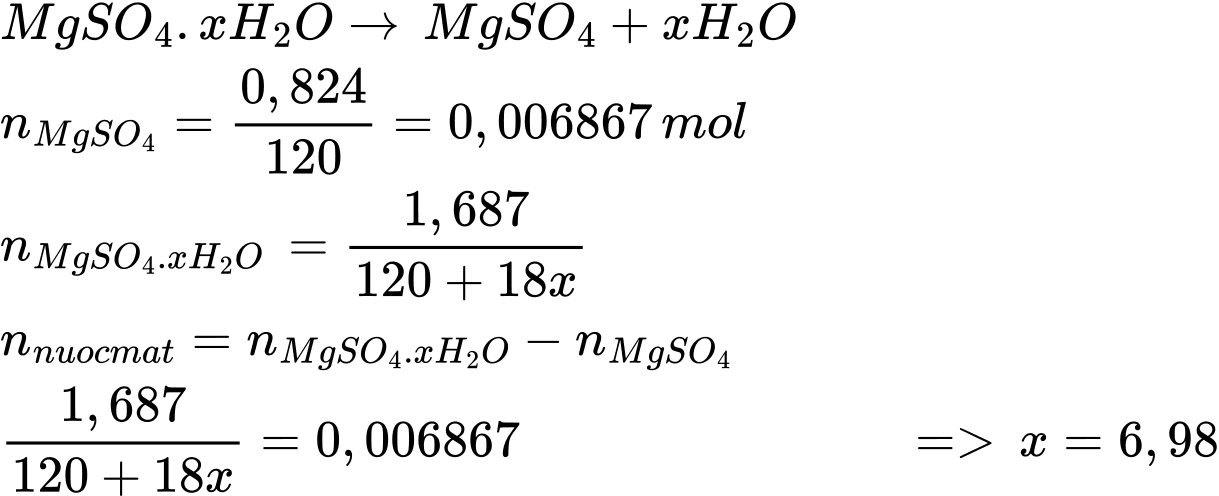
Điền đáp án: 7
CaO(s) + 2NH4Cl(s)
 2NH3(g) + H2O(g) + CaCl2(s)
2NH3(g) + H2O(g) + CaCl2(s)Nếu trộn 112 gam CaO và 224 gam NH4Cl để thực hiện phản ứng nhưng chỉ thu được 16,3 gam NH3 thì hiệu suất của phản ứng là bao nhiêu? (làm tròn đến hàng đơn vị)
Điền đáp án: ..........
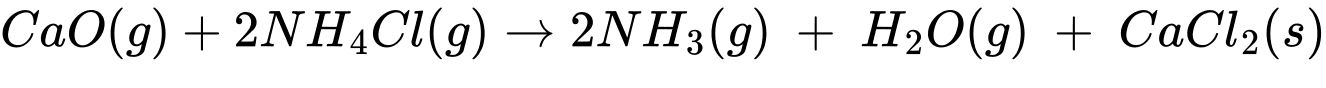
Số mol của CaO và NH4Cl lần lượt là
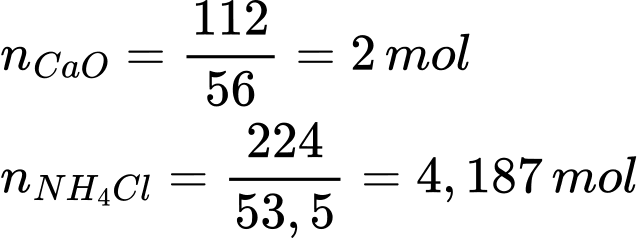
Ta có:
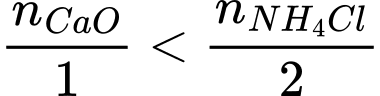
→ CaO hết, NH4Cl dư
Từ phương trình hóa học số mol của NH3 là: nNH3 = 2nCaO = 4 mol
Hiệu suất của phản ứng là:
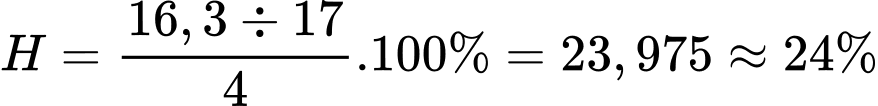
⇒ Điền đáp án: 24
CaCO3(s)
 CaO (s) + CO2(g)
CaO (s) + CO2(g)Lấy 1,506 g mẫu đá vôi trên nung nóng thì thu được 0,558 g CO2. Phần trăm khối lượng của CaCO3 trong mẫu đá vôi là bao nhiêu? (làm tròn tới hàng phần mười)
Điền đáp án: ..........
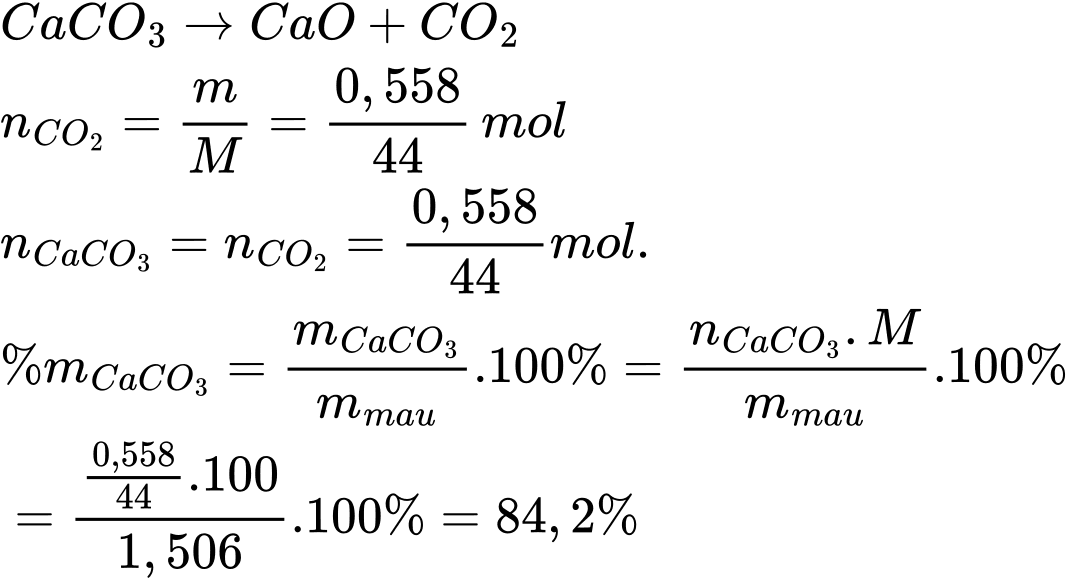
Điền đáp án: 84,2
2Al(s) + 3Ca(OH)2(s) + 6 H2O(l)
 3CaO.Al2O3.6H2O(s) + 3H2(g)
3CaO.Al2O3.6H2O(s) + 3H2(g)Giả sử hỗn hợp các chất phản ứng chứa 0,56 g Al và lượng calcium hydroxide, nước dùng dư cho mỗi viên gạch. Thế tích khí hydrogen tối đa có thể tạo ra ở điều kiện chuẩn là bao nhiêu?
(Làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
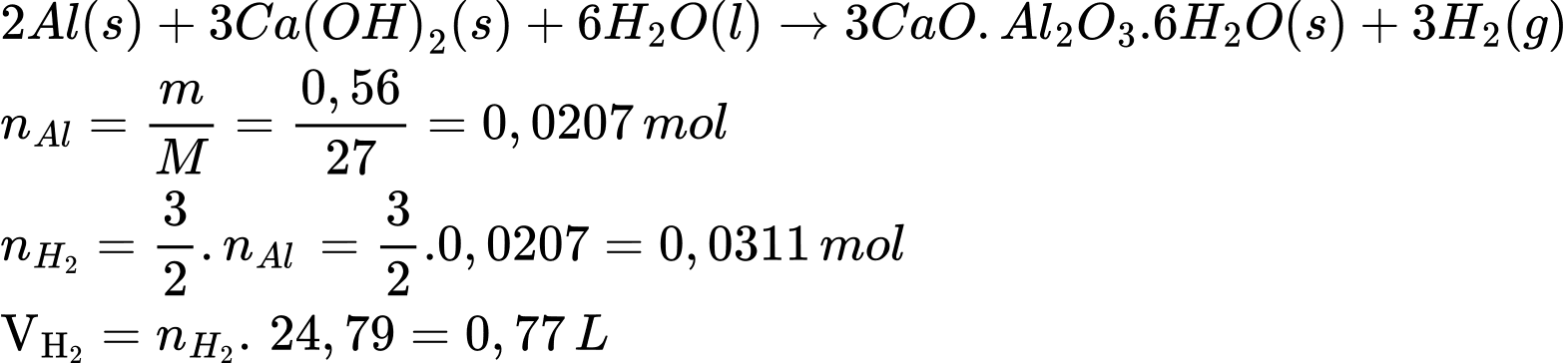
Điền đáp án: 0,77
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó
Sau khi thu lấy Mg(OH)2 thì cho HCl vào để hòa tan tạo muối chlorine của magnesim MgCl2. Vì Mg là kim loại có tính khử mạnh nên để thu được Mg kim loại từ MgCl2 thì cần điện phân nóng chảy. Quá trình sản xuất kim loại Mg từ nước biển được đưa dưới đây:
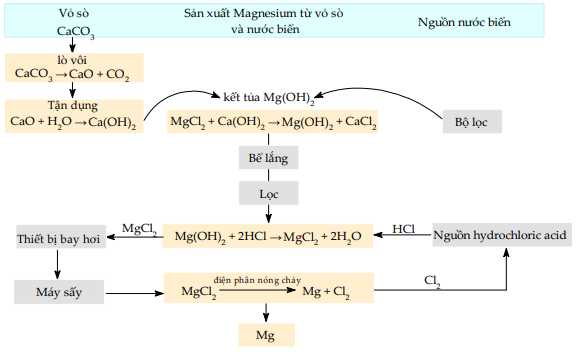
=> Chọn đáp án A Đáp án: A
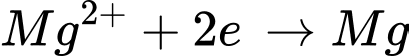
+ Điện cực dương (anode): Ion Cl- bị oxy hóa để tạo thành khí Cl2.
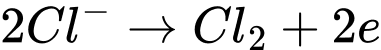
Phương trình tổng quát:
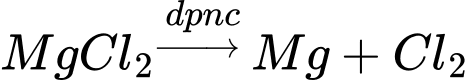
Ở cathode thu được Mg
Chọn đáp án B Đáp án: B
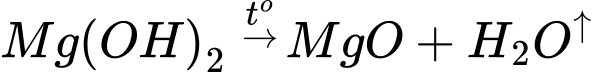
Điện phân MgO:
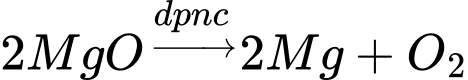
X là MgO
=> Chọn đáp án B Đáp án: B