Dạng 1: TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.

⇒ Chọn đáp án A Đáp án: A
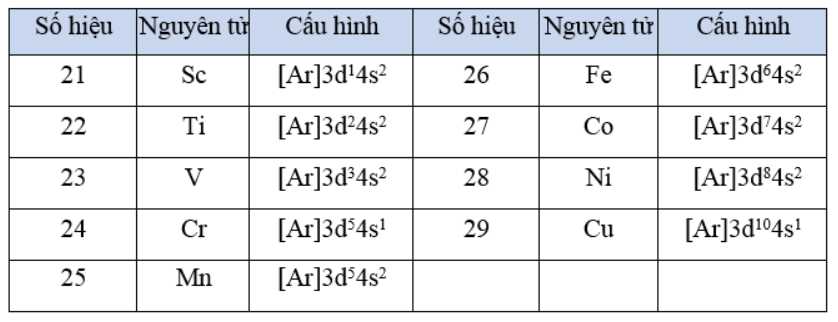
Các electron hóa trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở phân lớp 4s và 3d
Chọn đáp án A

⇒ Chọn đáp án B Đáp án: B
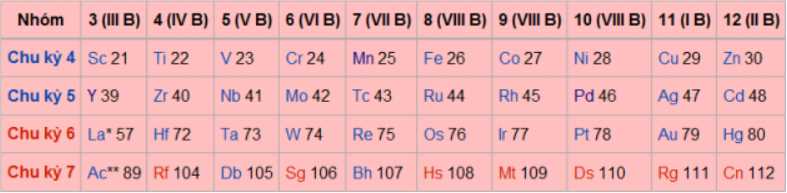
Nguyên tố Fe ở ô số 26, chu kì 4, nhóm VIIIB
Chọn đáp án C
Đồng( Cu ) ở ô số 29, chu kì 4 nhóm IB
Chọn đáp án D
Các nguyên tố nhóm B có cấu hình e nguyên tử tận cùng là (n-1)dxnsy
Cấu hình các nguyên tố chu kì 4 : [Ar]3dx4sy
Cấu hình các nguyên tố chu kì 5: [Kr]3dx4sy
⇒ Chọn đáp án A Đáp án: A
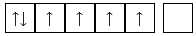
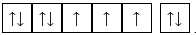

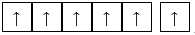
Ion Fe2+ không còn electron trên phân lớp 4s => obital trống, 6 electron ở lớp 3d phân bố đều vào các obital phân lớp 3d.
⟹ Chọn đáp án A



Dựa vào cấu hình e, Cu ở phân lớp 3d đã đầy (10 electron) => Không có electron độc thân.
Chọn đáp án B
1s22s22p63s23p63d44s2
Dạng 2. Một electron từ orbital 3d chuyển sang 4s, dẫn đến cấu hình electron:
1s22s22p63s23p63d54s1
Chọn đáp án A Đáp án: A
1s22s22p63s23p63d104s2
Do orbital 3d đã được lấp đầy hoàn toàn (3d10), và không có orbital d chưa hoàn toàn lấp đầy trong nguyên tử Zn => Zn không phải nguyên tố chuyển tiếp.
⟹ Chọn đáp án A Đáp án: A
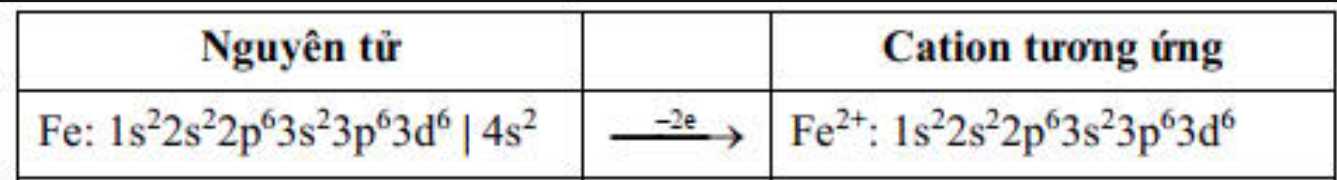
⇒ Chọn đáp án A Đáp án: A
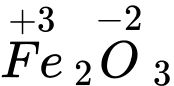
⇒ Chọn đáp án B Đáp án: B
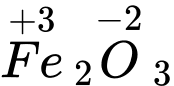
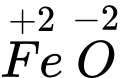
⇒ Chọn đáp án C Đáp án: C
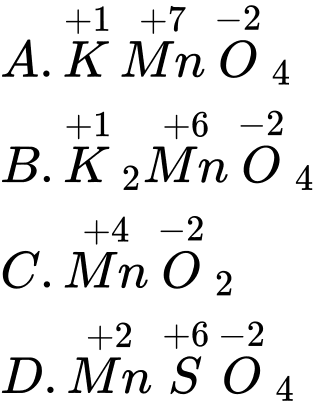
⟹ Chọn đáp án B Đáp án: B
- Các nguyên tố chuyển tiếp thường có nhiều electron hóa trị và độ âm điện tương đối nhỏ, điều này tạo điều kiện cho chúng thể hiện nhiều số oxi hóa khác nhau trong các hợp chất.
⟹ Chọn đáp án B Đáp án: B

Dung dịch có chứa ion Cr2+ có màu xanh lục
Dung dịch có chứa ion Cr6+ có màu vàng
⟹ Chọn đáp án A
Đáp án: A

⟹ Dung dịch chứa ion Fe3+ có màu vàng nâu.
⇒ Chọn đáp án C

⟹ Dung dịch Cu2+ có màu xanh lam.
⇒ Chọn đáp án D

Dung dịch KMnO4 có chứa nguyên tử Mn với mức oxi hóa +7 có màu tím.
⇒ Chọn đáp án D
⇒ Chọn đáp án C Đáp án: C
Số electron hóa trị = số electron trong phân lớp 4s và các electron đã bắt đầu lấp đầy phân lớp 3d
⟹ Số electron hóa trị tăng dần.
⟹ Chọn đáp án A Đáp án: A
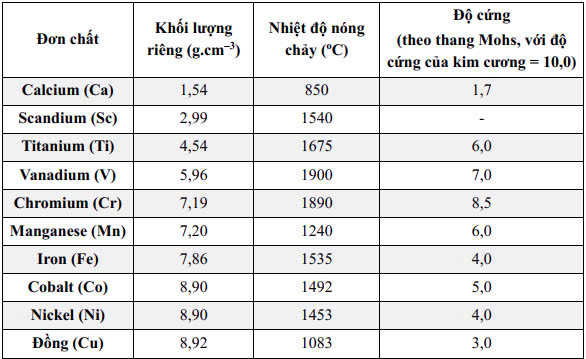
Xu hướng biến đổi về khối lượng riêng của các kim loại từ scandium đến đồng : tăng dần,chủ yếu do sự tăng khối lượng mol và sự giảm bán kính nguyên tử, dẫn đến mật độ nguyên tử trong mạng tinh thể kim loại tăng.
⟹ Chọn đáp án A
✔️B. Kim loại chuyển tiếp hàng đầu có điểm nóng chảy tương đối cao. Điều này có nghĩa là chúng sẽ không dễ nóng chảy khi có dòng điện tăng đột biến, khiến chúng không phù hợp để sử dụng trong cầu chì.
❌C. Bán kính nguyên tử lớn: Bán kính nguyên tử không ảnh hưởng trực tiếp đến chức năng của cầu chì.
❌D. Cấu trúc tinh thể phức tạp: Cấu trúc tinh thể liên quan nhiều hơn đến các đặc tính tổng thể của vật liệu như độ bền và độ dẫn điện, không phải là lý do khiến vật liệu không phù hợp để làm cầu chì.
⇒ Chọn đáp án B Đáp án: B
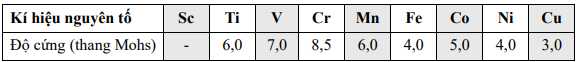
⟹ Độ cứng tăng so với Ca.
⟹Chọn đáp án A Đáp án: A
Thép không gỉ: Thép không gỉ là hợp kim của sắt chứa ít nhất 10,5% chromium. Crom tạo ra một lớp oxide chromium mỏng trên bề mặt, giúp thép chống ăn mòn và gỉ sét, được sử dụng trong các sản phẩm như dao, thìa, dụng cụ y tế, và thiết bị công nghiệp.
⇒ Chọn đáp án C Đáp án: C
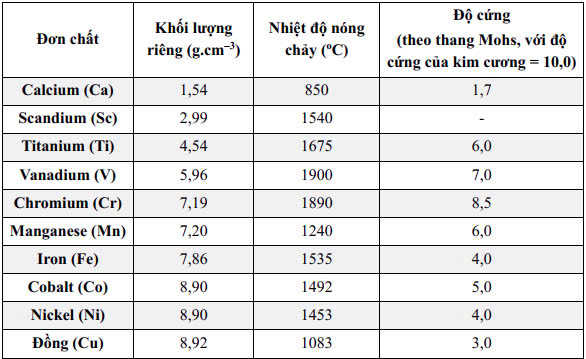
Độ cứng, nhiệt nóng chảy và khối lượng riêng của Fe > Ca.
Theo dãy điện hóa, Fe có tính khử < Ca
Chọn đáp án C
Ti có bán kính nhỏ hơn K
✔️ B. Ti (Z = 22) có cấu hình electron lớp ngoài cùng là 3d24s2, nên có 4 electron hóa trị; K (Z = 19) có cấu hình electron là 4s1, nên có 1 electron hóa trị.
✔️ C. Ti ở trạng thái cơ bản có 2 electron độc thân trong orbital 3d, K ở trạng thái cơ bản có 1 electron độc thân trong orbital 4s
✔️ D. Độ âm điện của Ti (1,54) lớn hơn K (0,82).
Chọn đáp án A Đáp án: A
• Nguyên tử có 4 electron độc thân.
• Có nhiều số oxi hoá trong các hợp chất, trong đó có số oxi hoá +2 và +3.
• Ở dạng đơn chất, là kim loại nặng.
M là nguyên tố nào sau đây?
❌ A. Cr (Z = 24)
+ Cấu hình electron: [Ar] 3d5 4s1
+ Ô orbital:
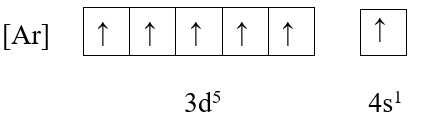
→ Có 6 electron độc thân
❌ B. Ni (Z = 28)
+ Cấu hình electron: [Ar] 3d8 4s2
+ Ô orbital:
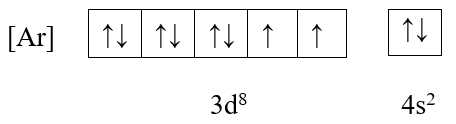
→ Có 2 electron độc thân
✔️ C. Fe (Z = 26)
+ Cấu hình electron: [Ar] 3d6 4s2
+ Ô orbital:
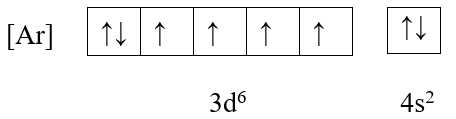
→ Có 4 electron độc thân
❌ D. Cu (Z = 29)
Cấu hình electron: [Ar] 3d10 4s1
+ Ô orbital:
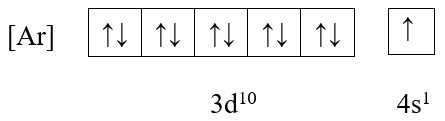
→ Có 1 electron độc thân
Vì nguyên tử M có 4 electron độc thân nên chỉ Fe là thỏa mãn. Fe có 4 electron độc thân, có số oxi hóa +2 và +3 trong hợp chất và là kim loại nặng.
⇒ Chọn đáp án C Đáp án: C
• Nguyên tử M có 1 electron ở lớp ngoài cùng.
• Trong hợp chất, số oxi hoá phổ biến của nguyên tố M là +2.
M là nguyên tố nào sau đây?
❌ Mn : có số oxi hoá phổ biến là +2, +3, +4, +6, +7. Tuy nhiên, manganese có nhiều electron ở lớp ngoài cùng, không chỉ 1 electron.
❌ Ni: có số oxi hoá phổ biến là +2 và +3, nhưng nickel có 2 electron ở lớp ngoài cùng.
✔️ Cu : có số oxi hoá phổ biến là +1 và +2, nhưng copper có 1 electron ở lớp ngoài cùng trong trạng thái +1.
⇒ Chọn đáp án D Đáp án: D
• Hợp chất M(II) có tính oxi hoá nên phản ứng được với dung dịch thuốc tím.
• Ion M3+ có 5 electron độc thân.
• Là nguyên tố kim loại thuộc nhóm nguyên tố hoá học phổ biến trong tự nhiên.
M là nguyên tố nào sau đây?
⇒ một chất oxi hoá mạnh.
- Là nguyên tố kim loại thuộc nhóm nguyên tố hoá học phổ biến trong tự nhiên
⇒ M là một kim loại chuyển tiếp trong dãy thứ nhất.
⇒ M là Fe.
+ Fe có số oxi hoá +2 (Fe2+) và có tính khử mạnh, do đó có thể phản ứng với thuốc tím (KMnO4).
+ Ion Mn3+ có cấu hình electron [Ar] 3d5, trong đó có 5 electron độc thân.
+ Fe là nguyên tố kim loại phổ biến trong tự nhiên.
⇒ Chọn đáp án A Đáp án: A
Mặc dù là kim loại chuyển tiếp, đồng có nhiệt độ nóng chảy thấp hơn một số kim loại nhóm IIA như Beri (Be)
✔️B. Các kim loại chuyển tiếp dãy thứ nhất có thể thể hiện nhiều trạng thái oxi hoá khác nhau, nhờ vào sự dễ dàng trong việc thay đổi số electron ở phân lớp d.
Ví dụ, Fe có thể có các trạng thái oxi hoá +2 và +3, Mn có thể có nhiều trạng thái oxi hoá khác nhau từ +2 đến +7.
❌C.Sai vì không phải tất cả hợp chất của kim loại chuyển tiếp đều có màu. Một số hợp chất có thể không có màu.
❌D.Sai vì cấu hình electron của các kim loại chuyển tiếp dãy thứ nhất không phải lúc nào cũng có phân lớp 4s bão hoà, vì sự chuyển electron giữa phân lớp 4s và 3d có thể xảy ra trong các nguyên tử kim loại.
Chọn đáp án B Đáp án: B

=> Dung dịch KMnO4 có màu tím
=> Chọn đáp án D
Đáp án: C
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.

a. Các kim loại chuyển tiếp dãy thứ nhất là nguyên tố s.
b. Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở phân lớp 3d và phân lớp 4s.
c. Chromium được chế tạo khung xe do có độ cứng lớn, copper được sử dụng trong dây điện do khả năng dẫn điện tốt.
d. Từ Sc đến Cu, số electron trong phân lớp d có xu hướng tăng dần (trừ trường hợp ngoại lệ).
❌a. Sai. Các kim loại chuyển tiếp dãy thứ nhất không phải là nguyên tố s mà là nguyên tố d, vì chúng có cấu hình electron với electron ở phân lớp 3d. Các nguyên tố thuộc nhóm s là các nguyên tố kim loại kiềm và kim loại kiềm thổ.
✔️b. Đúng. Các electron hóa trị của các kim loại chuyển tiếp dãy thứ nhất phân bố ở phân lớp 3d và 4s do điện tích lớn.
✔️c. Đúng. Chromium (Cr) được sử dụng trong chế tạo khung xe do độ cứng lớn của nó (đặc biệt là khi hợp kim với các nguyên tố khác), và copper (Cu) được sử dụng trong dây điện do khả năng dẫn điện rất tốt.
✔️d. Đúng.Từ Sc (Scandium) đến Cu (Copper), số electron trong phân lớp 3d tăng dần, trường hợp ngoại lệ như Chromium (Cr) và Copper (Cu) electron được phân bố một cách khác biệt trong các phân lớp d và s để tạo ra cấu hình electron ổn định hơn.
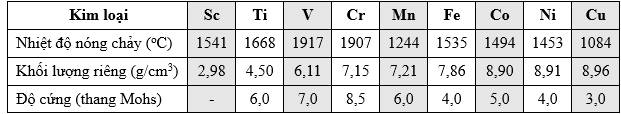
a. Các kim loại chuyển tiếp có độ cứng lớn hơn so với các kim loại kiềm, kiềm thổ.
b. Trong bảng trên, có 8 kim loại chuyển tiếp được xếp vào kim loại nặng.
c. Các kim loại chuyển tiếp dãy thứ nhất khó nóng chảy, đặc biệt là vanadium, chromium.
d. Chromium được ứng dụng để chế tạo hợp kim không gỉ hoặc siêu cứng do có nhiệt độ nóng chảy cao.
✔️a. Đúng. Các kim loại chuyển tiếp có độ cứng lớn hơn so với các kim loại kiềm và kiềm thổ. Do sự liên kết giữa các nguyên tử kim loại chuyển tiếp thường mạnh do có electron 3d và 4s vào liên kết kim loại, khiến chúng bền vững và cứng hơn.
❌b. Sai. Kim loại nặng là những kim loại có khối lượng riêng lớn hơn 5g/cm3. Trong dãy kim loại chuyển tiếp thứ nhất có 7 kim loại có khối lượng riêng lớn hơn 5g/cm3 được coi là kim loại nặng.
✔️c. Đúng. Các kim loại chuyển tiếp dãy thứ nhất nói chung có nhiệt độ nóng chảy cao như vanadium (V) và chromium (Cr)
❌d. Sai. Chromium được ứng dụng để chế tạo hợp kim không gỉ hoặc siêu cứng do có độ cứng cao.
a. Nguyên tố chromium thuộc chu kì 4, nhóm VIB trong bảng tuần hoàn.
b. Các ứng dụng nêu trên do chromium có khối lượng riêng nhỏ, khôngbị oxi hóa trong không khí.
c. Nguyên tử chromiun có số oxi hoá cao nhất là +3 trong các hợp chất.
d. Khi tham gia phản ứng hóa học tạo Cr3+, số electron còn lại trên phânlớp d của chromium là 2.
Phân tích các phát biểu:
✔️a. Đúng. Chromium (Cr) thuộc chu kỳ 4, nhóm VIB trong bảng tuần hoàn. Đây là một kim loại chuyển tiếp và có số hiệu nguyên tử là 24.
❌b. Sai. Các ứng dụng của chromium trong chế tạo hợp kim không gỉ hoặc siêu cứng không phải do nó có khối lượng riêng nhỏ, mà chủ yếu là do tính chống oxi hóa và khả năng tạo ra hợp kim bền vững, đặc biệt là khi kết hợp với sắt trong inox. Chromium có thể tạo ra một lớp oxit mỏng, bảo vệ kim loại khỏi sự ăn mòn.
❌c. Sai. Chromium có thể có nhiều số oxi hóa, với +2, +3 và +6 là phổ biến nhất. Số oxi hóa cao nhất của chromium là +6, như trong CrO3 (chromium trioxide), một hợp chất quan trọng trong công nghiệp.
❌d. Sai. Khi chromium tham gia phản ứng hóa học tạo Cr3+ (ion chromium với số oxi hóa +3), số electron còn lại trên phân lớp d của chromium là 3. 
a. Calcium không phải là nguyên tố chuyển tiếp do không có phân lớp d trong cấu hình electron của nguyên tử.
b. Nguyên tố có điện tích hạt nhân Z = 30 là nguyên tố chuyển tiếp.
c. Nguyên tố có chứa 29 điện tích dương trong hạt nhân không phải lànguyên tố chuyển tiếp.
d. Nguyên tố chuyển tiếp có tính kim loại nên còn được gọi là nguyên tốkim loại chuyển tiếp.
✔️a. Đúng. Calcium (Ca) thuộc nhóm kim loại kiềm thổ và có cấu hình electron [Ar] 4s2 ,Calcium không có electron trong phân lớp d ở trạng thái nguyên tử.
❌b. Sai. Nguyên tố có điện tích hạt nhân Z = 30 là Zn có cấu hình electron [Ar] 3d10 4s2 đã đạt bão hòa, nên không được đưa vào nhóm nguyên tố chuyển tiếp
❌c. Sai. Nguyên tố có Z= 29 là Copper (Cu), có cấu hình electron [Ar] 3d10 4s1. Đây là một kim loại chuyển tiếp.
✔️d. Đúng. Nguyên tố chuyển tiếp có tính kim loại, vì chúng có đặc điểm chung là có khả năng dẫn điện, dẻo, bền và có nhiệt độ nóng chảy cao.
a. Nếu nguyên tử chromium có 6 electron độc thân thì nguyên tử nàychứa 6 ô orbital nguyên tử mà trong mỗi ô này chỉ có 1 electron.
b. Theo các quy ước về viết cấu hình electron thì cấu hình electron củanguyên tử chromium là [Ar]3d34s14p1.
c. Cấu hình electron của nguyên tử là [Ar]3d54s1sẽ phù hợp với nhậnđịnh từ phổ phát xạ của nguyên tử chromium.
d. Cấu hình electron của nguyên tử phải luôn phù hợp với các quy ướcvề viết cấu hình electron.
Phân tích các phát biểu:
✔️a. Đúng. Cấu hình của Cr trên các AO như sau:

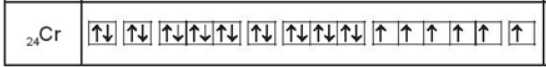
❌b. Sai. Cấu hình electron [Ar] 3d3 4s1 4p1là không chính xác. Cấu hình electron đúng của chromium (Cr) là [Ar] 3d54s1.
✔️c. Đúng. Cấu hình electron [Ar] 3d54s1 của chromium phù hợp với nhận định từ phổ phát xạ của nguyên tử chromium. Cấu hình này tối ưu hóa sự phân bố electron và có 6 electron độc thân (5 electron ở phân lớp 3d và 1 electron ở phân lớp 4s)
❌d. Sai. Theo quy tắc cấu hình electron của Cr là [Ar] 3d44s2. Nhưng để bền hơn, 1electron của phân lớ 4s chuyển qua 3d để đạt bán bão hòa.Vậy nên Cr có cấu hình [Ar] 3d54s1.
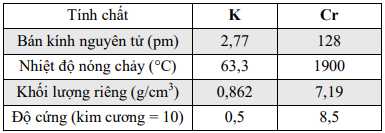
a. Tinh thể Cr có liên kết kim loại mạnh hơn tinh thể K.
b. Trong cùng một đơn vị thể tích thì khối lượng kim loại trong tinh thểCr và K bằng nhau.
c. Nguyên tử Cr có bán kính nhỏ hơn nguyên tử K vì nguyên tử Cr có sốlớp electron ít hơn.
d. K là kim loại nhẹ và Cr là kim loại nặng.
✔️a. Đúng. Vì các electron 3d và 4s trong Cr tham gia vào liên kết kim loại, làm tăng cường độ liên kết. Trong khi đó, K chỉ có electron 4s tham gia, dẫn đến liên kết kim loại yếu hơn.
❌b. Sai. Trong cùng một đơn vị thể tích, khối lượng kim loại trong tinh thể Cr sẽ lớn hơn tinh thể K. Do Cr có khối lượng riêng lớn hơn (khoảng 7,19 g/cm3) so với K (khoảng 0,86 g/cm3), nghĩa là Cr có mật độ nguyên tử cao hơn trong cùng một thể tích.
❌c. Sai. Nguyên tử Cr có bán kính nhỏ hơn nguyên tử K, cả Cr và K đều có số lớp electron bằng nhau (4 lớp, thuộc chu kỳ 4), nhưng Cr có điện tích hạt nhân lớn hơn, làm tăng lực hút lên các electron ngoài cùng, khiến bán kính nguyên tử nhỏ hơn.
✔️d. Đúng. K là kim loại nhẹ (khối lượng riêng 0,86 g/cm3), trong khi Cr là kim loại nặng (khối lượng riêng 7,19 g/cm3).
a. Oxide Fe3O4 có khả năng bị nam châm hút.
b. Chiết xuất Fe từ quặng có chứa Fe3O4 có thể sử dụng phương phápnhiệt luyện.
c. Số mol HCl trong dung dịch hydrochloric acid cần để hoà tan vừa đủ1,5 mol Fe3O4 theo phương trình dưới là 6 mol.
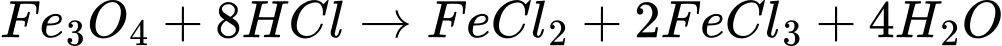
d. Trong phản ứng khử Fe3O4 thành Fe bằng carbon monoxide, mỗi phântử Fe3O4 đã nhận 3 electron.
✔️a. Đúng.Fe3O4 có từ tính mạnh và có khả năng bị nam châm hút. Đây là tính chất đặc trưng của oxide sắt từ, làm cho nó trở nên quan trọng trong các ứng dụng như lưu trữ từ tính và chế tạo vật liệu từ.
✔️b. Đúng. Quá trình nhiệt luyện thường sử dụng chất khử như carbon hoặc carbon monoxide để khử Fe3O4 thành kim loại (Fe).
❌c. Sai. Theo phương trình:
1 mol Fe3O4 cần 8 mol HCl.
1,5 mol Fe3O4, cần: 1,5×8=12 mol HCl.
Vậy số mol HCl cần là 12 mol, không phải 6 mol.
❌d. Sai. Trong phản ứng mỗi phân tử Fe3O4 nhận tổng cộng 8 electron. Do Fe3O4 có 3 ion Fe: 1 ion Fe2+ và 2 ion Fe3+.
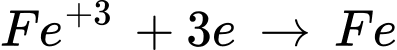 và
và 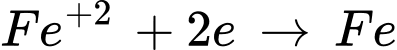
Tổng electron nhận=1×2+2×3=8 electron.
Vì vậy, mỗi phân tử Fe3O4 nhận 8 electron, không phải 3 electron.
a. Ở dạng đơn chất, iron là kim loại nặng, có độ hoạt động hoá học mạnh.
b. Ở trạng thái cơ bản, nguyên tử iron có 8 electron hóa trị.
c. Số oxi hoá của iron trong các hợp chất FeO, Fe2O3 và FeO(OH).H2Olần lượt là +2, +3 và +3.
d. Sắt ít được sử dụng ở dạng nguyên chất mà chủ yếu được sử dụng ởdạng hợp kim (thép thường, inox,...).
❌a. Sai. Iron (Fe) là kim loại nặng (khối lượng riêng khoảng 7,87 g/cm3), độ hoạt động hóa học của Fe mạnh hơn 1 số kim loại yếu, Fe là kim loại trung bình.
✔️b. Đúng. Ở trạng thái cơ bản, cấu hình electron của iron là [Ar]3d64s2 => iron có 8 electron hóa trị
✔️c. Đúng.Số oxi hóa của iron trong các hợp chất:
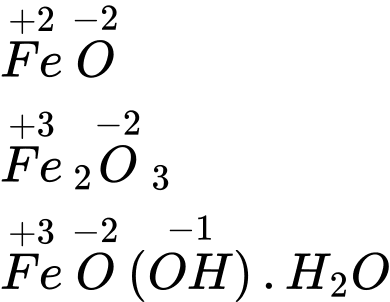
✔️d. Đúng. Sắt ít được sử dụng ở dạng nguyên chất vì dễ bị oxi hóa và rỉ sét. Thay vào đó, sắt được sử dụng chủ yếu dưới dạng hợp kim như thép (sắt và carbon) hoặc inox (hợp kim sắt với Cr và Ni) để tăng độ bền, khả năng chống ăn mòn và các tính chất cơ học khác.
a. Thuốc tím phải cho vào burette, không được cho vào bình tam giác.
b. Cần sử dụng chất chỉ thị để nhận biết điểm kết thúc chuẩn độ.
c. Iron(II) sulfate là chất khử, thuốc tím là chất oxi hoá.
d. Phải đun nóng dung dịch trong bình tam giác trước khi chuẩn độ.
✔️a. Đúng. Vì KMnO4 vừa là chất chuẩn vừa có màu đặc trưng. Dung dịch KMnO4 đóng vai trò chất oxi hóa và được thêm dần vào dung dịch chứa iron(II) sulfate trong bình tam giác.
❌b. Sai. Trong phản ứng chuẩn độ với KMnO4, không cần sử dụng chất chỉ thị vì KMnO4 có màu tím đặc trưng. Điểm kết thúc chuẩn độ được nhận biết khi dung dịch chuyển từ không màu (hoặc nhạt màu) sang màu hồng nhạt bền.
✔️c. Đúng. Phương trình chuẩn độ:
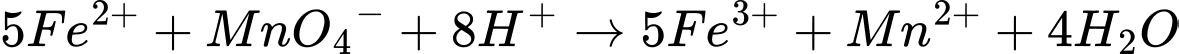
❌d. Sai. Trước khi chuẩn độ, dung dịch trong bình tam giác cần được đun nóng (thường đến khoảng 50–60°C) để tăng tốc độ phản ứng giữa KMnO4và Fe2+, đồng thời đảm bảo quá trình khử MnO4- thành Mn2+ diễn ra hoàn toàn và chính xác. Nhưng không bắt buộc.
Bước 1: Dùng pipette lấy 5,0 mL dung dịch FeSO4 cho vào bình tam giác; thêm tiếp khoảng 5 mL dung dịch H2SO4 10% (lấy bằng ống đong).
Bước 2: Cho dung dịch KMnO4 vào burette, điều chỉnh thể tích dung dịch trong burette vềmức 0. Mở khoá burette, nhỏ từng giọt dung dịch KMnO4 xuống bình tam giác, lắc đều.
a. Phương pháp được sử dụng trong thí nghiệm trên là phương phápchuẩn độ.
b. Hiện tượng quan sát được khi thí nghiệm kết thúc là dung dịch trongbình tam giác có màu hồng bền.
c. Có thể thay dung dịch H2SO4 bằng dung dịch HCl.
d. Sản phẩm thu được sau phản ứng có chứa manganese(II) sulfate. Khitham gia phản ứng hóa học trong thí nghiệm trên, mỗi phân tử KMnO4đã nhận thêm 2 electron.
✔️a. Đúng. Đây là phương pháp định lượng dựa trên phản ứng oxi hóa khử giữa hai dung dịch, trong đó một dung dịch có nồng độ đã biết (dung dịch chuẩn) được dùng để xác định nồng độ của dung dịch còn lại.
✔️b. Đúng. Khi dung dịch KMnO4 dư một lượng nhỏ, màu hồng của ion MnO4- sẽ xuất hiện và tồn tại bền vững trong dung dịch, báo hiệu phản ứng đã kết thúc.
✔️c. Đúng. Cả HCl và H2SO4 đều là các acid mạnh, cung cấp môi trường acid cho phản ứng oxi hóa khử xảy ra. Tuy nhiên, H2SO4 thường được ưu tiên hơn vì nó tạo ra môi trường ổn định hơn, HCl gây ra các phản ứng phụ làm ảnh hưởng tới sai số chuẩn độ.
2Cl- ⟶ Cl2
❌d. Sai.Khi tham gia phản ứng hóa học trong thí nghiệm trên, mỗi phân tử KMnO4 đã nhận thêm 5 electron.
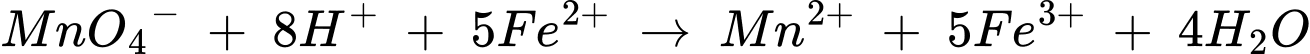
Ống nghiệm (1): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 1 ml dung dịch CuSO4.
Ống nghiệm (2): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 1 mL dung dịch FeCl3.
a. Ở thí nghiệm (1) thấy xuất hiện kết tủa màu xanh nhạt.
b. Ở thí nghiệm (2) xuất hiện kết tủa màu trắng hơi xanh.
c. Có thể sử dụng thí nghiệm trên để nhận biết ra sự có mặt của cationCu2+, Fe3+trong dung dịch.
d. Có thể thay dung dịch NaOH bằng dung dịch KOH.
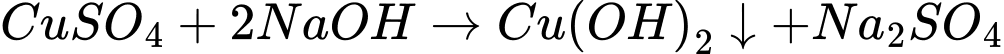
Ống nghiệm (2): Khi cho dung dịch NaOH vào dung dịch FeCl3, xảy ra phản ứng:
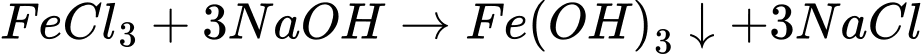
Phân tích các phát biểu:
✔️A.Đúng. Cu(OH)2 là kết tủa màu xanh nhạt
❌B. Sai. Fe(OH)3 là kết tủa màu nâu đỏ, không phải màu trắng hơi xanh.
✔️C. Đúng. Các phản ứng xảy ra đều tạo kết tủa đặc trưng của từng cation (Cu2+: xanh nhạt, Fe3+: nâu đỏ). Vì vậy, có thể sử dụng thí nghiệm để nhận biết sự có mặt của các cation này.
✔️D. Đúng. Cả NaOH và KOH đều là bazơ mạnh, nên có thể thay thế nhau mà vẫn xảy ra các phản ứng tạo kết tủa tương tự.
a. Chất chuẩn được sử dụng trong thí nghiệm này là dung dịch thuốc tímđã biết trước nồng độ.
b. Quá trình chuẩn độ cần phải sử dụng chất chỉ thị biến đổi màu theopH của dung dịch phản ứng.
c. Phản ứng diễn ra trong quá trình chuẩn độ chứng tỏ rằng
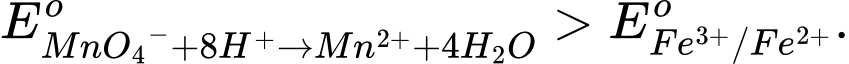
d. Tại điểm tương đương, số mol FeSO4 trong dung dịch ban đầu bằng 5lần số mol của KMnO4 đã phản ứng.
✔️A.Đúng. Chất chuẩn trong thí nghiệm này là dung dịch KMnO4 có nồng độ đã biết trước. Dung dịch KMnO4 vừa là chất chuẩn vừa tự đóng vai trò chất chỉ thị, vì nó có màu tím và mất màu khi phản ứng.
❌B. Sai. Trong phản ứng chuẩn độ này, không cần sử dụng thêm chất chỉ thị pH vì KMnO4 tự biến đổi màu (từ tím sang không màu hoặc xuất hiện màu hồng nhạt tại điểm tương đương).
✔️C.Đúng. Phản ứng chuẩn độ:
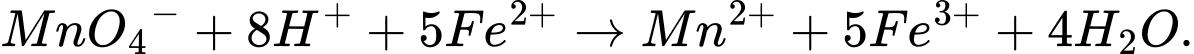
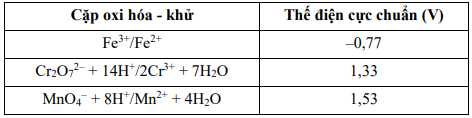
Phản ứng xảy ra vì thế điện cực chuẩn EoMnO4−/Mn2+ (khoảng 1,51 V) lớn hơn EoFe3+/Fe2+ (khoảng 0,77 V) => MnO4 − có khả năng oxi hóa Fe2+ thành Fe3+.
✔️D. Đúng. Tỉ lệ số mol giữa FeSO4 và KMnO4 là 5:1. Tại điểm tương đương, số mol FeSO4 gấp 5 lần số mol KMnO4 .
Biết
 có màu cam và
có màu cam và  có màu xanh lá cây.
có màu xanh lá cây.a. Trong môi trường acid, anionCr2O72-(từ sự phân li của muối potassiumdichromate, K2Cr2O7) có tính oxi hoá mạnh hơn anion MnO4- (từ sự phânli của muối KMnO4).
b. Chuẩn độ được Fe2+ trong dung dịch gồm Fe2+ ,SO42- và H+bằng dungdịch chứa chất chuẩn là KMnO4.
c. Không chuẩn độ được Fe2+ trong dung dịch gồm Fe2+ ,SO42- và H+bằng dung dịch chứa chất chuẩn là K2Cr2O7.
d. Có phản ứng oxi hoá - khử diễn ra theo phương trình hoá học sau:
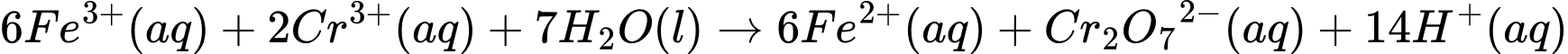
❌A.Sai. Trong môi trường acid, MnO4- có tính oxi hóa mạnh hơn Cr2O72- vì EoMnO4- =1,53 > EoCr2O72- = 1,33
✔️B.Đúng. Có thể chuẩn độ Fe2+ trong môi trường acid bằng dung dịch chứa MnO4- vì EoMnO4- > Fe3+/Fe2+
❌C. Sai. Có thể chuẩn độ Fe2+ bằng dung dịch chứa Cr2O72- vì Eo Cr2O72- > Eo Fe3+/Fe2+, phản ứng oxi hóa khử vẫn xảy ra.
❌D. Sai. Phương trình xảy ra:
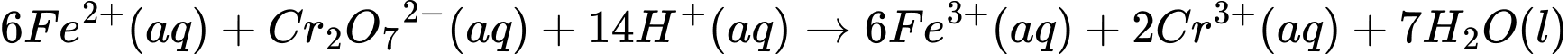
a. Trong quá trình chuẩn độ trên, cần nhỏ từ từ dung dịch thuốc tím từburette vào bình tam giác chứa dung dịch A.
b. Cần thêm chất chỉ thị phù hợp vào bình tam giác chứa dung dịch A đểxác định được thời điểm kết thúc quá trình chuẩn độ.
c. Cần lặp lại thí nghiệm chuẩn độ 2 lần để bảo đảm tính chính xác củakết quả.
d. Trong khoáng vật, iron chiếm 60,26% về khối lượng.
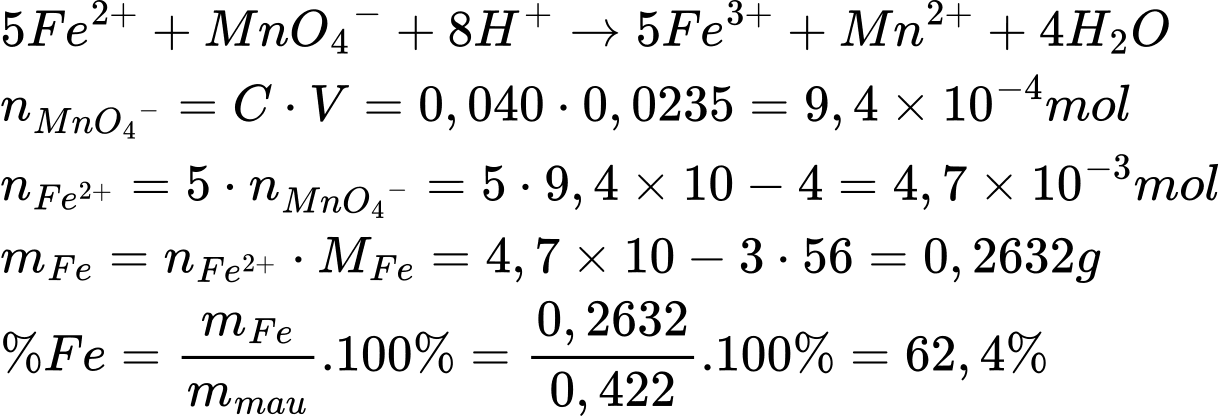
Phân tích các phát biểu:
✔️A.Đúng.Trong chuẩn độ oxi hóa khử giữa Fe2+ và MnO4−, dung dịch KMnO4 cần được thêm từ từ vào dung dịch Fe2+ để tránh vượt quá điểm tương đương, giúp phản ứng xảy ra hoàn toàn.
❌B. Sai. Không cần thêm chất chỉ thị vào bình tam giác vì KMnO4 tự đóng vai trò chất chỉ thị. Sau khi phản ứng kết thúc, dung dịch sẽ có màu hồng nhạt do dư KMnO4, đánh dấu điểm tương đương.
❌C. Sai. Lặp lại thí nghiệm chuẩn độ ít nhất 3 lần là cần thiết để tăng độ chính xác, giảm sai số thí nghiệm.
❌D. Sai. Kết quả tính toán cho thấy sắt chiếm khoảng 62,4%
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
Điền đáp án: ..........

Lớp ngoài cùng của Fe là 4s2→ 2 electron.
Lớp con 3dchưa bão hòa, chứa 3d6 → 6 electron.
Vậy số electron hóa trị của Fe là 2 (từ 4s) + 6 (từ 3d) = 8 electron.
Điền đáp án: 8
Điền đáp án: ..........
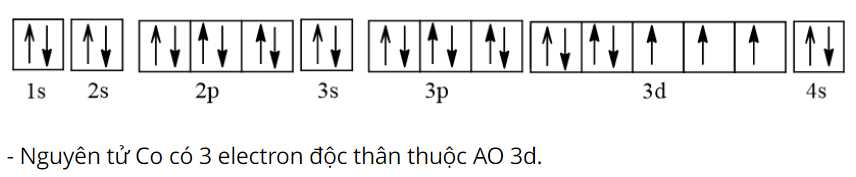
Phân lớp 4s đã điền đầy, ở phân lớp 3d của Co còn 3electron độc thân.
Điền đáp án: 3
Điền đáp án: ..........
Mn:1s22s22p63s23p63d54s2 ⇒ Mn2+: 1s22s22p63s23p63d5
Vậy Mn2+ có 5 electron độc thânĐiền đáp án: 5
Điền đáp án: ..........
=> ion X2+ đã mất 2 electron so với nguyên tử trung hòa của X.
Do đó, cấu hình electron của X là: [Ar]3d94s2 =>Z = 29
Điền đáp án: 29
5Fe2++ MnO4− + 8H+
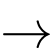 5Fe3+ + Mn2+ + 4H2O
5Fe3+ + Mn2+ + 4H2OĐiền đáp án: ..........
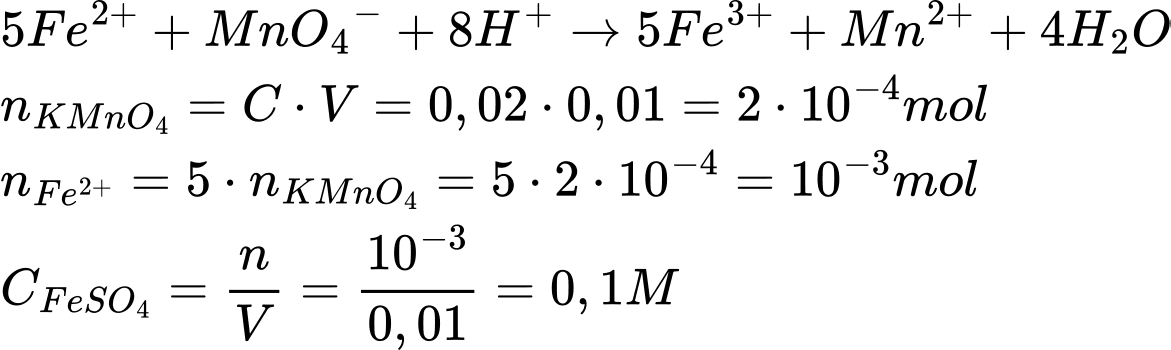
Điền đáp án: 0,1
Bước 1: Dùng pipette hút chính xác 5,00 mL dung dịch FeSO4 nồng độ a mol/L cho vào bình định mức loại 50 mL. Thêm tiếp nước cất và định mức đến vạch, thu được 50 mL dung dịch Y.
Bước 2: Chuẩn độ 5,00 mL dung dịch Y trong môi trường H2SO4 loãng cần vừa đủ 4,40 mL dung dịch KMnO4 0,02 M. Giá trị của a là bao nhiêu?
Điền đáp án: ..........
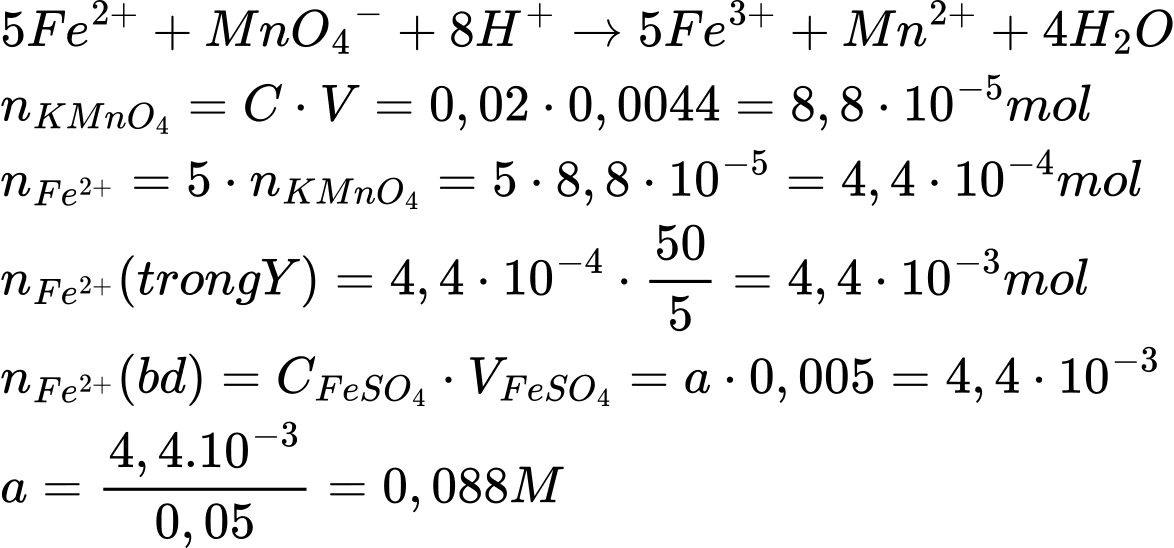
Điền đáp án: 0,088
Điền đáp án: ..........
2 × 0,13 = (x × 2) + (0,02 × 3)
0,26 = 2x + 0,06
x = 0,1 = n Fe2+
MnO4- + 5Fe2+ + 8H+ ⟶ Mn2+ + 5Fe3+ + 4H2O
n MnO4- = n Fe2+ ÷ 5= 0,1 ÷ 5 = 0,02 (mol)
Điền đáp án: 0,02
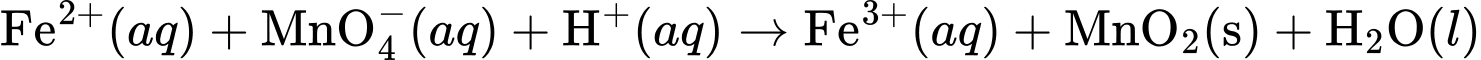
Giả sử một học sinh thao tác sai, làm 60% lượng MnO4– chuẩn độ chuyển thành MnO2 (phần còn lại vẫn phản ứng tạo Mn2+), tổng lượng Fe2+ bị oxi hoá là 2,2 mmol. Thể tích dung dịch KMnO4 0,020 M đã dùng tăng bao nhiêu mL so với khi chuẩn độ với thao tác phù hợp?
Điền đáp án: ..........
Phương trình phản ứng chuẩn độ đúng giữa ion Fe2+ và KMnO4 là:
MnO4−(aq) + 8H+(aq) + 5Fe2+(aq) → Mn2+(aq) + 5Fe3+(aq) + 4H2O(l)
Vì tỉ lệ giữa KMnO4 và Fe2+ là 5:1, ta có thể tính được thể tích dung dịch KMnO4 cần thiết cho chuẩn độ khi không có sai sót:
VKMnO4 = 2,2 ÷ (5 × 0,02) = 22 (mL)
+) Khi chuẩn độ sai:
Khi thao tác sai, 60% lượng KMnO4 chuyển thành MnO2 (kết tủa), và phần còn lại vẫn phản ứng tạo Mn2+. Phương trình phản ứng khi xảy ra sai sót là:
MnO4−(aq) + 4H+(aq) + 3Fe2+(aq) → MnO2(s) + 3Fe3+(aq) + 2H2O(l)
Do 60% KMnO4 không tham gia phản ứng chuẩn độ, chỉ 40% KMnO4 phản ứng đúng theo phương trình. Số mol Fe2+ bị oxi hoá là:
nFe2+ = 3,8x = 2,2 → x = 0,579 (mol)
Thể tích dung dịch KMnO4 cần thiết khi thao tác sai là:
VKMnO4 = 0,579 ÷ 0,02 = 28,95(mL)
Vậy thể tích dung dịch KMnO4 đã dùng tăng so với khi thao tác chuẩn là:
Vtăng = 28,95 − 22 = 6,95(mL).
⇒ Điền đáp án: 6,95
Cho biết: Công thức tính thể tích hình cầu:
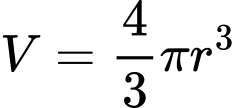
- Số Avogadro NA = 6,023.1023 ; π = 3,1416; nguyên tử khối của Fe là 55,85 amu.
Bán kính nguyên tử Fe là bao nhiêu pm?
(Làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
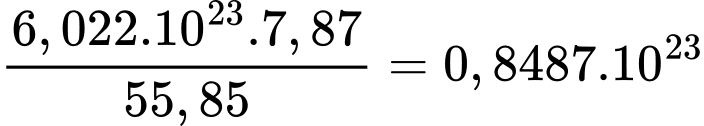
Tổng thể tích các quả cầu:
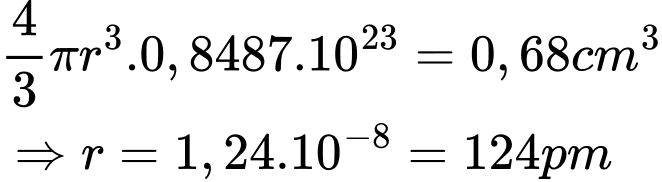
Điền đáp án: 124
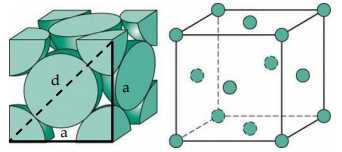
(Biết: Cu = 63,54 amu, 1 amu = 1,66.10-24 g.) Bán kính nguyên tử Cu là bao nhiêu pm?
Điền đáp án: ..........
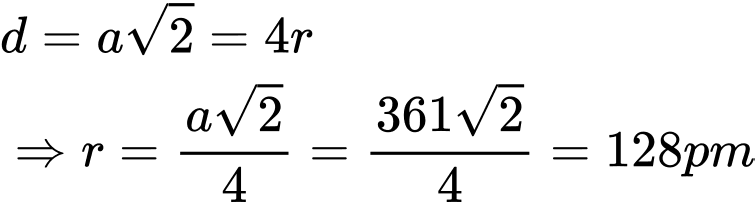
Điền đáp án: 128
Điền đáp án: ..........
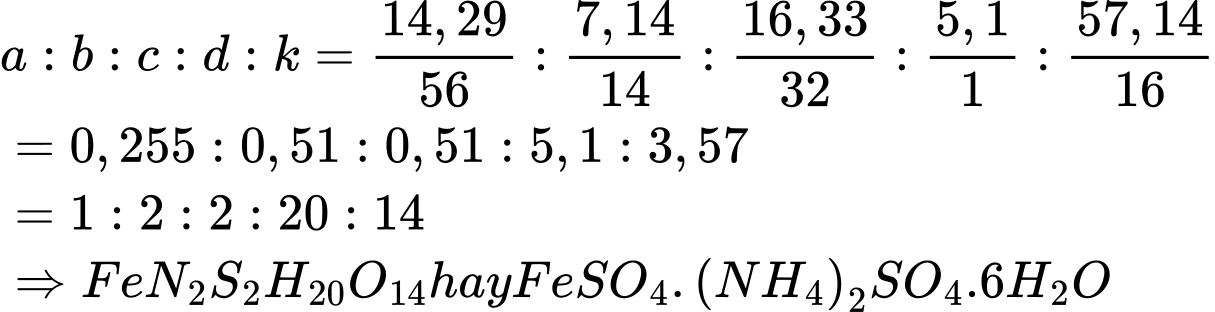
Ở 80oC:
n Mohr = x mol => m Mohr = 392x
n H2O = 6x ; n FeSO4 = n (NH4)2SO4 = x
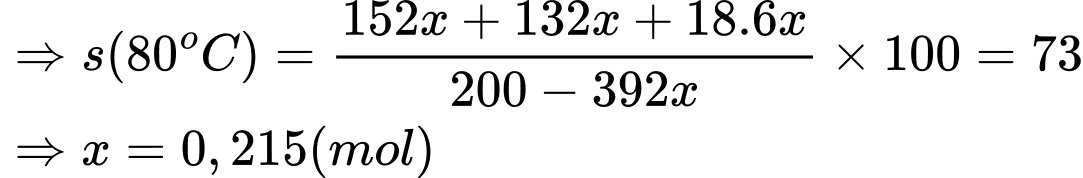
Ở 20oC:
n Mohr = y mol
n H2O = 6y ; n FeSO4 = n (NH4)2SO4 = y (mol)
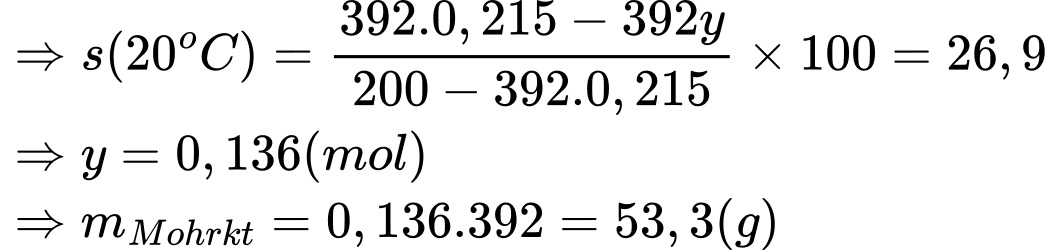
⟹ Điền đáp án: 53,3
Ta có phương trình:
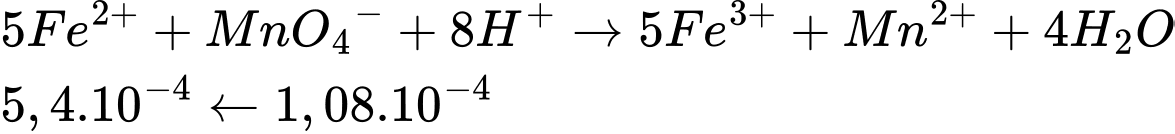
Bảo toàn nguyên tố Fe, trong muối Mohr chỉ chứa 1 Fe nên:
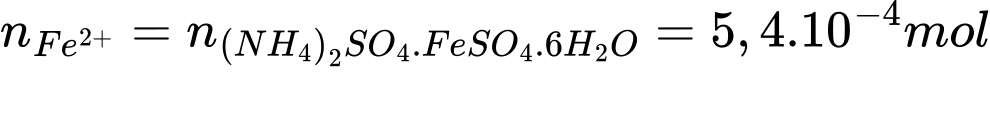
⟹ Điền đáp án: 98
Bước 1: Hoà tan toàn bộ đinh sắt trong dung dịch H2SO4 loãng (dùng gấp đôi lượng phản ứng, giả thiết Fe chỉ phản ứng với acid), thu được 250 mL dung dịch X.
Bước 2: Nhỏ dung dịch BaCl2 dư vào cốc chứa 10,0 mL dung dịch X, thu được 0,8202 g kết tủa trắng.
Bước 3: Tiến hành chuẩn độ 10,0 mL dung dịch X bằng dung dịch KMnO4 0,02 M cần vừa đủ 12,80 mL. Khối lượng của Fe2O3 ở đinh sắt ban đầu là bao nhiêu gam?
(Làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
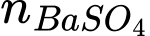 bằng mol kết tủa và bằng
bằng mol kết tủa và bằng 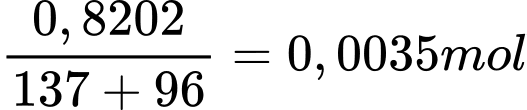
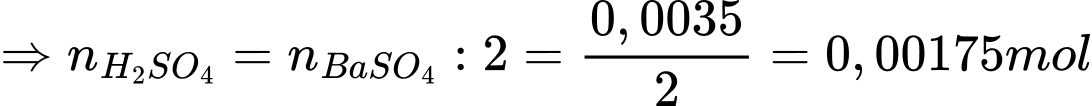
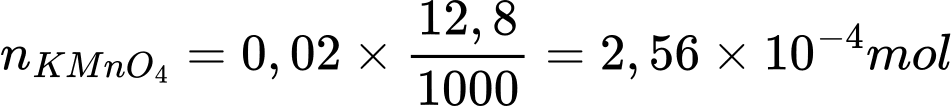
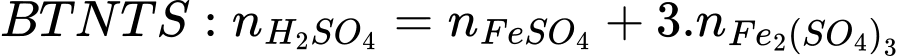
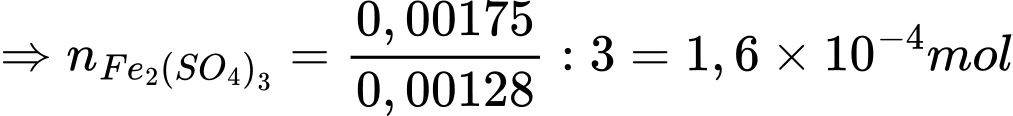
nFe3O4 = nFe2(SO4)3 = 1,6×10-4 mol
mFe3O4 = n×M×250:10 = 1,6×10-4 ×160×250:10 = 0,64 (g)
Điền đáp án: 0,64
Thí nghiệm 1: Cân 1,96 g muối Mohr rồi hoà tan vào nước, sau đó định mức trong bình 50 mL. Chuẩn độ 5,00 mL dung dịch vừa pha cần dùng 5,00 mL dung dịch KMnO4 0,02 M trong môi trường H2SO4 loãng.
Thí nghiệm 2: Làm lạnh 100 g dung dịch muối Mohr bão hoà ở 30 °C đến nhiệt độ ổn định ở 0 °C, thu được m gam muối Mohr kết tinh.
Cho độ tan của muối Mohr trong nước ở các nhiệt độ như sau:
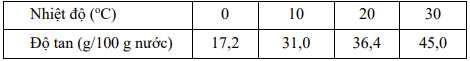
Giá trị của m là bao nhiêu gam? (Làm tròn đến hàng phần mười)
Điền đáp án: ..........
10FeSO4 + 2KMnO4 + 8H2SO4 ⟶ K2SO4 + MnSO4 + 5Fe2(SO4)3 + 8H2O
n KMnO4 = 5.10-3 . 0,02 = 10-4 (mol)
⟶ n FeSO4 = 10-4 . 10 : 2 = 5.10-2 (mol)
Bảo toàn Fe, ta có:
n Mohr = n FeSO4 = 5.10-4
⟶ M Mohr = 152 + 132 + 18n = 1,96 : 10 .5.10-4
(Vì chỉ lấy 5mL trong 50mL để chuẩn độ)
n = 6 ⟶ FeSO4. (NH4)2SO4. 6H2O
Thí nghiệm 2:
+ Ở 30oC:
m Mohr . 100 / (100 - mMohr) = 45 (g)
⟶ mMohr = 31,03 (g)
⟶ mH2O = 100 - 31,03 = 68,97 (g)
+ Ở 0oC :
(31,03 - mMohr tách) . 100 / 68,97 = 17,2
⟶ mMohr tách = 19,2 (g)
Điền đáp án: 19,2
Điền đáp án: ..........
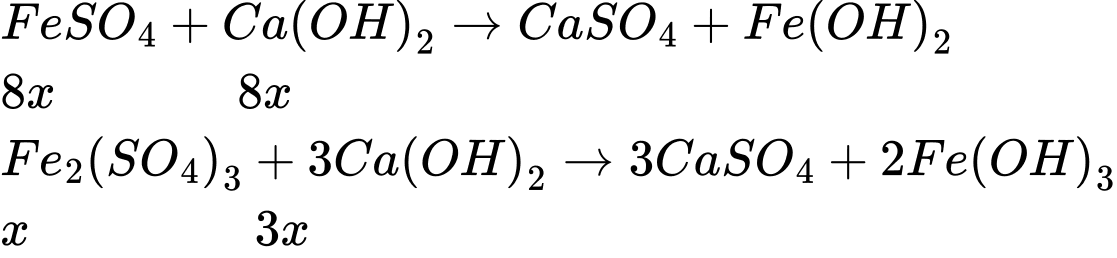
Bảo toàn Fe ta có : 56 × ( 8x + 2x ) = 44,8 × 0,3 × 10
⟹ x = 0,24
⟹ m Ca(OH)2 = 11 × 0,24 × 74 = 195,36 g = 0,2 kg
Điền đáp án: 0,20
(1) Fe3+ + OH- → Fe(OH)3
(2) Fe2+ + OH- + O2 + H2O → Fe(OH)3
Một mẫu nước có hàm lượng sắt cao gấp 28 lần so với ngưỡng cho phép là 0,30 mg/L (theo QCVN 01-1:2018/BYT). Giả thiết sắt trong mẫu nước trên chỉ tồn tại ở hai dạng là Fe3+ và Fe2+ với tỉ lệ mol Fe3+ : Fe2+ = 1 : 4. Cần tối thiểu m gam Ca(OH)2 để kết tủa hoàn toàn lượng sắt trong 10 m³ mẫu nước trên. Giá trị của m là bao nhiêu?
(Làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
Đặt: nFe3+ = a ⇒ nFe2+ = 4a
⇒ a + 4a = 1.5 ⇒ a = 0,3
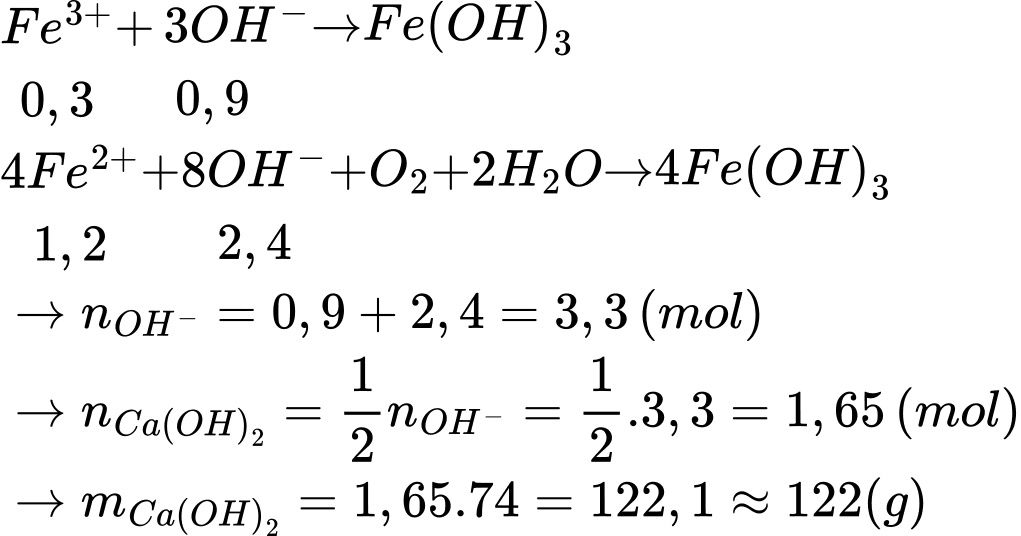
⇒ Điền đáp án: 122
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó
Trong một thí nghiệm chuẩn độ, 13,4 g sodium oxalate (Na2C2O4) khô nguyên chất (M = 134 g/mol) được hòa tan trong 100 mL nước cất, sau đó thêm 100 mL H2SO4 2M thì thu được 200 mL dung dịch, giả sử sự thay đổi thể tích không đáng kể. Dung dịch được làm lạnh đến 25,30°C. Bây giờ thêm dung dịch KMnO4 0,1M vào 20 mL dung dịch này cho đến khi có màu hồng nhạt
MnO2 + 2KOH + KClO3 ⟶ K2MnO4 + KCl + H2O
Sản phẩm thu được là K2MnO4.
Chọn đáp án B
Đáp án: B
Nồng độ Na2C2O4 là: 0,1 / 0,2 = 0,5M
Số mol Na2C2O4 trong 20mL dung dịch là: 0,5 × 20/1000 = 0,01 mol
n (MnO4 - )= 2/5 n (C2O4 2- ) = 2/5 × 0,01 = 0,004 mol
V (KMnO4) = n : V = 0,004 : 0,1 = 0,04 L = 40 mL
Chọn đáp án D. Đáp án: D
Chọn đáp án C Đáp án: C
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 65 đến 67
Khi thêm NH4OH hoặc NaOH vào dung dịch (A) sẽ tạo thành kết tủa màu nâu, kết tủa không tan trong dung dịch NaOH nhưng tan trong HCl đặc. Dung dịch A phản ứng được với dung dịch [K4Fe(CN)6] tạo ra kết tủa có màu xanh đặc trưng, thường gọi là xanh phổ hay xanh Prussia Fe4[Fe(CN)6]3. Trong y học, xanh phổ được dùng để giải độc kim loại nặng, thậm chí cả đồng vị phóng xạ.

Fe2(SO4)3 + 3BaCl2 → 2FeCl3 + 3BaSO4↓
Các lựa chọn khác:
FeSO4 tạo ra dung dịch màu xanh lục nhạt.
FeCl2 tạo ra dung dịch màu xanh lục.
FeO là một chất rắn màu đen, không tan trong nước.
Chọn đáp án B Đáp án: B
Fe2(SO4)3 + 6NH4OH → 2Fe(OH)3↓ + 3(NH4)2SO4
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3↓ + 3Na2SO4
Các lựa chọn khác:
Fe(OH)2 là kết tủa màu trắng xanh, sau đó chuyển dần sang màu nâu đỏ trong không khí bị oxy hóa.
FeCl3, Na2SO4 là muối tan trong nước, không kết tủa.
Chọn đáp án A Đáp án: A
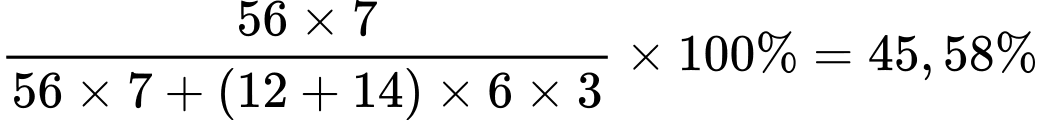
Chọn đáp án A Đáp án: A
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 68 đến 70
Các nguyên tố nhóm chính là các nguyên tố thuộc nhóm 1A đến nhóm 7A. Khí hiếm (nhóm 8A) có cấu hình electron lớp ngoài cùng là 1s2 đối với helium và ns2np6 đối với các khí hiếm khác. Các kim loại chuyển tiếp là các nguyên tố thuộc nhóm 1B, 3B đến 8B và chúng có phân lớp d chưa được lấp đầy electron. Theo định nghĩa này, các nguyên tố thuộc nhóm 2B không phải là kim loại chuyển tiếp. Tuy nhiên, zinc (Zn), cadmium (Cd) và Mercury (thủy ngân – Hg) là các nguyên tố khối d nên chúng vẫn thường được đưa vào thảo luận chung khi nói về kim loại chuyển tiếp.
Chọn đáp án C Đáp án: C
Zn, Cd và Hg đều có lớp vỏ d đầy đủ electron (10 electron) trong trạng thái cơ bản và trong tất cả các trạng thái oxy hóa của chúng. Do đó, chúng không có các đặc tính cụ thể của loại chuyển tiếp kim loại và không được coi là loại chuyển tiếp kim loại.
Chọn đáp án B Đáp án: B
Tổng số e trong X và Y là 51 nên : Zy + Zx = 51
Giải hệ phương trình:
⟹ Zx = 25 (Mn)
Chọn đáp án B Đáp án: B