Dạng 1: TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.
Câu 1 [561071]: Phân tử hay ion nào sau đây không phải là phức chất?
A, [Cu(NH3)4](OH)2.
B, [PtCl4]2–.
C, KMnO4.
D, [PtBr4]2–.
Đặc điểm nổi bật của phức chất:
-Ion kim loại trung tâm: Thường là các kim loại chuyển tiếp, có khả năng tạo liên kết với nhiều loại phối tử khác nhau.
-Phối tử: Có thể là các phân tử hoặc ion mang điện tích âm hoặc trung hòa, có khả năng cung cấp cặp electron cho ion kim loại trung tâm để tạo liên kết.
-Liên kết phối trí: Liên kết giữa ion kim loại trung tâm và phối tử là liên kết đặc biệt, trong đó cặp electron liên kết được cung cấp bởi phối tử.
A.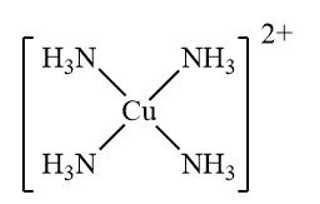
B.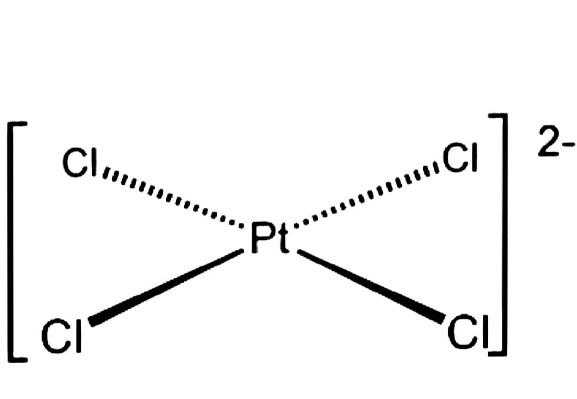
C.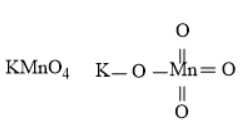
D.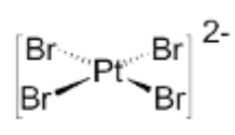
⇒ Chọn đáp án C Đáp án: C
-Ion kim loại trung tâm: Thường là các kim loại chuyển tiếp, có khả năng tạo liên kết với nhiều loại phối tử khác nhau.
-Phối tử: Có thể là các phân tử hoặc ion mang điện tích âm hoặc trung hòa, có khả năng cung cấp cặp electron cho ion kim loại trung tâm để tạo liên kết.
-Liên kết phối trí: Liên kết giữa ion kim loại trung tâm và phối tử là liên kết đặc biệt, trong đó cặp electron liên kết được cung cấp bởi phối tử.
A.

B.

C.
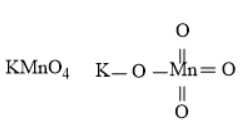
D.

⇒ Chọn đáp án C Đáp án: C
Câu 2 [561072]: Phối tử trong phức chất sau đây là
A, Cl–.
B, NH3.
C, Cl– và NH3.
D, Pt2+ và Cl–.
Phức chất bao gồm:
- Nguyên tử hoặc ion kim loại trung tâm: Là ion kim loại có khả năng nhận cặp electron từ phối tử.Thường là các kim loại chuyển tiếp như Fe, Cu, Co, Ni, Zn, Pt, Ag...
- Phối tử: Là các phân tử hoặc ion có chứa cặp electron chưa sử dụng, có thể cho cặp electron này để tạo liên kết với ion kim loại trung tâm. Phối tử có thể là trung hòa (H2O, NH3, CO) hoặc mang điện tích (Cl- , CN- ,…)
Có 2 loại phối tử trong phức chất trên là Cl- và NH3
⇒ Chọn đáp án C Đáp án: C
- Nguyên tử hoặc ion kim loại trung tâm: Là ion kim loại có khả năng nhận cặp electron từ phối tử.Thường là các kim loại chuyển tiếp như Fe, Cu, Co, Ni, Zn, Pt, Ag...
- Phối tử: Là các phân tử hoặc ion có chứa cặp electron chưa sử dụng, có thể cho cặp electron này để tạo liên kết với ion kim loại trung tâm. Phối tử có thể là trung hòa (H2O, NH3, CO) hoặc mang điện tích (Cl- , CN- ,…)
Có 2 loại phối tử trong phức chất trên là Cl- và NH3
⇒ Chọn đáp án C Đáp án: C
Câu 3 [561073]: Phối tử trong phức chất [Co(NH3)6]Cl3 là
A, Co3+.
B, NH3.
C, Cl–.
D, NH3 và Cl–.
Phức chất bao gồm:
- Nguyên tử hoặc ion kim loại trung tâm: Là ion kim loại có khả năng nhận cặp electron từ phối tử.Thường là các kim loại chuyển tiếp như Fe, Cu, Co, Ni, Zn, Pt, Ag...
- Phối tử: Là các phân tử hoặc ion có chứa cặp electron chưa sử dụng, có thể cho cặp electron này để tạo liên kết với ion kim loại trung tâm. Phối tử có thể là trung hòa (H2O, NH3, CO) hoặc mang điện tích (Cl- , CN- ,…)
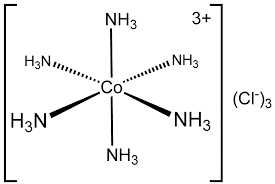
⟹ Phối tử trong phức chất [Co(NH3)6]Cl3 là NH3
⇒ Chọn đáp án B Đáp án: B
- Nguyên tử hoặc ion kim loại trung tâm: Là ion kim loại có khả năng nhận cặp electron từ phối tử.Thường là các kim loại chuyển tiếp như Fe, Cu, Co, Ni, Zn, Pt, Ag...
- Phối tử: Là các phân tử hoặc ion có chứa cặp electron chưa sử dụng, có thể cho cặp electron này để tạo liên kết với ion kim loại trung tâm. Phối tử có thể là trung hòa (H2O, NH3, CO) hoặc mang điện tích (Cl- , CN- ,…)

⟹ Phối tử trong phức chất [Co(NH3)6]Cl3 là NH3
⇒ Chọn đáp án B Đáp án: B
Câu 4 [561074]: Phần tử có thể trở thành phối tử trong phức chất là
A, Anion hoặc phân tử trung hoà có cặp electron hoá trị riêng.
B, Anion có kích thước lớn.
C, Phân tử trung hoà có hoặc không có cặp electron hoá trị riêng.
D, Cation kim loại chuyển tiếp có các orbital trống.
Phần tử có thể trở thành phối tử trong phức chất là Anion hoặc phân tử trung hoà có cặp electron hoá trị riêng. Do cặp electron chưa tham gia liên kết và có khả năng tạo liên kết với ion kim loại trung tâm trong phức chất.
Ví dụ: H2O, NH3,Cl-, Br-, CN-, OH-
Chọn đáp án A Đáp án: A
Ví dụ: H2O, NH3,Cl-, Br-, CN-, OH-
Chọn đáp án A Đáp án: A
Câu 5 [561075]: Vì sao phân tử NH3 có thể đóng vai trò là phối tử?
A, Nguyên tử N có độ âm điện lớn.
B, Nguyên tử N có ba liên kết với ba nguyên tử H.
C, Nguyên tử N có thể kết hợp với ion H+.
D, Nguyên tử N còn cặp electron chưa tham gia liên kết.
Phân tử NH3 có thể đóng vai trò là phối tử vì trên nguyên tử N còn cặp electron chưa tham gia liên kết. Do đó có thể liên kết với ion kim loại trung tâm trong phức chất.
Chọn đáp án D Đáp án: D
Chọn đáp án D Đáp án: D
Câu 6 [561076]: Nguyên tử trung tâm trong phức chất sau đây là
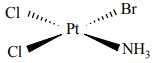

A, Cl–.
B, Br–.
C, Pt2+.
D, NH3.
Nguyên tử trung tâm trong phức chất thường là ion kim loại có khả năng tạo liên kết phối trí với các phối tử xung quanh. Ở đây, Pt 2+ tạo liên kết với 4 phối tử: Cl-, Br-, NH3
⇒ Chọn đáp án C Đáp án: C
⇒ Chọn đáp án C Đáp án: C
Câu 7 [561077]: Nguyên tử trung tâm trong phức chất [Co(en)2Br2]+ là
A, Co+.
B, CO2+.
C, CO3+.
D, CO6+.
Giả sử điện tích của Co trong phức là x
Tổng hợp điện tích trong phức [Co(en)2Br2]+ ta có:
x + 0.2 + (-1).2 = +1
⟹ x = +3
Vậy nguyên tử trung tâm trong phức [Co(en)2Br2]+ là Co3+
⟹ Chọn đáp án C Đáp án: C
Tổng hợp điện tích trong phức [Co(en)2Br2]+ ta có:
x + 0.2 + (-1).2 = +1
⟹ x = +3
Vậy nguyên tử trung tâm trong phức [Co(en)2Br2]+ là Co3+
⟹ Chọn đáp án C Đáp án: C
Câu 8 [561078]: Phần tử có thể trở thành nguyên tử trung tâm trong phức chất khi chúng sử dụng các orbital trống để nhận cặp electron hoá trị riêng từ phối tử. Các phần tử đó là
A, Tất cả các cation kim loại.
B, Nguyên tử hoặc cation của một số kim loại.
C, Các nguyên tử nguyên tố chuyển tiếp dãy thứ nhất.
D, Các cation kim loại của nguyên tố chuyển tiếp dãy thứ nhất.
Nguyên tử trung tâm trong phức chất là ion hoặc nguyên tử kim loại có khả năng nhận cặp electron từ các phối tử.
Cation kim loại thường có orbital trống do mất electron để tạo thành ion dương.
Nguyên tố chuyển tiếp có nhiều orbital d trống, tạo điều kiện cho việc hình thành phức chất.
Chọn đáp án B Đáp án: B
Cation kim loại thường có orbital trống do mất electron để tạo thành ion dương.
Nguyên tố chuyển tiếp có nhiều orbital d trống, tạo điều kiện cho việc hình thành phức chất.
Chọn đáp án B Đáp án: B
Câu 9 [561079]: Nguyên tử trung tâm và phối tử trong phức chất sau đây lần lượt là
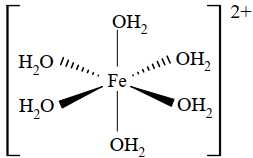

A, Fe2+ và Cl–.
B, Fe3+ và Cl–.
C, Fe2+ và H2O.
D, Fe2+ và OH–.
Phức chất bao gồm:
- Nguyên tử hoặc ion kim loại trung tâm: Là ion kim loại có khả năng nhận cặp electron từ phối tử.Thường là các kim loại chuyển tiếp như Fe, Cu, Co, Ni, Zn, Pt, Ag...
- Phối tử: Là các phân tử hoặc ion có chứa cặp electron chưa sử dụng, có thể cho cặp electron này để tạo liên kết với ion kim loại trung tâm. Phối tử có thể là trung hòa (H2O, NH3, CO) hoặc mang điện tích (Cl- , CN- ,…)
Với phức trên, nguyên tử trung tâm là Fe 2+ và 6 phối tử là H2O
⟹ Chọn đáp án C Đáp án: C
- Nguyên tử hoặc ion kim loại trung tâm: Là ion kim loại có khả năng nhận cặp electron từ phối tử.Thường là các kim loại chuyển tiếp như Fe, Cu, Co, Ni, Zn, Pt, Ag...
- Phối tử: Là các phân tử hoặc ion có chứa cặp electron chưa sử dụng, có thể cho cặp electron này để tạo liên kết với ion kim loại trung tâm. Phối tử có thể là trung hòa (H2O, NH3, CO) hoặc mang điện tích (Cl- , CN- ,…)
Với phức trên, nguyên tử trung tâm là Fe 2+ và 6 phối tử là H2O
⟹ Chọn đáp án C Đáp án: C
Câu 10 [561080]: Chlorophyll là phức chất tạo màu xanh cho lá cây, có cấu tạo như hình bên.
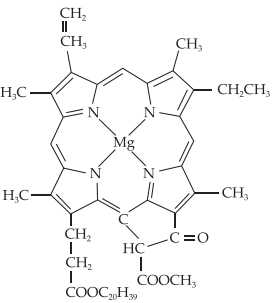
Số liên kết quanh nguyên tử trung tâm và số phối tử trong chlorophyll lần lượt là

Số liên kết quanh nguyên tử trung tâm và số phối tử trong chlorophyll lần lượt là
A, 6 và 6.
B, 4 và 1.
C, 4 và 4.
D, 6 và 4.
Mg là nguyên tử trung tâm trong chlorophyll được phối trí bởi bốn nguyên tử (N) trong vòng tạo thành 4 liên kết nằm trong 1 vòng.
Phối tử là porphyrin => Có 1 phối tử
⟹ Chọn đáp án B Đáp án: B
Phối tử là porphyrin => Có 1 phối tử
⟹ Chọn đáp án B Đáp án: B
Câu 11 [561081]: Theo thuyết liên kết hoá trị, tương tác giữa phối tử và nguyên tử trung tâm trong phức chất là
A, Liên kết cộng hoá trị theo kiểu cho - nhận.
B, Liên kết ion.
C, Tương tác van der Waals.
D, Liên kết hydrogen.
Phối tử cho cặp electron này vào orbital trống của nguyên tử trung tâm, tạo thành liên kết phối trí (một dạng của liên kết cộng hóa trị nhưng chỉ có một phía đóng góp electron).
⟹ Liên kết cộng hoá trị theo kiểu cho - nhận.
Chọn đáp án A Đáp án: A
⟹ Liên kết cộng hoá trị theo kiểu cho - nhận.
Chọn đáp án A Đáp án: A
Câu 12 [561082]: Phức chất sau đây có điện tích bằng bao nhiêu?
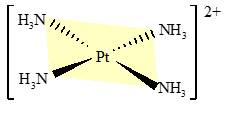

A, 1+.
B, 2+.
C, 3+.
D, 4+.
Phức chất [Pt(NH3)4]2+ gồm ion trung tâm Pt2+ và 4 phối tử trung hòa NH3 nên phức chất [Pt(NH3)4]2+ có điện tích là 2+.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 13 [561083]: Cho các phức chất sau: [Cu(OH2)6]2+, [CoF6]3–, [Ni(CO)4], [PtCl2(NH3)2]. Hãy cho biết điện tích của các phức chất trên lần lượt là
A, 1+, 3–, 0, 0.
B, 2+, 3–, 0, 0.
C, 2+, 1–, 2+, 0.
D, 3+, 1–, +2, +2.
Điện tích của các phức là chỉ số bên ngoài dấu [...].
Điện tích của các phức [Cu(OH2)6]2+, [CoF6]3–, [Ni(CO)4], [PtCl2(NH3)2] lần lượt là 2+, 3+, 0, 0
⇒ Chọn đáp án B Đáp án: B
Điện tích của các phức [Cu(OH2)6]2+, [CoF6]3–, [Ni(CO)4], [PtCl2(NH3)2] lần lượt là 2+, 3+, 0, 0
⇒ Chọn đáp án B Đáp án: B
Câu 14 [561084]: Khi cho copper(II) sulfate vào nước thì hình thành phức chất bát diện với các phối tử là 6 phân tử H2O. Công thức của phức chất là
A, [Cu(OH2)6]3+.
B, [Cu(OH2)6]2+.
C, [Cu(OH2)4]3+.
D, [Cu(OH2)4]2+.
Khi cho copper(II) sulfate vào nước thì hình thành phức chất bát diện với các phối tử là 6 phân tử H2O. Công thức của phức chất là
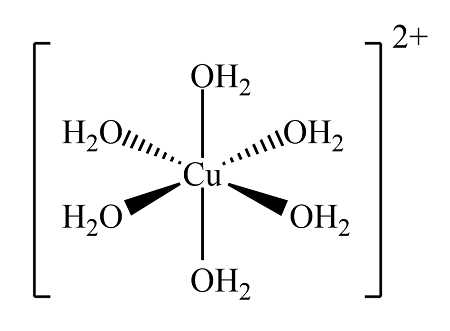
⇒ Chọn đáp án B Đáp án: B

⇒ Chọn đáp án B Đáp án: B
Câu 15 [561085]: Phức chất [Ni(OH2)6]2+ có dạng hình học bát diện như sau:
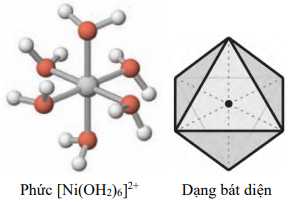
Số phối tử xung quanh nguyên tử trung tâm là

Số phối tử xung quanh nguyên tử trung tâm là
A, 2.
B, 4.
C, 6.
D, 8.
Số phối tử quanh nguyên tử trung tâm Ni2+ là các chấm màu cam => có 6 phối tử.
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C Đáp án: C
Câu 16 [561086]: Phức chất [Pt(NH3)2Cl2] có dạng hình học vuông phẳng như sau:
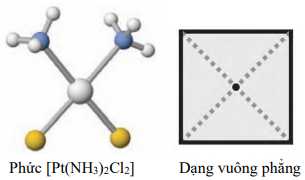
Số phối tử xung quanh nguyên tử trung tâm là

Số phối tử xung quanh nguyên tử trung tâm là
A, 1.
B, 2.
C, 3.
D, 4.
Phức [Pt(NH3)2Cl2] có 2 phối tử NH3 và 2 phối tử Cl => có tổng 4 phối tử xung quanh
Chọn đáp án D Đáp án: D
Chọn đáp án D Đáp án: D
Câu 17 [561087]: Phức chất [Zn(OH)4]2– có dạng hình học tứ diện. Dạng hình học biểu diễn của phức chất trên là
A, 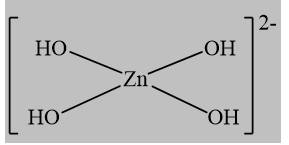

B, 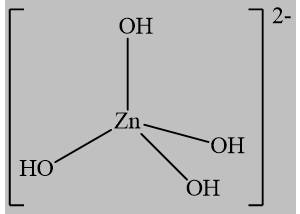

C, 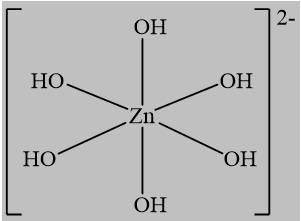

D, 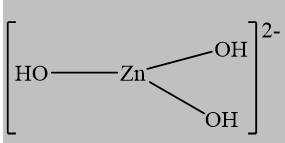

Phức [Zn(OH)4]2- có dạng hình học tứ diện, vậy chọn đáp án B.
A. Có dạng hình học phẳng
C. Có dạng bát diện
D. Có dạng tam giác Đáp án: B
A. Có dạng hình học phẳng
C. Có dạng bát diện
D. Có dạng tam giác Đáp án: B
Câu 18 [561088]: Phức chất nào sau đây có dạng hình học tứ diện?
A, [Ni(CO)4].
B, [Cu(NH3)4(OH2)2]2+.
C, [Co(NH3)6]3+.
D, [CoCl2(OH2)4].
Phức chất có dạng hình tứ diện thường xuất hiện khi:
- Nguyên tử trung tâm có số phối trí là 4.
- Phối tử có kích thước tương đối lớn hoặc đẩy nhau mạnh, khiến cấu trúc tứ diện trở nên ổn định hơn so với hình vuông phẳng.
Đáp án B,C,D đều là các phức chất chứa 6 phối trí => loại
Chọn đáp án A Đáp án: A
- Nguyên tử trung tâm có số phối trí là 4.
- Phối tử có kích thước tương đối lớn hoặc đẩy nhau mạnh, khiến cấu trúc tứ diện trở nên ổn định hơn so với hình vuông phẳng.
Đáp án B,C,D đều là các phức chất chứa 6 phối trí => loại
Chọn đáp án A Đáp án: A
Câu 19 [561089]: Phức chất [NiCl4]2– có dạng hình học tứ diện như bên. Số phối tử xung quanh nguyên tử trung tâm là
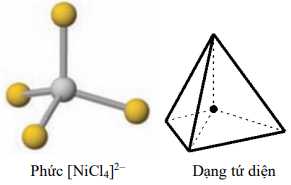

A, 1.
B, 2.
C, 3.
D, 4.
Phức chất có dạng hình tứ diện thường xuất hiện khi:
- Nguyên tử trung tâm có số phối trí là 4.
- Phối tử có kích thước tương đối lớn hoặc đẩy nhau mạnh, khiến cấu trúc tứ diện trở nên ổn định hơn so với hình vuông phẳng.
Chọn đáp án D Đáp án: D
- Nguyên tử trung tâm có số phối trí là 4.
- Phối tử có kích thước tương đối lớn hoặc đẩy nhau mạnh, khiến cấu trúc tứ diện trở nên ổn định hơn so với hình vuông phẳng.
Chọn đáp án D Đáp án: D
Câu 20 [561090]: Phức chất nào sau đây không có dạng hình học bát diện?
A, [Cu(EDTA)]3–.
B, [Cu(en)3]2+.
C, [Co(C2O4)3]3–.
D, [PtCl2(NH3)2].
Phân tích các đáp án:
A. EDTA là phối tử đa càng => dạng bát diện
B.en là phối tử hai càng, có 3 en nên ở dạng ML6 => dạng bát diện.
C. C2O4 2- là phối tử hai càng, có 3 C2O4 2- nên ở dạng ML6 => dạng bát diện.
⇒ Chọn đáp án D
Đáp án: D
A. EDTA là phối tử đa càng => dạng bát diện
B.en là phối tử hai càng, có 3 en nên ở dạng ML6 => dạng bát diện.
C. C2O4 2- là phối tử hai càng, có 3 C2O4 2- nên ở dạng ML6 => dạng bát diện.
⇒ Chọn đáp án D
Đáp án: D
Câu 21 [561091]: Phức chất có công thức [PtCl2(NH3)2] có cấu tạo như hình bên:
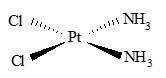
Phát biểu nào dưới đây về phức chất trên là không đúng?

Phát biểu nào dưới đây về phức chất trên là không đúng?
A, Phức chất có điện tích bằng 0.
B, Có hai loại phối tử trong phức chất.
C, Để hình thành phức chất trên thì cation Pt2+ đã dùng 4 orbital trống để nhận các cặp electron hoá trị riêng của các phân tử NH3 và các anion Cl-.
D, Nối từng cặp phối tử cạnh nhau ở cấu tạo trên bằng một đoạn thẳng. Bốn đoạn thẳng tạo ra hình dạng của phức chất, đó là hình tứ diện.
Phân tích các phát biểu:
✔️ A. Đúng. [Pt(NH3)2Cl2] có ion trung tâm là Pt2+, 2 phối tử NH3 trung hòa, 2 phối tử là ion Cl-
→ Tổng điện tích của phức chất là 0
✔️ B. Đúng. [Pt(NH3)2Cl2] có 2 phối tử NH3 và 2 phối tử là ion Cl-
✔️ C. Đúng. Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm. Kiểu lai hoá các orbital của nguyên tử trung tâm quyết định dạng hình học của phức chất.
❌ D. Sai. [Pt(NH3)2Cl2] có ion trung tâm là Pt2+, 2 phối tử NH3 trung hòa, 2 phối tử là ion Cl- các phối tử cùng nằm trên 1 mặt phẳng nên không thể thu được hình tứ diện khi nối từng cặp phối tử cạnh nhau ở cấu tạo trên bằng một đoạn thẳng.
⇒ Chọn đáp án D Đáp án: D
✔️ A. Đúng. [Pt(NH3)2Cl2] có ion trung tâm là Pt2+, 2 phối tử NH3 trung hòa, 2 phối tử là ion Cl-
→ Tổng điện tích của phức chất là 0
✔️ B. Đúng. [Pt(NH3)2Cl2] có 2 phối tử NH3 và 2 phối tử là ion Cl-
✔️ C. Đúng. Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm. Kiểu lai hoá các orbital của nguyên tử trung tâm quyết định dạng hình học của phức chất.
❌ D. Sai. [Pt(NH3)2Cl2] có ion trung tâm là Pt2+, 2 phối tử NH3 trung hòa, 2 phối tử là ion Cl- các phối tử cùng nằm trên 1 mặt phẳng nên không thể thu được hình tứ diện khi nối từng cặp phối tử cạnh nhau ở cấu tạo trên bằng một đoạn thẳng.
⇒ Chọn đáp án D Đáp án: D
Câu 22 [561092]: Cho phức chất có cấu tạo như hình vẽ sau:
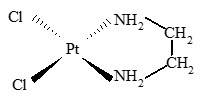
(a) Điện tích của phức chất bằng 0.
(b) Số liên kết cho - nhận giữa mỗi phối tử với nguyên tử trung tâm là như nhau.
(c) Số oxi hoá của nguyên tử trung tâm trong phức chất là +4.
(d) Tất cả các liên kết trong phức chất đều là liên kết cộng hoá trị.
(e) Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho - nhận.
Có bao nhiêu phát biểu đúng trong những phát biểu sau về các phức chất trên?

(a) Điện tích của phức chất bằng 0.
(b) Số liên kết cho - nhận giữa mỗi phối tử với nguyên tử trung tâm là như nhau.
(c) Số oxi hoá của nguyên tử trung tâm trong phức chất là +4.
(d) Tất cả các liên kết trong phức chất đều là liên kết cộng hoá trị.
(e) Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho - nhận.
Có bao nhiêu phát biểu đúng trong những phát biểu sau về các phức chất trên?
A, 2.
B, 3.
C, 4.
D, 5.
Phân tích các phát biểu:
✔️a.Đúng. Trong hình vẽ, ion trung tâm là (Pt) có số oxi hóa +2 (do 4 liên kết với Cl-).
- Mỗi phối tử Cl- có điện tích -1.
- Phức chất có 2 nhóm NH3 trung hòa điện tích.
- Tổng điện tích của phức chất là: (+2) + 2.(-1) + 0 = 0.
❌(b) Sai. Số liên kết cho - nhận giữa mỗi phối tử với nguyên tử trung tâm là khác nhau.
- Mỗi phối tử Cl- liên kết với Pt thông qua 1 liên kết cho - nhận.
- Mỗi phối tử en tạo 2 liên kết.
❌(c) Sai. Số oxi hoá của nguyên tử trung tâm(Pt) trong phức chất là +2, không phải +4
✔️(d) Đúng. Liên kết giữa Pt và Cl- và liên kết giữa Pt và NH3 là liên kết cộng hóa trị cho - nhận.
✔️(e) Đúng.Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho - nhận.
Có 4 phát biểu đúng.
⇒ Chọn đáp án B Đáp án: B
✔️a.Đúng. Trong hình vẽ, ion trung tâm là (Pt) có số oxi hóa +2 (do 4 liên kết với Cl-).
- Mỗi phối tử Cl- có điện tích -1.
- Phức chất có 2 nhóm NH3 trung hòa điện tích.
- Tổng điện tích của phức chất là: (+2) + 2.(-1) + 0 = 0.
❌(b) Sai. Số liên kết cho - nhận giữa mỗi phối tử với nguyên tử trung tâm là khác nhau.
- Mỗi phối tử Cl- liên kết với Pt thông qua 1 liên kết cho - nhận.
- Mỗi phối tử en tạo 2 liên kết.
❌(c) Sai. Số oxi hoá của nguyên tử trung tâm(Pt) trong phức chất là +2, không phải +4
✔️(d) Đúng. Liên kết giữa Pt và Cl- và liên kết giữa Pt và NH3 là liên kết cộng hóa trị cho - nhận.
✔️(e) Đúng.Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho - nhận.
Có 4 phát biểu đúng.
⇒ Chọn đáp án B Đáp án: B
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.
Câu 23 [561093]: Cho cấu tạo của một số phức chất
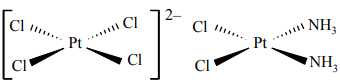
a. Phức chất có thể mang điện tích hoặc không mang điện tích.
b. Hai phức chất trên có cùng nguyên tử trung tâm.
c. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên
kết cộng hóa trị.
d. Nguyên tử Cl, phân tử NH3 cho cặp electron liên kết vào orbital trống
của nguyên tử trung tâm.
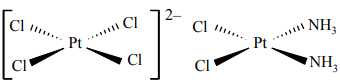
a. Phức chất có thể mang điện tích hoặc không mang điện tích.
b. Hai phức chất trên có cùng nguyên tử trung tâm.
c. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên
kết cộng hóa trị.
d. Nguyên tử Cl, phân tử NH3 cho cặp electron liên kết vào orbital trống
của nguyên tử trung tâm.
Phân tích các phát biểu:
✔️a. Đúng
- Phức chất bên trái [PtCl4]2- có điện tích 2- (mang điện tích âm).
- Phức chất bên phải [PtCl2(NH3)2] không mang điện tích (trung hòa).
✔️b. Đúng.Cả hai phức chất đều có nguyên tử Pt ở trung tâm.
✔️c. Đúng. Liên kết giữa nguyên tử trung tâm (Pt) và phối tử (Cl-, NH3) trong phức chất là liên kết cho nhận (hay còn gọi là liên kết cộng hoá trị phối trí).
❌d. Sai. Ion Cl- và phân tử NH3 có cặp electron tự do, được sử dụng để tạo liên kết với orbital trống của nguyên tử Pt trong phức chất. Đáp án: D
✔️a. Đúng
- Phức chất bên trái [PtCl4]2- có điện tích 2- (mang điện tích âm).
- Phức chất bên phải [PtCl2(NH3)2] không mang điện tích (trung hòa).
✔️b. Đúng.Cả hai phức chất đều có nguyên tử Pt ở trung tâm.
✔️c. Đúng. Liên kết giữa nguyên tử trung tâm (Pt) và phối tử (Cl-, NH3) trong phức chất là liên kết cho nhận (hay còn gọi là liên kết cộng hoá trị phối trí).
❌d. Sai. Ion Cl- và phân tử NH3 có cặp electron tự do, được sử dụng để tạo liên kết với orbital trống của nguyên tử Pt trong phức chất. Đáp án: D
Câu 24 [561094]: Hình dưới đây minh họa sự hình thành phức chất [Fe(OH2)6]2+:
Fe2+ + 6H2O [Fe(OH2)6]2+
[Fe(OH2)6]2+
a. Trong phức chất trên nguyên tử trung tâm là Fe, phối tử là H2O.
b. Một cation Fe2+
đã sử dụng ba orbital trống để nhận 6 cặp electron
chưa liên kết từ H2O.
c. Phân tử H2O còn cặp electron chưa tham gia liên kết nằm trên nguyên
tử oxygen.
d. Mỗi cation Fe2+
đã tạo 6 liên kết sigma với phối tử nên có dạng hình
học tứ diện.
Fe2+ + 6H2O
 [Fe(OH2)6]2+
[Fe(OH2)6]2+a. Trong phức chất trên nguyên tử trung tâm là Fe, phối tử là H2O.
b. Một cation Fe2+
đã sử dụng ba orbital trống để nhận 6 cặp electron
chưa liên kết từ H2O.
c. Phân tử H2O còn cặp electron chưa tham gia liên kết nằm trên nguyên
tử oxygen.
d. Mỗi cation Fe2+
đã tạo 6 liên kết sigma với phối tử nên có dạng hình
học tứ diện.
Phân tích các phát biểu:
❌(a) Sai.
- Nguyên tử trung tâm trong phức chất [Fe(OH2)6]2+ là ion Fe2+.
- Các phân tử H2O đóng vai trò là phối tử, cho cặp electron để tạo liên kết phối trí với Fe2+.
❌(b) Sai. Ion Fe2+ có cấu hình electron: [Ar] 3d6.
Trong quá trình tạo phức, Fe2+. sử dụng các orbital d, s, p để nhận 6 cặp electron từ H2O, chứ không chỉ dùng ba orbital trống.
✔️(c) Đúng. Phân tử H2O có 2 cặp electron chưa tham gia liên kết trên nguyên tử oxygen.Chính một trong hai cặp này sẽ được dùng để tạo liên kết với Fe2+.
❌(d) Sai.Phức [Fe(OH2)6]2+có số phối trí là 6, nên có hình học bát diện.
❌(a) Sai.
- Nguyên tử trung tâm trong phức chất [Fe(OH2)6]2+ là ion Fe2+.
- Các phân tử H2O đóng vai trò là phối tử, cho cặp electron để tạo liên kết phối trí với Fe2+.
❌(b) Sai. Ion Fe2+ có cấu hình electron: [Ar] 3d6.
Trong quá trình tạo phức, Fe2+. sử dụng các orbital d, s, p để nhận 6 cặp electron từ H2O, chứ không chỉ dùng ba orbital trống.
✔️(c) Đúng. Phân tử H2O có 2 cặp electron chưa tham gia liên kết trên nguyên tử oxygen.Chính một trong hai cặp này sẽ được dùng để tạo liên kết với Fe2+.
❌(d) Sai.Phức [Fe(OH2)6]2+có số phối trí là 6, nên có hình học bát diện.
Câu 25 [561095]: Phức chất đơn giản thường được tạo bởi một nguyên tử trung tâm liên kết với các phối tử.
a. Nguyên tử trung tâm trong phức chất là cation kim loại hoặc nguyêntử kim loại đã nhận cặp electron hoá trị riêng của phân tử hoặc anion.
b. Cation tạo nguyên tử trung tâm trong phức chất [Co(OH2)6]3+là Co3+.
c. Nguyên tử trung tâm trong phức chất phải còn orbital trống.
d. Nguyên tử trung tâm trong phức chất [Ni(CO)4] được hình thành từquá trình cation Ni2+sử dụng các orbital trống để nhận các cặp electronhoá trị của các phân tử CO.
a. Nguyên tử trung tâm trong phức chất là cation kim loại hoặc nguyêntử kim loại đã nhận cặp electron hoá trị riêng của phân tử hoặc anion.
b. Cation tạo nguyên tử trung tâm trong phức chất [Co(OH2)6]3+là Co3+.
c. Nguyên tử trung tâm trong phức chất phải còn orbital trống.
d. Nguyên tử trung tâm trong phức chất [Ni(CO)4] được hình thành từquá trình cation Ni2+sử dụng các orbital trống để nhận các cặp electronhoá trị của các phân tử CO.
Phân tích các phát biểu:
✔️a. Đúng – Nguyên tử trung tâm trong phức chất thường là cation kim loại hoặc nguyên tử kim loại trung tính có khả năng nhận cặp electron từ phối tử.
✔️b. Đúng – Trong phức chất [Co(OH2)6]3+ nguyên tử Co có số oxi hóa +3, tức là cation trung tâm là Co3+
✔️c. Đúng – Nguyên tử trung tâm trong phức chất phải có orbital trống để nhận cặp electron từ phối tử.
❌d. Sai – Phức chất [Ni(CO)4] có Ni ở trạng thái oxi hóa 0 không phải Ni2+ , Ni trung hòa nhận cặp electron từ CO để tạo liên kết, chứ không phải Ni2+ sử dụng orbital trống.
✔️a. Đúng – Nguyên tử trung tâm trong phức chất thường là cation kim loại hoặc nguyên tử kim loại trung tính có khả năng nhận cặp electron từ phối tử.
✔️b. Đúng – Trong phức chất [Co(OH2)6]3+ nguyên tử Co có số oxi hóa +3, tức là cation trung tâm là Co3+
✔️c. Đúng – Nguyên tử trung tâm trong phức chất phải có orbital trống để nhận cặp electron từ phối tử.
❌d. Sai – Phức chất [Ni(CO)4] có Ni ở trạng thái oxi hóa 0 không phải Ni2+ , Ni trung hòa nhận cặp electron từ CO để tạo liên kết, chứ không phải Ni2+ sử dụng orbital trống.
Câu 26 [561096]: Phức chất đơn giản thường được tạo bởi một nguyên tử trung tâm liên kết với các phối tử.
a. Phối tử là các phân tử hoặc anion đã cho một hoặc một số cặp electron
hoá trị riêng.
b. Các phân tử NH3, N2, H2 và các ion OH–
, Cl–
đều có thể trở thành phối
tử trong phức chất.
c. Trong phức chất [Cu(NH3)4(OH2)2]2+
có chứa phối tử là NH3 và H2O.
d. Khi tham gia quá trình tạo phức chất, phân tử ethylenediamine
H2NCH2CH2NH2 sử dụng hai cặp electron hoá trị riêng để tạo 2 liên kết
cho - nhận
a. Phối tử là các phân tử hoặc anion đã cho một hoặc một số cặp electron
hoá trị riêng.
b. Các phân tử NH3, N2, H2 và các ion OH–
, Cl–
đều có thể trở thành phối
tử trong phức chất.
c. Trong phức chất [Cu(NH3)4(OH2)2]2+
có chứa phối tử là NH3 và H2O.
d. Khi tham gia quá trình tạo phức chất, phân tử ethylenediamine
H2NCH2CH2NH2 sử dụng hai cặp electron hoá trị riêng để tạo 2 liên kết
cho - nhận
Phân tích các phát biểu:
✔️a. Đúng. Phối tử là các ion hoặc phân tử có khả năng liên kết với ion trung tâm trong phức chất bằng cách cung cấp cặp electron của chúng.
❌b. Sai. NH3, OH- và Cl- có thể là phối tử, nhưng N2 và H2 thì không.
- NH3 có cặp electron không chia trên nguyên tử nitơ, cho phép nó liên kết với ion trung tâm.
- OH- và Cl- là các ion mang điện tích âm, có thể tương tác và liên kết với ion trung tâm mang điện tích dương.
- N2 và H2 là các phân tử không phân cực, không có cặp electron không chia hoặc điện tích để tương tác mạnh với ion trung tâm trong phức chất.
✔️c. Đúng. Trong phức chất này, ion đồng (Cu2+) là ion trung tâm, và bốn phân tử NH3 và hai phân tử H2O đóng vai trò là phối tử, liên kết với ion Cu2+.
✔️d. Đúng. Ethylenediamine là một phối tử hai càng có khả năng liên kết với ion trung tâm thông qua hai nguyên tử nitơ, mỗi nguyên tử nitơ đóng góp một cặp electron.
✔️a. Đúng. Phối tử là các ion hoặc phân tử có khả năng liên kết với ion trung tâm trong phức chất bằng cách cung cấp cặp electron của chúng.
❌b. Sai. NH3, OH- và Cl- có thể là phối tử, nhưng N2 và H2 thì không.
- NH3 có cặp electron không chia trên nguyên tử nitơ, cho phép nó liên kết với ion trung tâm.
- OH- và Cl- là các ion mang điện tích âm, có thể tương tác và liên kết với ion trung tâm mang điện tích dương.
- N2 và H2 là các phân tử không phân cực, không có cặp electron không chia hoặc điện tích để tương tác mạnh với ion trung tâm trong phức chất.
✔️c. Đúng. Trong phức chất này, ion đồng (Cu2+) là ion trung tâm, và bốn phân tử NH3 và hai phân tử H2O đóng vai trò là phối tử, liên kết với ion Cu2+.
✔️d. Đúng. Ethylenediamine là một phối tử hai càng có khả năng liên kết với ion trung tâm thông qua hai nguyên tử nitơ, mỗi nguyên tử nitơ đóng góp một cặp electron.
Câu 27 [561097]: Phức chất [Cu(OH2)6]2+ có dạng hình học là bát diện.
a. Nguyên tử trung tâm được hình thành từ quá trình cation Cu2+
sử dụng
6 orbital trống để nhận các cặp electron hoá trị riêng của các phân tử
H2O.
b. Số oxi hoá của nguyên tử trung tâm là 2+.
c. Mỗi phân tử nước sử dụng 2 cặp electron hoá trị riêng của nó để tạo
liên kết cho - nhận với cation Cu2+.
d. Trong phức chất trên mỗi nguyên tử trung tâm tạo 6 liên kết sigma với
phối tử.
a. Nguyên tử trung tâm được hình thành từ quá trình cation Cu2+
sử dụng
6 orbital trống để nhận các cặp electron hoá trị riêng của các phân tử
H2O.
b. Số oxi hoá của nguyên tử trung tâm là 2+.
c. Mỗi phân tử nước sử dụng 2 cặp electron hoá trị riêng của nó để tạo
liên kết cho - nhận với cation Cu2+.
d. Trong phức chất trên mỗi nguyên tử trung tâm tạo 6 liên kết sigma với
phối tử.
Phân tích các phát biểu:
✔️a. Đúng. Nguyên tử trung tâm Cu2+ có cấu hình electron là [Ar]3d9. Ion Cu2+ sử dụng 6 orbital trống (4s, 4p, và 4d) để nhận 6 cặp electron từ 6 phân tử H2O, tạo thành 6 liên kết phối trí (cho - nhận).
❌b. Sai. Số oxi hóa của đồng trong phức chất [Cu(OH2)6]2+ là +2. Điều này được xác định dựa trên điện tích tổng cộng của phức chất là +2 và điện tích của các phối tử H2O là 0.
❌c. Sai. Mỗi phân tử H2O chỉ sử dụng 1 cặp electron hóa trị riêng của nó để tạo liên kết cho - nhận với ion Cu2+. Phân tử H2O có 2 cặp electron hóa trị, nhưng chỉ có 1 cặp được sử dụng để liên kết với Cu2+, cặp còn lại là cặp electron không liên kết.
✔️d. Đúng. Trong phức chất [Cu(OH2)6]2+, mộtnguyên tử Cu tạo ra 6 liên kết sigma với 6 phối tử H2O. Liên kết sigma là loại liên kết đơn, bền vững, được hình thành do sự chồng chéo trực tiếp của các orbital nguyên tử.
✔️a. Đúng. Nguyên tử trung tâm Cu2+ có cấu hình electron là [Ar]3d9. Ion Cu2+ sử dụng 6 orbital trống (4s, 4p, và 4d) để nhận 6 cặp electron từ 6 phân tử H2O, tạo thành 6 liên kết phối trí (cho - nhận).
❌b. Sai. Số oxi hóa của đồng trong phức chất [Cu(OH2)6]2+ là +2. Điều này được xác định dựa trên điện tích tổng cộng của phức chất là +2 và điện tích của các phối tử H2O là 0.
❌c. Sai. Mỗi phân tử H2O chỉ sử dụng 1 cặp electron hóa trị riêng của nó để tạo liên kết cho - nhận với ion Cu2+. Phân tử H2O có 2 cặp electron hóa trị, nhưng chỉ có 1 cặp được sử dụng để liên kết với Cu2+, cặp còn lại là cặp electron không liên kết.
✔️d. Đúng. Trong phức chất [Cu(OH2)6]2+, mộtnguyên tử Cu tạo ra 6 liên kết sigma với 6 phối tử H2O. Liên kết sigma là loại liên kết đơn, bền vững, được hình thành do sự chồng chéo trực tiếp của các orbital nguyên tử.
Câu 28 [561098]: Hemoglobin đóng vai trò quan trọng trong quá trình vận chuyển oxygen từ phổi đến tế bào và mô, năng lượng cần thiết cho cơ thể. Hemoglobin có chứa phức có công thứ như sau:
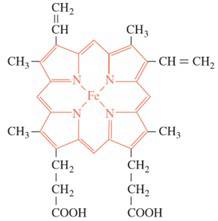
a. Phức chất trên có điện tích bằng 0.
b. Nguyên tử trung tâm trong hemoglobin là kim loại chuyển tiếp.
c. Trong phân tử hemoglobin có 4 phối tử.
d. Mỗi nguyên tử Fe đã nhận 4 electron chưa tham gia liên kết từ các phối tử.

a. Phức chất trên có điện tích bằng 0.
b. Nguyên tử trung tâm trong hemoglobin là kim loại chuyển tiếp.
c. Trong phân tử hemoglobin có 4 phối tử.
d. Mỗi nguyên tử Fe đã nhận 4 electron chưa tham gia liên kết từ các phối tử.
Phân tích các phát biểu:
✔️a.Đúng. Hemoglobin là một phân tử trung hòa về điện. Các nhóm chức (-COOH) trong cấu trúc có thể ion hóa, nhưng chúng thường ở trạng thái cân bằng với các ion ngược dấu, khiến phân tử có điện tích tổng bằng không.
✔️b. Đúng. Nguyên tử trung tâm trong hemoglobin là sắt (Fe), một kim loại chuyển tiếp. Sắt đóng vai trò then chốt trong quá trình liên kết và vận chuyển oxygen.
❌c. Sai .Fe liên kết với 4N trong một phân tử hemoglobin hoàn chỉnh, nhưng ở dạng vòng nên tạo 1 phối tử.
❌d.Sai. Mỗi nguyên tử Fe đã nhận 4 cặp electron chưa tham gia liên kết từ các phối tử.
✔️a.Đúng. Hemoglobin là một phân tử trung hòa về điện. Các nhóm chức (-COOH) trong cấu trúc có thể ion hóa, nhưng chúng thường ở trạng thái cân bằng với các ion ngược dấu, khiến phân tử có điện tích tổng bằng không.
✔️b. Đúng. Nguyên tử trung tâm trong hemoglobin là sắt (Fe), một kim loại chuyển tiếp. Sắt đóng vai trò then chốt trong quá trình liên kết và vận chuyển oxygen.
❌c. Sai .Fe liên kết với 4N trong một phân tử hemoglobin hoàn chỉnh, nhưng ở dạng vòng nên tạo 1 phối tử.
❌d.Sai. Mỗi nguyên tử Fe đã nhận 4 cặp electron chưa tham gia liên kết từ các phối tử.
Câu 29 [561099]: Cho hai phức chất A và B có công thức lần lượt sau:
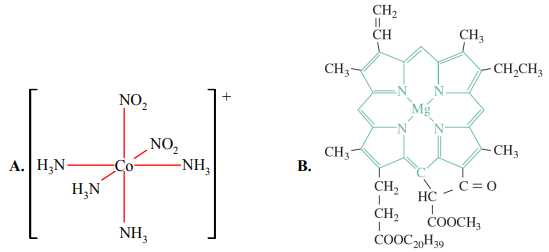
a. Nguyên tử trung tâm của hai phức chất đều là nguyên tố kim loạichuyển tiếp.
b. Trong phức chất B có 4 phối tử.
c. Hai phức chất A và B có dạng hình học khác nhau.
d. Trong A và trong B đều có hai loại phối tử.

a. Nguyên tử trung tâm của hai phức chất đều là nguyên tố kim loạichuyển tiếp.
b. Trong phức chất B có 4 phối tử.
c. Hai phức chất A và B có dạng hình học khác nhau.
d. Trong A và trong B đều có hai loại phối tử.
Phân tích các phát biểu:
❌a. Sai. Mg không phải kim loại chuyển tiếp.
❌b. Sai. Phức chất B có 1 phối tử gắn với 4 nguyên tử nitrogen trong vòng.
✔️c. Đúng. Phức chất A có dạng hình học bát diện, trong khi phức chất B có dạng hình học vuông phẳng.
❌d. Sai. Phức chất A có 2 phối tử NH3 và NO2-, phức chất B có 1 phối tử gắn với 4 N khác nhau.
❌a. Sai. Mg không phải kim loại chuyển tiếp.
❌b. Sai. Phức chất B có 1 phối tử gắn với 4 nguyên tử nitrogen trong vòng.
✔️c. Đúng. Phức chất A có dạng hình học bát diện, trong khi phức chất B có dạng hình học vuông phẳng.
❌d. Sai. Phức chất A có 2 phối tử NH3 và NO2-, phức chất B có 1 phối tử gắn với 4 N khác nhau.
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
Câu 30 [561100]: Mỗi phân tử ethylenediamine  có bao nhiêu cặp electron hoá trị riêng có thể được dùng để tạo phức chất với cation kim loại?
có bao nhiêu cặp electron hoá trị riêng có thể được dùng để tạo phức chất với cation kim loại?
Điền đáp án: ..........
 có bao nhiêu cặp electron hoá trị riêng có thể được dùng để tạo phức chất với cation kim loại?
có bao nhiêu cặp electron hoá trị riêng có thể được dùng để tạo phức chất với cation kim loại?Điền đáp án: ..........
Ethylenediamine (H2N-CH2-CH2-NH2) có hai nhóm amine (-NH2) trong phân tử. Mỗi nhóm amine có một cặp electron chưa liên kết trên nguyên tử nitrogen.
Do đó, mỗi phân tử ethylenediamine có hai cặp electron hóa trị riêng có thể được sử dụng để tạo phức chất với cation kim loại.
Điền đáp án: 2
Do đó, mỗi phân tử ethylenediamine có hai cặp electron hóa trị riêng có thể được sử dụng để tạo phức chất với cation kim loại.
Điền đáp án: 2
Câu 31 [561101]: Khi tạo phức chất, cation Co3+ nhận được 6 cặp electron hoá trị riêng từ các phối tử. Hãy cho biết giá trị n trong công thức 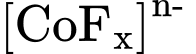 là bao nhiêu.
là bao nhiêu.
Điền đáp án: ..........
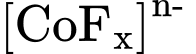 là bao nhiêu.
là bao nhiêu. Điền đáp án: ..........
Công thức của phức chất là [CoFx]n-
Cân bằng điện tích, ta có: 3 + x × (-1) = n
Do phức chất có số phối trí = 6 nên x = 6 => n = -3
Điền đáp án: 3
Cân bằng điện tích, ta có: 3 + x × (-1) = n
Do phức chất có số phối trí = 6 nên x = 6 => n = -3
Điền đáp án: 3
Câu 32 [561102]: Cho phức chất có cấu tạo như hình bên.
Số phối tử có trong phức chất là bao nhiêu?
Điền đáp án: ..........

Số phối tử có trong phức chất là bao nhiêu?
Điền đáp án: ..........
Thành phần của phức chất:
Ion kim loại trung tâm: thường là kim loại chuyển tiếp (Fe, Cu, Co, Ni, Pt...).
Phối tử: có thể là phân tử trung hòa (H2O, NH3, CO) hoặc ion (Cl-,OH-)
Trong phức chất trên, phối tử là H2O => Có 6 phối tử.
Điền đáp án: 6
Ion kim loại trung tâm: thường là kim loại chuyển tiếp (Fe, Cu, Co, Ni, Pt...).
Phối tử: có thể là phân tử trung hòa (H2O, NH3, CO) hoặc ion (Cl-,OH-)
Trong phức chất trên, phối tử là H2O => Có 6 phối tử.
Điền đáp án: 6
Câu 33 [561103]: Hemoglobin là thành phần cấu tạo nên hồng cầu trong các mạch máu. Mỗi phân tử hemoglobin chứa 4 heme B. (Mỗi heme B là phức chất với nguyên tử trung tâm là iron). Heme B kết hợp thêm một phân tử oxygen thông qua đường hô hấp để vận chuyển dưỡng khí đến mô. Mỗi lần đến mô, một phân tử hemoglobin có thể đem đến cho mô tối đa bao nhiêu nguyên tử oxygen?
Điền đáp án: ..........
Điền đáp án: ..........
Mỗi phân tử hemoglobin chứa 4 heme B. Mỗi heme B có thể liên kết với 1 phân tử O2 (gồm 2 nguyên tử oxygen).
Vậy, một phân tử hemoglobin có thể vận chuyển tối đa:
4 × 2 = 8 nguyên tử oxygen
Điền đáp án: 8
Vậy, một phân tử hemoglobin có thể vận chuyển tối đa:
4 × 2 = 8 nguyên tử oxygen
Điền đáp án: 8
Câu 34 [561104]: Số liên kết cộng hoá trị trong phức chất [Ag(NH3)2]OH là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
-Phức chất [Ag(NH3)2]OH bao gồm ion phức [Ag(NH3)2]+ và (OH-)
-Trong ion phức [Ag(NH3)2]+, ion Ag+ là ion kim loại trung tâm, và hai phân tử NH3 là phối tử.
Tổng số liên kết cộng hóa trị:
-Trong hai phân tử NH3: 3 liên kết/phân tử * 2 phân tử = 6 liên kết
-Trong ion OH- : 1 liên kết
- Ag tạo 1 liên kết với N => 2 liên kết
-Tổng cộng: 6 + 1 + 2 = 9 liên kết cộng hóa trị
Điền đáp án: 9
-Trong ion phức [Ag(NH3)2]+, ion Ag+ là ion kim loại trung tâm, và hai phân tử NH3 là phối tử.
Tổng số liên kết cộng hóa trị:
-Trong hai phân tử NH3: 3 liên kết/phân tử * 2 phân tử = 6 liên kết
-Trong ion OH- : 1 liên kết
- Ag tạo 1 liên kết với N => 2 liên kết
-Tổng cộng: 6 + 1 + 2 = 9 liên kết cộng hóa trị
Điền đáp án: 9
Câu 35 [561105]: Theo thuyết liên kết hoá trị, có tối đa bao nhiêu orbital trống của cation Co2+ nhận cặp electron hoá trị để tạo thành phức chất [Co(en)2(OH2)2]2+? Với en là H2NCH2CH2NH2.
Điền đáp án: ..........
Điền đáp án: ..........
- Cobal (Co) có số nguyên tử là 27. Cấu hình electron của Co là [Ar] 3d7 4s2
- Co2+, cấu hình electron sẽ là [Ar] 3d7
Trong phức chất [Co(en)2(OH2)2]2+, ion Co2+ đóng vai trò là ion kim loại trung tâm
- Ion Co2+ có 7 electron trong orbital 3d. Để tạo liên kết với 4 phối tử (2 "en" và 2 H2O), Co2+ cần 6 orbital trống để nhận cặp electron từ các phối tử.
Vậy theo thuyết liên kết hóa trị, có tối đa 6orbital trống của cation Co2+ nhận cặp electron hóa trị để tạo thành phức chất.
Điền đáp án: 6
- Co2+, cấu hình electron sẽ là [Ar] 3d7
Trong phức chất [Co(en)2(OH2)2]2+, ion Co2+ đóng vai trò là ion kim loại trung tâm
- Ion Co2+ có 7 electron trong orbital 3d. Để tạo liên kết với 4 phối tử (2 "en" và 2 H2O), Co2+ cần 6 orbital trống để nhận cặp electron từ các phối tử.
Vậy theo thuyết liên kết hóa trị, có tối đa 6orbital trống của cation Co2+ nhận cặp electron hóa trị để tạo thành phức chất.
Điền đáp án: 6
Câu 36 [561106]: Số oxi hoá của nguyên tử trung tâm trong phức chất (NH4)2[PtCl6] là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
Phức chất (NH4)2[PtCl6] gồm:
2 ion NH4+, mỗi ion có số oxi hóa +1, tổng cộng (+1) × 2 = +2
Ion phức [PtCl6]2- có tổng số oxi hóa -2.
Gọi số oxi hóa của Pt là x, ta có phương trình:
x + 6 × (−1) = −2
⟹ x = +4
Điền đáp án: +4
2 ion NH4+, mỗi ion có số oxi hóa +1, tổng cộng (+1) × 2 = +2
Ion phức [PtCl6]2- có tổng số oxi hóa -2.
Gọi số oxi hóa của Pt là x, ta có phương trình:
x + 6 × (−1) = −2
⟹ x = +4
Điền đáp án: +4
Câu 37 [561107]: Số oxi hoá của nguyên tử trung tâm trong phức chất Na2[CuCl4] là bao nhiêu?
Điền đáp án: ..........
Điền đáp án: ..........
Phức chất Na2[CuCl4] gồm: 2 ion Na+ (mỗi ion có số oxi hóa +1) và Ion phức [CuCl4]2- có tổng số oxi hóa -2.
Gọi số oxi hóa của Cu là x, ta có phương trình:
x + 4 × (−1) = −2 => x = +2.
Điền đáp án: +2
Gọi số oxi hóa của Cu là x, ta có phương trình:
x + 4 × (−1) = −2 => x = +2.
Điền đáp án: +2
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó
THUỐC ĐIỀU TRỊ UNG THƯ CISPLATIN – Pt(NH3)2Cl2
Có nhiều phân tử xuất hiện trong tự nhiên như heme, vitamin B12 và enzyme liên quan đến việc tạo thành liên kết giữa nitrogen với ion kim loại. Các nhà hóa học cũng đã tổng hợp được nhiều hợp chất khác nhau cho mục đích y tế. Một trong số đó, cisplatin [PtCl2(NH3)2], đã được biết đến từ nhiều năm, nhưng nó được phát hiện một cách tình cờ là có hiệu quả trong điều trị một số loại ung thư. Năm 1965, Barnett Rosenberg, nhà vật lý sinh học tại Đại học bang Michigan, bắt đầu nghiên cứu tác động của điện trường lên tế bào sống, nhưng kết quả thí nghiệm của ông rất khác so với mong đợi của ông. Ông và các sinh viên của mình đã đặt một dung dịch huyền phù chứa vi khuẩn Escherichia coli sống trong một điện trường giữa các điện cực được cho là bạch kim Pt trơ. Thật ngạc nhiên, họ phát hiện ra rằng sự phát triển của tế bào bị ảnh hưởng đáng kể. Sau khi thử nghiệm cẩn thận, người ta thấy rằng tác động lên sự phân chia tế bào là do dấu vết của phức chất ion bạch kim, ammonia và chloride được hình thành.
Thuốc trị ung thư cisplatin, Pt(NH3)2Cl2, có thể được điều chế bằng cách cho (NH4)2PtCl4 phản ứng với ammonia trong dung dịch nước. Ngoài cisplatin còn có sản phẩm khác là NH4Cl.
Câu 38 [561108]: Phương trình điều chế cisplatin từ (NH4)2PtCl4 phản ứng với ammonia là
A, (NH4)2PtCl4 + NH3  Pt(NH3)3Cl + NH4Cl.
Pt(NH3)3Cl + NH4Cl.
 Pt(NH3)3Cl + NH4Cl.
Pt(NH3)3Cl + NH4Cl.B, (NH4)2PtCl4 + 3NH3  Pt(NH3)Cl3 + 3NH4Cl.
Pt(NH3)Cl3 + 3NH4Cl.
 Pt(NH3)Cl3 + 3NH4Cl.
Pt(NH3)Cl3 + 3NH4Cl.C, (NH4)2PtCl4 + 2NH3  Pt(NH3)2Cl2 + 2NH4Cl.
Pt(NH3)2Cl2 + 2NH4Cl.
 Pt(NH3)2Cl2 + 2NH4Cl.
Pt(NH3)2Cl2 + 2NH4Cl.D, (NH4)2PtCl4 + 4NH3  PtCl2 + 4NH4Cl.
PtCl2 + 4NH4Cl.
 PtCl2 + 4NH4Cl.
PtCl2 + 4NH4Cl.
Cisplatin có công thức Pt(NH3)2Cl2Pt(NH3)2Cl2, trong đó hai nhóm NH3 và hai nguyên tử Cl nằm ở vị trí cis (gần nhau).
Trong phản ứng, ion Pt2+ (trong (NH4)2PtCl4) phối trí với hai phân tử NH3 và giữ lại hai ion Cl− để tạo phức cis. Các ion NH4+ hình thành từ phản ứng giữa NH3 và (NH4)2PtCl4(NH4)2PtCl4.
Phương trình điều chế cisplatin từ (NH4)2PtCl4 phản ứng với ammonia là:
(NH4)2PtCl4 + 2NH3 Pt(NH3)2Cl2 + 2NH4Cl.
Pt(NH3)2Cl2 + 2NH4Cl.
⇒ Chọn đáp án C Đáp án: C
Trong phản ứng, ion Pt2+ (trong (NH4)2PtCl4) phối trí với hai phân tử NH3 và giữ lại hai ion Cl− để tạo phức cis. Các ion NH4+ hình thành từ phản ứng giữa NH3 và (NH4)2PtCl4(NH4)2PtCl4.
Phương trình điều chế cisplatin từ (NH4)2PtCl4 phản ứng với ammonia là:
(NH4)2PtCl4 + 2NH3
 Pt(NH3)2Cl2 + 2NH4Cl.
Pt(NH3)2Cl2 + 2NH4Cl.⇒ Chọn đáp án C Đáp án: C
Câu 39 [561109]: Để thu được 12,50 g cisplatin cần bao nhiêu gam khối lượng (NH4)2PtCl4? Cho nguyên tử khối của Pt là 195 g/mol.
A, 15,54 g.
B, 29,58 g.
C, 19,40 g.
D, 48,95 g.
(NH4)2PtCl4 + 2NH3 → Pt(NH3)2Cl2 + 2NH4Cl
Số mol của cisplatin là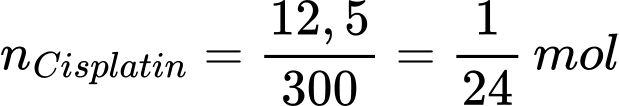
Từ phương trình hóa học số mol của (NH4)2PtCl4 là:
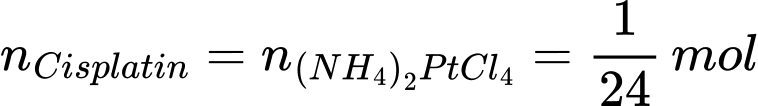
Khối lượng của (NH4)2PtCl4 là:
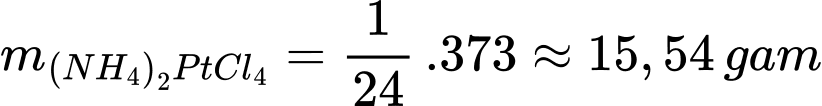
Chọn đáp án A Đáp án: A
Số mol của cisplatin là
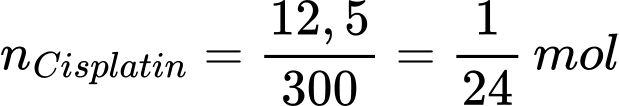
Từ phương trình hóa học số mol của (NH4)2PtCl4 là:
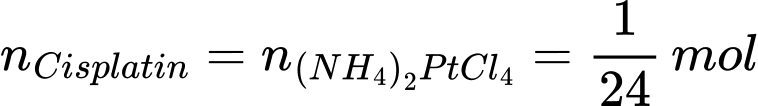
Khối lượng của (NH4)2PtCl4 là:
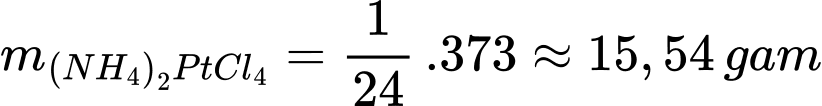
Chọn đáp án A Đáp án: A
Câu 40 [561110]: Cisplatin có thể phản ứng với hợp chất hữu cơ pyridine, C5H5N, để tạo thành hợp chất mới:
Pt(NH3)2Cl2(aq) + xC5H5N(aq) Pt(NH3)2Cl2(C5H5N)x(s)
Pt(NH3)2Cl2(C5H5N)x(s)
Giả sử bạn xử lý 0,150 g cisplatin với lượng mà bạn cho là dư thừa pyridine lỏng (1,50 mL; d=0,979 g/mL). Khi phản ứng hoàn tất, bạn có thể biết lượng pyridine chưa được sử dụng bằng cách chuẩn độ dung dịch bằng HCl đã chuẩn hóa. Nếu cần 37,0 mL dung dịch HCl 0,475 M để chuẩn độ lượng pyridine dư:
C5H5N(aq) + HCl(aq) C5H5NH+(aq) + Cl–(aq)
C5H5NH+(aq) + Cl–(aq)
Công thức của hợp chất chưa biết Pt(NH3)2Cl2(C5H5N)x là gì?
Pt(NH3)2Cl2(aq) + xC5H5N(aq)
 Pt(NH3)2Cl2(C5H5N)x(s)
Pt(NH3)2Cl2(C5H5N)x(s)Giả sử bạn xử lý 0,150 g cisplatin với lượng mà bạn cho là dư thừa pyridine lỏng (1,50 mL; d=0,979 g/mL). Khi phản ứng hoàn tất, bạn có thể biết lượng pyridine chưa được sử dụng bằng cách chuẩn độ dung dịch bằng HCl đã chuẩn hóa. Nếu cần 37,0 mL dung dịch HCl 0,475 M để chuẩn độ lượng pyridine dư:
C5H5N(aq) + HCl(aq)
 C5H5NH+(aq) + Cl–(aq)
C5H5NH+(aq) + Cl–(aq)Công thức của hợp chất chưa biết Pt(NH3)2Cl2(C5H5N)x là gì?
A, 1.
B, 2.
C, 3.
D, 4.
(1) Pt(NH3)2Cl2(aq) + xC5H5N(aq) → Pt(NH3)2Cl2(C5H5N)x(s)
(2) C5H5N(aq) + HCl(aq) → C5H5NH+(aq) + Cl–(aq)
Đổi 37 mL = 0,037 L
Khối lượng của pyridine là:
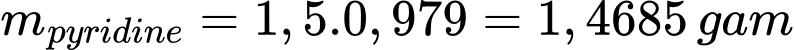
Số mol ban đầu của pyridine là:
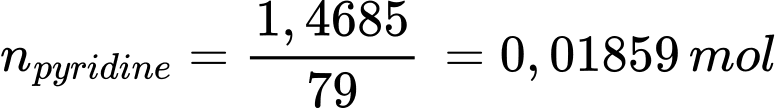
Số mol của HCl phản ứng với pyridine dư là:
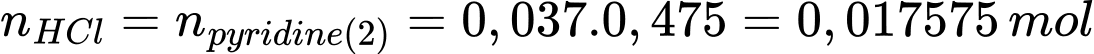
Số mol pyridine phản ứng với cisplatin là:
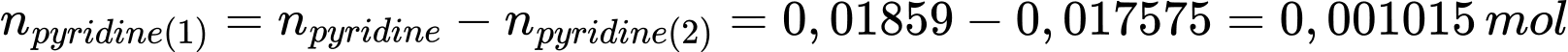
Số mol của cisplatin là:
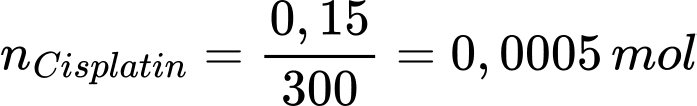
Tỉ lệ mol của pyridine với cisplatin là:
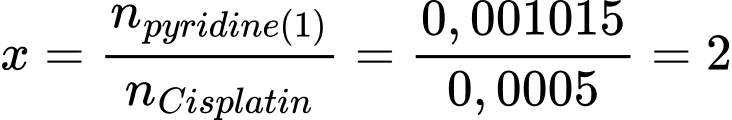
Chọn đáp án B Đáp án: B
(2) C5H5N(aq) + HCl(aq) → C5H5NH+(aq) + Cl–(aq)
Đổi 37 mL = 0,037 L
Khối lượng của pyridine là:
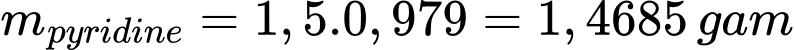
Số mol ban đầu của pyridine là:
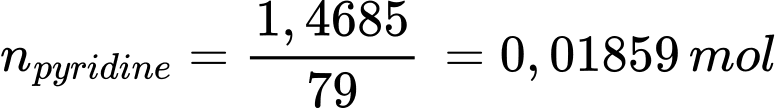
Số mol của HCl phản ứng với pyridine dư là:
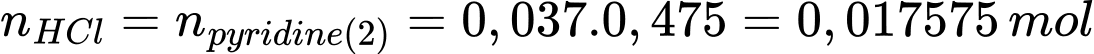
Số mol pyridine phản ứng với cisplatin là:
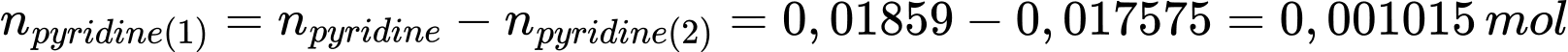
Số mol của cisplatin là:
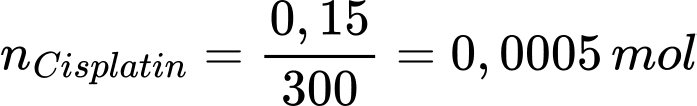
Tỉ lệ mol của pyridine với cisplatin là:
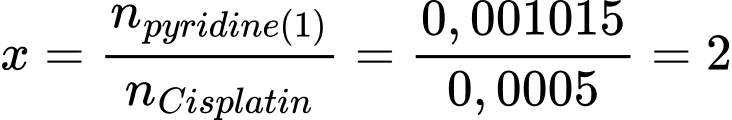
Chọn đáp án B Đáp án: B