Dạng 1: TRẮC NGHIỆM KHÁCH QUAN: mỗi câu hỏi chỉ có một đáp án đúng.
Câu 1 [561111]: Biết rằng phức chất aqua của ion Mn2+ có dạng hình học bát diện. Công thức hoá học các phức chất là
A, [Mn(OH2)6]2+.
B, [Mn(OH2)6]3+.
C, [Mn(OH2)4]2+.
D, [Mn(OH2)4]3+.
Mn2+ là ion trung tâm.
H2O là phối tử trung tính.
Số phối trí là 6, tạo cấu trúc bát diện.
Công thức của phức là: [Mn(OH2)6]2+.
⇒ Chọn đáp án A Đáp án: A
H2O là phối tử trung tính.
Số phối trí là 6, tạo cấu trúc bát diện.
Công thức của phức là: [Mn(OH2)6]2+.
⇒ Chọn đáp án A Đáp án: A
Câu 2 [561112]: Biết rằng phức chất aqua của ion Co2+ có dạng hình học bát diện. Công thức hoá học các phức chất là
A, [Co(OH2)6]2+.
B, [Co(OH2)6]3+.
C, [Co(OH2)4]2+.
D, [Co(OH2)4]3+.
Co2+ là ion trung tâm.
H2O là phối tử trung tính.
Số phối trí là 6, tạo cấu trúc bát diện.
Công thức của phức là: [Co(OH2)6]2+.
⇒ Chọn đáp án A Đáp án: A
H2O là phối tử trung tính.
Số phối trí là 6, tạo cấu trúc bát diện.
Công thức của phức là: [Co(OH2)6]2+.
⇒ Chọn đáp án A Đáp án: A
Câu 3 [561113]: Phức chất aqua có dạng hình học bát diện được hình thành khi cho CrCl3 vào nước. Phương trình hoá học của quá trình tạo phức chất trên là
A, Cr3+(aq) + 4H2O(l) 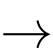 [Cr(OH2)4]3+(aq).
[Cr(OH2)4]3+(aq).
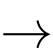 [Cr(OH2)4]3+(aq).
[Cr(OH2)4]3+(aq).B, Cr3+(aq) + 6H2O(l) 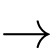 [Cr(OH2)6]3+(aq).
[Cr(OH2)6]3+(aq).
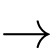 [Cr(OH2)6]3+(aq).
[Cr(OH2)6]3+(aq).C, Cr2+(aq) + 6H2O(l) 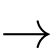 [Cr(OH2)6]2+(aq).
[Cr(OH2)6]2+(aq).
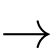 [Cr(OH2)6]2+(aq).
[Cr(OH2)6]2+(aq).D, Cr3+(aq) + 6H2O(l) 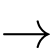 [Cr(OH2)6]2+(aq).
[Cr(OH2)6]2+(aq).
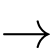 [Cr(OH2)6]2+(aq).
[Cr(OH2)6]2+(aq).
Phương trình xảy ra:
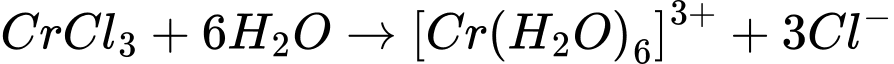
Vậy phương trình rút gọn:
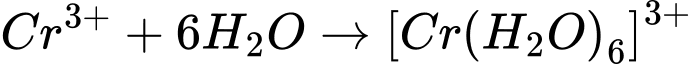
Chọn đáp án B Đáp án: B
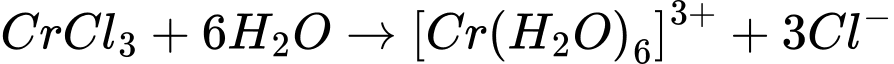
Vậy phương trình rút gọn:
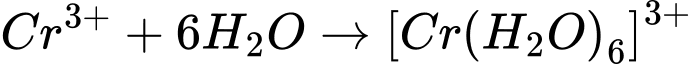
Chọn đáp án B Đáp án: B
Câu 4 [561114]: Quan sát hình sau:

CuSO4 khan có màu trắng nhưng khi hòa tan vào trong nước, do có phức chất [Cu(OH2)6]2+ nên dung dịch có màu xanh lam. Dấu hiệu nào quan sát được cho biết đã có phức chất hình thành?

CuSO4 khan có màu trắng nhưng khi hòa tan vào trong nước, do có phức chất [Cu(OH2)6]2+ nên dung dịch có màu xanh lam. Dấu hiệu nào quan sát được cho biết đã có phức chất hình thành?
A, Có sự đổi màu.
B, CuSO4 khan có màu trắng.
C, Có khí xuất hiện.
D, Có kết tủa xuất hiện.
CuSO4 khan có màu trắng nhưng khi hòa tan vào trong nước, do có phức chất [Cu(OH2)6]2+ nên dung dịch có màu xanh lam.
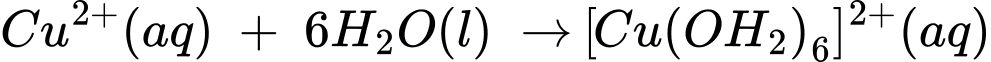
⇒ Chọn đáp án A Đáp án: A
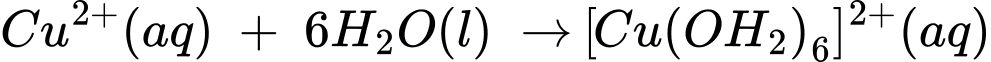
⇒ Chọn đáp án A Đáp án: A
Câu 5 [561115]: Có 3 ống nghiệm riêng biệt, mỗi ống nghiệm đựng dung dịch của một trong các phức chất sau: [Ag(NH3)2]+, [Cu(OH2)6]2+, [Cu(NH3)4(OH2)2]2+ và được đánh số ngẫu nhiên. Màu sắc của các ống nghiệm được ghi dưới đây:

Nhận định nào sau đây là đúng?

Nhận định nào sau đây là đúng?
A, Ống nghiệm (1) chứa phức chất [Cu(NH3)4(OH2)2]2+.
B, Phức chất trong ống nghiệm (3) chứa nguyên tử trung tâm có số oxi hóa +2.
C, Phức chất trong ống nghiệm (1) có dạng bát diện.
D, Phức chất trong ống nghiệm (1) và (3) chứa cùng loại phối tử.
Ống nghiệm (1) có màu xanh nhạt → chứa [Cu(OH2)6]2+
Ống nghiệm (2) có màu xanh lam đậm → chứa [Cu(NH3)4(OH2)2]2+
Ống nghiệm (3) không màu → chứa [Ag(NH3)2]+
❌A. Sai, vì ống nghiệm (1) chứa [Cu(OH2)6]2+, không phải [Cu(NH3)4(OH2)2]2+
❌B. Sai, vì phức [Ag(NH3)2]+ trong ống (3) có Ag với số oxi hóa +1, không phải +2.
✔️C. Đúng. Phức trong ống (1) tồn tại ở dạng ML6, dạng bát diện.
❌D. Sai, vì phức trong ống (1) chứa phối tử H2O, còn ống (3) chứa NH3
⇒ Chọn đáp án C Đáp án: C
Ống nghiệm (2) có màu xanh lam đậm → chứa [Cu(NH3)4(OH2)2]2+
Ống nghiệm (3) không màu → chứa [Ag(NH3)2]+
❌A. Sai, vì ống nghiệm (1) chứa [Cu(OH2)6]2+, không phải [Cu(NH3)4(OH2)2]2+
❌B. Sai, vì phức [Ag(NH3)2]+ trong ống (3) có Ag với số oxi hóa +1, không phải +2.
✔️C. Đúng. Phức trong ống (1) tồn tại ở dạng ML6, dạng bát diện.
❌D. Sai, vì phức trong ống (1) chứa phối tử H2O, còn ống (3) chứa NH3
⇒ Chọn đáp án C Đáp án: C
Câu 6 [561116]: Phương trình hoá học của phản ứng xảy ra khi hoà tan kết tủa Cu(OH)2 bằng dung dịch ammonia là
A, Cu(OH)2(s) + 4NH3(aq)  [Cu(NH3)4](OH)2(aq).
[Cu(NH3)4](OH)2(aq).
 [Cu(NH3)4](OH)2(aq).
[Cu(NH3)4](OH)2(aq).B, Cu(OH)2(s) + 6NH3(aq)  [Cu(NH3)6](OH)2(aq).
[Cu(NH3)6](OH)2(aq).
 [Cu(NH3)6](OH)2(aq).
[Cu(NH3)6](OH)2(aq).C, Cu(OH)2(aq) + 4NH3(aq)  [Cu(NH3)4](OH)2(s).
[Cu(NH3)4](OH)2(s).
 [Cu(NH3)4](OH)2(s).
[Cu(NH3)4](OH)2(s).D, [Cu(OH2)4]2+(aq) + 4NH3(aq)  [Cu(NH3)4]2+(aq) + 4H2O(l).
[Cu(NH3)4]2+(aq) + 4H2O(l).
 [Cu(NH3)4]2+(aq) + 4H2O(l).
[Cu(NH3)4]2+(aq) + 4H2O(l).
Cu(OH)2 là kết tủa màu xanh lam, không tan trong nước.
Khi cho NH3 dư vào, ion Cu2+ tạo phức với NH3 thành ([Cu(NH3)4]2+)làm kết tủa tan dần.
Dung dịch thu được có màu xanh đậm đặc trưng của phức [Cu(NH3)4]2+
PT: Cu(OH)2(s) + 4NH3(aq) [Cu(NH3)4](OH)2(aq).
[Cu(NH3)4](OH)2(aq).
Chọn đáp án A
Đáp án: A
Khi cho NH3 dư vào, ion Cu2+ tạo phức với NH3 thành ([Cu(NH3)4]2+)làm kết tủa tan dần.
Dung dịch thu được có màu xanh đậm đặc trưng của phức [Cu(NH3)4]2+
PT: Cu(OH)2(s) + 4NH3(aq)
 [Cu(NH3)4](OH)2(aq).
[Cu(NH3)4](OH)2(aq).Chọn đáp án A
Đáp án: A
Câu 7 [561117]: Phối tử thay thế và phối tử bị thay thế trong phương trình sau lần lượt là
[Ni(OH2)6]2+(aq) + 6NH3(aq) [Ni(NH3)6]2+(aq) + 6H2O(l)
[Ni(NH3)6]2+(aq) + 6H2O(l)
[Ni(OH2)6]2+(aq) + 6NH3(aq)
 [Ni(NH3)6]2+(aq) + 6H2O(l)
[Ni(NH3)6]2+(aq) + 6H2O(l) A, H2O và NH3.
B, NH3 và H2O.
C, [Ni(OH2)6]2+ và [Ni(NH3)6]2+.
D, [Ni(OH2)6]2+ và NH3.
[Ni(OH2)6]2+(aq) + 6NH3(aq) ⟶ [Ni(NH3)6]2+(aq) + 6H2O(l)
Ở Pt trên, H2O trong [Ni(OH2)6]2+ đã bị thay thế bởi NH3 để tạo thành phức [Ni(NH3)6]2+ Vây phối tử thay thế là NH3 và phối tử bị thay thế là H2O.
⇒ Chọn đáp án B Đáp án: B
Ở Pt trên, H2O trong [Ni(OH2)6]2+ đã bị thay thế bởi NH3 để tạo thành phức [Ni(NH3)6]2+ Vây phối tử thay thế là NH3 và phối tử bị thay thế là H2O.
⇒ Chọn đáp án B Đáp án: B
Câu 8 [561118]: Phối tử thay thế và phối tử bị thay thế trong phương trình sau lần lượt là
[PtCl4]2–(aq) + 2NH3(aq) [PtCl2(NH3)2](s) + 2Cl–(aq)
[PtCl2(NH3)2](s) + 2Cl–(aq)
[PtCl4]2–(aq) + 2NH3(aq)
 [PtCl2(NH3)2](s) + 2Cl–(aq)
[PtCl2(NH3)2](s) + 2Cl–(aq) A, Cl– và NH3.
B, NH3 và Cl–.
C, [PtCl4]2– và [PtCl2(NH3)2].
D, [PtCl4]2– và NH3.
[PtCl4]2–(aq) + 2NH3(aq) ⟶ [PtCl2(NH3)2](s) + 2Cl–(aq)
Ở Pt trên, Cl - trong [PtCl4]2– đã bị thay thế bởi NH3 để tạo thành phức [PtCl2(NH3)2]
Vây phối tử thay thế là NH3 và phối tử bị thay thế là Cl -
⇒ Chọn đáp án B Đáp án: B
Ở Pt trên, Cl - trong [PtCl4]2– đã bị thay thế bởi NH3 để tạo thành phức [PtCl2(NH3)2]
Vây phối tử thay thế là NH3 và phối tử bị thay thế là Cl -
⇒ Chọn đáp án B Đáp án: B
Câu 9 [561119]: Cho phản ứng dưới đây:
NiCl2(s) + X(l) [Ni(OH2)6]2+(aq) + Y(aq)
[Ni(OH2)6]2+(aq) + Y(aq)
Phối tử thay thế X có thể là
NiCl2(s) + X(l)
 [Ni(OH2)6]2+(aq) + Y(aq)
[Ni(OH2)6]2+(aq) + Y(aq)Phối tử thay thế X có thể là
A, H2O.
B, NH3.
C, Cl–.
D, O2.
Chất tạo thành là [Ni(OH2)6]2+, tức là ion Ni2+ trong dung dịch đã tạo phức với phối tử H2O (aqua).Điều này cho thấy NiCl2 đã hòa tan và các ion Cl- bị thay thế bởi H2O để tạo thành phức.
NiCl2 + 6H2O ⟶ [Ni(OH2)6]2+ + 2Cl-
⇒ Chọn đáp án A Đáp án: A
NiCl2 + 6H2O ⟶ [Ni(OH2)6]2+ + 2Cl-
⇒ Chọn đáp án A Đáp án: A
Câu 10 [561120]: Trong phản ứng thuận nghịch dưới đây:
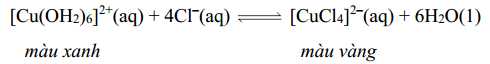
Việc tăng nồng độ Cl–(aq) ảnh hưởng thế nào đến sự thay đổi màu của dung dịch?
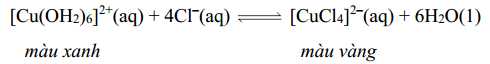
Việc tăng nồng độ Cl–(aq) ảnh hưởng thế nào đến sự thay đổi màu của dung dịch?
A, Màu của dung dịch có xu hướng chuyển sang màu xanh.
B, Màu của dung dịch có xu hướng chuyển sang màu vàng.
C, Màu của dung dịch có xu hướng chuyển sang màu đỏ.
D, Màu của dung dịch có xu hướng chuyển sang màu hồng.
Theo nguyên lí chuyển dịch cân bằng, khi tăng nồng độ Cl- thì cân bằng sẽ chuyển dịch theo chiều giảm nồng độ Cl- (chiều thuận), nên dung dịch sẽ chuyển từ màu xanh sang màu vàng.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 11 [561121]: Phản ứng nào dưới đây không phải là phản ứng thay thế phối tử trong phức chất?
A, [Co(OH2)6]3+(aq) + 6NH3(aq)  [Co(NH3)6]3+(aq) + 6H2O(l).
[Co(NH3)6]3+(aq) + 6H2O(l).
 [Co(NH3)6]3+(aq) + 6H2O(l).
[Co(NH3)6]3+(aq) + 6H2O(l).B, 2Na[Au(CN)2](aq) + Zn(s)  Na2[Zn(CN)4](aq) + 2Au(s).
Na2[Zn(CN)4](aq) + 2Au(s).
 Na2[Zn(CN)4](aq) + 2Au(s).
Na2[Zn(CN)4](aq) + 2Au(s).C, [Co(OH2)6]2+(aq) + 4Cl–(aq)  [CoCl4]2–(aq) + 6H2O(l).
[CoCl4]2–(aq) + 6H2O(l).
 [CoCl4]2–(aq) + 6H2O(l).
[CoCl4]2–(aq) + 6H2O(l).D, [PtCl4]2–(aq) + 2NH3(aq)  [PtCl2(NH3)2](s) + 2Cl–(aq).
[PtCl2(NH3)2](s) + 2Cl–(aq).
 [PtCl2(NH3)2](s) + 2Cl–(aq).
[PtCl2(NH3)2](s) + 2Cl–(aq).
Phản ứng thay thế phối tử là phản ứng trong đó các phối tử xung quanh ion trung tâm bị thay thế bởi phối tử khác.
Ở phương trình B: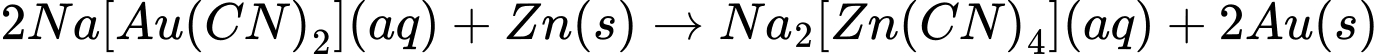
Đây là phản ứng oxi hóa - khử, trong đó Au bị khử từ ion phức xuống kim loại Au và Zn bị oxi hóa thành ion phức.
Chọn đáp án B Đáp án: B
Ở phương trình B:
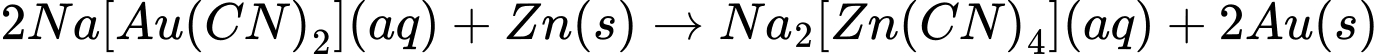
Đây là phản ứng oxi hóa - khử, trong đó Au bị khử từ ion phức xuống kim loại Au và Zn bị oxi hóa thành ion phức.
Chọn đáp án B Đáp án: B
Dạng 2: TRẮC NGHIỆM ĐÚNG SAI – mỗi ý a), b), c), d) chọn đúng hoặc sai.
Câu 12 [561122]: Khi hoà tan hợp chất AgNO3 vào nước thì thu được dung dịch chứa phức chất tứ diện [Ag(OH2)m]+(aq).
a. Phức chất có điện tích là +1.
b. Phức chất trên được hình thành từ quá trình cation Ag+(aq) nhận cáccặp electron hoá trị riêng từ các phân tử nước.
c. Giá trị của m là 6.
d. Phức chất [Ag(OH2)m]+(aq) kém bền hơn cation Ag+(aq).
a. Phức chất có điện tích là +1.
b. Phức chất trên được hình thành từ quá trình cation Ag+(aq) nhận cáccặp electron hoá trị riêng từ các phân tử nước.
c. Giá trị của m là 6.
d. Phức chất [Ag(OH2)m]+(aq) kém bền hơn cation Ag+(aq).
Phân tích các phát biểu:
✔️a. Đúng. Vì ion Ag+ có điện tích +1 và nước là phối tử trung hòa về điện tích, nên phức chất vẫn giữ điện tích +1.
✔️b. Đúng. Ag+ có lớp vỏ electron d⁹ nên có thể nhận cặp electron từ các phân tử nước (H2O), tạo thành phức chất phối trí.
❌c. Sai. Trong dung dịch nước, Ag+ thường tạo phức tứ diện (m = 4), không phải bát diện (m = 6) như các ion chuyển tiếp khác (ví dụ Cu2+).
❌d. Sai. Thực tế, phức chất này bền hơn ion Ag+ tự do do sự hình thành liên kết phối trí giữa Ag+ và H2O, giúp ổn định ion bạc trong dung dịch.
✔️a. Đúng. Vì ion Ag+ có điện tích +1 và nước là phối tử trung hòa về điện tích, nên phức chất vẫn giữ điện tích +1.
✔️b. Đúng. Ag+ có lớp vỏ electron d⁹ nên có thể nhận cặp electron từ các phân tử nước (H2O), tạo thành phức chất phối trí.
❌c. Sai. Trong dung dịch nước, Ag+ thường tạo phức tứ diện (m = 4), không phải bát diện (m = 6) như các ion chuyển tiếp khác (ví dụ Cu2+).
❌d. Sai. Thực tế, phức chất này bền hơn ion Ag+ tự do do sự hình thành liên kết phối trí giữa Ag+ và H2O, giúp ổn định ion bạc trong dung dịch.
Câu 13 [561123]: Hòa tan phèn nhôm có công thức K2SO4.Al2(SO4)3.24H2O vào nước một phần phức chất aqua chuyển thành phức chất không tan theo phương trình hoá học sau:
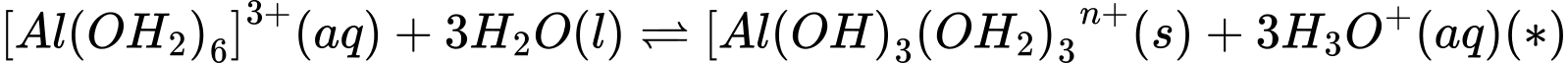
a. Chỉ có nguyên tố chuyển tiếp mới tạo được phức chất aqua.
b. Giá trị n ở phức chất trong cân bằng (*) là 1.
c. Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai tròbase theo Brønsted - Lowry.
d. Trong thực tế, sự hình thành phức chất từ phản ứng thuận của cân bằng(*) giúp giải thích ứng dụng làm trong nước của phèn nhôm.
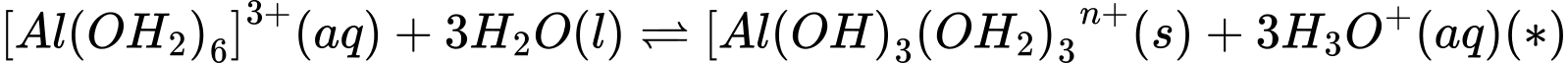
a. Chỉ có nguyên tố chuyển tiếp mới tạo được phức chất aqua.
b. Giá trị n ở phức chất trong cân bằng (*) là 1.
c. Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai tròbase theo Brønsted - Lowry.
d. Trong thực tế, sự hình thành phức chất từ phản ứng thuận của cân bằng(*) giúp giải thích ứng dụng làm trong nước của phèn nhôm.
Phân tích các phát biểu:
❌a. Sai. Không chỉ nguyên tố chuyển tiếp mới tạo được phức chất aqua. (Al) không phải nguyên tố chuyển tiếp nhưng vẫn có thể tạo phức [Al(H2O)6]3+
❌b. Sai. Trong phức chất [Al(OH)3(H2O)3]n+ khi Al(OH)3 kết tủa, Al thường ở trạng thái trung hòa về điện tích, tức là n=0
❌c. Sai. Theo lý thuyết Brønsted-Lowry, base là chất nhận proton. Trong phản ứng thuận của cân bằng (*), phức chất [Al(H2O)6]3+ nhường proton (H3O+ sinh ra), nên nó đóng vai trò là acid chứ không phải base.
✔️d. Đúng. Phản ứng thuận tạo ra kết tủa Al(OH)3 , giúp keo tụ các tạp chất trong nước, làm trong nước. Đây chính là ứng dụng của phèn nhôm trong xử lý nước.
❌a. Sai. Không chỉ nguyên tố chuyển tiếp mới tạo được phức chất aqua. (Al) không phải nguyên tố chuyển tiếp nhưng vẫn có thể tạo phức [Al(H2O)6]3+
❌b. Sai. Trong phức chất [Al(OH)3(H2O)3]n+ khi Al(OH)3 kết tủa, Al thường ở trạng thái trung hòa về điện tích, tức là n=0
❌c. Sai. Theo lý thuyết Brønsted-Lowry, base là chất nhận proton. Trong phản ứng thuận của cân bằng (*), phức chất [Al(H2O)6]3+ nhường proton (H3O+ sinh ra), nên nó đóng vai trò là acid chứ không phải base.
✔️d. Đúng. Phản ứng thuận tạo ra kết tủa Al(OH)3 , giúp keo tụ các tạp chất trong nước, làm trong nước. Đây chính là ứng dụng của phèn nhôm trong xử lý nước.
Câu 14 [561124]: Một mẫu nước có chứa các ion Ca2+, [Cu(OH2)6]2+, [Fe(OH2)6]2+, Na+, Сl–, SO42–. Sau một thời gian tiếp xúc với không khí, mẫu nước này chuyển sang màu vàng và nổi váng màu nâu.
a. Mẫu nước trên có pH lớn hơn 7.
b. Ion bị oxi hoá và gây nên hiện tượng trên là [Fe(OH2)6]2+.
c. Trong nước, ion H+nhận cặp electron từ H2O để tạo thành ion H2O.
d. Chất màu nâu sinh trong mô tả trên là phức chất có công thức là[Fe(OH)2(OH2)4].
a. Mẫu nước trên có pH lớn hơn 7.
b. Ion bị oxi hoá và gây nên hiện tượng trên là [Fe(OH2)6]2+.
c. Trong nước, ion H+nhận cặp electron từ H2O để tạo thành ion H2O.
d. Chất màu nâu sinh trong mô tả trên là phức chất có công thức là[Fe(OH)2(OH2)4].
Hiện tượng mẫu nước chuyển màu vàng và nổi váng nâu sau một thời gian tiếp xúc với không khí được gây ra bởi sự oxi hóa ion Fe2+ có trong mẫu nước.
Ion Fe2+ bị oxi hóa, tồn tại trong nước dưới dạng phức chất [Fe(OH2)6]2+
Khi tiếp xúc với không khí, oxy (O2) sẽ oxi hóa Fe2+ thành Fe3+:
4[Fe(OH2)6]2+ + O2 + 4H+ → 4[Fe(OH2)6]3+ + 2H2O
Chất màu nâu:
Ion Fe3+ tạo thành sẽ kết tủa với các ion (OH-) trong nước để tạo thành Fe(OH)3, chất này có màu nâu:
[Fe(OH2)6]3+ + 3OH- → Fe(OH)3↓ + 6H2O
Fe(OH)3 là chất rắn màu nâu, không tan trong nước, tạo thành váng trên bề mặt nước.
Môi trường:
Phản ứng oxi hóa Fe2+ xảy ra nhanh hơn trong môi trường acid (pH <7). Do đó, mẫu nước có pH lớn hơn 7 sẽ thúc đẩy quá trình này.
Phân tích các phát biểu:
❌a Sai: Mẫu nước có pH nhỏ hơn 7.
✔️b Đúng: Ion Fe2+ bị oxi hóa và gây nên hiện tượng trên.
❌c Sai: Trong nước, ion H+ không nhận cặp electron từ H2O. Thực tế, H2O đóng vai trò là bazơ, nhận proton (H+) từ các chất khác.
❌d Sai: Chất màu nâu sinh ra là Fe(OH)3, không phải là phức chất [Fe(OH)2(OH2)4].
Ion Fe2+ bị oxi hóa, tồn tại trong nước dưới dạng phức chất [Fe(OH2)6]2+
Khi tiếp xúc với không khí, oxy (O2) sẽ oxi hóa Fe2+ thành Fe3+:
4[Fe(OH2)6]2+ + O2 + 4H+ → 4[Fe(OH2)6]3+ + 2H2O
Chất màu nâu:
Ion Fe3+ tạo thành sẽ kết tủa với các ion (OH-) trong nước để tạo thành Fe(OH)3, chất này có màu nâu:
[Fe(OH2)6]3+ + 3OH- → Fe(OH)3↓ + 6H2O
Fe(OH)3 là chất rắn màu nâu, không tan trong nước, tạo thành váng trên bề mặt nước.
Môi trường:
Phản ứng oxi hóa Fe2+ xảy ra nhanh hơn trong môi trường acid (pH <7). Do đó, mẫu nước có pH lớn hơn 7 sẽ thúc đẩy quá trình này.
Phân tích các phát biểu:
❌a Sai: Mẫu nước có pH nhỏ hơn 7.
✔️b Đúng: Ion Fe2+ bị oxi hóa và gây nên hiện tượng trên.
❌c Sai: Trong nước, ion H+ không nhận cặp electron từ H2O. Thực tế, H2O đóng vai trò là bazơ, nhận proton (H+) từ các chất khác.
❌d Sai: Chất màu nâu sinh ra là Fe(OH)3, không phải là phức chất [Fe(OH)2(OH2)4].
Câu 15 [561125]: Hoà tan lượng nhỏ hợp chất iron(III) sulfate vào ống nghiệm chứa nước thu được dung dịch màu vàng nâu. Sau một thời gian, xuất hiện phức chất không tan màu nâu trong ống nghiệm. Phức chất này được hình thành từ quá trình sau:
[Fe(OH2)6]3+(aq) + 3H2O(l) [Fe(OH)3(OH2)3](s) + 3H3O+(aq)
[Fe(OH)3(OH2)3](s) + 3H3O+(aq)
a. Phản ứng trên là phản ứng giữa acid và base theo quan điểm của Brønsted - Lowry.
b. Phần dung dịch trong ống nghiệm có pH > 7.
c. Trong nước, iron(III) sulfate là hợp chất bền.
d. Nếu hoà tan iron(III) sulfate trong ống nghiệm chứa nước và vài giọt dung dịch sulfuric acid loãng thì hạn chế được hiện tượng xuất hiện kết tủa màu nâu.
[Fe(OH2)6]3+(aq) + 3H2O(l)
 [Fe(OH)3(OH2)3](s) + 3H3O+(aq)
[Fe(OH)3(OH2)3](s) + 3H3O+(aq)a. Phản ứng trên là phản ứng giữa acid và base theo quan điểm của Brønsted - Lowry.
b. Phần dung dịch trong ống nghiệm có pH > 7.
c. Trong nước, iron(III) sulfate là hợp chất bền.
d. Nếu hoà tan iron(III) sulfate trong ống nghiệm chứa nước và vài giọt dung dịch sulfuric acid loãng thì hạn chế được hiện tượng xuất hiện kết tủa màu nâu.
Khi hòa tan (Fe2(SO4)3) vào nước, ion Fe3+ sẽ tồn tại dưới dạng phức chất [Fe(OH2)6]3+. Phức chất này có tính axit yếu, có khả năng thủy phân trong nước:
[Fe(OH2)6]3+(aq) + H2O(l) ⟶ Fe(OH)3(OH2)3 + 3H3O+(aq)
Phản ứng này tạo ra kết tủa Fe(OH)3 màu nâu, làm dung dịch có màu vàng nâu và sau một thời gian sẽ xuất hiện kết tủa màu nâu trong ống nghiệm.
Phân tích các phát biểu
✔️a. Đúng: Phản ứng trên là phản ứng giữa acid và base theo Brønsted - Lowry.
[Fe(OH2)6]3+ đóng vai trò là acid, nhường proton (H+) cho H2O. H2O đóng vai trò là base, nhận proton (H+) từ[Fe(OH2)6]3+.
❌b. Sai: Dung dịch trong ống nghiệm có pH < 7.
Phản ứng thủy phân tạo ra H3O+, làm tăng tính axit của dung dịch.
❌c. Sai: Iron(III) sulfate không bền trong nước, nó bị thủy phân tạo ra kết tủa Fe(OH)3.
✔️d. Đúng: Nếu hòa tan iron(III) sulfate trong ống nghiệm chứa nước và vài giọt dung dịch acid loãng, hiện tượng xuất hiện kết tủa màu nâu sẽ hạn chế. Sulfuric acid (H2SO4) là một acid mạnh, khi hòa tan vào nước sẽ làm tăng nồng độ H3O+ trong dung dịch.
Khi tăng nồng độ H3O+, cân bằng của phản ứng thủy phân sẽ dịch chuyển theo chiều nghịch, làm giảm lượng kết tủa Fe(OH)3 được tạo thành.
[Fe(OH2)6]3+(aq) + H2O(l) ⟶ Fe(OH)3(OH2)3 + 3H3O+(aq)
Phản ứng này tạo ra kết tủa Fe(OH)3 màu nâu, làm dung dịch có màu vàng nâu và sau một thời gian sẽ xuất hiện kết tủa màu nâu trong ống nghiệm.
Phân tích các phát biểu
✔️a. Đúng: Phản ứng trên là phản ứng giữa acid và base theo Brønsted - Lowry.
[Fe(OH2)6]3+ đóng vai trò là acid, nhường proton (H+) cho H2O. H2O đóng vai trò là base, nhận proton (H+) từ[Fe(OH2)6]3+.
❌b. Sai: Dung dịch trong ống nghiệm có pH < 7.
Phản ứng thủy phân tạo ra H3O+, làm tăng tính axit của dung dịch.
❌c. Sai: Iron(III) sulfate không bền trong nước, nó bị thủy phân tạo ra kết tủa Fe(OH)3.
✔️d. Đúng: Nếu hòa tan iron(III) sulfate trong ống nghiệm chứa nước và vài giọt dung dịch acid loãng, hiện tượng xuất hiện kết tủa màu nâu sẽ hạn chế. Sulfuric acid (H2SO4) là một acid mạnh, khi hòa tan vào nước sẽ làm tăng nồng độ H3O+ trong dung dịch.
Khi tăng nồng độ H3O+, cân bằng của phản ứng thủy phân sẽ dịch chuyển theo chiều nghịch, làm giảm lượng kết tủa Fe(OH)3 được tạo thành.
Câu 16 [561126]: Khi cho dung dịch sodium choride bão hoà đến dư vào dung dịch copper(II) sulfate loãng, chỉ thấy dấu hiệu nhạt màu, không thấy dấu hiệu dung dịch chuyển sang màu khác. Tương tự, nếu tiến hành thí nghiệm cho dung dịch hydrochloric acid và dung dịch copper(II) sulfate cũng giúp tìm hiểu khả năng phản ứng giữa chúng.
a. Thí nghiệm được tiến hành bằng cách cho từ từ đến dư dung dịchhydrochloric acid loãng vào dung dịch copper(II) sulfate đặc.
b. Nếu dung dịch chuyển từ màu này sang màu khác thì đề xuất rằng giữadung dịch copper(II) sulfate và dung dịch hydrochloric acid có phản ứnghình thành phức chất.
c. Khả năng thay thế phối tử trong phức chất [Cu(OH2)6]2+không phụthuộc vào nồng độ của anion Cl–trong dung dịch mà phụ thuộc vào tínhacid mạnh của hydrochloric acid.
d. Dung dịch phản ứng chuyển từ màu xanh sang màu vàng.
a. Thí nghiệm được tiến hành bằng cách cho từ từ đến dư dung dịchhydrochloric acid loãng vào dung dịch copper(II) sulfate đặc.
b. Nếu dung dịch chuyển từ màu này sang màu khác thì đề xuất rằng giữadung dịch copper(II) sulfate và dung dịch hydrochloric acid có phản ứnghình thành phức chất.
c. Khả năng thay thế phối tử trong phức chất [Cu(OH2)6]2+không phụthuộc vào nồng độ của anion Cl–trong dung dịch mà phụ thuộc vào tínhacid mạnh của hydrochloric acid.
d. Dung dịch phản ứng chuyển từ màu xanh sang màu vàng.
Phân tích các phát biểu:
✔️a. Đúng: Thí nghiệm nên được tiến hành bằng cách cho từ từ đến dư dung dịch HCl đặc vào dung dịch copper(II) sulfate loãng,
✔️b. Đúng: Nếu dung dịch chuyển từ màu này sang màu khác rõ rệt, đó là dấu hiệu cho thấy có phản ứng hình thành phức chất giữa dung dịch copper(II) sulfate và dung dịch HCl.
❌c. Sai: Khả năng thay thế phối tử trong phức chất [Cu(OH2)6]2+ phụ thuộc vào cả nồng độ của ion Cl- và pH của dung dịch.
✔️d. Đúng: Dung dịch phản ứng có thể chuyển từ màu xanh lam sang màu vàng hoặc vàng lục, tùy thuộc vào nồng độ HCl và các phức chất được tạo thành.
✔️a. Đúng: Thí nghiệm nên được tiến hành bằng cách cho từ từ đến dư dung dịch HCl đặc vào dung dịch copper(II) sulfate loãng,
✔️b. Đúng: Nếu dung dịch chuyển từ màu này sang màu khác rõ rệt, đó là dấu hiệu cho thấy có phản ứng hình thành phức chất giữa dung dịch copper(II) sulfate và dung dịch HCl.
❌c. Sai: Khả năng thay thế phối tử trong phức chất [Cu(OH2)6]2+ phụ thuộc vào cả nồng độ của ion Cl- và pH của dung dịch.
✔️d. Đúng: Dung dịch phản ứng có thể chuyển từ màu xanh lam sang màu vàng hoặc vàng lục, tùy thuộc vào nồng độ HCl và các phức chất được tạo thành.
Câu 17 [561127]: Heme B là phức chất có trong thành phần của hemoglobin trong máu (mỗi phân tử hemoglobin chứa 4 heme B). Mỗi phân tử heme B kết hợp với một phân tử oxygen thông qua đường hô hấp để vận chuyển dưỡng khí đến mô. Khi con người hít thở không khí có nồng độ CO cao, heme B kết hợp với CO, có thể bị hôn mê, thậm chí tử vong do oxygen không được vận chuyển đến mô.
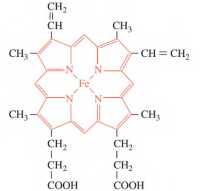
a. Dạng hình học của heme B là bát diện.
b. Mỗi phân tử hemoglobin có khả năng kết hợp tối đa với 2 phân tử O2.
c. Liên kết giữa heme B với O2 bền hơn liên kết giữa heme B với CO.
d. Heme B là phức chất có màu.

a. Dạng hình học của heme B là bát diện.
b. Mỗi phân tử hemoglobin có khả năng kết hợp tối đa với 2 phân tử O2.
c. Liên kết giữa heme B với O2 bền hơn liên kết giữa heme B với CO.
d. Heme B là phức chất có màu.
Phân tích các phát biểu:
❌a. Sai: Dạng hình học của Heme B không phải là bát diện. Nó có cấu trúc phẳng với ion Fe2+ nằm ở trung tâm vòng porphyrin.
❌b. Sai: Mỗi phân tử hemoglobin có khả năng kết hợp tối đa với 4 phân tử O2, không phải 2.
❌c. Sai: Liên kết giữa Heme B với CO bền hơn liên kết giữa Heme B với O2. Đây là lý do tại sao CO lại gây độc.
✔️d. Đúng: Heme B là một phức chất có màu đỏ đặc trưng, góp phần tạo nên màu đỏ của máu.
❌a. Sai: Dạng hình học của Heme B không phải là bát diện. Nó có cấu trúc phẳng với ion Fe2+ nằm ở trung tâm vòng porphyrin.
❌b. Sai: Mỗi phân tử hemoglobin có khả năng kết hợp tối đa với 4 phân tử O2, không phải 2.
❌c. Sai: Liên kết giữa Heme B với CO bền hơn liên kết giữa Heme B với O2. Đây là lý do tại sao CO lại gây độc.
✔️d. Đúng: Heme B là một phức chất có màu đỏ đặc trưng, góp phần tạo nên màu đỏ của máu.
Câu 18 [561128]: Hoà tan CoCl2 màu xanh vào ống nghiệm chứa nước thu được dung dịch màu hồng do hình thành phức chất bát diện (dung dịch X). Thêm dung dịch hydrochloric acid đặc vào dung dịch X thì thu được dung dịch Y có màu xanh do hình thành phức chất mới theo cân bằng sau:
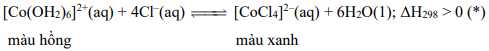
a. Có thể dùng bột CoCl2 làm chất chỉ thị để phát hiện nước ẩm trong cácmẫu vật.
b. Phản ứng thuận trong cân bằng (*) là phản ứng toả nhiệt.
c. Nếu đặt ống nghiệm chứa dung dịch Y vào cốc nước nóng thì dung dịch chuyển từ màu xanh sang màu hồng.
d. Nếu thêm nhiều nước vào ống nghiệm chứa dung dịch Y thì dung dịchchuyển từ màu xanh sang màu hồng.
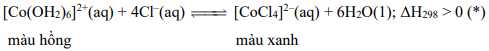
a. Có thể dùng bột CoCl2 làm chất chỉ thị để phát hiện nước ẩm trong cácmẫu vật.
b. Phản ứng thuận trong cân bằng (*) là phản ứng toả nhiệt.
c. Nếu đặt ống nghiệm chứa dung dịch Y vào cốc nước nóng thì dung dịch chuyển từ màu xanh sang màu hồng.
d. Nếu thêm nhiều nước vào ống nghiệm chứa dung dịch Y thì dung dịchchuyển từ màu xanh sang màu hồng.
Phân tích các phát biểu:
✔️a. Đúng: Có thể dùng bột CoCl2 làm chất chỉ thị để phát hiện nước ẩm trong các mẫu vật.
CoCl2 khan có màu xanh lam. Khi tiếp xúc với hơi nước, nó sẽ chuyển sang màu hồng do tạo thành phức chất ngậm nước.
❌b. Sai: Phản ứng thuận trong cân bằng (*) là phản ứng thu nhiệt.
Khi thêm HCl đặc (làm nóng) vào dung dịch X, cân bằng chuyển dịch theo chiều thuận (tạo ra màu xanh).=> phản ứng thuận là phản ứng thu nhiệt.
✔️c. Đúng: Nếu đặt ống nghiệm chứa dung dịch Y (màu xanh) vào cốc nước nóng, dung dịch sẽ chuyển từ màu xanh sang màu hồng.Khi tăng nhiệt độ, cân bằng (*) sẽ dịch chuyển theo chiều thuận (chiều thu nhiệt), tạo ra nhiều phức chất [Co(H2O)6]2+ màu hồng.
✔️d. Đúng: Nếu thêm nhiều nước vào ống nghiệm chứa dung dịch Y (màu xanh), dung dịch sẽ chuyển sang màu xanh.
Khi thêm nước, nồng độ Cl- giảm xuống, cân bằng (*) sẽ dịch chuyển theo chiều nghịch, tạo ra nhiều phức chất [Co(H2O)6]2+ màu hồng.
✔️a. Đúng: Có thể dùng bột CoCl2 làm chất chỉ thị để phát hiện nước ẩm trong các mẫu vật.
CoCl2 khan có màu xanh lam. Khi tiếp xúc với hơi nước, nó sẽ chuyển sang màu hồng do tạo thành phức chất ngậm nước.
❌b. Sai: Phản ứng thuận trong cân bằng (*) là phản ứng thu nhiệt.
Khi thêm HCl đặc (làm nóng) vào dung dịch X, cân bằng chuyển dịch theo chiều thuận (tạo ra màu xanh).=> phản ứng thuận là phản ứng thu nhiệt.
✔️c. Đúng: Nếu đặt ống nghiệm chứa dung dịch Y (màu xanh) vào cốc nước nóng, dung dịch sẽ chuyển từ màu xanh sang màu hồng.Khi tăng nhiệt độ, cân bằng (*) sẽ dịch chuyển theo chiều thuận (chiều thu nhiệt), tạo ra nhiều phức chất [Co(H2O)6]2+ màu hồng.
✔️d. Đúng: Nếu thêm nhiều nước vào ống nghiệm chứa dung dịch Y (màu xanh), dung dịch sẽ chuyển sang màu xanh.
Khi thêm nước, nồng độ Cl- giảm xuống, cân bằng (*) sẽ dịch chuyển theo chiều nghịch, tạo ra nhiều phức chất [Co(H2O)6]2+ màu hồng.
Câu 19 [561129]: Khi cho dung dịch ammonia dư vào dung dịch chứa phức chất [Ni(OH2)6]2+ và anion Cl–thì có phản ứng sau:
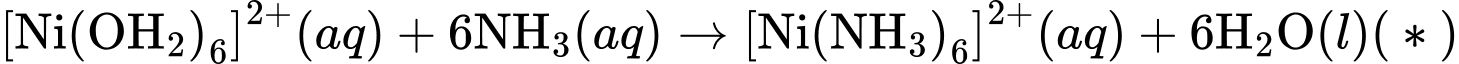
a. Phản ứng (*) là phản ứng thế phối tử.
b. Dung dịch sau phản ứng có pH > 7.
c. Trong phản ứng không có sự thay đổi số oxi hoá của các nguyên tố.
d. Trong điều kiện của phản ứng(*), phức chất [Ni(NH3)6]2+kém bền hơnphức chất [Ni(OH2)6]2+.
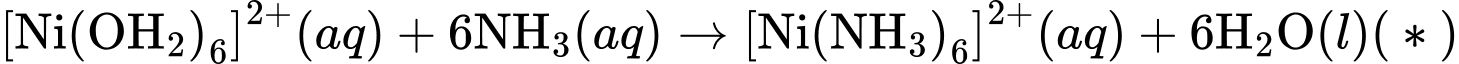
a. Phản ứng (*) là phản ứng thế phối tử.
b. Dung dịch sau phản ứng có pH > 7.
c. Trong phản ứng không có sự thay đổi số oxi hoá của các nguyên tố.
d. Trong điều kiện của phản ứng(*), phức chất [Ni(NH3)6]2+kém bền hơnphức chất [Ni(OH2)6]2+.
Phức chất [Ni(OH2)6]2+:
Ion Ni2+ tồn tại trong dung dịch dưới dạng phức chất [Ni(OH2)6]2+, thường có màu xanh lục.
Phản ứng với ammonia:
Khi cho dung dịch ammonia (NH3) dư vào dung dịch chứa phức chất [Ni(OH2)6]2+ các phân tử NH3 sẽ thay thế các phân tử H2O trong phức chất, tạo thành phức chất mới
Phản ứng xảy ra như sau:
[Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O(l) (*)
Phân tích các phát biểu
✔️a. Đúng: Phản ứng (*) là phản ứng thế phối tử. Trong phản ứng này, các phối tử H2O trong phức chất [Ni(OH2)6]2+ được thay thế bởi các phối tử NH3.
✔️b. Đúng: Dung dịch sau phản ứng có pH > 7.(NH3) là một base yếu, khi tan trong nước sẽ tạo ra môi trường kiềm (pH > 7).
✔️c. Đúng: Trong phản ứng không có sự thay đổi số oxi hoá của các nguyên tố. Số oxi hoá của Ni trong cả hai phức chất đều là +2.
❌d. Sai: Phản ứng xảy ra theo chiều tạo ra phức chất [Ni(NH3)6]2+, cho thấy phức chất này bền hơn.
Ion Ni2+ tồn tại trong dung dịch dưới dạng phức chất [Ni(OH2)6]2+, thường có màu xanh lục.
Phản ứng với ammonia:
Khi cho dung dịch ammonia (NH3) dư vào dung dịch chứa phức chất [Ni(OH2)6]2+ các phân tử NH3 sẽ thay thế các phân tử H2O trong phức chất, tạo thành phức chất mới
Phản ứng xảy ra như sau:
[Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O(l) (*)
Phân tích các phát biểu
✔️a. Đúng: Phản ứng (*) là phản ứng thế phối tử. Trong phản ứng này, các phối tử H2O trong phức chất [Ni(OH2)6]2+ được thay thế bởi các phối tử NH3.
✔️b. Đúng: Dung dịch sau phản ứng có pH > 7.(NH3) là một base yếu, khi tan trong nước sẽ tạo ra môi trường kiềm (pH > 7).
✔️c. Đúng: Trong phản ứng không có sự thay đổi số oxi hoá của các nguyên tố. Số oxi hoá của Ni trong cả hai phức chất đều là +2.
❌d. Sai: Phản ứng xảy ra theo chiều tạo ra phức chất [Ni(NH3)6]2+, cho thấy phức chất này bền hơn.
Câu 20 [561130]: Có hai thí nghiệm dưới đây.
Thí nghiệm 1 ở 00C : Có một ống nghiệm chứa dung dịch copper(II) sulfate màu xanh nhạt. Thêm từ từ cho đến hết dung dịch hydrochloric acid đặc không màu vào ống nghiệm đó thì thu được dung dịch có màu vàng chanh do có quá trình:
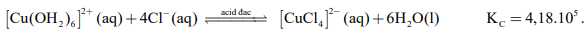
Thí nghiệm 2 ở 200C: Có một ống nghiệm chứa dung dịch copper(II) sulfate màu xanh nhạt. Thêm từ từ cho đến hết dung dịch sodium chloride bão hoà không màu vào ống nghiệm đó thì thu được dung dịch có màu xanh nhạt hơn so với ban đầu.
a. Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là: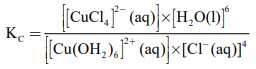
b. Trong thí nghiệm 1, phản ứng nghịch diễn ra thuận lợi hơn so với phảnứng thuận.
c. Trong thí nghiệm 1, nồng độ anion Cl–càng cao thì phản ứng thuậncàng dễ diễn ra.
d. Trong thí nghiệm 2 không có dấu hiệu của phản ứng hình thành phứcchất.
Thí nghiệm 1 ở 00C : Có một ống nghiệm chứa dung dịch copper(II) sulfate màu xanh nhạt. Thêm từ từ cho đến hết dung dịch hydrochloric acid đặc không màu vào ống nghiệm đó thì thu được dung dịch có màu vàng chanh do có quá trình:
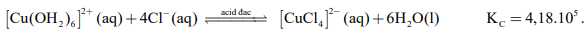
Thí nghiệm 2 ở 200C: Có một ống nghiệm chứa dung dịch copper(II) sulfate màu xanh nhạt. Thêm từ từ cho đến hết dung dịch sodium chloride bão hoà không màu vào ống nghiệm đó thì thu được dung dịch có màu xanh nhạt hơn so với ban đầu.
a. Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
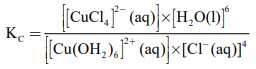
b. Trong thí nghiệm 1, phản ứng nghịch diễn ra thuận lợi hơn so với phảnứng thuận.
c. Trong thí nghiệm 1, nồng độ anion Cl–càng cao thì phản ứng thuậncàng dễ diễn ra.
d. Trong thí nghiệm 2 không có dấu hiệu của phản ứng hình thành phứcchất.
Thí nghiệm 1:
Cân bằng: [Cu(H2O)6]2+ + 4Cl- ⟶[CuCl4]2- + 6H2O
Thí nghiệm 2:
Copper(II) sulfate trong nước: Tương tự như thí nghiệm 1, ion Cu2+ tồn tại dưới dạng phức chất [Cu(H2O)6]2+, có màu xanh lam nhạt.
Phân tích các phát biểu
❌a. Sai: Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
K = ([CuCl4]2-) / ([Cu(H2O)6]2+ × [Cl-]4)
❌b. Sai: Trong thí nghiệm 1, phản ứng thuận diễn ra thuận lợi hơn so với phản ứng nghịch.
Màu vàng chanh của dung dịch cho thấy phản ứng thuận (tạo ra [CuCl4]2-) diễn ra mạnh mẽ.
✔️c. Đúng: Trong thí nghiệm 1, nồng độ anion Cl- càng cao thì phản ứng thuận càng dễ diễn ra.
Nồng độ Cl- cao sẽ thúc đẩy quá trình tạo thành phức chất [[CuCl4]2-màu vàng chanh.
❌d. Sai: Trong thí nghiệm 2, vẫn có dấu hiệu của phản ứng hình thành phức chất, nhưng không rõ ràng như thí nghiệm 1.
Dung dịch nhạt màu hơn cho thấy có sự thay thế phối tử, nhưng không tạo ra phức chất [CuCl4]2- với nồng độ đủ cao để làm thay đổi màu sắc rõ rệt.
Cân bằng: [Cu(H2O)6]2+ + 4Cl- ⟶[CuCl4]2- + 6H2O
Thí nghiệm 2:
Copper(II) sulfate trong nước: Tương tự như thí nghiệm 1, ion Cu2+ tồn tại dưới dạng phức chất [Cu(H2O)6]2+, có màu xanh lam nhạt.
Phân tích các phát biểu
❌a. Sai: Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
K = ([CuCl4]2-) / ([Cu(H2O)6]2+ × [Cl-]4)
❌b. Sai: Trong thí nghiệm 1, phản ứng thuận diễn ra thuận lợi hơn so với phản ứng nghịch.
Màu vàng chanh của dung dịch cho thấy phản ứng thuận (tạo ra [CuCl4]2-) diễn ra mạnh mẽ.
✔️c. Đúng: Trong thí nghiệm 1, nồng độ anion Cl- càng cao thì phản ứng thuận càng dễ diễn ra.
Nồng độ Cl- cao sẽ thúc đẩy quá trình tạo thành phức chất [[CuCl4]2-màu vàng chanh.
❌d. Sai: Trong thí nghiệm 2, vẫn có dấu hiệu của phản ứng hình thành phức chất, nhưng không rõ ràng như thí nghiệm 1.
Dung dịch nhạt màu hơn cho thấy có sự thay thế phối tử, nhưng không tạo ra phức chất [CuCl4]2- với nồng độ đủ cao để làm thay đổi màu sắc rõ rệt.
Câu 21 [561131]: Khi hoà tan một lượng phèn nhôm potassium vào nước thì có các quá trình cơ bản sau diễn ra:
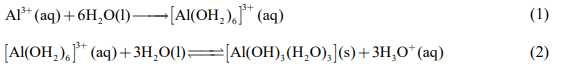
a. Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+. Quá trìnhnày diễn ra rất thuận lợi.
b. Các quá trình (1) và (2) giúp giải thích vì sao cation Al3+là một basetrong dung dịch nước theo Bronsted - Lowry.
c. Ở quá trình (2), các phân tử nước đóng vai trò là dung môi.
d. Để thu được nhiều kết tủa keo thì cần hoà tan lượng nhỏ phèn tronglượng lớn nước.
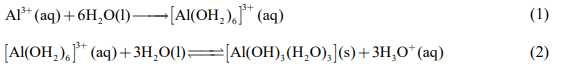
a. Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+. Quá trìnhnày diễn ra rất thuận lợi.
b. Các quá trình (1) và (2) giúp giải thích vì sao cation Al3+là một basetrong dung dịch nước theo Bronsted - Lowry.
c. Ở quá trình (2), các phân tử nước đóng vai trò là dung môi.
d. Để thu được nhiều kết tủa keo thì cần hoà tan lượng nhỏ phèn tronglượng lớn nước.
Phân tích các phát biểu:
✔️a. Đúng: Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+. Quá trình này diễn ra rất thuận lợi do ái lực mạnh mẽ giữa ion Al3+và các phân tử nước.
❌b. Sai: Các quá trình (1) và (2) giải thích vì sao cation Al3+ là một acid trong dung dịch nước theo Bronsted - Lowry.
Theo Bronsted - Lowry, acid là chất có khả năng nhường proton (H+).
Trong quá trình thủy phân, phức chất aqua [Al(H2O)6]3+ nhường proton cho nước, do đó đóng vai trò là acid.
❌c. Sai: Ở quá trình (2), các phân tử nước vừa đóng vai trò là dung môi, vừa đóng vai trò là chất phản ứng (nhận proton H+ từ phức chất aqua).
❌d. : Để thu được nhiều kết tủa keo Al(OH)3, cần hòa tan lượng lớn phèn nhôm sodium trong lượng nước ít. Nếu hòa tan lượng nhỏ phèn thì nồng độ Al(OH)3 sẽ thấp dẫn đến lượng kết tủa keo ít.
✔️a. Đúng: Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+. Quá trình này diễn ra rất thuận lợi do ái lực mạnh mẽ giữa ion Al3+và các phân tử nước.
❌b. Sai: Các quá trình (1) và (2) giải thích vì sao cation Al3+ là một acid trong dung dịch nước theo Bronsted - Lowry.
Theo Bronsted - Lowry, acid là chất có khả năng nhường proton (H+).
Trong quá trình thủy phân, phức chất aqua [Al(H2O)6]3+ nhường proton cho nước, do đó đóng vai trò là acid.
❌c. Sai: Ở quá trình (2), các phân tử nước vừa đóng vai trò là dung môi, vừa đóng vai trò là chất phản ứng (nhận proton H+ từ phức chất aqua).
❌d. : Để thu được nhiều kết tủa keo Al(OH)3, cần hòa tan lượng lớn phèn nhôm sodium trong lượng nước ít. Nếu hòa tan lượng nhỏ phèn thì nồng độ Al(OH)3 sẽ thấp dẫn đến lượng kết tủa keo ít.
Câu 22 [561132]: Cho các quá trình tạo phức chất bát diện sau:
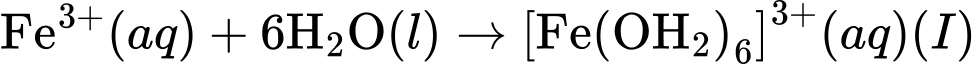
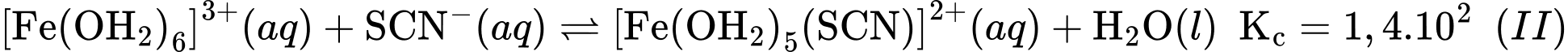
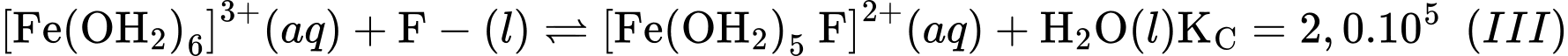
Biết dung dịch màu vàng nâu, dung dịch
màu vàng nâu, dung dịch 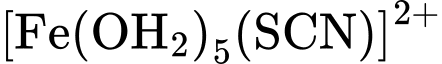 có màu đỏ, dung dịch
có màu đỏ, dung dịch 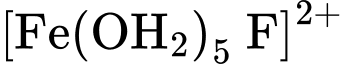 và các anion
và các anion  đều không có màu.
đều không có màu.
a. Quá trình (I) xảy ra khi hoà tan iron(III) chloride trong nước. Kết thúcquá trình này thu được dung dịch có chứa lượng lớn cation Fe3+và phứcchất aqua [Fe(OH2)6]3+.
b. So với anion F–, anion SCN–dễ thay thế phối tử H2O trong[Fe(OH2)6]3+hơn.
c. Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III) thì dungdịch này sẽ có màu.
d. Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN–hay anion F–đều sử dụng số cặp electron hoá trị riêng như nhau để chovào orbital trống của cation Fe3+ .
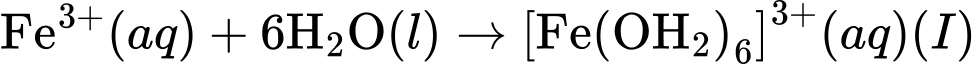
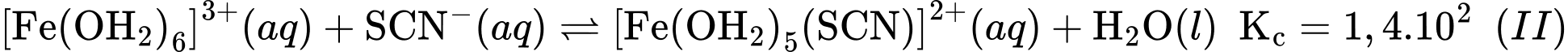
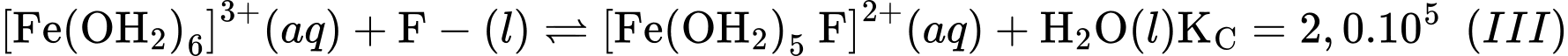
Biết dung dịch
 màu vàng nâu, dung dịch
màu vàng nâu, dung dịch 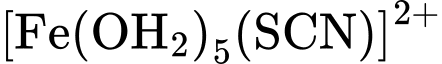 có màu đỏ, dung dịch
có màu đỏ, dung dịch 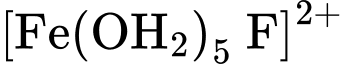 và các anion
và các anion  đều không có màu.
đều không có màu.a. Quá trình (I) xảy ra khi hoà tan iron(III) chloride trong nước. Kết thúcquá trình này thu được dung dịch có chứa lượng lớn cation Fe3+và phứcchất aqua [Fe(OH2)6]3+.
b. So với anion F–, anion SCN–dễ thay thế phối tử H2O trong[Fe(OH2)6]3+hơn.
c. Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III) thì dungdịch này sẽ có màu.
d. Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN–hay anion F–đều sử dụng số cặp electron hoá trị riêng như nhau để chovào orbital trống của cation Fe3+ .
Phân tích các phát biểu:
❌a. Sai: Quá trình (I) xảy ra khi hòa tan iron(III) chloride trong nước, tạo ra phức chất aqua [Fe(H2O)6]3+. Dung dịch thu được chứa chủ yếu là phức chất này, không chứa lượng lớn cation Fe3+ tự do.
✔️b. Đúng: So với anion F-, anion SCN- dễ thay thế phối tử H2O trong [Fe(H2O)6]3+ hơn.
✔️c. Đúng: Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III), sẽ có màu đỏ.
Phản ứng (III) tạo ra phức chất không màu [Fe(H2O)5F]2+.
Khi cho từ từ dung dịch KSCN tạo phức chất [Fe(OH2)5(SCN)]2+ có màu đỏ
✔️d. Đúng: Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN- hay anion F- đều sử dụng một cặp electron hóa trị riêng để cho vào orbital trống của cation Fe3+.
Đây là kiểu liên kết phối trí, trong đó các phối tử (H2O, SCN-, F-) đóng vai trò là chất cho electron, ion Fe3+ đóng vai trò là chất nhận electron.
❌a. Sai: Quá trình (I) xảy ra khi hòa tan iron(III) chloride trong nước, tạo ra phức chất aqua [Fe(H2O)6]3+. Dung dịch thu được chứa chủ yếu là phức chất này, không chứa lượng lớn cation Fe3+ tự do.
✔️b. Đúng: So với anion F-, anion SCN- dễ thay thế phối tử H2O trong [Fe(H2O)6]3+ hơn.
✔️c. Đúng: Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III), sẽ có màu đỏ.
Phản ứng (III) tạo ra phức chất không màu [Fe(H2O)5F]2+.
Khi cho từ từ dung dịch KSCN tạo phức chất [Fe(OH2)5(SCN)]2+ có màu đỏ
✔️d. Đúng: Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN- hay anion F- đều sử dụng một cặp electron hóa trị riêng để cho vào orbital trống của cation Fe3+.
Đây là kiểu liên kết phối trí, trong đó các phối tử (H2O, SCN-, F-) đóng vai trò là chất cho electron, ion Fe3+ đóng vai trò là chất nhận electron.
Dạng 3: TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
Câu 23 [561133]: Phức chất [Cu(NH3)4]2+ được hình thành khi cho dung dịch NH3 tới dư vào dung dịch chứa ion Cu2+.

Hình ảnh. Lớp bên trên là phức chất [Cu(NH3)4]2+ màu xanh thẫm. Lớp dưới là dung dịch chứa Cu2+.
Nếu như thay thế toàn bộ phối tử NH3 bằng phối tử Cl– thì điện tích của phức chất lúc này là bao nhiêu?
Điền đáp án: ..........

Hình ảnh. Lớp bên trên là phức chất [Cu(NH3)4]2+ màu xanh thẫm. Lớp dưới là dung dịch chứa Cu2+.
Nếu như thay thế toàn bộ phối tử NH3 bằng phối tử Cl– thì điện tích của phức chất lúc này là bao nhiêu?
Điền đáp án: ..........
Cu 2+ có điện tích +2
NH3 là phối tử trung hòa không mang điện
Khi thay thế Cl- vào làm giảm điện tích đi 4 đơn vị do có điện tích -1.
Điện tích của phức chất [CuCl4]x là:
X= +2 + 4 × (-1) = -2
Điền đáp án: -2
NH3 là phối tử trung hòa không mang điện
Khi thay thế Cl- vào làm giảm điện tích đi 4 đơn vị do có điện tích -1.
Điện tích của phức chất [CuCl4]x là:
X= +2 + 4 × (-1) = -2
Điền đáp án: -2
Câu 24 [561134]: Cho các phản ứng sau:
a) [Co(OH2)6]3+(aq) + 6NH3(aq) → [Co(NH3)6]3+(aq) + 6H2O(l)
b) 2Na[Au(CN)2](aq) + Zn(s) → Na2[Zn(CN)4](aq) + 2Au(s)
c) [Co(OH2)]2+(aq) +4Cl–(aq) → [CoCl4]2–(aq) + 6H2O(l)
d) [Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O(l)
e) [PtCl]2–(aq) + 2NH3(aq) → [PtCl2(NH3)2](s) + 2Cl–(aq)
Có bao nhiêu phản ứng thuộc vào phản ứng thế phối tử trong phức chất?
Điền đáp án: ..........
a) [Co(OH2)6]3+(aq) + 6NH3(aq) → [Co(NH3)6]3+(aq) + 6H2O(l)
b) 2Na[Au(CN)2](aq) + Zn(s) → Na2[Zn(CN)4](aq) + 2Au(s)
c) [Co(OH2)]2+(aq) +4Cl–(aq) → [CoCl4]2–(aq) + 6H2O(l)
d) [Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O(l)
e) [PtCl]2–(aq) + 2NH3(aq) → [PtCl2(NH3)2](s) + 2Cl–(aq)
Có bao nhiêu phản ứng thuộc vào phản ứng thế phối tử trong phức chất?
Điền đáp án: ..........
Phản ứng thế phối tử trong phức chất là phản ứng trong đó một hoặc nhiều phối tử trong phức chất bị thay thế bởi các phối tử khác
Xét các phản ứng:
✔️a) [Co(OH2)6]3+(aq) + 6NH3(aq) → [Co(NH3)6]3+(aq) + 6H2O(l)
❌b) 2Na[Au(CN)2](aq) + Zn(s) → Na2[Zn(CN)4](aq) + 2Au(s)
✔️c) [Co(OH2)]2+(aq) +4Cl–(aq) → [CoCl4]2–(aq) + 6H2O(l)
✔️d) [Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O(l)
✔️e) [PtCl]2–(aq) + 2NH3(aq) → [PtCl2(NH3)2](s) + 2Cl–(aq)
Có 4 phản ứng thuộc vào phản ứng thế phối tử trong phức chất
Điền đáp án: 4
Xét các phản ứng:
✔️a) [Co(OH2)6]3+(aq) + 6NH3(aq) → [Co(NH3)6]3+(aq) + 6H2O(l)
❌b) 2Na[Au(CN)2](aq) + Zn(s) → Na2[Zn(CN)4](aq) + 2Au(s)
✔️c) [Co(OH2)]2+(aq) +4Cl–(aq) → [CoCl4]2–(aq) + 6H2O(l)
✔️d) [Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O(l)
✔️e) [PtCl]2–(aq) + 2NH3(aq) → [PtCl2(NH3)2](s) + 2Cl–(aq)
Có 4 phản ứng thuộc vào phản ứng thế phối tử trong phức chất
Điền đáp án: 4
Câu 25 [561135]: Cần dùng 22,5 mL dung dịch KMnO4 0,04 M để phản ứng vừa đủ với 20 mL dung dịch A gồm Fe2+ (hay [Fe(OH2)6]2+), H+ và SO42-. Giá trị nồng độ mol của Fe2+ trong dung dịch A là bao nhiêu? (Làm tròn đến hai chữ số thập phân)
Điền đáp án: ..........
Điền đáp án: ..........
MnO4- + 5Fe2+ + 8H+ ⟶ Mn2+ + 5Fe3+ + 4H2O
Số mol KMnO4 = CM × V= 0,04 × 22,5/1000 = 9 × 10-4 mol
nFe2+ = 5 n KMnO4= 5 × 9 × 10-4 = 4,5 × 10-3 mol
C Fe2+ = n : V = 4,5 × 10-3 : 0,02 = 0,225M
Điền đáp án: 0,23
Số mol KMnO4 = CM × V= 0,04 × 22,5/1000 = 9 × 10-4 mol
nFe2+ = 5 n KMnO4= 5 × 9 × 10-4 = 4,5 × 10-3 mol
C Fe2+ = n : V = 4,5 × 10-3 : 0,02 = 0,225M
Điền đáp án: 0,23
Câu 26 [561136]: Hoà tan 1,61 g FeCl3 vào 10 mL nước thu được dung dịch (I). Hoà tan 5,52 g K2C2O4 vào 30 mL nước thu được dung dịch (II). Cho từ từ dung dịch (II) vào dung dịch (I) và khuấy liên tục. Sau một thời gian thêm ethanol vào dung dịch phản ứng thì xuất hiện tinh thể. Lọc, thu tinh thể sạch của phức chất có công thức là K3[Fe(C2O4)3].3H2O với khối lượng là 3,51 g. Phương trình hoá học của phản ứng diễn ra là:
FeCl3 + 3K2C2O4 + 3H2O ⟶ K3[Fe(C2O4)3].3H2O + 3KCl
Hiệu suất của phản ứng hình thành phức chất trên là bao nhiêu?
(Làm tròn đến hàng đơn vị)
FeCl3 + 3K2C2O4 + 3H2O ⟶ K3[Fe(C2O4)3].3H2O + 3KCl
Hiệu suất của phản ứng hình thành phức chất trên là bao nhiêu?
(Làm tròn đến hàng đơn vị)
FeCl3 + 3K2C2O4 + 3H2O ⟶ K3[Fe(C2O4)3].3H2O + 3KCl
Số mol phức thu được theo lí thuyết bằng số mol FeCl3:
1,61 : 162,5 = 9,9.10-3 (mol)
Khối lượng phức chất thu được theo lí thuyết là: 491 × 9,9.10-3 = 4,86 g
Hiệu suất phản ứng là:
( 3,51 : 4,86 ) × 100% = 72,2%
Điền đáp án: 72
Số mol phức thu được theo lí thuyết bằng số mol FeCl3:
1,61 : 162,5 = 9,9.10-3 (mol)
Khối lượng phức chất thu được theo lí thuyết là: 491 × 9,9.10-3 = 4,86 g
Hiệu suất phản ứng là:
( 3,51 : 4,86 ) × 100% = 72,2%
Điền đáp án: 72
Câu 27 [561137]: Trong dung dịch nitric acid loãng, Fe3+ phản ứng với ion thiocyanate (SCN−) tạo thành phức màu đỏ sẫm:
(*) [Fe(H2O)6]3+ + SCN−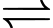 H2O + [Fe(H2O)5NCS]2+
H2O + [Fe(H2O)5NCS]2+
Cân bằng nồng độ của [Fe(H2O)5NCS]2+ có thể được xác định bằng độ đậm của dung dịch (được đo bằng quang phổ kế). Trong một thí nghiệm như vậy, 1,0 mL Fe(NO3)3 0,20 M được trộn với 1,0 mL KSCN 1,0 × 10−3M và 8,0 mL HNO3 loãng. Tại thời điểm cân bằng, màu sắc của dung dịch cho thấy nồng độ [Fe(H2O)5NCS]2+ là 7,3 × 10−5 M. Tính hằng số cân bằng của phản ứng (*). (Làm tròn đến hai số thập phân)
Điền đáp án: ..........
(*) [Fe(H2O)6]3+ + SCN−
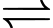 H2O + [Fe(H2O)5NCS]2+
H2O + [Fe(H2O)5NCS]2+Cân bằng nồng độ của [Fe(H2O)5NCS]2+ có thể được xác định bằng độ đậm của dung dịch (được đo bằng quang phổ kế). Trong một thí nghiệm như vậy, 1,0 mL Fe(NO3)3 0,20 M được trộn với 1,0 mL KSCN 1,0 × 10−3M và 8,0 mL HNO3 loãng. Tại thời điểm cân bằng, màu sắc của dung dịch cho thấy nồng độ [Fe(H2O)5NCS]2+ là 7,3 × 10−5 M. Tính hằng số cân bằng của phản ứng (*). (Làm tròn đến hai số thập phân)
Điền đáp án: ..........
[Fe(H2O)6]3+ + SCN = H2O + [Fe(H2O)5NCS]2+
Số mol Fe3+ trong 1mL dung dịch:
CM. V = 0,2 × 1× 10-3= 2 × 10-4 mol
Nồng độ Fe 3+ = n : V = 2 × 10-4 : 0,01= 2 × 10-2 M
Số mol SCN- trong 1mL dung dịch:
CM. V = 1× 10-3 × 1× 10-3= 10-6 mol
Nồng độ SCN- = n : V = 10-6 : 0,01= 10-4 M
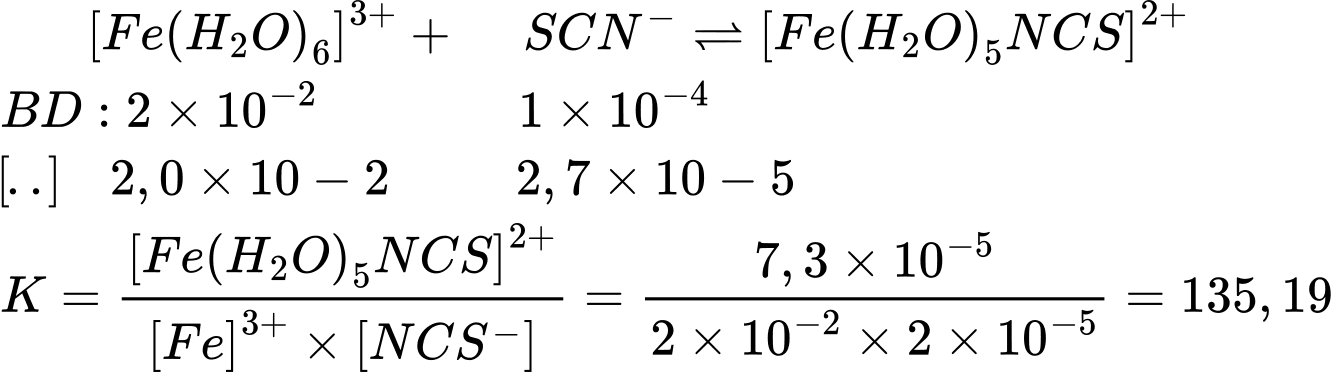
⇒ Điền đáp án: 136
Số mol Fe3+ trong 1mL dung dịch:
CM. V = 0,2 × 1× 10-3= 2 × 10-4 mol
Nồng độ Fe 3+ = n : V = 2 × 10-4 : 0,01= 2 × 10-2 M
Số mol SCN- trong 1mL dung dịch:
CM. V = 1× 10-3 × 1× 10-3= 10-6 mol
Nồng độ SCN- = n : V = 10-6 : 0,01= 10-4 M
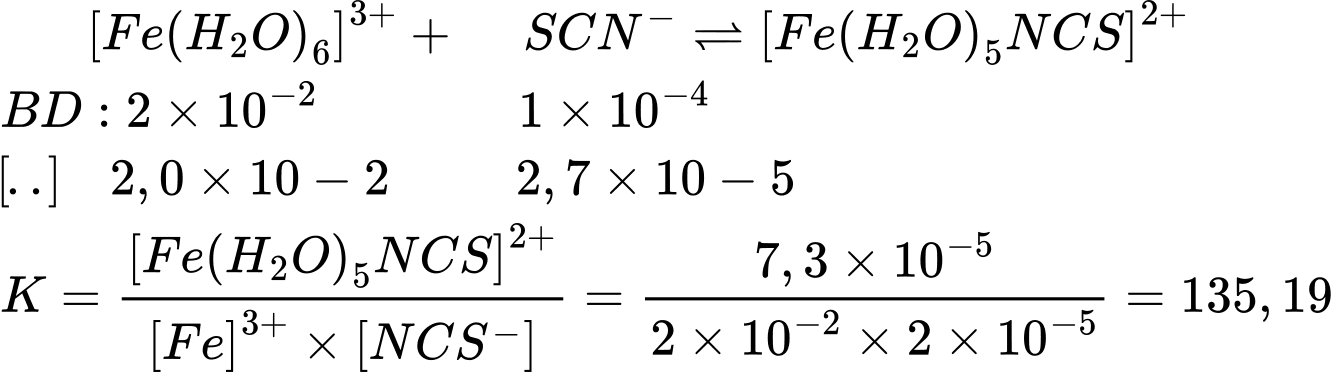
⇒ Điền đáp án: 136
Dạng 4: BÀI TẬP ĐỌC HIỂU – đọc thông tin và trả lời các câu hỏi sau đó
ẢNH HƯỞNG CỦA NHIỆT ĐỘ ĐẾN SỰ HÌNH THÀNH PHỨC CHẤT
Nhiệt độ là một trong những yếu tố quan trọng ảnh hưởng đến trạng thái cân bằng của một phản ứng. Để hiểu rõ hơn về điều này, ta cùng xem xét trạng thái cân bằng giữa các ion sau: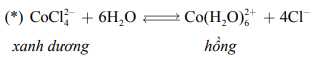
Dung dịch chứa sẽ có màu xanh dương, còn dung dịch chứa sẽ có màu hồng. Ban đầu, hỗn hợp đang ở trạng thái cân bằng chứa đồng thời hai ion và ion nên màu sắc tổ hợp của dung dịch sẽ là màu tím (Hình a).
Sự hình thành sẽ tỏa ra một nhiệt lượng. Do đó, phản ứng nghịch, sự hình thành sẽ là phản ứng thu nhiệt. Khi đun nóng bằng đèn Bunsen, cân bằng chuyển dịch sang bên trái và dung dịch sẽ có màu xanh lam (hình b). Khi làm lạnh bằng đá, tạo điều kiện cho phản ứng tỏa nhiệt xảy ra (sự hình thành Co(H2O)62+ ) và dung dịch sẽ có màu hồng (Hình c).

Câu 28 [382562]: Quan sát Hình a, dung dịch ban đầu có màu tím là do dung dịch chứa
A, ion 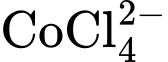 có màu tím.
có màu tím.
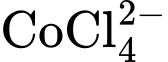 có màu tím.
có màu tím.B, ion 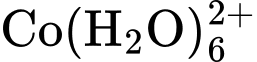 có màu tím.
có màu tím.
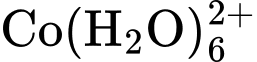 có màu tím.
có màu tím.C, ion 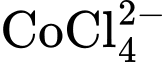 và ion
và ion 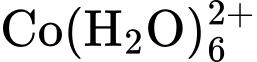 nên có sự tổ hợp màu.
nên có sự tổ hợp màu.
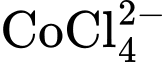 và ion
và ion 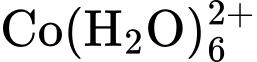 nên có sự tổ hợp màu.
nên có sự tổ hợp màu.D, ion 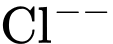 và ion
và ion 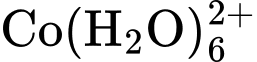 nên có sự tổ hợp màu.
nên có sự tổ hợp màu.
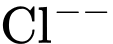 và ion
và ion 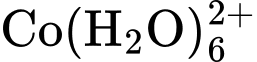 nên có sự tổ hợp màu.
nên có sự tổ hợp màu.
Ban đầu, hỗn hợp đang ở trạng thái cân bằng chứa đồng thời hai ion CoCl42- và ion Co(H2O)62+ nên màu sắc tổ hợp của dung dịch sẽ là màu tím (Hình a)
⇒ Chọn đáp án C Đáp án: C
⇒ Chọn đáp án C Đáp án: C
Câu 29 [382563]: Cho ion 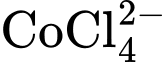 vào trong một cốc nước A. Tiến hành làm lạnh cốc nước A thì màu sắc của dung dịch sẽ thay đổi
vào trong một cốc nước A. Tiến hành làm lạnh cốc nước A thì màu sắc của dung dịch sẽ thay đổi
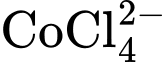 vào trong một cốc nước A. Tiến hành làm lạnh cốc nước A thì màu sắc của dung dịch sẽ thay đổi
vào trong một cốc nước A. Tiến hành làm lạnh cốc nước A thì màu sắc của dung dịch sẽ thay đổi A, từ màu tím sang màu hồng.
B, từ màu hồng sang màu xanh dương.
C, từ màu tím sang màu xanh dương.
D, từ màu xanh dương sang màu hồng.
Dung dịch chứa CoCl42- sẽ có màu xanh dương. Khi làm lạnh bằng đá, dung dịch sẽ có màu hồng (Hình c).
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 30 [382564]: Hình ảnh dưới đây mô tả trạng thái cân bằng với sự có mặt của hai ion 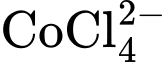 và ion
và ion 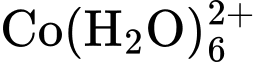 ở những nhiệt độ T1, T2, T3 và T4 khác nhau.
ở những nhiệt độ T1, T2, T3 và T4 khác nhau.
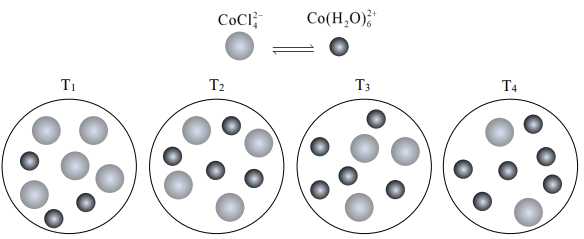
Ở nhiệt độ nào thì hằng số cân bằng KC của phản ứng (*) là lớn nhất?
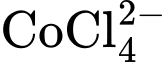 và ion
và ion 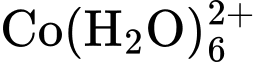 ở những nhiệt độ T1, T2, T3 và T4 khác nhau.
ở những nhiệt độ T1, T2, T3 và T4 khác nhau.
Ở nhiệt độ nào thì hằng số cân bằng KC của phản ứng (*) là lớn nhất?
A, T2.
B, T3.
C, T1.
D, T4.
Ta có: 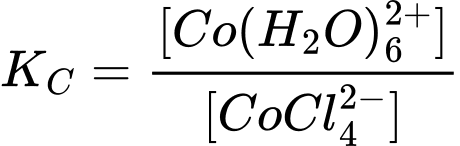
→ Tỉ lệ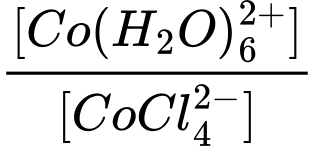 càng lớn thì Kc càng lớn
càng lớn thì Kc càng lớn
T1 có 5 ion CoCl42- và 3 ion Co(H2O)62+
T2 có 4 ion CoCl42- và 4 ion Co(H2O)62+
T3 có 3 ion CoCl42- và 5 ion Co(H2O)62+
T4 có 2 ion CoCl42-- và 6 ion Co(H2O)62+
→ T4 có hằng số Kc lớn nhất.
⇒ Chọn đáp án D Đáp án: D
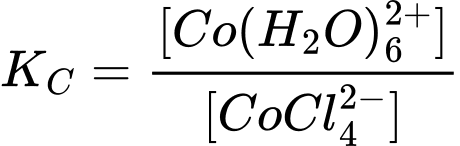
→ Tỉ lệ
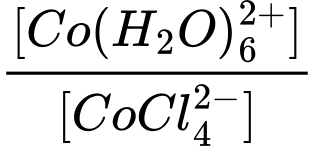 càng lớn thì Kc càng lớn
càng lớn thì Kc càng lớnT1 có 5 ion CoCl42- và 3 ion Co(H2O)62+
T2 có 4 ion CoCl42- và 4 ion Co(H2O)62+
T3 có 3 ion CoCl42- và 5 ion Co(H2O)62+
T4 có 2 ion CoCl42-- và 6 ion Co(H2O)62+
→ T4 có hằng số Kc lớn nhất.
⇒ Chọn đáp án D Đáp án: D
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu hỏi từ 31 đến 33
PHỨC CHẤT CỦA KIM LOẠI CHROMIUM
Một mẫu muối X chứa chromium, chlorine, và nước có công thức dạng CrCln(OH2)m. Tiến hành điện phân dung dịch muối X trong 1310 s với dòng điện 1,24 A thì thu được 0,292 g kim loại Cr.Mặt khác để xác định số phân tử H2O có trong mẫu X, đưa 3,000 g muối chromium X đun nóng cẩn thận ở nhiệt độ 600 °C để đuổi hết nước trong muối, cho đến khi mẫu đạt được khối lượng không đổi 1,783 g thì dừng lại.
Trên thực tế, hợp chất X tồn tại ở dạng phức chất [CrA6]B. Trong đó A được gọi là các phối tử, phức chất X chứa tối đa được 6 phối tử. Phần nằm trong ngoặc vuông […] được gọi là cầu nội, nằm ngoài ngoặc vuông được gọi là cầu ngoại. Khi thực hiện phản ứng, phần nằm ở cầu ngoại (phần B) sẽ dễ dàng bị thay thế hơn so với phần nằm ở cầu nội (phần A).
Hòa tan 0,300 g mẫu muối X trong 10 mL nước. Chuẩn độ nhanh dung dịch bằng dung dịch silver nitrate AgNO3 0,400 M; thấy có 2,810 mL dung dịch AgNO3 tham gia phản ứng.
Câu 31 [382673]: Giá trị của n trong muối là bao nhiêu?
A, 2.
B, 3.
C, 4.
D, 5.
Số mol của Cr là: nCr = 0,292 ÷ 52 = 0,005615 mol
Số mol electron trao đổi là: ne = It / F = 1,24 × 1310 : 96500 = 0,01683 mol
Số electron trao đổi là: 0,01683 ÷ 0,005615 ≈ 3
Trong muối trên Cr tồn tại dạng Cr3+
Dạng tồn tại của Cl là Cl-
Số nguyên tử Cl trong muối là n = 3
⇒ Chọn đáp án B Đáp án: B
Số mol electron trao đổi là: ne = It / F = 1,24 × 1310 : 96500 = 0,01683 mol
Số electron trao đổi là: 0,01683 ÷ 0,005615 ≈ 3
Trong muối trên Cr tồn tại dạng Cr3+
Dạng tồn tại của Cl là Cl-
Số nguyên tử Cl trong muối là n = 3
⇒ Chọn đáp án B Đáp án: B
Câu 32 [382674]: Giá trị của m trong muối là bao nhiêu?
A, 2.
B, 4.
C, 6.
D, 8.
Số mol của Cr là: nCr = 0,292 ÷ 52 = 0,005615 mol
Số mol electron trao đổi là: ne = It / F = 1,24 × 1310 : 96500 = 0,01683 mol
Số electron trao đổi là: 0,01683 ÷ 0,005615 ≈ 3
Trong muối trên Cr tồn tại dạng Cr3+
Dạng tồn tại của Cl là Cl-
Số nguyên tử Cl trong muối là n = 3
→ Công thức của muối khan là là CrCl3
Khối lượng nước trong muối mất đi là: mH2O = 3 – 1,783 = 1,217 gam
Số phân tử nước trong muối X là: m = nH2O / nCrCl3 = (1,217 ÷ 18) / (1,783 ÷ 158,5) ≈ 6.
→ Công thức của muối là CrCl2(OH)6
⇒ Chọn đáp án C Đáp án: C
Số mol electron trao đổi là: ne = It / F = 1,24 × 1310 : 96500 = 0,01683 mol
Số electron trao đổi là: 0,01683 ÷ 0,005615 ≈ 3
Trong muối trên Cr tồn tại dạng Cr3+
Dạng tồn tại của Cl là Cl-
Số nguyên tử Cl trong muối là n = 3
→ Công thức của muối khan là là CrCl3
Khối lượng nước trong muối mất đi là: mH2O = 3 – 1,783 = 1,217 gam
Số phân tử nước trong muối X là: m = nH2O / nCrCl3 = (1,217 ÷ 18) / (1,783 ÷ 158,5) ≈ 6.
→ Công thức của muối là CrCl2(OH)6
⇒ Chọn đáp án C Đáp án: C
Câu 33 [382675]: Dạng tồn tại tốt nhất của muối X là
A, [CrCl2(H2O)4]Cl(H2O)2.
B, [CrCl3(H2O)3](H2O)3.
C, [CrCl(H2O)5]Cl2(H2O).
D, [CrCl2(H2O)2]Cl(H2O)2.
Công thức của muối là CrCl2(OH)6
Số mol AgNO3 phản ứng là: nAgNO3 = 2,81.10-3.0,4 = 1,124.10-3 mol
Bảo toàn nguyên tố Cr: nCr = nCrCl3
Ta có: nCr/nAgNO3 = (1,783 ÷ 158,5)/1,124.10-3 ≈ 1
→ Phản ứng giữa muối X và AgNO3 xảy ra theo tỉ lệ 1:1 → Chỉ có 1 ion Cl- bị thế
Trong thực tế dạng tồn tại của muối X là [CrA6]B
→ Dạng tồn tại tốt nhất của muối X là [CrCl2(H2O)4]Cl(H2O)2
⇒ Chọn đáp án A Đáp án: A
Số mol AgNO3 phản ứng là: nAgNO3 = 2,81.10-3.0,4 = 1,124.10-3 mol
Bảo toàn nguyên tố Cr: nCr = nCrCl3
Ta có: nCr/nAgNO3 = (1,783 ÷ 158,5)/1,124.10-3 ≈ 1
→ Phản ứng giữa muối X và AgNO3 xảy ra theo tỉ lệ 1:1 → Chỉ có 1 ion Cl- bị thế
Trong thực tế dạng tồn tại của muối X là [CrA6]B
→ Dạng tồn tại tốt nhất của muối X là [CrCl2(H2O)4]Cl(H2O)2
⇒ Chọn đáp án A Đáp án: A